Method Article
Crio-EM e analisi a singola particella con Scipion
In questo articolo
Riepilogo
L'analisi a singola particella in microscopia crioelettronica è una delle principali tecniche utilizzate per determinare la struttura degli insiemi biologici ad alta risoluzione. Scipion fornisce gli strumenti per creare l'intera pipeline per elaborare le informazioni acquisite dal microscopio e ottenere una ricostruzione 3D del campione biologico.
Abstract
La crioscopia elettronica è diventata uno degli strumenti più importanti nella ricerca biologica per rivelare le informazioni strutturali delle macromolecole a risoluzione quasi atomica. Nell'analisi a singola particella, il campione vetrificato viene ripreso da un fascio di elettroni e i rivelatori all'estremità della colonna del microscopio producono filmati di quel campione. Questi filmati contengono migliaia di immagini di particelle identiche in orientamenti casuali. I dati devono passare attraverso un flusso di lavoro di elaborazione delle immagini con più passaggi per ottenere il volume finale ricostruito in 3D. L'obiettivo del flusso di lavoro di elaborazione delle immagini è quello di identificare i parametri di acquisizione per poter ricostruire il campione in studio. Scipion fornisce tutti gli strumenti per creare questo flusso di lavoro utilizzando diversi pacchetti di elaborazione delle immagini in un framework integrativo, consentendo anche la tracciabilità dei risultati. In questo articolo l'intero flusso di lavoro di elaborazione delle immagini in Scipion viene presentato e discusso con dati provenienti da un vero e proprio test case, fornendo tutti i dettagli necessari per passare dai filmati ottenuti al microscopio ad una ricostruzione 3D finale ad alta risoluzione. Inoltre, viene discusso il potere di utilizzare strumenti di consenso che consentono di combinare metodi e confermare i risultati lungo ogni fase del flusso di lavoro, migliorando l'accuratezza dei risultati ottenuti.
Introduzione
Nella microscopia crioelettronica (cryo-EM), l'analisi di singole particelle (SPA) di campioni vetrificati congelati-idratati è una delle varianti più utilizzate e di successo dell'imaging per macromolecole biologiche, in quanto consente di comprendere le interazioni molecolari e la funzione degli insiemi biologici1. Questo grazie ai recenti progressi in questa tecnica di imaging che hanno dato origine alla "rivoluzione della risoluzione"2 e hanno permesso la determinazione di successo di strutture biologiche 3D con risoluzione quasi atomica. Attualmente, la risoluzione più alta raggiunta in SPA cryo-EM è stata di 1,15 Å per apoferritin3 (voce EMDB: 11668). Questi progressi tecnologici comprendono miglioramenti nella preparazione dei campioni4, nell'acquisizione delle immagini5 e nei metodi di elaborazione delle immagini6. Questo articolo è focalizzato su quest'ultimo punto.
In breve, l'obiettivo dei metodi di elaborazione delle immagini è quello di identificare tutti i parametri di acquisizione per invertire il processo di imaging del microscopio e recuperare la struttura 3D del campione biologico in studio. Questi parametri sono il guadagno della fotocamera, il movimento indotto dal fascio, le aberrazioni del microscopio (principalmente il defocalizzato), l'orientamento angolare 3D e la traduzione di ogni particella e lo stato conformazionale in caso di avere un campione con cambiamenti conformazionali. Tuttavia, il numero di parametri è molto elevato e la crio-EM richiede l'utilizzo di immagini a basso dosaggio per evitare danni da radiazioni, il che riduce significativamente il rapporto segnale-rumore (SNR) delle immagini acquisite. Pertanto, il problema non può essere risolto in modo inequivocabile e tutti i parametri da calcolare solo possono essere stime. Lungo il flusso di lavoro di elaborazione delle immagini, è necessario identificare i parametri corretti, scartando quelli rimanenti per ottenere finalmente una ricostruzione 3D ad alta risoluzione.
I dati generati dal microscopio sono raccolti in fotogrammi. Semplificando, un fotogramma contiene il numero di elettroni che sono arrivati in una particolare posizione (pixel) nell'immagine, ogni volta che vengono utilizzati rilevatori di conteggio degli elettroni. In un particolare campo visivo, vengono raccolti diversi fotogrammi e questo è chiamato film. Poiché vengono utilizzate basse dosi di elettroni per evitare danni da radiazioni che potrebbero distruggere il campione, l'SNR è molto basso e i fotogrammi corrispondenti allo stesso film devono essere mediati per ottenere un'immagine che riveli informazioni strutturali sul campione. Tuttavia, non viene applicata solo una media semplice, il campione può subire spostamenti e altri tipi di movimenti durante il tempo di imaging a causa del movimento indotto dal fascio che deve essere compensato. I fotogrammi compensati e mediati dal cambio originano una micrografia.
Una volta ottenute le micrografie, dobbiamo stimare le aberrazioni introdotte dal microscopio per ciascuna di esse, chiamate Funzione di trasferimento di contrasto (CTF), che rappresenta i cambiamenti nel contrasto della micrografia in funzione della frequenza. Quindi, le particelle possono essere selezionate ed estratte, che si chiama raccolta di particelle. Ogni particella dovrebbe essere una piccola immagine contenente solo una copia del campione in studio. Esistono tre famiglie di algoritmi per il prelievo di particelle: 1) quelli che usano solo una parametrizzazione di base dell'aspetto della particella per trovarli nell'intero set di micrografie (ad esempio, la dimensione delle particelle), 2) quelli che imparano come appaiono le particelle dall'utente o da un set pre-addestrato e 3) quelli che usano modelli di immagine. Ogni famiglia ha proprietà diverse che verranno mostrate in seguito.
L'insieme estratto di particelle trovate nelle micrografie verrà utilizzato in un processo di classificazione 2D che ha due obiettivi: 1) pulire l'insieme di particelle scartando il sottoinsieme contenente immagini di rumore puro, particelle sovrapposte o altri artefatti e 2) le particelle medie che rappresentano ciascuna classe potrebbero essere utilizzate come informazioni iniziali per calcolare un volume iniziale 3D.
Il calcolo del volume iniziale 3D è il prossimo passo cruciale. Il problema di ottenere la struttura 3D può essere visto come un problema di ottimizzazione in un panorama di soluzioni multidimensionali, in cui il minimo globale è il miglior volume 3D che rappresenta la struttura originale, ma si possono trovare diversi minimi locali che rappresentano soluzioni non ottimali e dove è molto facile rimanere intrappolati. Il volume iniziale rappresenta il punto di partenza per il processo di ricerca, quindi una cattiva stima del volume iniziale potrebbe impedirci di trovare il minimo globale. Dal volume iniziale, una fase di classificazione 3D aiuterà a scoprire diversi stati conformazionali e a ripulire l'insieme delle particelle; l'obiettivo è quello di ottenere una popolazione strutturalmente omogenea di particelle. Successivamente, una fase di perfezionamento 3D sarà incaricata di perfezionare i parametri angolari e di traslazione per ogni particella per ottenere il miglior volume 3D possibile.
Infine, negli ultimi passaggi, la ricostruzione 3D ottenuta può essere affilata e lucidata. L'affilatura è un processo di potenziamento delle alte frequenze del volume ricostruito, e la lucidatura è un passo per perfezionare ulteriormente alcuni parametri, come CTF o compensazione del movimento indotta dal fascio, a livello di particelle. Inoltre, alcune procedure di convalida potrebbero essere utilizzate per comprendere meglio la risoluzione raggiunta alla fine del flusso di lavoro.
Dopo tutti questi passaggi, i processi di tracciamento e attracco7 aiuteranno a dare un significato biologico alla ricostruzione 3D ottenuta, costruendo modelli atomici de novo o adattando modelli esistenti. Se si raggiunge un'alta risoluzione, questi processi ci diranno le posizioni delle strutture biologiche, anche dei diversi atomi, nella nostra struttura.
Scipion8 consente di creare l'intero flusso di lavoro combinando i pacchetti di elaborazione delle immagini più rilevanti in modo integrativo. Xmipp9, Relion10, CryoSPARC11, Eman12, Spider13, Cryolo14, Ctffind15, CCP416, Phenix17 e molti altri pacchetti possono essere inclusi in Scipion. Inoltre, incorpora tutti gli strumenti necessari per favorire l'integrazione, l'interoperabilità, la tracciabilità e la riproducibilità per effettuare un monitoraggio completo dell'intero flusso di lavoro di elaborazione delle immagini8.
Uno degli strumenti più potenti che Scipion ci consente di utilizzare è il consenso, il che significa confrontare i risultati ottenuti con diversi metodi in una fase dell'elaborazione, creando una combinazione delle informazioni veicolate con metodi diversi per generare un output più accurato. Ciò potrebbe contribuire a migliorare le prestazioni e migliorare la qualità raggiunta nei parametri stimati. Si noti che un flusso di lavoro più semplice può essere creato senza l'uso di metodi di consenso; tuttavia, abbiamo visto la potenza di questo strumento22,25 e il flusso di lavoro presentato in questo manoscritto lo utilizzerà in diversi passaggi.
Tutti i passaggi che sono stati riassunti nei paragrafi precedenti saranno spiegati in dettaglio nella sezione seguente e combinati in un flusso di lavoro completo utilizzando Scipion. Inoltre, verrà mostrato come utilizzare gli strumenti di consenso per raggiungere un accordo più elevato nei risultati generati. A tal fine, è stato scelto il set di dati di esempio del ribosoma Plasmodium falciparum 80S (voce EMPIAR: 10028, voce EMDB: 2660). Il set di dati è formato da 600 filmati di 16 fotogrammi di dimensioni 4096x4096 pixel a una dimensione di pixel di 1,34 Å ripresi a un FEI POLARA 300 con una fotocamera FEI FALCON II, con una risoluzione riportata su EMDB è 3.2Å18 .
Protocollo
1. Creazione di un progetto in Scipion e importazione dei dati
- Aprire Scipion e fare clic su Crea progetto, specificare il nome del progetto e la posizione in cui verrà salvato (Figura supplementare 1). Scipion aprirà la finestra del progetto mostrando una tela con, sul lato sinistro, un pannello con un elenco di metodi disponibili, ognuno dei quali rappresenta uno strumento di elaborazione delle immagini che può essere utilizzato per gestire i dati.
NOTA: CTRL+F può essere utilizzato per trovare un metodo se non viene visualizzato nell'elenco. - Per importare i filmati ripresi dal microscopio selezionare il pwem - importa filmati sul pannello di sinistra (o digitarlo quando si preme Ctrl+F).
- Verrà aperta una nuova finestra (Figura supplementare 2). Lì, includi il percorso dei dati e i parametri di acquisizione. In questo esempio, utilizzare la seguente configurazione: Tensione del microscopio 300 kV, Aberrazione sferica 2,0 mm, Contrasto di ampiezza 0,1, Frequenza di ingrandimento 50000, Modalità frequenza di campionamento a Immagine da e Dimensione pixel 1,34 Å. Quando tutti i parametri nel modulo sono compilati, fare clic sul pulsante Esegui .
NOTA: all'avvio di un metodo, nell'area di disegno viene visualizzata una casella di colore giallo contrassegnata come in esecuzione. Al termine di un metodo, la casella diventa verde e l'etichetta diventa finita. In caso di errore durante l'esecuzione di un metodo, la casella apparirà in rosso, etichettata come fallita. In tal caso, controlla la parte inferiore del canvas, nella scheda Registro di output apparirà una spiegazione dell'errore. - Al termine del metodo, controllare i risultati nella parte inferiore dell'area di disegno nella scheda Riepilogo . Qui, gli output generati dal metodo sono presentati, in questo caso, il set di film. Fai clic sul pulsante Analizza risultati e apparirà una nuova finestra con l'elenco dei film.
2. Allineamento dei filmati: dai filmati alle micrografie
- Utilizzare il metodo xmipp3 - allineamento ottico che implementa il flusso ottico19. Utilizzare i seguenti parametri per compilare il modulo (Figura supplementare 3): i filmati di input sono quelli ottenuti nel passaggio 1, l'intervallo in Fotogrammi per ALIGN è compreso tra 2 e 13, le altre opzioni rimangono con i valori predefiniti. Eseguire il programma.
NOTA: i parametri in grassetto in un modulo devono essere sempre compilati. Gli altri avranno un valore predefinito o non saranno obbligatoriamente richiesti. Nella parte superiore della finestra del modulo, è possibile trovare i campi in cui sono distribuite le risorse di calcolo, come thread, MPI o GPU. - Fare clic su Analizza risultati per controllare le micrografie ottenute e la traiettoria dei turni stimati (Figura 1). Per ogni micrografia vista: guarda la densità spettrale di potenza (PSD), le traiettorie ottenute per allineare il filmato (un punto per fotogramma) in coordinate cartesiane e polari e il nome del file della micrografia ottenuta (cliccandoci sopra, la micrografia può essere ispezionata). Si noti che le particelle del campione sono molto più visibili nella micrografia, rispetto a un singolo fotogramma del filmato.
3. Stima CTF: calcolo delle aberrazioni del microscopio
- Innanzitutto, utilizzare il metodo grigoriefflab - ctffind15. La configurazione è: le micrografie di ingresso sono l'uscita del passaggio 2, il fattore di downsampling CTF manuale è impostato su 1,5 e l'intervallo di risoluzione va da 0,06 a 0,42. Inoltre, nelle opzioni Avanzate (che puoi trovare selezionando questa scelta nel livello Esperto del modulo), imposta la dimensione della finestra su 256. I parametri rimanenti rimangono con i valori predefiniti (Figura supplementare 4).
NOTA: nella maggior parte dei metodi in Scipion l'opzione Avanzate mostra più parametri di configurazione. Utilizzare queste opzioni con attenzione, quando il programma da avviare è completamente noto e il significato dei parametri è compreso. Alcuni parametri possono essere difficili da compilare senza dare un'occhiata ai dati; in tal caso, Scipion mostra una bacchetta magica sul lato destro che mostrerà una finestra della procedura guidata (Figura supplementare 5). Ad esempio, nel campo Risoluzione di questo modulo è particolarmente utile, in quanto questi valori devono essere selezionati per coprire approssimativamente la regione dal primo zero all'ultimo anello evidente del PSD. - Fare clic su Esegui e su Analizza risultati (Figura 2) al termine del metodo. Verificare che il CTF stimato corrisponda a quello sperimentale. A tal fine, guarda il PSD e confronta gli anelli stimati nell'angolo con quelli provenienti dai dati. Controllare anche i valori di sfocatura ottenuti per trovare eventuali valori imprevisti e le rispettive micrografie possono essere scartate o ricalcolate. In questo esempio, è possibile utilizzare l'intero set di micrografie.
NOTA: utilizzare i pulsanti nella parte inferiore della finestra per creare un sottoinsieme di micrografie (con pulsante rosso Micrografie ) e per ricalcolare un CTF (con pulsante rosso Ricalcola CTF ), in caso di necessità. - Per perfezionare la stima precedente, utilizzare xmipp3 - ctf estimation20. Selezionare come Micrografie di input l'output del passaggio 2, selezionare l'opzione Usa defoci da una stima CTF precedente, come Stima CTF precedente scegliere l'output di grigoriefflab - ctffind e, nel livello Avanzato, modificare la dimensione della finestra su 256 (Figura supplementare 6). Eseguilo.
- Fare clic su Analizza risultati per controllare i CTF ottenuti. Con questo metodo, più dati vengono stimati e rappresentati in alcune colonne aggiuntive. Poiché nessuno di essi mostra valori stimati errati, tutte le micrografie verranno utilizzate nei passaggi seguenti.
4. Particle picking: trovare particelle nelle micrografie
- Prima di iniziare il picking, effettuare una pre-elaborazione delle micrografie. Apri xmipp3 - micrografie di pre-elaborazione, imposta come micrografie di input quelle ottenute nel passaggio 2 e seleziona le opzioni Rimuovi pixel danneggiati? con Multiplo di Stddev a 5 e Micrografie di downsample? con un fattore di downsampling di 2 (Figura supplementare 7). Fare clic su Esegui e verificare che la dimensione delle micrografie risultanti sia stata ridotta.
- Per il picking utilizzare xmipp3 - manual-picking (step 1) e xmipp3 - auto-picking (step 2)21. Il picking manuale permette di preparare manualmente un set di particelle con cui la fase di auto-picking imparerà e genererà il set completo di particelle. Innanzitutto, esegui xmipp3 - manual-picking (passaggio 1) con micrografie di input come le micrografie ottenute nel precedente preprocesso. Fare clic su Esegui e verrà visualizzata una nuova finestra interattiva (Figura 3).
- In questa finestra viene presentato un elenco delle micrografie (Figura 3a) e altre opzioni. Cambia Dimensione (px) a 150, questa sarà la dimensione della scatola contenente ogni particella. La micrografia selezionata viene visualizzata in una finestra più grande. Scegliere una regione e selezionare tutte le particelle visibili al suo interno (Figura 3b). Quindi, fai clic su Attiva formazione per iniziare l'apprendimento. Le restanti regioni della micrografia vengono raccolte automaticamente (Figura 3c). Controlla le particelle raccolte e includi di più facendo clic su di esse o rimuovi quelle errate con maiusc + clic, se necessario.
- Selezionare la micrografia successiva nella prima finestra. La micrografia verrà prelevata automaticamente. Controllare di nuovo per includere o rimuovere alcune particelle, se necessario. Ripeti questo passaggio con, approssimativamente, 5 micrografie per creare un set di formazione rappresentativo.
- Una volta fatto questo, fai clic su Coordinate nella finestra principale per salvare le coordinate di tutte le particelle raccolte. Il set di formazione di particelle è pronto per essere utilizzato per il prelievo automatico per completare il processo per tutte le micrografie.
- Apri xmipp3 - il prelievo automatico (passaggio 2) indica che nel prelievo di particelle Xmipp esegui il prelievo manuale precedente e micrografie da selezionare come uguale supervisionato. Fare clic su Esegui. Questo metodo genererà come output un insieme di circa 100000 coordinate.
- Applica un approccio di consenso, quindi esegui un secondo metodo di picking per selezionare le particelle in cui entrambi i metodi sono d'accordo. Aprire sphire - cryolo picking14 e selezionare le micrografie preelaborate come micrografie di input, utilizzare il modello generale? a Sì, con una soglia di confidenza di 0,3 e una dimensione della scatola di 150 (Figura supplementare 8). Eseguilo. Questo metodo dovrebbe generare anche circa 100000 coordinate.
- Esegui xmipp3 - deep consensus picking22. Poiché le coordinate di input includono l'uscita di sphire - cryolo picking (passaggio 4.7) e xmipp3 - auto-picking (passaggio 4.6), impostare Seleziona tipo di modello su Pretrained e Salta l'addestramento e il punteggio direttamente con il modello pre-addestrato? a Sì (Figura supplementare 9). Eseguilo.
- Fai clic su Analizza risultati e, nella nuova finestra, sull'icona dell'occhio accanto a Seleziona particelle /coordinate con valori elevati di "zScoreDeepLearning1". Verrà aperta una nuova finestra con un elenco di tutte le particelle (Figura 4). I valori zScore nella colonna danno un'idea della qualità di una particella, valori bassi significano cattiva qualità.
- Clicca sull'etichetta_xmipp_zScoreDeepLearning per ordinare le particelle dallo zScore più alto al più basso. Selezionare le particelle con zScore superiore a 0,75 e fare clic su Coordinate per creare il nuovo sottoinsieme. Questo dovrebbe creare un sottoinsieme con circa 50000 coordinate.
- Open xmipp3 - pulitore micrografico profondo. Selezionare come Coordinate di input il sottoinsieme ottenuto nel passaggio precedente, Origine micrografie uguale alle coordinate e mantenere Soglia a 0,75. Eseguilo. Verificare nella scheda Riepilogo che il numero di coordinate sia stato ridotto, anche se in questo caso vengono rimosse solo poche coordinate.
NOTA: questo passaggio è in grado di pulire ulteriormente l'insieme di coordinate e potrebbe essere molto utile per pulire altri set di dati con più artefatti cinematografici come zone di carbonio o grandi impurità. - Esegui xmipp3 - estrai particelle (Figura supplementare 10). Indicare come Coordinate di input le coordinate ottenute dopo il passaggio precedente, Micrographs source come altro, Input micrographs come output del step 2, CTF estimation come output della stima xmipp3 - ctf, Downsampling factor to 3 e Particle box size to 100. Nella scheda Pre-elaborazione del modulo selezionare Sì a tutti. Eseguilo.
- Verificare che l'output contenga le particelle in dimensioni ridotte di 100x100 pixel e una dimensione in pixel di 4,02Å/px.
- Esegui di nuovo xmipp3 - estrai le particelle modificando i seguenti parametri: fattore di downsampling a 1 e dimensione della scatola delle particelle a 300. Verificare che l'output sia lo stesso insieme di particelle ma ora alla massima risoluzione.
5. Classificazione 2D: raggruppamento di particelle simili
- Aprire il metodo cryosparc2 - Classificazione 2d11 con particelle di input come quelle ottenute nel passaggio 4.11 e, nella scheda Classificazione 2D, il Numero di classi a 128, mantenere tutti gli altri parametri con i valori predefiniti. Eseguilo.
- Fare clic su Analizza risultati e quindi sull'icona dell'occhio accanto a Visualizza classi di particelle con Scipion (Figura 5). Questa classificazione aiuterà a pulire l'insieme di particelle, poiché diverse classi appariranno rumorose o con artefatti. Selezionare le classi contenenti buone viste. Fare clic su Particelle (pulsante rosso nella parte inferiore della finestra) per creare il sottoinsieme più pulito.
- Ora, apri xmipp3 - cl2d23 e imposta come immagini di input le immagini ottenute nel passaggio precedente e Numero di classi come 128. Fare clic su Esegui.
NOTA: questa seconda classificazione viene utilizzata come fase di pulizia aggiuntiva dell'insieme di particelle. Di solito è utile rimuovere quante più particelle rumorose possibile. Tuttavia, se si desidera un flusso di lavoro più semplice, è possibile utilizzare un solo metodo di classificazione 2D. - Al termine del metodo, controllare le 128 classi generate facendo clic su Analizza risultati e su Cosa mostrare: classi. La maggior parte delle classi generate mostra una proiezione della macromolecola con un certo livello di dettaglio. Tuttavia, alcuni di essi appaiono rumorosi (in questo esempio circa 10 classi). Seleziona tutte le classi buone e fai clic sul pulsante Classi per generare un nuovo sottoinsieme con solo quelle buone. Questo sottoinsieme verrà utilizzato come input per uno dei metodi per generare un volume iniziale. Con le stesse classi selezionate clicca su Particelle per creare un sottoinsieme più pulito dopo aver rimosso quelle appartenenti alle classi cattive.
- Open pwem - sottoinsieme con set completo di elementi come output di 4.13 (tutte le particelle a grandezza naturale), Crea sottoinsieme casuale su No, Altro insieme come sottoinsieme di particelle create nel passaggio precedente e Imposta operazione come intersezione. Questo estrarrà il sottoinsieme precedente dalle particelle a piena risoluzione.
6. Stima iniziale del volume: costruire la prima ipotesi del volume 3D
- In questa fase, stimare due volumi iniziali con metodi diversi e quindi utilizzare uno strumento di consenso per generare il volume 3D stimato finale. Apri xmipp3 - ricostruisci il metodo significant24 con le classi Input come quelle ottenute dopo il passaggio 5, il gruppo Symmetry come c1 e mantieni i parametri rimanenti con i loro valori predefiniti (Figura supplementare 11). Eseguilo.
- Fare clic su Analizza risultati. Verificare che si ottenga un volume a bassa risoluzione di dimensioni 100x100x100 pixel e una dimensione dei pixel di 4,02Å/px.
- Apri xmipp3 - ritaglia/ridimensiona i volumi (Figura supplementare 12) utilizzando come volumi di input quello ottenuto nel passaggio precedente, Ridimensiona volumi? su Sì, Ridimensiona opzione su Frequenza di campionamento e Ridimensiona frequenza di campionamento a 1,34 Å/px. Eseguilo. Verificare nella scheda Riepilogo che il volume di output abbia le dimensioni corrette.
- Ora crea il secondo volume iniziale. Open relion - Modello iniziale 3D10, poiché le particelle di input utilizzano le particelle buone a piena risoluzione (uscita di 5,5) e impostano il diametro della maschera di particelle su 402Å, mantenere i parametri rimanenti con i valori predefiniti. Eseguilo.
- Fare clic su Analizza risultati e quindi in Volume di visualizzazione con: sezioni. Verificare che si ottenga un volume a bassa risoluzione ma con la forma principale della struttura (Figura supplementare 13).
- Ora, apri pwem - unisci i set per combinare i due volumi iniziali generati per creare l'input al metodo di consenso. Basta indicare Volumi come tipo di input e selezionare i due volumi iniziali nel set di input. Eseguilo. L'output deve essere un set contenente due elementi con entrambi i volumi.
- Lo strumento di consenso è quello incluso in xmipp3 - swarm consensus25. Aprilo. Utilizzare come immagini a grandezza naturale le particelle buone a piena risoluzione (output di 5,5), come volumi iniziali il set con due elementi generati nel passaggio precedente e assicurarsi che il gruppo simmetria sia c1. Fare clic su Esegui.
- Fare clic su Analizza risultati. Verificare che si ottenga un volume di output più dettagliato (Figura 6). Sebbene ci sia più rumore che circonda la struttura, avere più dettagli nella mappa della struttura aiuterà i seguenti passaggi di perfezionamento per evitare i minimi locali.
NOTA: se UCSF Chimera26 è disponibile, utilizzare l'ultima icona nella parte superiore della finestra per effettuare una visualizzazione 3D del volume ottenuto. - Apri ed esegui relion - 3D auto-refine10 per effettuare una prima assegnazione angolare 3D delle particelle. Selezionate come particelle di ingresso l'uscita di 5,5 e impostate il diametro della maschera particellare su 402Å. Nella scheda Mappa 3D di riferimento selezionare come Volume di input quello ottenuto nel passaggio precedente, Simmetria come c1 e Filtro passa-basso iniziale a 30Å (Figura supplementare 14).
- Fare clic su Analizza risultati. Nella nuova finestra selezionare finale come Volume da visualizzare e fare clic su Visualizza volume con: sezioni per vedere il volume ottenuto. Controllare anche la correlazione della shell di Fourier (FSC) facendo clic su Visualizza grafici di risoluzione nella finestra dei risultati e la copertura angolare in Visualizza distribuzione angolare: grafico 2D (Figura 7). Il volume ricostruito contiene molti più dettagli (probabilmente con alcune aree sfocate nella parte esterna della struttura), e l'FSC supera la soglia di 0,143 intorno a 4,5 Å. La copertura angolare copre l'intera sfera 3D.
7.3D classificazione: scoperta degli stati conformazionali
- Utilizzando un approccio di consenso, se nei dati sono presenti diversi stati conformazionali. Open relion - Classificazione 3D10 (Figura supplementare 15). Come particelle di input utilizzare quelle appena ottenute in 6.10 e impostare il diametro della maschera di particelle su 402Å. Nella scheda Mappa 3D di riferimento, utilizzare come volume di input quello ottenuto dopo il passaggio 6.10, impostare Simmetria su c1 e Filtro passa-basso iniziale su 15Å. Infine, nella scheda Ottimizzazione, impostare il Numero di classi su 3. Eseguilo.
- Controlla i risultati facendo clic su Analizza risultati, seleziona Mostra classificazione in Scipion. Vengono mostrate le tre classi generate e alcune misure interessanti. Le prime due classi dovrebbero avere un numero simile di immagini assegnate (colonna delle dimensioni ) e apparire molto simili, mentre la terza ha meno immagini e un aspetto più sfocato. Inoltre, rlnAccuracyRotations e rlnAccuracyTranslations dovrebbero essere chiaramente migliori per le prime due classi. Selezionare le due classi migliori e fare clic sul pulsante Classi per generare un sottoinsieme che le contiene.
- Ripetere i passaggi 7.1 e 7.2 per generare un secondo gruppo di classi valide. Entrambi saranno l'input dello strumento di consenso.
- Apri ed esegui xmipp3 - classi di consenso 3D e seleziona come classi di input i due sottoinsiemi generati nei passaggi precedenti.
- Fare clic su Analizza risultati. Viene presentato il numero di particelle coincidenti tra le classi: il primo valore è il numero di particelle coincidenti nella prima classe del sottoinsieme 1 e nella prima classe del sottoinsieme 2, il secondo valore è il numero di particelle coincidenti nella prima classe del sottoinsieme 1 e nella seconda classe del sottoinsieme 2, ecc. Verificare che le particelle siano assegnate in modo casuale alle classi uno o due, il che significa che il metodo di classificazione 3D non è in grado di trovare cambiamenti conformazionali. Dato questo risultato, l'intero set di particelle verrà utilizzato per continuare l'elaborazione.
8.3D affinamento: affinamento delle assegnazioni angolari di una popolazione omogenea
- Ancora una volta, applica un approccio di consenso in questo passaggio. Innanzitutto, apri ed esegui pwem - sottoinsieme con set completo di elementi come output di 6.9, Crea sottoinsieme casuale su Sì e Numero di elementi su 5000. Con questo, viene creato un sottoinsieme di immagini con un allineamento precedente per addestrare il metodo utilizzato nel passaggio successivo.
- Apri xmipp3 - allineamento profondo, imposta le immagini di input come output di particelle buone ottenute in 5.5, Volume come quello ottenuto dopo 6.10, Set di addestramento input come quello creato nel passaggio precedente, Risoluzione target a 10Å e mantieni i parametri rimanenti con i valori predefiniti (Figura supplementare 16). Fare clic su Esegui.
- Clicca su Analizza risultati per verificare la distribuzione angolare ottenuta, dove non ci sono direzioni mancanti e la copertura angolare migliora leggermente rispetto a quella di 6.10 (Figura 8).
- Apri ed esegui xmipp3 - confronta gli angoli e seleziona come particelle di input 1 l'uscita di 6.9 e particelle di input 2 l'uscita di 8.2, assicurati che il gruppo di simmetria sia c1. Questo metodo calcola l'accordo tra xmipp3 - deep align e relion - 3D auto refine.
- Clicca su Analizza risultati, viene mostrato l'elenco delle particelle, con le differenze ottenute in spostamenti e angoli. Fare clic sull'icona della barra nella parte superiore della finestra, verrà aperta un'altra finestra che consente di effettuare grafici delle variabili calcolate. Selezionate _xmipp_angleDiff e fate clic su Plot (Plot) per visualizzare una rappresentazione delle differenze angolari per particella. Fai lo stesso con _xmipp_shiftDiff. In queste cifre, circa la metà delle particelle entrambi i metodi concordano (Figura 9). Selezionare le particelle con differenze angolari inferiori a 10º e creare un nuovo sottoinsieme.
- Ora, apri xmipp3 - highres27 per fare un affinamento locale degli angoli assegnati. Innanzitutto, selezionare come Immagini a grandezza naturale le immagini ottenute nel passaggio precedente e come Volumi iniziali l'output di 6,9, impostare Raggio della particella su 150 pixel e Gruppo simmetria su c1. Nella scheda Assegnazione angolare, impostare Allineamento immagine su Locale, Numero di iterazioni su 1 e Massimo. Risoluzione target come 5Å/px (Figura supplementare 17). Eseguilo.
- Nella scheda Riepilogo verificare che il volume di output sia inferiore a 300x300x300 pixel e con dimensioni dei pixel leggermente superiori.
- Clicca su Analizza risultati per vedere i risultati ottenuti. Fare clic su Grafici di risoluzione dello schermo per vedere l'FSC e su Volume di visualizzazione: Ricostruito per vedere il volume ottenuto (Figura supplementare 18). Si ottiene un volume di buona risoluzione vicino a 4-3,5 Å.
- Fare clic su Visualizza particelle di output e, nella finestra con l'elenco delle particelle, fare clic sull'icona a barre. Nella nuova finestra, selezionare Digita come istogramma, con 100 raccoglitori, selezionare _xmipp_cost etichetta e infine premere Plot (Figura supplementare 19). In questo modo, viene presentato l'istogramma dell'etichetta di costo , che contiene la correlazione della particella con la direzione di proiezione selezionata per essa. In questo caso, si ottiene una funzione di densità unimodale, che è un segno di non avere popolazioni diverse nell'insieme delle particelle. Quindi tutti saranno utilizzati per continuare il perfezionamento
NOTA: in caso di visualizzazione di una funzione di densità multimodale, è necessario selezionare l'insieme di particelle appartenenti al massimo più alto per continuare il flusso di lavoro solo con loro. - Aprire ed eseguire di nuovo xmipp3 - highres con Continue da una corsa precedente? a Sì, impostare come immagini a grandezza naturale quelle ottenute dopo la 8.5 e selezionare l'esecuzione precedente con l'esecuzione precedente di Xmipp Highres. Nella scheda Assegnazione angolare , impostare l'allineamento dell'immagine su Locale, con 1 iterazione e 2,6 Å/px come risoluzione di destinazione (risoluzione completa).
- Ora l'output dovrebbe contenere un volume a piena risoluzione (dimensioni 300x300x300 pixel). Fare clic su Analizza risultati per controllare nuovamente il volume ottenuto e l'FSC, che ora dovrebbe essere un volume ad alta risoluzione a circa 3Å (Figura 10).
9. Valutazione e post-elaborazione
- Apri xmipp3 - MonoRes28 locale. Questo metodo calcolerà la risoluzione localmente. Impostare come volume di ingresso quello ottenuto dopo 8.10, impostare Desideri utilizzare mezzi volumi? su Sì e Intervallo di risoluzione da 1 a 10Å. Eseguilo.
- Fare clic su Analizza risultati e selezionare Mostra istogramma di risoluzione e Mostra sezioni colorate (Figura 11). Viene mostrata la risoluzione nelle diverse parti del volume. La maggior parte dei voxel della parte centrale della struttura dovrebbe presentare risoluzioni intorno al 3%, mentre le risoluzioni peggiori si ottengono nelle parti esterne. Inoltre, viene mostrato un istogramma delle risoluzioni per voxel con un picco intorno (anche al di sotto) di 3Å.
- Aprire ed eseguire xmipp3 - localdeblur sharpening29 per applicare una affilatura. Selezionare come Mappa di input quella ottenuta in 8.10, e come Mappa risoluzione quella ottenuta nel passaggio precedente con MonoRes.
- Fare clic su Analizza risultati per verificare i volumi ottenuti. Apri l'ultimo, corrispondente all'ultima iterazione dell'algoritmo. Si consiglia di aprire il volume con altri strumenti, come UCSF Chimera26, per vedere meglio le caratteristiche del volume in 3D (Figura 12).
- Infine, apri lo strumento di convalida incluso in xmipp3 - convalida overfitting30 che mostrerà come cambia la risoluzione con il numero di particelle. Aprirlo e includere come particelle di input le particelle ottenute nel passaggio 8.5, impostare Calcola il rumore legato alla risoluzione? su Sì, con volume di riferimento 3D iniziale come output di 8.10. In Opzioni avanzate, impostare il numero di particelle su "500 1000 1500 2000 3000 5000 10000 15000 20000" (Figura supplementare 20). Eseguilo.
- Fare clic su Analizza risultati. Appariranno due grafici (Figura 13) con l'evoluzione della risoluzione, nella linea verde, man mano che cresce il numero di particelle utilizzate nella ricostruzione. La linea rossa rappresenta la risoluzione raggiunta con una ricostruzione del rumore gaussiano allineato. La risoluzione migliora con il numero di particelle e si osserva una grande differenza della ricostruzione dalle particelle rispetto a quella dal rumore, che è un indicatore di avere particelle con buone informazioni strutturali.
- Dai risultati precedenti, potrebbe essere effettuato un adattamento di un modello nel volume post-elaborato, che consentirebbe di scoprire le strutture biologiche della macromolecola.
Risultati
Abbiamo utilizzato il dataset del Ribosoma Plasmodium falciparum 80S (voce EMPIAR: 10028, voce EMDB: 2660) per condurre il test e, con il protocollo Scipion presentato nella sezione precedente, è stato raggiunto un volume ricostruito in 3D ad alta risoluzione della macromolecola in questo particolare esempio, a partire dalle informazioni raccolte dal microscopio che consistono in immagini molto rumorose contenenti proiezioni 2D in qualsiasi orientamento del campione.
I principali risultati ottenuti dopo l'esecuzione dell'intero protocollo sono presentati nella Figura 10, nella Figura 11 e nella Figura 12. La Figura 10 rappresenta il volume 3D ottenuto prima della post-elaborazione. Nella Figura 10a, si può vedere un FSC di 3 Å, che è molto vicino al limite di Nyquist (con dati con una dimensione dei pixel di 1,34 Å, il limite di Nyquist è 2,6 Å). La Figura 10b mostra alcune fette del volume 3D ricostruito con alti livelli di dettagli e strutture ben definite. Nella Figura 11 vengono presentati i risultati dopo l'analisi locale della risoluzione del volume 3D ottenuto. Si può vedere che la maggior parte dei voxel nella struttura raggiunge una risoluzione inferiore a 3 Å, principalmente quelli situati nella parte centrale della struttura. Tuttavia, la parte esterna mostra risoluzioni peggiori, ciò che è coerente con la sfocatura che appare in quelle aree nelle sezioni della Figura 10b. La Figura 12 mostra la stessa mappa 3D dopo la post-elaborazione che è in grado di evidenziare le frequenze più alte del volume, rivelando maggiori dettagli e migliorando la rappresentazione, che può essere vista soprattutto nella presentazione 3D in Figura 12c.
Nella Figura 14, Chimera26 è stato utilizzato per vedere una rappresentazione 3D del volume ottenuto (Figura 14a), il post-elaborato (Figura 14b) e la mappa della risoluzione (Figura 14c), colorata con il codice colore delle risoluzioni locali. Questo può dare ancora più informazioni sulla struttura ottenuta. Questo strumento è molto utile per ottenere una visione della qualità del volume ottenuto, poiché si possono vedere dettagli molto piccoli nell'intero contesto 3D della struttura. Quando la risoluzione raggiunta è sufficiente, si possono trovare anche alcune parti biochimiche della struttura (ad esempio, alfa-eliche nella Figura 14d. In questa figura, va evidenziata l'alta risoluzione raggiunta in tutte le parti centrali della struttura 3D, che possono essere viste come le aree blu scuro nella Figura 14c.
Tutti i risultati precedenti sono stati raggiunti grazie ad una buona performance dell'intero protocollo, ma questo potrebbe non essere il caso. Esistono diversi modi per identificare un cattivo comportamento. Nel caso più generale, questo accade quando la struttura ottenuta ha una bassa risoluzione e non è in grado di evolvere in una migliore. Un esempio di questo è presentato nella Figura 15. Un volume sfocato (Figura 15c) si traduce in un FSC basso, che può essere visto nella curva FSC (Figura 15a) e nell'istogramma della stima locale (Figura 15b). Questo esempio è stato generato utilizzando un metodo di perfezionamento 3D con dati di input errati, poiché si aspettavano alcune proprietà specifiche nel set di particelle di input che non soddisfano. Come si può vedere, è sempre molto importante sapere come i diversi metodi si aspettano di ricevere i dati e prepararli correttamente. In generale, quando si ottiene un output come quello nella Figura 15 , potrebbe esserci un problema nel flusso di lavoro di elaborazione o nei dati sottostanti.
Ci sono diversi checkpoint lungo il flusso di lavoro che possono essere analizzati per sapere se il protocollo si evolve correttamente o meno. Ad esempio, subito dopo la raccolta, molti dei metodi discussi in precedenza possono classificare le particelle e dare un punteggio per ciascuna di esse. Nel caso di avere particelle cattive, questi metodi consentono di identificarle e rimuoverle. Inoltre, la classificazione 2D può essere un buon indicatore di avere un cattivo insieme di particelle. La Figura 16 mostra un esempio di un set così cattivo. Nella Figura 16a sono mostrate le classi buone contenenti alcuni dettagli della struttura, mentre la Figura 16b mostra le classi cattive, rumorose o non centrate, in quest'ultimo caso si può vedere che il picking non è stato corretto e due particelle sembrano apparire insieme. Un altro punto di controllo è la stima iniziale del volume, la Figura 17 mostra un esempio di stime iniziali buone (Figura 17a) e cattive (Figura 17b). La stima errata è stata creata utilizzando un'impostazione non corretta per il metodo. Bisogna tenere conto che tutte le configurazioni devono essere fatte con attenzione, scegliendo opportunamente ogni parametro in base ai dati analizzati. In caso di non avere una mappa con alcune informazioni strutturali minime, il seguente perfezionamento non sarà in grado di ottenere una buona ricostruzione.
Quando il problema è una cattiva acquisizione, in cui i film non conservano informazioni strutturali, sarà impossibile estrarre particelle buone da loro e ottenere un'elaborazione di successo. In tal caso, dovrebbero essere raccolti più film per ottenere una ricostruzione 3D ad alta risoluzione. Ma, se questo non è il caso, ci sono diversi modi per gestire i problemi lungo il flusso di lavoro di elaborazione. Se il picking non è abbastanza buono, ci sono diversi modi per provare a risolverlo, ad esempio, ripetendo il picking, usando metodi diversi o cercando di raccogliere manualmente più particelle per aiutare i metodi a imparare da loro. Durante la classificazione 2D, se solo poche classi sono buone, considera anche di ripetere il processo di picking. Nella stima iniziale del volume, prova a utilizzare diversi metodi se alcuni di essi hanno dato risultati imprecisi. Lo stesso vale per la raffinatezza 3D. Seguendo questo ragionamento, in questo manoscritto sono stati presentati diversi strumenti di consenso, che potrebbero essere molto utili per evitare problemi e continuare l'elaborazione con dati accurati. Grazie all'utilizzo di un consenso tra diversi metodi, possiamo scartare dati difficili da selezionare, classificare, allineare, ecc., Che probabilmente è un indicatore di dati scadenti. Tuttavia, se diversi metodi sono in grado di concordare l'output generato, probabilmente questi dati contengono informazioni preziose con cui continuare l'elaborazione.
Incoraggiamo il lettore a scaricare più set di dati e cercare di elaborarli seguendo le raccomandazioni presentate in questo manoscritto e di creare un flusso di lavoro simile che combini pacchetti di elaborazione utilizzando Scipion. Provare a elaborare un dataset è il modo migliore per apprendere la potenza degli strumenti di elaborazione disponibili nello stato dell'arte in Cryo-EM, per conoscere le regole migliori per superare i possibili inconvenienti che appaiono durante l'elaborazione e per migliorare le prestazioni dei metodi disponibili in ogni specifico test case.
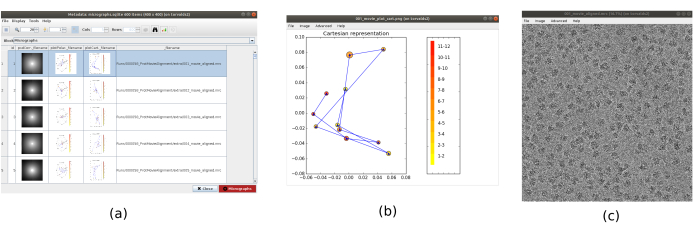
Figura 1. Risultato dell'allineamento del filmato. (a) La finestra principale dei risultati, con un elenco di tutte le micrografie generate e informazioni aggiuntive: la densità spettrale di potenza, la traiettoria dell'allineamento stimato in coordinate polari, lo stesso in coordinate cartesiane, il nome del file della micrografia generata. (b) La traiettoria di allineamento rappresentata in coordinate cartesiane. c) La micrografia generata. Fare clic qui per visualizzare una versione più grande di questa figura.
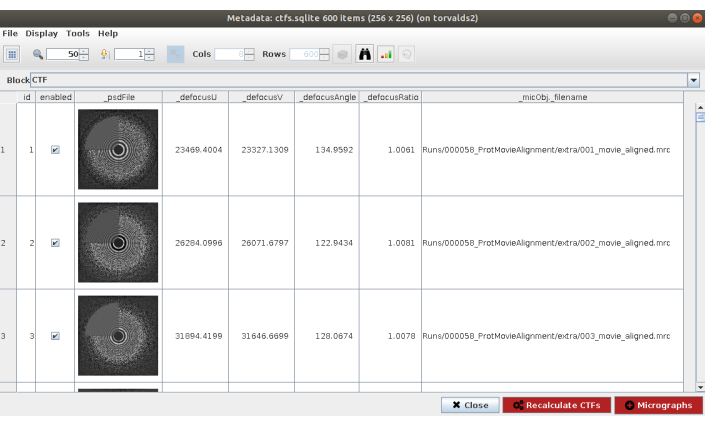
Figura 2. Stima CTF con risultato Ctffind. La finestra principale con i risultati include una figura con la PSD stimata (in un angolo) insieme alla PSD proveniente dai dati e diversi parametri di sfocatura. Fare clic qui per visualizzare una versione più grande di questa figura.
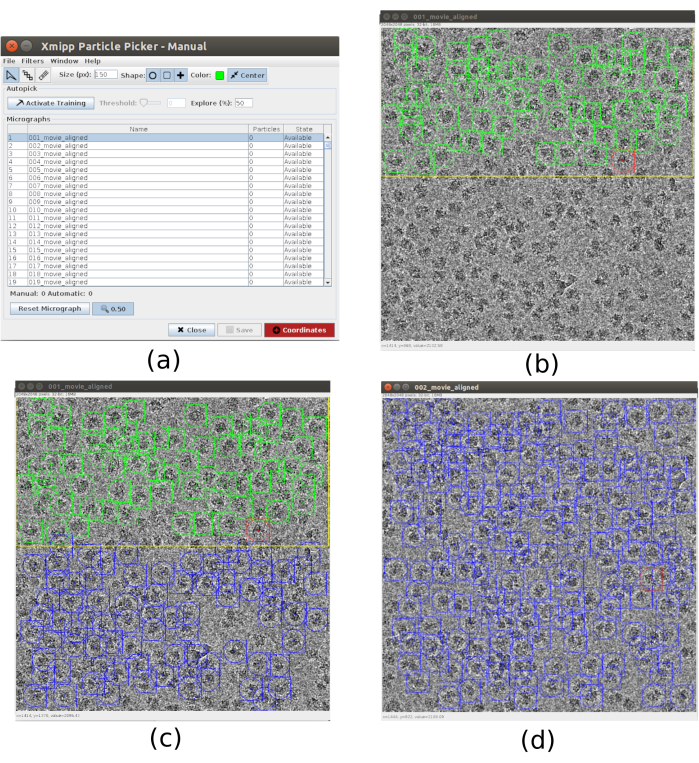
Figura 3. Finestre di prelievo manuali con Xmipp. (a) La finestra principale con l'elenco delle micrografie da elaborare e alcuni altri parametri. b) Prelievo manuale di particelle all'interno di una regione di una micrografia. (c) e (d) Selezionare automaticamente le particelle da controllare per creare una serie di particelle di addestramento per il metodo di prelievo automatico Xmipp. Fare clic qui per visualizzare una versione più grande di questa figura.
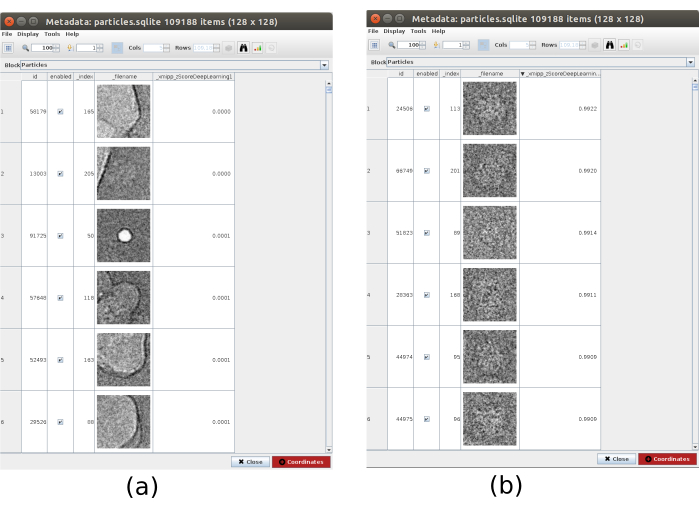
Figura 4. Raccolta di consenso profondo con risultato Xmipp. Il parametro zScoreDeepLearning dà peso alla bontà di una particella ed è fondamentale per scoprire le particelle cattive. (a) I valori zScores più bassi sono associati agli artefatti. (b) Gli zScore più alti sono associati a particelle contenenti la macromolecola. Fare clic qui per visualizzare una versione più grande di questa figura.
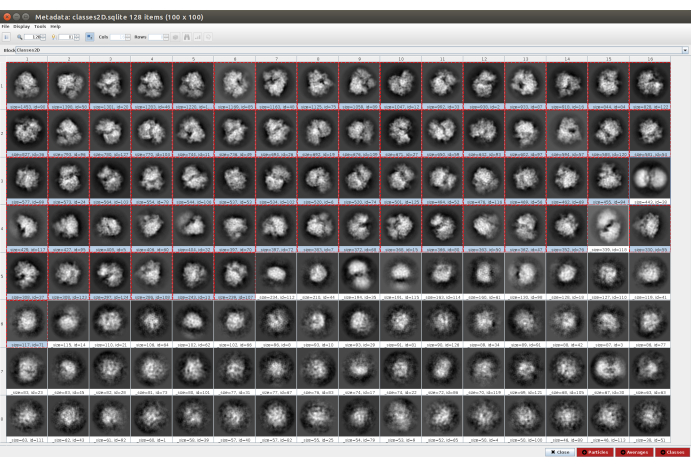
Figura 5. Classificazione 2D con risultato Cryosparc. Vengono mostrate le classi generate (medie di sottoinsiemi di particelle provenienti dallo stesso orientamento). Diverse buone classi selezionate in rosso (con un certo livello di dettaglio) e alcune cattive classi non selezionate (classi rumorose e non centrate). Fare clic qui per visualizzare una versione più grande di questa figura.
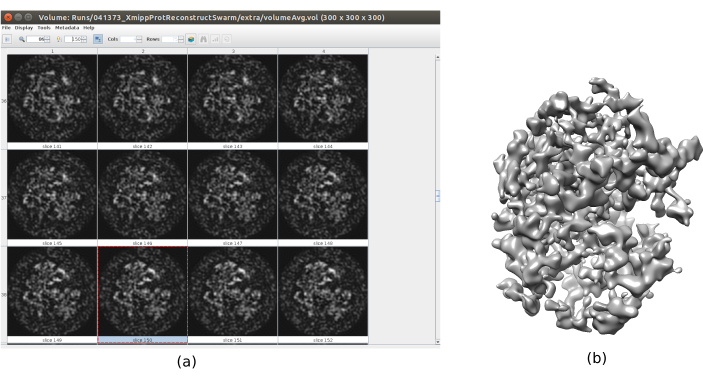
Figura 6. Volume iniziale 3D con risultato di consenso dello sciame. Una vista del volume iniziale 3D ottenuta dopo l'esecuzione dello strumento di consenso xmipp3 - consenso sciame, utilizzando le precedenti stime del volume iniziale 3D di Xmipp e Relion. a) Il volume è rappresentato da fette. (b) Visualizzazione 3D del volume. Fare clic qui per visualizzare una versione più grande di questa figura.
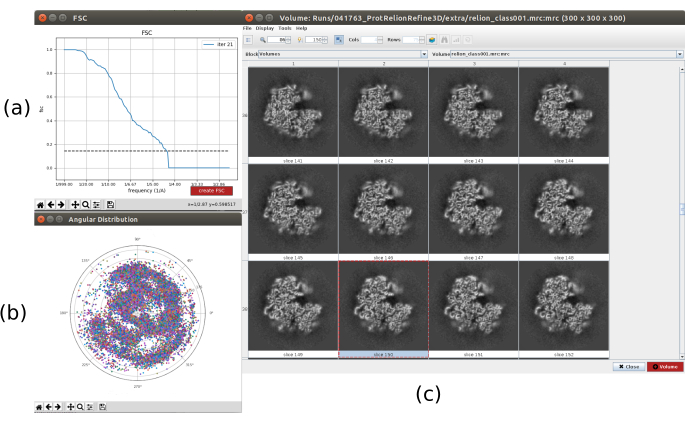
Figura 7. Affinamento di un volume iniziale 3D con risultato Relion. a) curva FSC ottenuta, superando la soglia a 4,5 Å, approssimativamente. (b) Copertura angolare mostrata come vista superiore della sfera 3D. In questo caso, poiché non vi è simmetria, le particelle assegnate dovrebbero coprire l'intera sfera. c) Volume raffinato rappresentato da fette. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura 8. Allineamento 3D basato sul deep learning con risultato Xmipp. I risultati generati da xmipp3 - metodo di allineamento profondo per l'allineamento 3D. (a) L'assegnazione angolare per ogni particella sotto forma di matrice di trasformazione. b) La copertura angolare. Fare clic qui per visualizzare una versione più grande di questa figura.
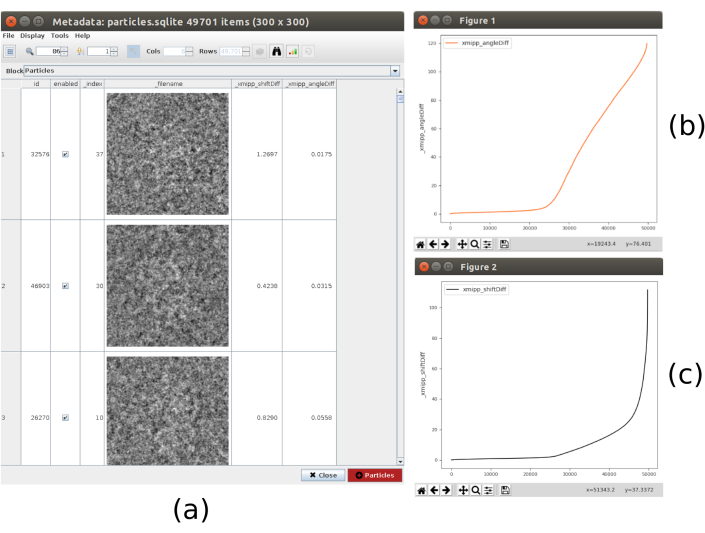
Figura 9. Risultato del consenso sull'allineamento 3D. (a) Elenco delle particelle con le differenze ottenute nei parametri di spostamento e angoli. b) Trama delle differenze angolari per particella. c) Traccia della differenza di spostamento per particella. Fare clic qui per visualizzare una versione più grande di questa figura.
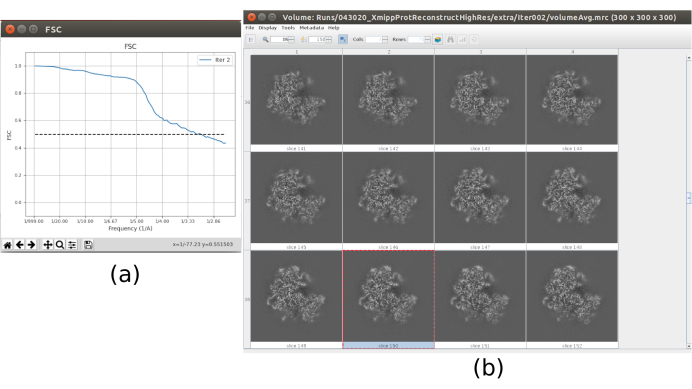
Figura 10. Iterazione finale del risultato del perfezionamento 3D. a) Curva FSC. (b) Volume ottenuto a piena risoluzione per fette. Fare clic qui per visualizzare una versione più grande di questa figura.
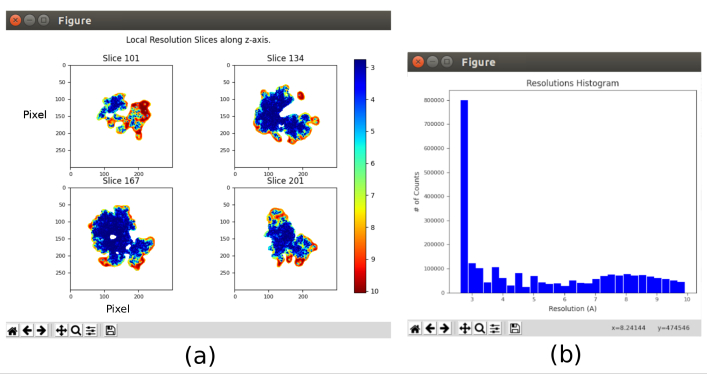
Figura 11. Analisi della risoluzione locale con risultato Xmipp. Risultati del metodo xmipp3 - MonoRes locale. (a) Alcune fette rappresentative colorate con il valore di risoluzione per voxel, come indicato nel codice colore. b) Istogramma di risoluzione locale. Fare clic qui per visualizzare una versione più grande di questa figura.
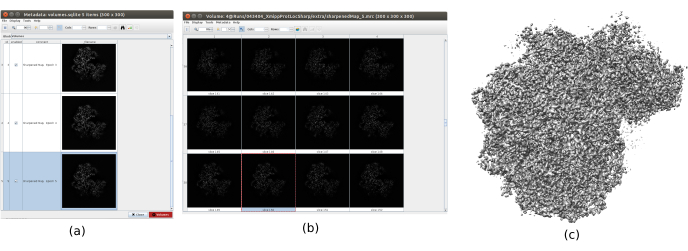
Figura 12. Affilatura con risultato Xmipp. Risultati di xmipp3 - metodo di affilatura localdeblur. (a) Elenco dei volumi ottenuti per iterazione. (b) volume 3D ottenuto dopo l'ultima iterazione rappresentata da slice. c) Una rappresentazione 3D del volume finale. Fare clic qui per visualizzare una versione più grande di questa figura.
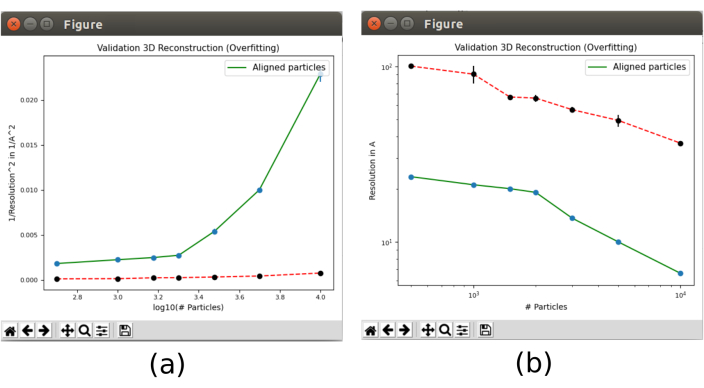
Figura 13. Convalida lo strumento di overfitting nel risultato Xmipp. Risultati di xmipp3 - overfitting di convalida. La linea verde corrisponde alla ricostruzione dai dati, la linea rossa dal rumore. (a) Inverso della risoluzione al quadrato con il logaritmo del numero di particelle. (b) Risoluzione con il numero di particelle. Fare clic qui per visualizzare una versione più grande di questa figura.
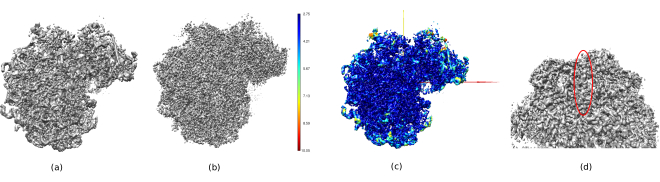
Figura 14. Diverse rappresentazioni 3D del volume ottenuto. a) Volume pretrificato. b) Volume post-elaborato. (c) Risoluzione locale, i voxel blu scuro sono quelli con risoluzione più alta (2,75 Å) e i voxel rosso scuro sono quelli con risoluzione inferiore (10,05 Å). (d) Ingrandire il volume post-elaborato in cui è possibile vedere un'alfa-elica (ovale rosso). Fare clic qui per visualizzare una versione più grande di questa figura.
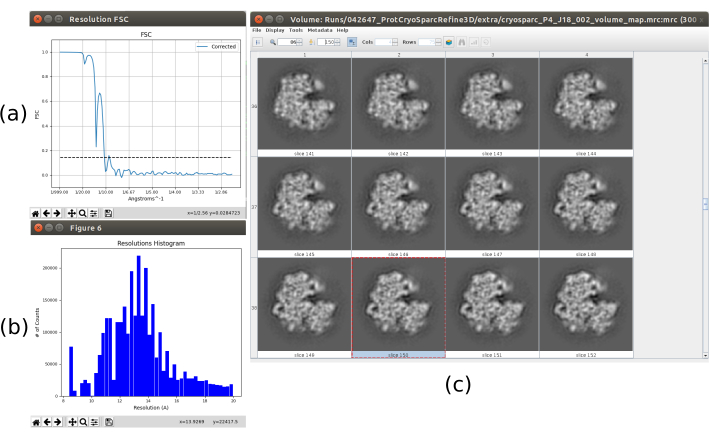
Figura 15. Esempio di una cattiva ricostruzione 3D. (a) Curva FSC con una forte caduta e superamento della soglia a bassa risoluzione. b) Istogramma di risoluzione locale. c) volume 3D per sezioni. Fare clic qui per visualizzare una versione più grande di questa figura.
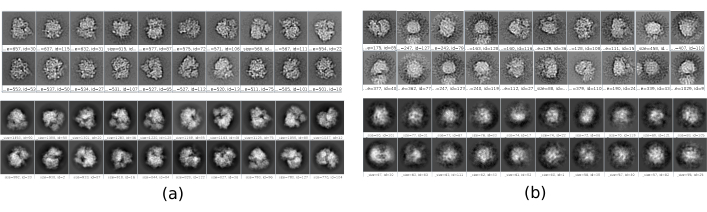
Figura 16. Esempio di classi 2D. (a) Buone classi che mostrano un certo livello di dettaglio. (b) Classi errate contenenti rumore e artefatti (parte superiore ottenuta con Xmipp, inferiore con CryoSparc). Fare clic qui per visualizzare una versione più grande di questa figura.
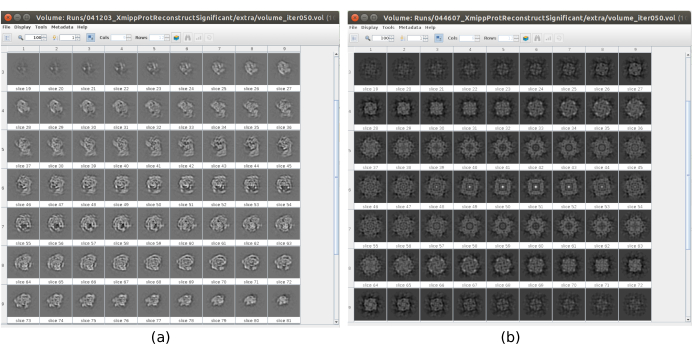
Figura 17. Esempio di volume iniziale 3D con diverse qualità. a) Buon volume iniziale in cui si può osservare la forma della macromolecola. b) Volume iniziale cattivo quando la forma ottenuta è completamente diversa da quella prevista. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1. Creazione di un progetto Scipion. Finestra visualizzata da Scipion in cui è possibile selezionare un vecchio progetto o crearne uno nuovo dando un nome e una posizione per quel progetto. Fare clic qui per scaricare questo file.
Figura supplementare 2. Metodo importa filmati. Finestra visualizzata da Scipion quando pwem - importa filmati è aperto. Qui, i principali parametri di acquisizione devono essere inclusi per consentire ai film disponibili di essere elaborati in Scipion. Fare clic qui per scaricare questo file.
Figura supplementare 3. Metodo di allineamento del filmato. Finestra visualizzata da Scipion quando si utilizza xmipp3 - allineamento ottico . I filmati di input, l'intervallo di fotogrammi considerati per l'allineamento e alcuni altri parametri per elaborare i filmati devono essere riempiti. Fare clic qui per scaricare questo file.
Figura supplementare 4. Metodo di stima CTF con Ctffind. Il modulo in Scipion con tutti i campi necessari per eseguire il programma Ctffind. Fare clic qui per scaricare questo file.
Figura supplementare 5. Wizard in Scipion. Una procedura guidata per aiutare l'utente a compilare alcuni parametri nel modulo. In questo caso, la procedura guidata deve completare il campo di risoluzione nel metodo grigoriefflab - ctffind . Fare clic qui per scaricare questo file.
Figura supplementare 6. Metodo di raffinamento CTF con Xmipp. La forma di stima xmipp3 - ctf con tutti i parametri per effettuare un perfezionamento di un CTF precedentemente stimato. Fare clic qui per scaricare questo file.
Figura supplementare 7. Metodo delle micrografie pre-elaborazione. La forma di xmipp3 - micrografie di pre-elaborazione che consente di eseguire alcune operazioni su di esse. In questo esempio, Rimuovi pixel danneggiati e micrografie Downsample è quello utile. Fare clic qui per scaricare questo file.
Figura supplementare 8. Metodo di raccolta con Cryolo. Modulo per eseguire il metodo di prelievo Cryolo utilizzando una rete pre-addestrata. Fare clic qui per scaricare questo file.
Figura supplementare 9. Metodo di consensus picking con Xmipp. La forma di xmipp3 - deep consensus picking basato sul deep learning per calcolare un consenso di coordinate, utilizzando una rete pre-addestrata su diversi set di coordinate ottenute con diversi metodi di picking. Fare clic qui per scaricare questo file.
Figura supplementare 10. Metodo di estrazione delle particelle. Schede di input e pre-elaborazione di xmipp3 - estrarre particelle. Fare clic qui per scaricare questo file.
Figura supplementare 11.3D metodo del volume iniziale con Xmipp. La forma del metodo xmipp3 - ricostruire significativo per ottenere una mappa 3D iniziale. Vengono visualizzate le schede Input e Criteri . Fare clic qui per scaricare questo file.
Figura supplementare 12. Metodo di ridimensionamento del volume. Modulo per ritagliare o ridimensionare un volume. In questo esempio, questo metodo viene utilizzato per generare un volume a grandezza naturale dopo xmipp3 - ricostruire significativo. Fare clic qui per scaricare questo file.
Figura supplementare 13.3D volume iniziale con risultato Relion. Una vista del volume iniziale 3D ottenuto con il metodo del modello iniziale 3D per sezioni. Fare clic qui per scaricare questo file.
Figura supplementare 14. Affinamento del volume iniziale con Relion. La forma del metodo relion - 3D auto-raffinazione. In questo esempio, è stato utilizzato per perfezionare un volume iniziale stimato dopo il consenso. Vengono visualizzate le schede Della mappa 3D Input e Reference. Fare clic qui per scaricare questo file.
Figura supplementare 15.3D metodo di classificazione. Forma di relion - classificazione 3D. Vengono visualizzate le schede Input, Mappa 3D di riferimento e Ottimizzazione . Fare clic qui per scaricare questo file.
Figura supplementare 16.3D allineamento basato su un metodo di deep learning. Il modulo aperto per il metodo xmipp3 - deep align. Qui è necessario addestrare una rete con un set di addestramento, quindi quella rete predirà l'assegnazione angolare per particella. Fare clic qui per scaricare questo file.
Figura supplementare 17.3D metodo di raffinamento. Forma del metodo xmipp3 - highres . Vengono visualizzate le schede Input e l'assegnazione angolare . Fare clic qui per scaricare questo file.
Figura supplementare 18. Prima iterazione del risultato del perfezionamento 3D. a) Curva FSC. (b) Volume ottenuto (di dimensioni inferiori alla piena risoluzione) rappresentato come fette. Fare clic qui per scaricare questo file.
Figura supplementare 19. Prima iterazione dell'analisi di correlazione di perfezionamento 3D. Una nuova finestra appare facendo clic sull'icona della barra nella parte superiore della finestra con l'elenco delle particelle. Nella finestra Colonne di plottaggio è possibile creare un istogramma del parametro stimato desiderato. Fare clic qui per scaricare questo file.
Figura supplementare 20. Strumento di overfitting di convalida. Forma di xmipp3 - convalidare il metodo di overfitting . Fare clic qui per scaricare questo file.
Discussione
Attualmente, cryo-EM è uno strumento chiave per rivelare la struttura 3D dei campioni biologici. Quando vengono raccolti buoni dati con il microscopio, gli strumenti di elaborazione disponibili ci permetteranno di ottenere una ricostruzione 3D della macromolecola in studio. L'elaborazione dei dati Cryo-EM è in grado di raggiungere una risoluzione quasi atomica, che è la chiave per comprendere il comportamento funzionale di una macromolecola ed è anche cruciale nella scoperta di farmaci.
Scipion è un software che consente di creare l'intero flusso di lavoro combinando i pacchetti di elaborazione delle immagini più rilevanti in modo integrativo, che aiuta la tracciabilità e la riproducibilità dell'intero flusso di lavoro di elaborazione delle immagini. Scipion fornisce un set molto completo di strumenti per effettuare l'elaborazione; tuttavia, l'ottenimento di ricostruzioni ad alta risoluzione dipende completamente dalla qualità dei dati acquisiti e dal modo in cui questi dati vengono elaborati.
Per ottenere una ricostruzione 3D ad alta risoluzione, il primo requisito è quello di ottenere buoni filmati dal microscopio, che preservino le informazioni strutturali ad alta risoluzione. In caso contrario, il flusso di lavoro non sarà in grado di estrarre informazioni ad alta definizione dai dati. Quindi, un flusso di lavoro di elaborazione di successo dovrebbe essere in grado di estrarre particelle che corrispondono realmente alla struttura e di trovare gli orientamenti di queste particelle nello spazio 3D. Se uno dei passaggi del flusso di lavoro non riesce, la qualità del volume ricostruito verrà ridotta. Scipion consente di utilizzare diversi pacchetti in una qualsiasi delle fasi di elaborazione, il che aiuta a trovare l'approccio più adeguato per elaborare i dati. Inoltre, grazie alla disponibilità di molti pacchetti, è possibile utilizzare strumenti di consenso che aumentano l'accuratezza trovando un accordo nei risultati stimati di diversi metodi. Inoltre, è stato discusso in dettaglio nella sezione Risultati rappresentativi diversi strumenti di convalida e come identificare risultati accurati e imprecisi in ogni fase del flusso di lavoro, per rilevare potenziali problemi e come cercare di risolverli. Ci sono diversi checkpoint lungo il protocollo che potrebbero aiutare a capire se il protocollo funziona correttamente o meno. Alcuni dei più rilevanti sono: picking, classificazione 2D, stima iniziale del volume e allineamento 3D. Controllare gli input, ripetere il passaggio con un metodo diverso o utilizzare il consenso, sono opzioni disponibili in Scipion che l'utente può utilizzare per trovare soluzioni quando si presentano problemi.
Per quanto riguarda i precedenti approcci all'integrazione dei pacchetti in ambito Cryo-EM, Appion31 è l'unico che consente una reale integrazione di diversi pacchetti software. Tuttavia, Appion è strettamente connesso con Leginon32, un sistema per la raccolta automatizzata di immagini da microscopi elettronici. La differenza principale con Scipion è che il modello di dati e l'archiviazione sono meno accoppiati. In tal modo, per creare un nuovo protocollo in Scipion, è necessario sviluppare solo uno script Python. Tuttavia, in Appion, lo sviluppatore deve scrivere lo script e modificare il database sottostante. In sintesi, Scipion è stato sviluppato per semplificare la manutenzione e l'estensibilità.
Abbiamo presentato in questo manoscritto un flusso di lavoro completo per l'elaborazione Cryo-EM, utilizzando il set di dati del caso reale del ribosoma Plasmodium falciparum 80S (voce EMPIAR: 10028, voce EMDB: 2660). I passaggi trattati e discussi qui possono essere riassunti come allineamento del film, stima CTF, raccolta delle particelle, classificazione 2D, stima iniziale della mappa, classificazione 3D, perfezionamento 3D, valutazione e post-elaborazione. Sono stati utilizzati diversi pacchetti e sono stati applicati strumenti di consenso in molti di questi passaggi. Il volume finale ricostruito in 3D ha raggiunto una risoluzione di 3 Å e, nel volume post-elaborato, si possono distinguere alcune strutture secondarie, come le alfa-eliche, che aiutano a descrivere come gli atomi sono disposti nello spazio.
Il flusso di lavoro presentato in questo manoscritto mostra come Scipion può essere utilizzato per combinare diversi pacchetti Cryo-EM in modo semplice e integrativo per semplificare l'elaborazione e ottenere risultati più affidabili allo stesso tempo.
In futuro, lo sviluppo di nuovi metodi e pacchetti continuerà a crescere e software come Scipion per integrarli facilmente tutti saranno ancora più importanti per i ricercatori. Gli approcci di consenso saranno più rilevanti anche allora, quando saranno disponibili molti metodi con basi diverse, contribuendo a ottenere stime più accurate di tutti i parametri coinvolti nel processo di ricostruzione in Cryo-EM. Il monitoraggio e la riproducibilità sono fondamentali nel processo di ricerca e più facili da raggiungere con Scipion grazie all'avere un framework comune per l'esecuzione di flussi di lavoro completi.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano riconoscere il sostegno economico di: Il Ministero spagnolo della Scienza e dell'Innovazione attraverso sovvenzioni: PID2019-104757RB-I00/AEI/10.13039/501100011033, la "Comunidad Autónoma de Madrid" attraverso Grant: S2017/BMD-3817, Instituto de Salud Carlos III, PT17/0009/0010 (ISCIII-SGEFI/FESR), Unione Europea (UE) e Horizon 2020 attraverso la sovvenzione: INSTRUCT - ULTRA (INFRADEV-03-2016-2017, Proposta: 731005), EOSC Life (INFRAEOSC-04-2018, Proposta: 824087), iNEXT - Discovery (Proposta: 871037) e HighResCells (ERC - 2018 - SyG, Proposta: 810057). Il progetto che ha dato origine a questi risultati ha ricevuto il sostegno di una borsa di studio della Fondazione "la Caixa" (ID 100010434). Il codice della borsa di studio è LCF/BQ/DI18/11660021. Questo progetto ha ricevuto finanziamenti dal programma di ricerca e innovazione Horizon 2020 dell'Unione europea nell'ambito della convenzione di sovvenzione Marie Skłodowska-Curie n. 713673. Gli autori riconoscono il supporto e l'uso delle risorse di Instruct, un progetto Landmark ESFRI.
Materiali
| Name | Company | Catalog Number | Comments |
| no material is used in this article | - | - | - |
Riferimenti
- Nogales, E. The development of cryo-EM into a mainstream structural biology technique. Nature Methods. 13 (1), 24-27 (2016).
- Kühlbrandt, W. The Resolution Revolution. Science. 343 (6178), 1443-1444 (2014).
- . 1.15 A structure of human apoferritin obtained from Titan Mono- BCOR microscope Available from: https://www.rcsb.org/structure/7A6A (2021)
- Arnold, S. A., et al. Miniaturizing EM Sample Preparation: Opportunities, Challenges, and "Visual Proteomics". PROTEOMICS. 18 (5-6), 1700176 (2018).
- Faruqi, A. R., McMullan, G. Direct imaging detectors for electron microscopy. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 878, 180-190 (2018).
- Vilas, J. L., et al. Advances in image processing for single-particle analysis by electron cryomicroscopy and challenges ahead. Current Opinion in Structural Biology. 52, 127-145 (2018).
- Martinez, M., et al. Integration of Cryo-EM Model Building Software in Scipion. Journal of Chemical Information and Modeling. 60, 2533-2540 (2020).
- de la Rosa-Trevín, J. M., et al. Scipion: A software framework toward integration, reproducibility and validation in 3D electron microscopy. Journal of Structural Biology. 195, 93-99 (2016).
- de la Rosa-Trevín, J. M., et al. Xmipp 3.0: an improved software suite for image processing in electron microscopy. Journal of Structural Biology. 184, 321-328 (2013).
- Scheres, S. H. W. . Methods in Enzymology. The Resolution Revolution: Recent Advances In cryoEM. , 125-157 (2016).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. cryoSPARC: algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. 14, 290-296 (2017).
- Ludtke, S. J. 3-D structures of macromolecules using single-particle analysis in EMAN. Methods in Molecular Biology. 673, 157-173 (2010).
- Shaikh, T. R., et al. SPIDER image processing for single-particle reconstruction of biological macromolecules from electron micrographs. Nature Protocols. 3, 1941-1974 (2008).
- Wagner, T., et al. SPHIRE-crYOLO is a fast and accurate fully automated particle picker for cryo-EM. Communications Biology. 2, (2019).
- Mindell, J. A., Grigorieff, N. Accurate determination of local defocus and specimen tilt in electron microscopy. Journal of Structural Biology. 142, 334-347 (2003).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta crystallographica. Section D, Biological crystallography. 67, 235-242 (2011).
- Liebschner, D., et al. Macromolecular structure determination using X-rays, neutrons and electrons: recent developments in Phenix. Acta Crystallographica Section D. 75, 861-887 (2019).
- Wong, W., et al. Cryo-EM structure of the Plasmodium falciparum 80S ribosome bound to the anti-protozoan drug emetine. eLife. 3, 03080 (2014).
- Abrishami, V., et al. Alignment of direct detection device micrographs using a robust Optical Flow approach. Journal of Structural Biology. 189, 163-176 (2015).
- Sorzano, C. O. S., Jonic, S., Nunez Ramirez, R., Boisset, N., Carazo, J. M. Fast, robust and accurate determination of transmission electron microscopy contrast transfer function. Journal of Structural Biology. 160, 249-262 (2007).
- Abrishami, V., et al. A pattern matching approach to the automatic selection of particles from low-contrast electron micrographs. Bioinformatics. 29, 2460-2468 (2013).
- Sanchez-Garcia, R., Segura, J., Maluenda, D., Carazo, J. M., Sorzano, C. O. S. Deep Consensus, a deep learning-based approach for particle pruning in cryo-electron microscopy. IUCrJ. 5, 854-865 (2018).
- Sorzano, C. O. S., et al. A clustering approach to multireference alignment of single-particle projections in electron microscopy. Journal of Structural Biology. 171, 197-206 (2010).
- Sorzano, C. O. S., et al. A statistical approach to the initial volume problem in Single Particle Analysis by Electron Microscopy. Journal of Structural Biology. 189, 213-219 (2015).
- Sorzano, C. O. S., et al. Swarm optimization as a consensus technique for Electron Microscopy Initial Volume. Applied Analysis and Optimization. 2, 299-313 (2018).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. Journal of computational chemistry. 25, 1605-1612 (2004).
- Sorzano, C. O. S., et al. A new algorithm for high-resolution reconstruction of single particles by electron microscopy. Journal of Structural Biology. 204, 329-337 (2018).
- Vilas, J. L., et al. MonoRes: Automatic and Accurate Estimation of Local Resolution for Electron Microscopy Maps. Structure. 26, 337-344 (2018).
- Ramirez-Aportela, E., et al. Automatic local resolution-based sharpening of cryo-EM maps. Bioinformatics. 36, 765-772 (2020).
- Heymann, J. B. Validation of 3D EM Reconstructions: The Phantom in the Noise. AIMS Biophys. 2, 21-35 (2015).
- Lander, G. C., et al. Appion: An integrated, database-drive pipeline to facilitate EM image processing. Journal of Structural Biology. 166, 95-102 (2009).
- Suloway, C., et al. Automated molecular microscopy: The new Leginon system. Journal of Structural Biology. 151, 41-60 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon