È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Istituzione dell'epatocarcinoma nei topi BALB/c-nu e studio dell'effetto terapeutico della formula Sanleng Jiashen
In questo articolo
Riepilogo
Qui, presentiamo il protocollo passo-passo per studiare gli effetti terapeutici e inibitori vascolari della formula Sanleng Jiashen su topi BALB/c-nu con carcinoma epatocellulare ortotopico.
Abstract
La letalità del cancro al fegato e la resistenza ai farmaci chimici hanno costretto alla ricerca di prescrizioni efficaci di erbe tradizionali per il cancro al fegato. Modelli animali ripetibili, facili da manipolare e altamente imitanti i processi fisiopatologici del cancro al fegato sono il prerequisito per il successo dello screening di candidati farmaci efficaci. Nel frattempo, indicatori e mezzi affidabili per la valutazione dell'efficacia dei farmaci sono anche la garanzia della ricerca e dello sviluppo di farmaci antitumorali al fegato.
Formula Sanleng Jiashen, una prescrizione rappresentativa della medicina tradizionale cinese contenente Sparganium stoloni erum, Buch. -Prosciutto. (Sanleng), Panax ginseng C. A. Mey. (ginseng), Rheum officinale Baill. (rabarbaro) e Ligusticum chuanxiong Hort. (Chuanxiong), è prescritto per nutrire il fegato e eliminare il calore, rimuovere le tossine e promuovere la circolazione sanguigna per trattare il cancro al fegato. Questo protocollo sperimentale descrive la preparazione della formula liofilizzata di Sanleng Jiashen e il processo di instaurazione del carcinoma epatico in situ nei topi BALB/c-nu. La colorazione istopatologica, il rilevamento immunoistochimico dei marcatori tumorali, l'imaging in vivo di topi e il test della membrana corioallantoica dell'embrione di pollo sono stati utilizzati per esplorare l'inibizione e l'effetto anti-angiogenesi della formula Sanleng Jiashen sulla proliferazione maligna del tessuto tumorale del fegato. I dati mostrano che la formula Sanleng Jiashen può resistere efficacemente alla proliferazione maligna del tessuto tumorale del fegato, che si manifesta con una riduzione del volume della massa tumorale, un miglioramento del danno patologico e livelli più bassi del marcatore tumorale ki67.
L'inibizione superiore dell'angiogenesi suggerisce anche che la formula Sanleng Jiashen può avere il potenziale per trattare e prevenire la progressione e il deterioramento del cancro al fegato. L'intero schema sperimentale mostra un processo completo di componenti della medicina tradizionale cinese nel trattamento del cancro al fegato del topo, che fornisce un riferimento per la creazione e l'ottimizzazione di un modello di cancro al fegato, nonché la ricerca e lo sviluppo di farmaci per prevenire e curare il cancro al fegato.
Introduzione
Il cancro al fegato è un tumore mortale che ha origine nel fegato ed è la seconda causa più comune di morte correlata al cancro in tutto il mondo1. I tassi di malattie del fegato negli Stati Uniti e in alcuni paesi in via di sviluppo stanno mostrando livelli elevati e potrebbero esserci più di 1 milione di casi di cancro al fegato in tutto il mondo entro il 20302. A causa di abitudini di vita malsane come il fumo, l'obesità e l'alcolismo e le devastazioni dell'epatite B, dell'epatite C e di altri virus, l'incidenza e la mortalità del cancro al fegato sono aumentate significativamente di annoin anno. Essendo un tumore maligno eterogeneo con diverse caratteristiche istologiche e prognosi infausta, il cancro del fegato ha una gamma molto ampia di incidenze, tra cui il carcinoma epatocellulare, il colangiocarcinoma intraepatico e il carcinoma epatico fibrolamellare4. Il cancro al fegato viene spesso diagnosticato in uno stadio avanzato e molti pazienti avanzati non sono candidati alla radioterapia5. L'inibitore della multichinasi sorafenib è un farmaco altamente accettato per i pazienti con carcinoma epatico avanzato, ma i pazienti spesso sviluppano una resistenza significativa entro un breve periodo6. Attualmente, gli inibitori del checkpoint immunitario PD-1 e PD-L1 combinati con sorafenib hanno fatto alcuni progressi nel controllo dello sviluppo del cancro al fegato, ma l'effetto terapeutico è ancora controverso7.
Il carcinoma epatico ortotopico è un tipo precoce di cancro al fegato: le cellule tumorali non si sono diffuse nel tessuto epatico né si verificano metastasi interorganiche e la funzione del fegato non è notevolmente influenzata8. Poiché il carcinoma epatico ortotopico generalmente non appare sintomi di disagio evidenti, alcuni pazienti possono avere lieve dolore al fegato, affaticamento e altri sintomi9. Nella pratica clinica, l'ecografia color Doppler del fegato e l'esame avanzato della tomografia computerizzata possono diagnosticare lesioni sostanziali che occupano spazio nel fegato10. Sebbene il cancro al fegato locale che non si è diffuso e metastatizzato possa essere rimosso chirurgicamente, ci sono alcuni rischi chirurgici e l'inevitabile carico psicologico per i pazienti11. La chemioradioterapia può uccidere tutte o parte delle cellule tumorali del fegato e l'immunosoppressione a lungo termine nei pazienti con farmaci può influenzare l'efficacia del trattamento e aumentare il rischio di altre malattie12. Pertanto, la ricerca di una terapia farmacologica sicura ed efficace per la prevenzione e il trattamento precoce del cancro al fegato è la chiave per frenare la progressione e il deterioramento del cancro al fegato.
Il principio della medicina cinese per il trattamento del cancro al fegato si basa sul concetto di equilibrio e armonia all'interno del corpo. La medicina cinese considera il cancro al fegato come uno squilibrio o una disarmonia nell'energia del corpo, nota come Qi, che colpisce il fegato13. Il trattamento della medicina cinese per il cancro al fegato prevede vari approcci, tra cui la fitoterapia, l'agopuntura, la terapia dietetica e le raccomandazioni sullo stile di vita. Il principio è quello di ripristinare l'equilibrio del Qi, rafforzare i meccanismi di difesa del corpo e promuovere la capacità del corpo di guarire se stesso14,15. Il cancro al fegato nella medicina tradizionale cinese appartiene alla categoria dei "timpaniti" e dell'"accumulo di fegato". Già nel "Canone Interno di Huangdi" c'è una registrazione dettagliata dei suoi sintomi, il cancro al fegato è causato dalla stasi del sangue e dalla carenza di Zhengqi e viene trattato rimuovendo la stasi del sangue, eliminando le timpaniti e rafforzando la resistenza del corpo per consolidare la costituzione13. La pillola Sanleng ha avuto origine dal libro "Weisheng Baojian" scritto da Luo Tianyi, un famoso medico della dinastia Yuan. È composto da tre tipi di farmaci: Sparganium stoloni erum, Buch. -Prosciutto. (Sanleng), Ligusticum chuanxiong Hort. (Chuanxiong), e Rheum officinale Baill. (rabarbaro). Questi tre tipi di farmaci possono entrare nel meridiano del fegato e avere un valore terapeutico per il trattamento del cancro al fegato14. La formula di Sanleng Jiashen è composta da 16 g di Sanleng, 16 g di Panax ginseng C.A.Mey. (ginseng), 8 g di rabarbaro e 2 g di Chuanxiong (Figura 1), che viene prescritto per tonificare il fegato, eliminare il calore, eliminare le tossine e favorire la circolazione sanguigna. Si ritiene che queste erbe abbiano proprietà antitumorali e aiutino a ridurre la crescita del tumore, alleviare i sintomi e migliorare il benessere generale. Nei precedenti esperimenti in vitro, la formula Sanleng Jiashen può inibire la proliferazione delle cellule tumorali del fegato15. Tuttavia, come valutare in modo efficiente e ragionevole l'effetto inibitorio dei composti erboristici cinesi sul cancro al fegato? Stabilendo un modello di carcinoma epatico in situ di topo BALB/c-nu, l'effetto inibitorio della formula Sanleng Jiashen sul cancro al fegato e sull'angiogenesi è stato studiato principalmente attraverso l'imaging dal vivo di piccoli animali e il test della membrana corioallantoica dell'embrione di pollo.
Protocollo
Topi nudi maschi BALB/c-nu privi di patogeni specifici, di età di 5 settimane e del peso di 18-22 g sono stati alimentati nell'Animal Experimental Center of Transformation Medical College dell'Università di Jilin; le condizioni di alimentazione erano 22 °C-24 °C con 40%-60% di umidità relativa. Il numero di licenza per animali da esperimento è SYXK(Ji) 2018-0006 e il processo sperimentale è conforme alle norme e ai regolamenti del Comitato Etico dell'Università di Jilin e il numero di approvazione dell'etica animale è 20221228-01.
1. Preparazione della formula liofilizzata Sanleng Jiashen 15
- Mettere 16 g di Sanleng, 16 g di ginseng, 8 g di rabarbaro e 2 g di Chuanxiong in un recipiente per decotto intelligente (vedi Tabella dei materiali) e immergere in 294 ml di acqua deionizzata a temperatura ambiente per 30 minuti. Dopo il riscaldamento e l'ebollizione, continuare la cottura per 30 minuti a 100 °C e filtrare il liquido con doppia garza medica (vedi Tabella dei Materiali). Aggiungere 252 mL di acqua deionizzata al residuo, cuocere per 30 min a 100 °C e filtrare il liquido con doppia garza.
- Raccogliere il filtrato del passaggio 1.1 in una capsula di acciaio inossidabile pulita e congelare per 12 ore a -80 °C (vedi Tabella dei materiali).
- Mettere la formula Sanleng Jiashen del passaggio 1.2 in un liofilizzatore sottovuoto (vedi Tabella dei materiali) (temperatura della trappola fredda: -55 °C) e asciugare per 48 ore per ottenere la polvere liofilizzata della formula Sanleng Jiashen.
2. Costruzione di una linea cellulare HCCLM3 che esprime stabilmente la luciferasi16
- Aggiungere 1,0 mL di sospensione cellulare HCCLM3 nella piastra a 24 pozzetti (vedere Tabella dei materiali) con 5 × 105 cellule/pozzetto e coltura in un terreno completo (10% siero fetale bovino + 1% soluzione di penicillina-streptomicina + DMEM) (vedere Tabella dei materiali) contenente 3 μg/mL di puromicina per 72 ore in un incubatore cellulare (37 °C, 5% CO2, vedi Tabella dei materiali).
- Scartare il surnatante cellulare al punto 2.1 e aggiungere 100 μL di soluzione di tripsina allo 0,25% per digerire le cellule in un incubatore cellulare per 1 minuto (vedere la Tabella dei materiali). Aggiungere 300 μl di terreno completo e utilizzare una pipetta per liberare le cellule aderenti e terminare la digestione. Raccogliere tutte le sospensioni cellulari e metterle in una provetta da centrifuga da 15 ml a temperatura ambiente a 1.000 × g per 5 minuti. Dopo aver eliminato il surnatante, aggiungere 1 mL di terreno completo e mescolare pipettando.
- Aggiungere 100 μl di sospensione cellulare di 4 ×10 3 cellule HCCLM3/pozzetto dalla fase 2.2 in una piastra a 96 pozzetti e coltivare in un incubatore cellulare per 24 ore (37 °C, 5% CO2, vedere la Tabella dei materiali).
- Aggiungere 0,27 μL di lentivirus GFP alle piastre a 96 pozzetti nella fase 2.3 e coltivare in un incubatore cellulare per 15 ore (37 °C, 5% CO2, vedere la Tabella dei materiali). Scartare il surnatante cellulare, aggiungere 100 μl di terreno di coltura completo e acquisire immagini utilizzando un microscopio a fluorescenza alla lunghezza d'onda di eccitazione di 488 nm e alla lunghezza d'onda di emissione di 507 nm (vedere la tabella dei materiali).
- Sostituire 2 mL di lentivirus GFP e continuare la coltura per 24 ore. Sostituire 2 mL di terreno di coltura completo senza lentivirus GFP per altre 24 ore.
NOTA: L'efficienza di trasfezione del lentivirus GFP in cellule HCCLM3 è stata dell'80% rispetto a un microscopio a fluorescenza invertita. - Aggiungere 5 mL di sospensione cellulare 2 × 105 dalla fase 2.1 in una piastra di Petri da 60 mm e coltivare in un incubatore cellulare per 24 ore. Aggiungere 64,5 μL di luciferasi e continuare la coltura in un incubatore cellulare per 15 ore (37 °C, 5% CO2, vedere la Tabella dei materiali).
- Scartare il surnatante e aggiungere 5 mL di terreno completo per continuare la coltura fino a quando le cellule non sono diventate confluenti al 90% nella piastra di Petri. Eliminare il surnatante cellulare, lavare con 2 x 1 mL di PBS e aggiungere 1 mL di soluzione di tripsina allo 0,25% per digerire le cellule in un incubatore cellulare per 1 minuto (37 °C, 5% CO2, vedere la Tabella dei materiali). Aggiungere 3 mL di terreno completo e pipettare su e giù per liberare le cellule aderenti e terminare la digestione. Raccogliere tutte le sospensioni cellulari per la successiva iniezione nel topo.
NOTA: Per ottenere un numero sufficiente di cellule, le cellule sono state continuamente fatte passare e coltivate.
3. Istituzione di un modello murino nudo BALB/c-nu di carcinoma epatico in situ e trattamento15
- Aggiungere 100 μl di 1 × 107 cellule HCCLM3 trasfettate con luciferasi al passaggio 2.7 e 100 μl di colla per matrici (vedere Tabella dei materiali) in una provetta da centrifuga da 1,5 mL (vedere Tabella dei materiali) e mescolare leggermente con una pipetta da 1 mL (vedere Tabella dei materiali).
NOTA: L'intero processo di preparazione della soluzione deve essere eseguito su ghiaccio per evitare che la colla della matrice si indurisca. - Disinfettare le ascelle sinistra e destra dei topi nudi BALB/c-nu con iodopina (vedi Tabella dei Materiali) e deiodare con alcool (vedi Tabella dei Materiali).
- Iniettare lentamente 100 μL della miscela di cellule HCCLM3 e colla per matrice dal passaggio 3.1 sotto le ascelle sinistra e destra di topi nudi BALB/c-nu con una siringa monouso da 1 mL.
NOTA: Dopo circa 10 giorni, i topi nudi BALB/c-nu hanno sviluppato una massa tumorale di circa 0,5cm3 nel sito di iniezione ascellare bilaterale. - Anestetizzare i topi nudi BALB/c-nu nella fase 3.3 mediante iniezione intraperitoneale dell'1%, 50 mg/kg di pentobarbital di sodio. Tagliare la pelle di entrambe le ascelle con una forbice oftalmica e una pinzetta (vedere Tabella dei materiali) e sbucciare delicatamente la massa tumorale sottocutanea per metterla in una piastra di coltura cellulare (vedere Tabella dei materiali) contenente un tampone PBS pre-raffreddato (vedere Tabella dei materiali) e tagliarla in 1 mm3 pezzi con un bisturi (vedere Tabella dei materiali).
NOTA: La massa tumorale ascellare dei topi nudi BALB/c-nu deve essere raccolta su ghiaccio entro 0,5 ore per mantenere l'attività delle cellule tumorali e aumentare il tasso di successo del modello. Al termine del campionamento, i topi sono stati uccisi mediante rimozione delle vertebre cervicali. Se c'è una parte necrotica del tumore, deve essere rimossa, lasciando solo il tumore bianco del pesce per prevenire l'infezione durante il trapianto di cancro ortotopico. - Anestetizzare topi nudi BALB/c-nu con l'1%, 50 mg/kg di pentobarbital di sodio per via intraperitoneale (vedi Tabella dei Materiali), disinfettare l'addome con iodio (vedi Tabella dei Materiali) e deiodare con alcol (vedi Tabella dei Materiali).
- Utilizzare una forbice oftalmica e una pinzetta (vedi Tabella dei materiali) per praticare un'incisione chirurgica di 45° a circa 1 cm nella posizione di 0,5 cm sotto il processo xifoideo per esporre il fegato, premere delicatamente il fegato per spremere il tessuto epatico e fissare il fegato con carta da pesare.
NOTA: Tamponi di cotone o bastoncini possono essere posizionati sotto le costole dei topi per esporre efficacemente il fegato. - Prelevare un piccolo pezzo di tessuto tumorale al punto 3.4 con un ago per iniezione monouso da 10 ml e impiantare la massa tumorale nel fegato a circa 0,5 cm parallelamente al fegato per fissarlo sotto la capsula epatica e ritirare lentamente l'ago.
NOTA: Utilizzare una siringa monouso da 1 ml per far cadere 2 gocce di colla per matrice fusa, osservare la massa tumorale senza scivolamenti accidentali e senza sanguinamento, quindi suturare l'incisione chirurgica. - Chiudere l'incisione chirurgica con una pinza porta-ago da 12 cm e suture chirurgiche 6-0 (vedi Tabella dei materiali). Applicare unguento oculare all'eritromicina (vedere Tabella dei materiali) sul sito chirurgico per prevenire l'infezione. Posiziona i topi su un tappetino riscaldato (vedi Tabella dei materiali) e tienili in gabbie separate dopo il risveglio.
- A partire dal primo giorno dopo la modellazione, somministrare 7,5 mg/kg di sorafenib e Sanleng Jiashen formula (7,8 g/kg, 15,6 g/kg e 31,2 g/kg) tramite sonda gastrica ai topi dal passaggio 3.8 per 14 giorni, una volta al giorno. Somministrare un volume uguale di soluzione fisiologica normale ai topi del gruppo modello.
4. Valutazione dell'imaging in vivo
NOTA: Il giorno 14, l'imaging dal vivo è stato eseguito 1 ora dopo la fine della somministrazione.
- Accendere il computer e lo strumento di imaging in vivo (vedere la Tabella dei materiali). Fare doppio clic sull'icona Immagine vivente sul desktop per avviare il programma. Fare clic su inizializza sistema IVIS nel pannello di controllo per avviare l'intero sistema IVIS.
NOTA: Dopo che la macchina ha completato l'autotest, la spia di stato della temperatura nel pannello di controllo è rossa. Attendere circa 5-10 minuti dopo che la temperatura è scesa e la luce diventa verde, è possibile eseguire l'acquisizione dell'immagine. - Disinfettare l'addome dei topi con alcol e iniettare intraperitonealmente 10 μL di D-luciferina per g di peso corporeo (vedere Tabella dei materiali) con una siringa monouso. Anestetizzare i topi mediante iniezione intraperitoneale dell'1%, 50 mg/kg di pentobarbital sodico.
NOTA: La D-luciferina è stata diluita con PBS sterile a 15 mg/mL. - Inserire i topi anestetizzati al punto 4.3 nella scatola di osservazione e chiudere lo sportello, impostare il tempo di esposizione su 30 s nel pannello di controllo: Selezione modalità: selezionare la luminescenza in base al tipo di campione, selezionare il programma automatico per impostazione predefinita e premere Acquisisci per acquisire le immagini.
- Fare clic su Salva dati immagine vivente, selezionare Tutti i file di dati immagine viventi e salvarlo sul desktop del computer.
- Fare clic su Esci nell'immagine vivente nella schermata principale. Spegnere la fotocamera, lo strumento di imaging e il computer a turno.
- Dopo l'imaging, sopprimere i topi anestetizzati (iniezione intraperitoneale dell'1%, 50 mg/kg di pentobarbital di sodio) mediante lussazione delle vertebre cervicali.
5. Colorazione con ematossilina-eosina17
- Fissare il tessuto epatico fresco dei topi dal passaggio 4.7 in paraformaldeide al 4% per 48 ore, quindi risciacquare con acqua corrente 3 volte per 5 minuti ogni volta per lavare via la paraformaldeide (vedi Tabella dei materiali).
- Disidratare i tessuti epatici al punto 5.1 in etanolo al 30%, etanolo al 50%, etanolo al 70%, etanolo
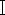 al 95%, etanolo
al 95%, etanolo 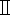 al 95% ed etanolo anidro per 1 ora a turno (vedere la Tabella dei Materiali).
al 95% ed etanolo anidro per 1 ora a turno (vedere la Tabella dei Materiali). - Mettere i tessuti epatici disidratati in sequenza da 5.2 a 50% di etanolo, 50% di xilene, xilene
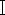 , xilene
, xilene 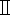 e xilene
e xilene  per renderli trasparenti per 1 ora (vedi Tabella dei materiali).
per renderli trasparenti per 1 ora (vedi Tabella dei materiali).
NOTA: Lo xilene è volatile e tossico, questo passaggio viene effettuato nella cappa aspirante. - Sciogliere la cera di paraffina e mantenere la temperatura a circa 55 °C. Posizionare i blocchi di tessuto epatico al punto 5.3 in una macchina per l'inclusione di paraffina (vedi Tabella dei materiali) riempita con una soluzione di cera per l'inclusione.
- Fissare il blocco di cera incorporato del tessuto epatico dei topi al punto 5.4 sull'affettatrice per paraffina (vedi Tabella dei materiali), tagliarlo a fette spesse 5 μm, adagiare le fette completamente piatte in acqua a 50 °C e raccoglierle con un vetrino. Infine metterli in una macchina da forno biologica per l'essiccazione 20 minuti a 70 °C (vedi Tabella dei Materiali).
- Immergere le sezioni da 5 μm nel passaggio 5.5 in xilene
 , xilene
, xilene  , etanolo
, etanolo  anidro ed etanolo
anidro ed etanolo  anidro per 10 minuti consecutivi, quindi immergere in etanolo al 95%, etanolo al 90%, etanolo all'80% ed etanolo al 70% rispettivamente per 5 minuti e infine lavare con acqua distillata per il trattamento di deceratura (vedere la tabella dei materiali).
anidro per 10 minuti consecutivi, quindi immergere in etanolo al 95%, etanolo al 90%, etanolo all'80% ed etanolo al 70% rispettivamente per 5 minuti e infine lavare con acqua distillata per il trattamento di deceratura (vedere la tabella dei materiali). - Colorare le sezioni di tessuto epatico di cera di parrafin disidratate e spesse 5 μm con ematossilina per 8 minuti, quindi risciacquare con acqua corrente.
- Differenziare in soluzione di acido cloridrico all'1% per 10 s e risciacquare con acqua corrente per 30 minuti (vedi Tabella dei materiali).
- Colorante con soluzione di eosina allo 0,5% per 1 minuto (vedi Tabella dei materiali).
- Mettere le fette in alcol
 al 95%, alcol
al 95%, alcol  al 95%, etanolo anidro, etanolo
al 95%, etanolo anidro, etanolo 
 anidro, xilene
anidro, xilene  e xilene
e xilene  per 5 minuti ciascuna per disidratare (vedi Tabella dei materiali).
per 5 minuti ciascuna per disidratare (vedi Tabella dei materiali). - Sigillare con gomma neutra e scattare foto al microscopio a luce invertita (vedi Tabella dei materiali).
6. Colorazione immunoistochimica18
- Versare l'1,5% di H2O2 sulle sezioni da 5 μm di fegato di topo al punto 5.6 e incubare a temperatura ambiente per 10 minuti, quindi lavare con PBS per 2 x 5 minuti (vedi Tabella dei materiali).
- Riparare il tessuto con una soluzione di acido citrico (vedere la Tabella dei materiali) per 5 minuti e lavare con PBS per 3 x 5 minuti.
- Incubare con tritone X-100 allo 0,2% (vedere Tabella dei materiali) a temperatura ambiente per 4 minuti, quindi incubare con tritone X-100 allo 0,5% a temperatura ambiente per 4 minuti e lavare con PBS.
- Aggiungere il siero di capra (vedere la Tabella dei materiali) per sigillare per 15 minuti, quindi aggiungere l'anticorpo primario ki67 (vedere la Tabella dei materiali) diluito con PBS (1:300) per incubare a 4 °C per una notte. Lavare con PBS per 3 x 5 min.
- Incubare con anticorpo secondario diluito con PBS (1:200) a temperatura ambiente per 1 ora e lavare con PBS per 3 x 5 minuti (vedere la Tabella dei materiali).
- Colorare con la soluzione di sviluppo per 5 minuti e risciacquare con acqua distillata doppia (vedi Tabella dei materiali).
- Colorare nuovamente con ematossilina per 2 minuti, differenziare in soluzione di acido cloridrico all'1% per 10 secondi e risciacquare con acqua corrente per 30 minuti (vedere la Tabella dei Materiali).
- Mettere le fette in alcol
 al 95%, alcol
al 95%, alcol  al 95%, etanolo anidro, etanolo
al 95%, etanolo anidro, etanolo 
 anidro, xilene
anidro, xilene  e xilene
e xilene  per 5 minuti ciascuna per disidratare (vedi Tabella dei materiali).
per 5 minuti ciascuna per disidratare (vedi Tabella dei materiali). - Sigillare con gomma neutra e scattare foto al microscopio a luce invertita (vedi Tabella dei materiali).
7. Test della membrana corioallantoidea dell'embrione di pollo19
- Lasciare le uova di gallina a piume bianche (vedi Tabella dei materiali) a temperatura ambiente per 2 ore e spruzzare con alcool per disinfettare. Praticare un foro nella camera d'aria con un trapano a cranio (vedi Tabella dei materiali) e incubare le uova con la camera d'aria sollevata per 7 giorni (temperatura di incubazione 37,8-38,2 °C e umidità relativa 65%).
NOTA: Durante i primi 3 giorni di incubazione, il pulsante di rotazione automatica delle uova viene attivato per evitare che la membrana corioallantoidea dell'embrione di pollo aderisca al guscio e crei una falsa camera d'aria. - Scartare le uova deboli/non fecondate nell'illuminatore dell'uovo (vedi Tabella dei materiali). Staccare con cura una finestra di 1 x 1 cm con una pinzetta per gli occhi (vedi Tabella dei materiali) dopo aver praticato un foro nella finta camera d'aria con un trapano a teschio (vedi Tabella dei materiali).
NOTA: Si prega di notare che il guscio d'uovo non deve cadere nella membrana corioallantoidea dell'embrione di pollo. - L'ottavo giorno di incubazione, aggiungere 100 μL di sospensione di cellule tumorali (1 × 106 cellule) a ciascun uovo dalla finta camera d'aria, ad eccezione del gruppo di controllo. Nei gruppi di farmaci, aggiungere 100 μL di soluzione di sorafenib e formula di Sanleng Jiashen. Nei gruppi di controllo e modello, aggiungere 100 μL di PBS.
NOTA: La sospensione delle cellule tumorali è composta da cellule HCCLM3 e colla per matrice in uguale volume. La concentrazione del farmaco è fissata come segue: 7,5 mg/kg di sorafenib e formula Sanleng Jiashen (7,8 g/kg, 15,6 g/kg e 31,2 g/kg). - Coprire la finestra con una medicazione trasparente (vedi Tabella dei materiali) e disinfettare con spray alcolico (vedi Tabella dei materiali). Dopo 7 giorni di incubazione, rimuovere la medicazione trasparente e aggiungere 1 mL di fissativo (metanolo:acetone = 1:1) (vedi Tabella dei materiali) dalla finta camera d'aria per un fissaggio di 30 minuti.
- Eliminare il fissativo con una siringa da 1 mL. Tagliare la membrana corioallantoica di ~5 x 5 cm nella finta camera d'aria con le forbici oftalmiche e metterla in una capsula di Petri da 60 mm.
NOTA: Per la membrana corioallantoidea dell'embrione di pollo con sangue, sciacquare con PBS. Per l'embrione di pollo membrana corioallantoidea attaccata al tessuto, separare con forbici oftalmiche. - Mettere la membrana corioallantoidea del passaggio 7.5 al microscopio ottico e fotografare i vasi (vedi Tabella dei materiali).
Risultati
Come mostrato nella Figura 2A, abbiamo stabilito un modello di carcinoma epatico in situ di topi BALB/c-nu e valutato l'effetto antitumorale della formula Sanleng Jiashen. La Figura 2B mostra che la formula Sanleng Jiashen può sopprimere significativamente la crescita dei tumori del fegato. I risultati patologici hanno indicato che, rispetto al gruppo di controllo, i focolai tumorali nel gruppo modello avevano confini ...
Discussione
Una grande quantità di prove ha confermato che Sanleng, ginseng, rabarbaro e Chuanxiong nella formula Sanleng Jiashen hanno effetti farmacologici sul trattamento del cancro al fegato. Gli studi hanno dimostrato che Sanleng può inibire significativamente la proliferazione e la crescita delle cellule tumorali per prevenire l'invasione e la metastasi delle cellule tumorali, indurre l'apoptosi cellulare e regolare il ciclo cellulare e il microambiente tumorale20. È...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fondazione cinese per la filosofia e le scienze sociali (20VYJ070), dal Progetto del Dipartimento provinciale per l'istruzione di Jilin (JJKH20230963KJ) e dal secondo lotto del progetto di ingegneria degli studiosi Xinglin presso l'Università di medicina cinese di Changchun (QNKXJ2-2021+ZR25).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin solution | HyClone, America | SH30042.01B | |
| 1 mL disposable syringe | Mingankang Medical Equipment Co., Ltd., China | RWSB | |
| 1% Penicillin & streptomycin solution | Hyclone, America | SV30010 | |
| 1.5 mL centrifuge tube | Corning, America | MCT-150-C-S | |
| 12 cm needle forceps | Hesdick, China | HKQS-211 | |
| 6-0 surgical sutures | Shanghai Jinhuan Medical Equipment Co., Ltd., Shanghai, China | CR631 | |
| 75% alcohol | Sichuan Youbang Enterprise Co., Ltd., Sichuan, China | 1.00009E+11 | |
| 96-well plates | NEST, China | 701001 | |
| Acetone | Tianjin Dingfu Chemical General Plant, Tianjin, China | GB686-89 | |
| BALB/c-nu male nude mice | Beijing Weitonglihua Experimental Animal Technology Co., Ltd., Beijing, China | SYXK(Ji) 2018-0006 | |
| Biological tissue baking machine | Leica, Germany | Leica HI1220 | |
| Cell culture dish | NEST, China | NEST.706001 | |
| Citric acid solution | Wuhan Canos Technology Co., Ltd., Wuhan, China | sj1074 | |
| D-luciferin | Gold Biotechnology®, Inc., China | LUCK-100 | |
| DMEM | Hyclone, America | SH30243.01 | |
| Egg illuminator | Shandong Weizhen Incubation Equipment Company, Shandong, China | WZSDT | |
| Eosin staining solution | Hunan BKMAM Biotechnology Co., Ltd., Hunan, China | 110703061 | |
| Erythromycin eye ointment | Cisen Pharmaceutical Co., Ltd., Shanghai, China | H37022025 | |
| Fetal bovine serum | Clark, America | FB25015 | |
| Fully automatic intelligent chick incubator | Shandong Weizhen Incubation Equipment Company, Shandong, China | 29538 | |
| GFP lentivirus solution | Suzhou GenePharma Co.,Ltd., Suzhou, China | F22AZ | |
| Goat serum | Shenyang Wanlei Biotechnology Co., Ltd., Shengyang, China | WLA067 | |
| Hand-held mouse skull drill | STRONGWT, China | 190 | |
| HCCLM3 cell line | WheLab, Shanghai, China | C1010 | |
| Heating pad | Zhongke Life Technology Co., Ltd., Hangzhou, China | GEJRD-10W | |
| Hematoxylin | Hunan BKMAM Biotechnology Co., Ltd., Hunan, China | B-YH250-1 | |
| Intelligent decoction pot | Hangzhou Jiuyang living Appliance Co., Ltd., Hangzhou, China | 3003BQ | |
| Inverted fluorescence microscope | Olympus, Japan | IX73 | |
| ki67 primary antibody | Wuhan Servicebio Technology Co., Ltd., Wuhan, China | GB121141-100 | |
| Lodophor disinfectant | Cofoe Medical Technology Co.,Ltd., Hunan, China | 202110073 | |
| Luciferase | Suzhou GenePharma Co.,Ltd., Suzhou, China | E26JZ | |
| Matrix glue | Corning, America | 356234 | |
| Medical gauze | Yunnan Chenye Biotechnology Co., Ltd., Yunnan, China | 71712049971 | |
| Methanol | Guangdong Guanghua Sci-Tech Co., Ltd., Guangdong, China | 1.17001.023 | |
| Ophthalmic scissor | Hesdick, China | HKQS-209 | |
| Ophthalmic tweezer | Hesdick, China | HKCL-20 | |
| Paraffin embedding machine | Leica, Germany | EG1150H | |
| Paraffin slicing machine | Leica, Germany | Leica CM1950 | |
| Paraformaldehyde | Biosharp, China | BL539A | |
| PBS buffer | Wuhan Servicebio Technology Co., Ltd., Wuhan, China | G2156-1L | |
| Puromycin | Beijing Solarbio Science & Technology Co., Ltd., Beijing, China | P8230 | |
| Refrigerator | Thermo Scientific, America | TDE40086FV-ULTS | |
| Scalpel | Hesdick, China | HKCL-93 | |
| Secondary antibody | Wuhan Servicebio Technology Co., Ltd., Wuhan, China | GB23301 | |
| Small animal live imaging system | Caliper Life Sciences, America | IVIS Lumina XR | |
| Sorafenib | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, China | 284461-73-0 | |
| Transparent dressing | 3M, America | 9534HP | |
| Triton X-100 | Beijing Solarbio Science & Technology Co., Ltd., Beijing, China | T8200 | |
| Vacuum freeze dryer | Ningbo Xinzhi Biotechnology Co., Ltd., Ningbo, China | sz-10N | |
| White feather chicken eggs | Shandong Haotai Experimental Animal Breeding Co., Ltd., Shandong, China | SCXK(Lu) 20180004 | |
| Xylene | Sigma-Aldrich, , America | 534056 |
Riferimenti
- Sia, D., Villanueva, A., Friedman, S. L., Llovet, J. M. Liver cancer cell of origin, molecular class, and effects on patient prognosis. Gastroenterology. 152 (4), 745-761 (2017).
- Starley, B. Q., Calcagno, C. J., Harrison, S. A. Nonalcoholic fatty liver disease and hepatocellular carcinoma: a weighty connection. Hepatology. 51 (5), 1820-1832 (2010).
- Siegel, R. L., Miller, K. D., Wagle, N. S., Jemal, A. Cancer statistics. CA-A Cancer J. Clin. 73 (1), 17-48 (2023).
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859), 2095-2128 (2012).
- Verslype, C., et al. The management of hepatocellular carcinoma. Current expert opinion and recommendations derived from the 10th World Congress on Gastrointestinal Cancer, Barcelona, 2008. Ann. Oncol. , (2009).
- Greten, T. F., et al. Biomarkers for immunotherapy of hepatocellular carcinoma. Nat. Rev. Clin. Oncol. 20 (11), 780-798 (2023).
- Rimassa, L., Finn, R. S., Sangro, B. Combination immunotherapy for hepatocellular carcinoma. J. Hepatol. 79 (2), 506-515 (2023).
- Wu, Z. H., et al. A terrylene-anthraquinone dyad as a chromophore for photothermal therapy in the NIR-II window. J. Am. Chem. Soc. 145 (48), 26487-26493 (2023).
- Pawlik, T. M. Hepatocellular carcinoma. Sure. Oncol. Clin. N. Am. 33 (1), (2024).
- Schwarze, V., et al. Diagnostic value of contrast-enhanced ultrasound versus computed tomography for hepatocellular carcinoma: a retrospective, single-center evaluation of 234 patients. J. Int. Med. Res. 48 (6), 1-10 (2020).
- Maki, H., Hasegawa, K. Advances in the surgical treatment of liver cancer. Biosci. Trends. 16 (3), 178-188 (2022).
- Pepe, A., et al. Medical radiology: current progress. Diagnostics. 13 (14), 2439 (2023).
- Li, Y., Zhang, C. Significance of 'harmonious' thinking in Inner Canon of Huangdi on the prevention and treatment of primary liver cancer. China Journal of Traditional Chinese Medicine and Pharmacy. 28 (02), 305-308 (2013).
- Luo, T. . Wishing Baojian (M). , (2019).
- Li, Y. . Effect and mechanism of Sanlengjiashen Decoction on hepatocellular carcinoma by JAK2/STAT3 signaling pathway [D]. , (2022).
- Wang, P., et al. BTF3 promotes proliferation and glycolysis in hepatocellular carcinoma by regulating GLUT1. Cancer Biol. Ther. 24 (1), 2225884 (2023).
- Xie, N., et al. Rhodiola crenulate alleviates hypobaric hypoxia-induced brain injury via adjusting NF-κB/NLRP3-mediated inflammation. Phytomedicine. 103, 154240 (2022).
- Wang, X., et al. Rhodiola crenulata attenuates apoptosis and mitochondrial energy metabolism disorder in rats with hypobaric hypoxia-induced brain injury by regulating the HIF-1α/microRNA210/ISCU1/2 (COX10) signaling pathway. J. Ethnopharmacol. 241, 111801 (2019).
- Guerrieri, A. N., et al. A novel patient-derived immortalised cell line of myxofibrosarcoma: a tool for preclinical drugs testing and the generation of near-patient models. BMC Cancer. 23 (1), 1194 (2023).
- Li, Y., Zhao, J., Zhao, H., Yu, C. Research progress of Sparganium Stoloniferum. Journal of Liaoning University of Traditional Chinese Medicine. 20 (09), 92-94 (2018).
- Kim, T. W., Lee, S. Y., Kim, M., Cheon, C., Ko, S. G. Kaempferol induces autophagic cell death via IRE1-JNK-CHOP pathway and inhibition of G9a in gastric cancer cells. Cell Death Dis. 9 (9), 875 (2018).
- Lee, M. J., et al. Kaempferol alleviates mitochondrial damage by reducing mitochondrial reactive oxygen species production in lipopolysaccharide-induced prostate organoids. Foods. 12 (20), 3836 (2023).
- Zhang, Q., et al. Molecular docking and in vitro experiments verified that kaempferol induced apoptosis and inhibited human HepG2 cell proliferation by targeting BAX, CDK1, and JUN. Mol. Cell. Biochem. 478 (4), 767-780 (2023).
- Kumar, S., et al. Myricetin: a potential plant-derived anticancer bioactive compound-an updated overview. N-S Arch. Pharmacol. 396 (10), 2179-2196 (2023).
- Wang, M., et al. Myricetin reverses epithelial-endothelial transition and inhibits vasculogenic mimicry and angiogenesis of hepatocellular carcinoma by directly targeting PAR1. Phytother. Res. 36 (4), 1807-1821 (2022).
- Li, J., Li, F., Jin, D. Ginsenosides are promising medicine for tumor and inflammation: A review. Am. J. Chinese Med. 51 (4), 883-908 (2023).
- Guo, X., Hu, N., Sun, G., Li, M., Zhang, P. Shenyi capsule plus chemotherapy versus chemotherapy for non-small cell lung cancer:A systematic review of overlapping meta-analyses. Chinese Journal of Integrative Medicine. 24 (3), 227-231 (2018).
- Zhang, R., et al. Network Meta-analysis of oral Chinese patent medicine for adjuvant treatment of primary liver cancer. China Journal of Chinese Materia Medica. 46 (09), 2333-2343 (2021).
- Oh, H. M., Cho, C. K., Son, C. G. Experimental evidence for the anti-metastatic action of ginsenoside Rg3: A systematic review. Int. J. Mol. Sci. 23 (16), 9077 (2022).
- Nowak-Perlak, M., Ziółkowski, P., Woźniak, M. A promising natural anthraquinones mediated by photodynamic therapy for anti-cancer therapy. Phytomedicine. 119, 155035 (2023).
- Bai, J., et al. Emodin, a natural anthraquinone, suppresses liver cancer in vitro and in vivo by regulating VEGFR and miR-34a. Invest. New Drug. 38 (2), 229-245 (2020).
- Cheng, G., et al. Cell metabolomics reveals the potential mechanism of aloe emodin and emodin inhibiting breast cancer metastasis. Int. J. Mol. Sci. 23 (22), 13738 (2022).
- Wang, X., et al. Inhibition of tetramethylpyrazine on P-gp, MRP2, MRP3 and MRP5 in multidrug resistant human hepatocellular carcinoma cells. Oncol. Rep. 23 (1), 211-215 (2010).
- Hu, J., et al. Ultrasonic extraction, antioxidant and anticancer activities of novel polysaccharides from Chuanxiong rhizome. Int. J. Biol. Macromol. 85, 277-284 (2016).
- Zhong, C., et al. Physicochemical properties of polysaccharides from Ligusticum chuanxiong and analysis of their anti-tumor potential through immunoregulation. Food Funct. 12 (4), 1719-1731 (2021).
- Hou, Y., et al. Salidroside intensifies mitochondrial function of CoCl2-damaged HT22 cells by stimulating PI3K-AKT-MAPK signaling pathway. Phytomedicine. 109, 154568 (2023).
- Wang, X., et al. Salidroside, a phenyl ethanol glycoside from Rhodiola crenulata, orchestrates hypoxic mitochondrial dynamics homeostasis by stimulating Sirt1/p53/Drp1 signaling. J. Ethnopharmacol. 293, 115278 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon