Legge dei gas perfetti
Panoramica
Fonte: Laboratorio del Dr. Andreas Züttel - Laboratori federali svizzeri per la scienza e la tecnologia dei materiali
La legge dei gas ideali descrive il comportamento dei gas più comuni in condizioni quasi ambientali e la tendenza di tutta la materia chimica nel limite diluito. È una relazione fondamentale tra tre variabili di sistema macroscopiche misurabili (pressione, temperatura e volume) e il numero di molecole di gas nel sistema, ed è quindi un collegamento essenziale tra l'universo microscopico e quello macroscopico.
La storia della legge del gas ideale risale alla metà del 17 ° secolo quando la relazione trala pressione e il volume dell'aria è risultata inversamente proporzionale, un'espressione confermata da Robert Boyle e che ora chiamiamo legge di Boyle (Equazione 1).
P 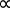 V-1 (Equazione 1)
V-1 (Equazione 1)
Il lavoro inedito di Jacques Charles nel 1780, che fu esteso a numerosi gas e vapori da Joseph Louis Gay-Lussac e riportato nel 1802, stabilì la relazione direttamente proporzionale tra la temperatura assoluta e il volume di un gas. Questa relazione è chiamata legge di Charles (Equazione 2).
V 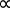 T (Equazione 2)
T (Equazione 2)
Guillaume Amontons è in genere accreditato di aver scoperto per la prima volta la relazione tra la temperatura e la pressione dell'aria all'interno di un volume fisso all'inizio del 18° secolo. Questa legge fu estesa anche a numerosi altri gas da Joseph Louis Gay-Lussac all'inizio del 19° secolo ed è quindi indicata come legge di Amontons o legge di Gay-Lussac, dichiarata come mostrato nell'equazione 3.
P 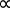 T (Equazione 3)
T (Equazione 3)
Insieme, queste tre relazioni possono essere combinate per dare la relazione nell'equazione 4.
V 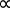 T (Equazione 4)
T (Equazione 4)
Infine, nel 1811, fu proposto da Amedeo Avogadro che due gas qualsiasi, tenuti nello stesso volume e alla stessa temperatura e pressione, contenevano lo stesso numero di molecole. Ciò ha portato alla conclusione che tutti i gas possono essere descritti da una costante comune, la costante di gas ideale R, che è indipendente dalla natura del gas. Questa è nota come legge del gas ideale (Equazione 5). 1,2
Fotovoltaico  T (Equazione 5)
T (Equazione 5)
Procedura
1. Misurazione del volume del campione
- Pulire accuratamente il campione e asciugarlo.
- Riempire un cilindro graduato ad alta risoluzione con acqua distillata sufficiente per coprire il campione. Prendere nota del volume iniziale
- Lascia cadere il campione nell'acqua e nota il cambiamento di volume. Questo è il volume del campione, V.
- Rimuovere il campione e asciugarlo. Nota: in alternativa, misurare la lunghezza o le lunghezze laterali del campione e calcolarne il volume utilizzando
Risultati
La legge del gas ideale è una valida descrizione delle effettive proprietà del gas di numerosi gas comuni in condizioni vicine all'ambiente(figura 1 inset) ed è quindi utile nel contesto di molte applicazioni. I limiti della legge del gas ideale nel descrivere i sistemi in condizioni di alte pressioni o basse temperature possono essere spiegati dalla crescente importanza delle interazioni molecolari e/o dalla dimensione finita delle molecole di gas che contribuiscono alle proprietà del sistema. Perta...
Applicazione e Riepilogo
La legge del gas ideale è un'equazione così fondamentale delle scienze chimiche che ha una pletora di usi sia nelle attività quotidiane di laboratorio che nei calcoli e nella modellazione di sistemi anche altamente complessi, almeno alla prima approssimazione. La sua applicabilità è limitata solo dalle approssimazioni inerenti alla legge stessa; a pressioni e temperature vicine all'ambiente, dove la legge del gas ideale è ben valida per molti gas comuni, è ampiamente utilizzata nell'interpretazione di sistemi e pr...
Riferimenti
- Zumdahl, S.S., Chemical Principles. Houghton Mifflin, New York, NY. (2002).
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole, Belmont, CA (2012).
- Rouquerol, F., Rouquerol, J., Sing, K.S.W., Llewellyn, P., Maurin, G. Adsorption by Powders and Porous Solids: Principles, Methodology and Applications.Academic Press, San Diego, CA. (2014).
Vai a...
Video da questa raccolta:

Now Playing
Legge dei gas perfetti
General Chemistry
78.5K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
656.1K Visualizzazioni

Soluzioni e concentrazioni
General Chemistry
274.2K Visualizzazioni

Determinazione della densità di un solido e di un liquido
General Chemistry
556.1K Visualizzazioni

Determinazione della composizione percentuale di massa in una soluzione acquosa
General Chemistry
383.5K Visualizzazioni

Determinazione della formula empirica (minima)
General Chemistry
181.9K Visualizzazioni

Determinazione delle regole di solubilità di composti ionici
General Chemistry
141.4K Visualizzazioni

Uso del pH-metro
General Chemistry
345.9K Visualizzazioni

Introduzione alla titolazione
General Chemistry
424.5K Visualizzazioni

Determinazione spettrofotometrica di una costante di equilibrio
General Chemistry
158.5K Visualizzazioni

Principio di Le Châtelier
General Chemistry
265.2K Visualizzazioni

Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
General Chemistry
160.7K Visualizzazioni

Determinazione dell'equazione cinetica e dell'ordine di reazione
General Chemistry
196.1K Visualizzazioni

Utilizzo della calorimetria a scansione differenziale per misurare cambiamenti nell'entalpia
General Chemistry
44.5K Visualizzazioni

Complessi chimici di coordinazione
General Chemistry
91.5K Visualizzazioni
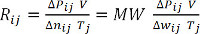 (Equazione 9)
(Equazione 9)