Determinazione dell'equazione cinetica e dell'ordine di reazione
Panoramica
Fonte: Laboratorio del Dr. Neal Abrams - SUNY College of Environmental Science and Forestry
Tutte le reazioni chimiche hanno un tasso specifico che definisce il progresso dei reagenti che vanno ai prodotti. Questo tasso può essere influenzato dalla temperatura, dalla concentrazione e dalle proprietà fisiche dei reagenti. Il tasso include anche gli intermedi e gli stati di transizione che si formano ma non sono né il reagente né il prodotto. La legge della velocità definisce il ruolo di ciascun reagente in una reazione e può essere utilizzata per modellare matematicamente il tempo necessario affinché una reazione proceda. La forma generale di un'equazione di tasso è mostrata di seguito:
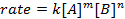
dove A e B sono concentrazioni di diverse specie molecolari, m e n sono ordini di reazione, e k è la costante di velocità. La velocità di quasi tutte le reazioni cambia nel tempo man mano che i reagenti si esauriscono, rendendo meno probabile che si verifichino collisioni efficaci. La costante di velocità, tuttavia, è fissa per ogni singola reazione a una data temperatura. L'ordine di reazione illustra il numero di specie molecolari coinvolte in una reazione. È molto importante conoscere la legge della velocità, compresa la costante di velocità e l'ordine di reazione, che possono essere determinati solo sperimentalmente. In questo esperimento, esploreremo un metodo per determinare la legge della velocità e lo useremo per comprendere il progresso di una reazione chimica.
Procedura
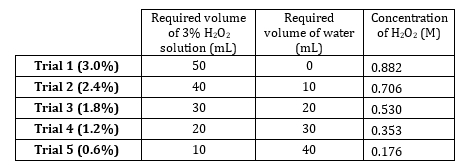
1. Preparazione delle diluizioni H2O2
- Il perossido di idrogeno al 3% ha una concentrazione di 0,882 M. Preparare 5 diluizioni che vanno da 0,882 M a 0,176 M (Tabella 1). Preparare queste soluzioni volumetricamente, ma prepararle in modo additivo poiché il soluto è molto diluito e i volumi di acqua sono additivi.
- Posizionare le soluzioni a bagnomaria a temperatura costante o lasciarle sul piano di lavoro per equilibrare a temperatura ambiente. Un intervallo di tem
Risultati
Dati sull'evoluzione dell'ossigeno e tassi iniziali
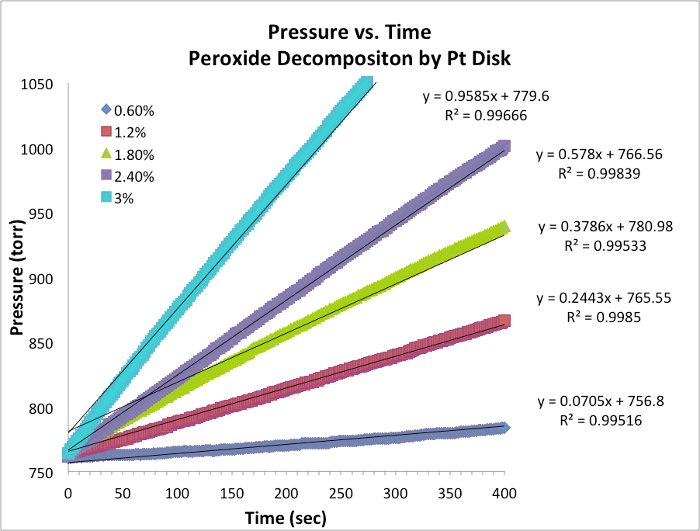
Figura 1. Dati di pressione e tempo per ogni prova a temperatura costante. La pendenza è equivalente alla velocità istantanea della reazione.
Ordine di reazione
- I dati per cinque prove e il grafico con pendenza sono riportat..
Applicazione e Riepilogo
Mentre la determinazione delle variabili della legge del tasso può essere coinvolta matematicamente, i metodi sono in realtà abbastanza semplici. Finché è possibile misurare la scomparsa di un reagente o l'aspetto di un prodotto, i grafici di velocità possono essere utilizzati per calcolare la costante di velocità. Un'estensione di questo metodo viene spesso utilizzata per determinare l'energia di attivazione diunareazione, E a , misurando la velocità e calcolando la costante di velocità a una varietà...
Riferimenti
- Method adapted from Vetter, T. A., Colombo, D. P. Jr. Kinetics of Platinum-Catalyzed Decomposition of Hydrogen Peroxide, J. Chem. Ed. 80 (7), 788-798 (2003).
- David R. Lide, ed. CRC Handbook of Chemistry and Physics. Boca Raton, Florida: CRC Press (2005).
Vai a...
Video da questa raccolta:

Now Playing
Determinazione dell'equazione cinetica e dell'ordine di reazione
General Chemistry
196.3K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
658.3K Visualizzazioni

Soluzioni e concentrazioni
General Chemistry
275.1K Visualizzazioni

Determinazione della densità di un solido e di un liquido
General Chemistry
556.8K Visualizzazioni

Determinazione della composizione percentuale di massa in una soluzione acquosa
General Chemistry
383.8K Visualizzazioni

Determinazione della formula empirica (minima)
General Chemistry
183.7K Visualizzazioni

Determinazione delle regole di solubilità di composti ionici
General Chemistry
141.6K Visualizzazioni

Uso del pH-metro
General Chemistry
346.7K Visualizzazioni

Introduzione alla titolazione
General Chemistry
425.4K Visualizzazioni

Legge dei gas perfetti
General Chemistry
79.0K Visualizzazioni

Determinazione spettrofotometrica di una costante di equilibrio
General Chemistry
158.7K Visualizzazioni

Principio di Le Châtelier
General Chemistry
265.8K Visualizzazioni

Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
General Chemistry
160.8K Visualizzazioni

Utilizzo della calorimetria a scansione differenziale per misurare cambiamenti nell'entalpia
General Chemistry
44.7K Visualizzazioni

Complessi chimici di coordinazione
General Chemistry
91.7K Visualizzazioni
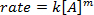 . Prendendo il logaritmo naturale (ln) dell'equazione si produce un'equazione lineare
. Prendendo il logaritmo naturale (ln) dell'equazione si produce un'equazione lineare 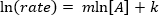 , dove m, la pendenza, è l'ordine della reazione.
, dove m, la pendenza, è l'ordine della reazione.