Introduzione alla titolazione
Panoramica
Fonte: Laboratorio del Dr. Yee Nee Tan - Agenzia per la scienza, la tecnologia e la ricerca
La titolazione è una tecnica comune utilizzata per determinare quantitativamente la concentrazione sconosciuta di un analita identificato. 1-4 È anche chiamata analisi volumetrica, poiché la misurazione dei volumi è fondamentale nella titolazione. Esistono molti tipi di titolazioni basate sui tipi di reazioni che sfruttano. I tipi più comuni sono le titolazioni acido-base e le titolazioni redox. 5-11
In un tipico processo di titolazione, una soluzione standard di titolante in una buretta viene gradualmente applicata per reagire con un analita con una concentrazione sconosciuta in un matraccio di Erlenmeyer. Per la titolazione acido-base, un indicatore di pH viene solitamente aggiunto nella soluzione analita per indicare l'endpoint della titolazione. 12 Invece di aggiungere indicatori di pH, il pH può anche essere monitorato utilizzando un pHmetro durante un processo di titolazione e l'endpoint è determinato graficamente da una curva di titolazione del pH. Il volume del titolante registrato all'endpoint può essere utilizzato per calcolare la concentrazione dell'analita in base alla stechiometria di reazione.
Per la titolazione acido-base presentata in questo video, il titolante è una soluzione standardizzata di idrossido di sodio e l'analita è aceto domestico. L'aceto è un liquido acido che viene spesso usato come condimento culinario o aromi. L'aceto è costituito principalmente da acido acetico (CH3COOH) e acqua. Il contenuto di acido acetico dell'aceto commerciale può variare ampiamente e l'obiettivo di questo esperimento è determinare il contenuto di acido acetico dell'aceto commerciale mediante titolazione.
Principi
La determinazione dell'acido acetico nell'aceto si basa sul principio di un metodo di titolazione acido-base. La reazione tra NaOH e CH3COOH è mostrata nell'equazione 1:
CH3COOH(aq) + NaOH(aq) → H2O(l) + NaCH3CO2(aq) (1)
La soluzione standardizzata di NaOH viene progressivamente aggiunta all'aceto con concentrazione sconosciuta di acido acetico fino al raggiungimento del punto finale. Durante la titolazione acido-base, il pH può essere tracciato in funzione del volume del titolante aggiunto. Il punto di inflessione sulla curva, il punto in cui esiste una quantità stechiometrica uguale di acido e base in una soluzione, è chiamato punto di equivalenza. La maggior parte degli acidi e delle basi sono incolori, senza alcuna reazione visibile che si verifica nel punto di equivalenza. Per osservare quando è stato raggiunto il punto di equivalenza, viene aggiunto un indicatore di pH. L'endpoint non è il punto di equivalenza, ma un punto in cui l'indicatore di pH cambia colore. È importante selezionare un indicatore di pH appropriato in modo che il punto finale sia il più vicino possibile al punto di equivalenza della titolazione.
Al punto finale di questa reazione, la base coniugata NaCH3CO2 è leggermente basica. L'indicatore della fenolftaleina ha un intervallo di pH di lavoro di 8,3-10,0, che è incolore in soluzione acida e magenta sopra pH 8,2. Pertanto, la fenolftaleina è un indicatore preferito in quanto cambierà da incolore a rosa in questa condizione. Quando si esegue l'esperimento, è meglio mantenere bassa la concentrazione dell'indicatore di pH perché gli indicatori di pH stessi sono solitamente acidi deboli che reagiscono con la base.
Il volume della soluzione standardizzata di NaOH aggiunta al punto finale può quindi essere utilizzato per calcolare le concentrazioni molari di acido acetico in base alla stechiometria dell'equazione di cui sopra. In questo esperimento, il titolante NaOH è un forte alcalino e l'acido acetico analitico è un acido debole.
Prima di eseguire l'esperimento, è importante considerare la natura igroscopica del NaOH. Questa proprietà richiede che la sua soluzione sia standardizzata con uno standard primario stabile come l'idrogeno ftalato di potassio (KHC8H4O4). L'esatta concentrazione molare della soluzione di NaOH può quindi essere determinata con precisione dopo la standardizzazione. La reazione tra lo standard acido primario e NaOH è mostrata nell'equazione 2:
KHC8H4O4(aq) + NaOH(aq) → H2O(l) + NaKC8H4O4(aq) (2)
Un protocollo di titolazione dettagliato passo-passo è presentato nella sezione seguente.
Procedura
1. Standardizzazione di NaOH con idrogenoftalato di potassio (KHC8H4O4)
- Per iniziare, il titolante, idrossido di sodio, deve essere standardizzato. Preparare una soluzione di NaOH di riserva sciogliendo circa 4 g di pellet di NaOH in 100 ml di acqua deionizzata. Si noti che NaOH è una sostanza chimica pericolosa che è corrosiva per la pelle e irritante per gli occhi, essere cauti e indossare adeguati dispositivi di protezione individuale (DPI) per evitare il contatto con la pelle o gli occhi.
- Effettuare una diluizione 1:10 della soluzione di idrossido di sodio aggiungendo 25 mL della soluzione di idrossido di sodio stock in una bottiglia da 500 mL. L'idrossido di sodio assorbe l'anidride carbonica. È importante prevenire questo assicurandosi di utilizzare acqua bollita e deionizzata, una bottiglia essiccata al forno e di tappare rapidamente la bottiglia. Preparare la soluzione fino a 250 ml con l'acqua deionizzata e agitare per mescolare.
- Asciugare 4-5 g dell'acido standard primario, KHC8H4O4 a 110 °C per 4 ore in un forno di essiccazione e quindi raffreddare il solido in un essiccatore per 1 ora.
- Sciogliere circa 4 g di KHC8H4O4 essiccato in 250 ml di acqua deionizzata. Registrare la massa in modo accurato. Calcolare la concentrazione molare della soluzione KHC8H4O4.
- Pipettare 25 mL di KHC8H4O4 in un matraccio Erlenmeyer pulito e asciutto. Aggiungere 2 gocce di fenolftaleina e ruotare delicatamente per mescolare bene. Si noti che la fenolftaleina è tossica e irritante, essere cauti per evitare il contatto con la pelle o gli occhi.
- Pulire accuratamente una buretta da 50 ml e un imbuto con detergente e acqua. Sciacquare la buretta con acqua e risciacquare 3 volte con acqua deionizzata. Risciacquare la buretta con la soluzione di NaOH diluita 3x, assicurandosi che il NaOH bagna l'intera superficie interna e scarichi i rifiuti attraverso la punta. Montare la buretta lavata su un supporto con un morsetto e assicurarsi che si trovi verticalmente.
- Riempire la buretta pulita con la soluzione naOH diluita. Va notato che la quantità di NaOH diluito non deve essere esattamente al segno zero, ma dovrebbe essere all'interno della scala e sufficiente per almeno una titolazione. Le bolle d'aria possono influire sulla precisione della lettura del volume. Controllare attentamente la buretta per le bolle d'aria e picchiettare delicatamente la buretta per liberarle e aprire il rubinetto per far fluire qualche mL di titolante e allo stesso tempo rilasciare l'aria intrappolata. Leggi il volume visualizzando la parte inferiore del menisco dopo 10 s. Registrare questo volume iniziale. Presta attenzione alle cifre significative della lettura. Registrare il valore con due cifre decimali in mL.
- Posizionare il matraccio Erlenmeyer contenente ftalato di idrogeno di potassio (KHC8H4O4) sotto la buretta e regolare correttamente l'altezza della buretta. Titolare lasoluzionekhc 8 H4O 4 aggiungendo lentamente lasoluzione di NaOH con incrementi di 1-2 ml usando una mano per controllare la portata regolando il rubinetto e l'altra facendo roteare il pallone.
- Quando sei vicino all'endpoint, inizia ad aggiungere il titolante goccia a goccia. Il punto finale viene raggiunto quando la soluzione diventa di un colore rosa debole e persistente. Registrare il volume finale del NaOH diluito nella buretta.
- Ripetere la titolazione almeno altre due volte per ottenere dati coerenti. Calcolare la concentrazione molare della soluzione di NaOH diluita.
2. Titolazione dell'aceto con soluzione standardizzata di idrossido di sodio
- La soluzione di idrossido di sodio è ora standardizzata e può essere utilizzata come titolante per analizzare l'aceto. Per ridurre l'aroma pungente dell'aceto, diluire 10 mL della soluzione di aceto da testare in una razione 1:10 fino a un volume totale di 100 ml.
- Pipettare 25 mL di analita, in un matraccio Erlenmeyer pulito e asciutto (indicato come VA). Aggiungere 2 gocce di fenolftaleina.
- Riempire la buretta con la soluzione Standardizzata naOH della prima parte della procedura. Registrare il volume iniziale del titolante (V1).
- Aggiungere progressivamente la soluzione standardizzata di NaOH all'aceto. Quando il volume del titolante si avvicina al valore atteso, regola il rubinetto per aggiungere il titolante goccia a goccia. Continuare a far roteare il pallone con una mano e tenere l'altra mano pronta a chiudere il rubinetto. Una volta che la soluzione di analita cambia in colore rosa chiaro, ruotare per alcuni secondi per vedere se il colore svanirà. Se il colore persiste, la titolazione raggiunge il punto finale. Registrare il volume finale del titolante (V1'). Se il colore della soluzione svanisce, aggiungi un'altra goccia di titolante. Lavare la punta inferiore della buretta usando il flacone di lavaggio. Raccogliere la miscela lavata e osservare il cambiamento di colore della soluzione analita. Continuare la titolazione fino al punto finale. Registrare la quantità di titolante necessaria (Vt1 = V1' V1).
- Ripetere la titolazione almeno due volte fino ad ottenere tre valori concordanti che si trovano entro 0,1 mL l'uno dall'altro (Vt2 e Vt3).
- Calcolare il valore medio del volume del titolante utilizzando i tre valori ottenuti in tre diverse titolazioni: Vt = (Vt1 + Vt2 + Vt3)/3. La concentrazione molare di acido acetico nell'aceto può quindi essere calcolata utilizzando l'equazione 3.
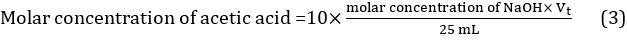
Risultati
| Unità | Prova 1 | Prova 2 | Prova 3 | |||
| Volume di acido aceto diluito (VA) | Ml | 25.00 | ||||
| Concentrazione molare di NaOH (cNaOH) | mol/L | 0.09928 | ||||
| Lettura iniziale della buretta di NaOH | Ml | 0.10 | 0. 05 | 1.20 | ||
| Lettura finale della buretta di NaOH | Ml | 18.75 | 18.60 | 19.80 | ||
| Volume di NaOH erogato | Ml | 18.65 | 18.55 | 18.60 | ||
| Volume medio di NaOH erogato (Vt) | Ml | 18.60 | ||||
Tabella 1. Risultati della titolazione.
Calcoli di esempio:
Massa di KC8H5O4 = 4.0754 g
Massa molare di KC8H5O4 = 204,22 g/mol
Numero di moli di KC8H5O4 in 25,00 mL soluzione standard = 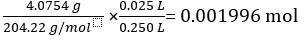
Secondo l'equazione 2,
Concentrazione della soluzione di NaOH diluita = 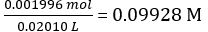
Moli di NaOH erogati = concentrazione di NaOH × volume medio di NaOH erogato = 0,09928 mol/L × 18,60 mL = 1,847 × 10-3 mol
Secondo l'equazione 1,
Numero di moli di CH3COOH in 25,00 ml di aceto diluito = 1,847 × 10-3 mol
Concentrazione di aceto diluito = 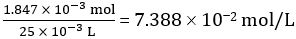
Quindi concentrazione di aceto non diluito = 10 × 7.388 102 mol/L = 0.7388 mol/L
I passaggi precedenti sono presentati per illustrare la procedura di calcolo; possiamo semplicemente applicare l'equazione 3 per ottenere la concentrazione di aceto non diluito in un unico passaggio.
Pertanto 1.000 L di aceto non diluito contengono 0,7388 mol di CH3COOH.
Volume di CH3COOH=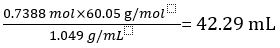
Percentuale di volume di aceto =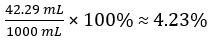
Applicazione e Riepilogo
La titolazione è un importante metodo chimico che viene spesso applicato nell'attuale ricerca chimica. Ad esempio, la titolazione acido-base viene applicata per determinare il valore di ammina o idrossile di un campione. Il valore dell'ammina è definito come il numero di milligrammi di KOH equivalente al contenuto di ammine in un grammo di campione. Per determinare il valore dell'idrossile, l'analita viene prima acetilato usando anidride acetica e poi titolato con KOH. La massa in milligrammi di KOH corrisponde quindi ai gruppi ossidrilici in un grammo di campione. 13 Un altro esempio è il test Winkler, un tipo specifico di titolazione redox utilizzato per determinare la concentrazione di ossigeno disciolto nell'acqua per studi sulla qualità dell'acqua. L'ossigeno disciolto viene ridotto utilizzando solfato di manganese (II), che quindi reagisce con lo ioduro di potassio per produrre iodio. Poiché lo iodio rilasciato è direttamente proporzionale al contenuto di ossigeno, la concentrazione di ossigeno viene determinata titolando lo iodio con tiosolfato utilizzando un indicatore di amido. 14 anni
Oltre alle applicazioni nella ricerca chimica di base, la titolazione è stata ampiamente adottata anche nell'uso industriale e quotidiano. Nell'industria del biodiesel, l'olio vegetale di scarto (WVO) deve prima essere neutralizzato per rimuovere gli acidi grassi liberi che normalmente reagirebbero per produrre sapone indesiderato. Una porzione di WVO è titolata con una base per determinare l'acidità del campione, in modo che il resto del lotto possa essere neutralizzato correttamente. 15 Il metodo di Benedetto, un test per la quantificazione del livello di glucosio nelle urine, è un altro esempio che dimostra l'importanza della titolazione nell'assistenza sanitaria. In questa titolazione, gli ioni rameici sono ridotti a ioni cupori dal glucosio, che poi reagiscono con il tiocianato di potassio per formare un precipitato bianco, indicando il punto finale. 16 anni
Riferimenti
- Llc, B. Titration: Ph Indicator, Thermometric Titration, Nonaqueous Titration, Equivalence Point, Acid-Base Titration, Amperometric Titration. General Books LLC, (2010).
- Jacobsen, J. J., Jetzer, K. H., Patani, N., Zweerink, G. & Zimmerman, J. Titration Techniques. J. Chem. Educ. 72, 612, doi:10.1021/ed072p612 (1995).
- Harris, D. C. Quantitative Chemical Analysis. 8th edn, W. H. Freeman, (2010).
- Mattock, G., Taylor, G. R. & Paul, M. A. pH Measurement and Titration. J. Electrochem. Soc. 110, 31C, doi:10.1149/1.2425702 (1963).
- De Levie, R. Aqueous Acid-base Equilibria and Titrations. Oxford University Press, (1999).
- Cannan, R. K. The Acid-Base Titration of Proteins. Chem. Rev. 30, 395-412, doi:10.1021/cr60097a005 (1942).
- Michalowski, T. & Lesiak, A. Acid-Base Titration Curves in Disproportionating Redox Systems. J. Chem. Educ. 71, 632, doi:10.1021/ed071p632 (1994).
- Waser, J. Acid-base Titration and Distribution Curves. J. Chem. Educ. 44, 274, doi:10.1021/ed044p274 (1967).
- Gorbikova, E. A., Vuorilehto, K., Wikström, M. & Verkhovsky, M. I. Redox Titration of All Electron Carriers of Cytochrome c Oxidase by Fourier Transform Infrared Spectroscopy. Biochemistry 45, 5641-5649, doi:10.1021/bi060257v (2006).
- Silverstein, T., Cheng, L. & Allen, J. F. Redox Titration of Multiple Protein Phosphorylations in Pea Chloroplast Thylakoids. Biochim. Biophys. Acta (BBA)-Bioenerg. 1183, 215-220, doi:10.1016/0005-2728(93)90022-8 (1993).
- Lenghor, N., Jakmunee, J., Vilen, M., Sara, R., Christian, G. D. & Grudpan, K. Sequential Injection Redox or Acid-Base Titration for Determination of Ascorbic Acid or Acetic Acid. Talanta 58, 1139-1144, doi:10.1016/S0039-9140(02)00444-7 (2002).
- Mitchell, P., Moyle, J. & Smith, L. Bromthymol Blue as a pH Indicator in Mitochondrial Suspensions. Eur. J. Biochem. 4, 9-19, doi:10.1111/j.1432-1033.1968.tb00166.x (1968).
- Perkins, E. G. Analyses of Fats, Oils and Derivatives. AOCS press, (1993).
- Spellman, F. R. Handbook of Water and Wastewater Treatment Plant Operations. 2 edn, CRC Press, (2009).
- Purcella, G. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, (2007).
- Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education (2007).
Tags
Vai a...
Video da questa raccolta:

Now Playing
Introduzione alla titolazione
General Chemistry
425.6K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
658.8K Visualizzazioni

Soluzioni e concentrazioni
General Chemistry
275.3K Visualizzazioni

Determinazione della densità di un solido e di un liquido
General Chemistry
556.8K Visualizzazioni

Determinazione della composizione percentuale di massa in una soluzione acquosa
General Chemistry
383.8K Visualizzazioni

Determinazione della formula empirica (minima)
General Chemistry
183.7K Visualizzazioni

Determinazione delle regole di solubilità di composti ionici
General Chemistry
141.6K Visualizzazioni

Uso del pH-metro
General Chemistry
346.9K Visualizzazioni

Legge dei gas perfetti
General Chemistry
79.2K Visualizzazioni

Determinazione spettrofotometrica di una costante di equilibrio
General Chemistry
158.8K Visualizzazioni

Principio di Le Châtelier
General Chemistry
265.8K Visualizzazioni

Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
General Chemistry
160.8K Visualizzazioni

Determinazione dell'equazione cinetica e dell'ordine di reazione
General Chemistry
196.3K Visualizzazioni

Utilizzo della calorimetria a scansione differenziale per misurare cambiamenti nell'entalpia
General Chemistry
44.8K Visualizzazioni

Complessi chimici di coordinazione
General Chemistry
91.7K Visualizzazioni