Method Article
内タンパク質の定方向進化のための変異導入と機能選択プロトコル E.大腸菌
要約
ここでは、特定の標的配列のランダム変異体ライブラリーを作成する単純なプロトコルを示しています。我々は、大腸菌の中で、生体内で行われるこの方法は、、新たな酵素活性を進化させ、機能の選択と結合することができる方法を示します。
要約
遺伝的多様性の効率的な世代は、ユニークな分子の署名を作成するために、または実験室での蛋白質を進化させ、DNA合成のラベル付けに使用することができる貴重な分子ツールを表します。ここでは、特定の標的配列のための大規模な(> 10 11)変異体ライブラリーの生成を可能にするプロトコルを示す。このメソッドは、DNAポリメラーゼI(LF -ポルI)の低忠実度の変異によってColE1プラスミドエンコーディングの複製所望の配列に基づいています。目的プラスミドは、E.のミューテーター株に変換されます大腸菌と固形培地上にプレーティングは、標的遺伝子の位置に応じて、0.2と1の変異/ KBの間得た。より高い突然変異の頻度は、突然変異誘発のこのプロセスを繰り返すことにより達成されています。変異導入の代替方法と比較して、我々のプロトコルは、クローニングまたはPCRが含まれないとして、そのシンプルさで際立っている。このように、私たちの方法は、変異プラスミドまたは他のポル私のテンプレートのラベルまたは元のターゲットには存在しない活動の発展のためにシーケンス空間の大部分を探索するために理想的です。 PCRやランダムオリゴヌクレオチドベースの手法の提案も、ライブラリの特定のセクションのその後のクローニングによって達成できることをタイトな空間的な制御。ここでは、ランダム変異体ライブラリーを作成する方法とE.の薬剤ベースの選択を確立する方法を示すプロトコルを提供する新しい生化学的な活動を示す変異体を同定するために大腸菌 。
プロトコル
ランダム変異体ライブラリーのI.の生成
ColE1プラスミド複製のPOL私の仲介の開始(でレビュー(1-3)。変異導入の我々の方法は、起点または複製にColE1プラスミド隣接の標的配列を配置することに基づいており、低忠実度DNAポリメラーゼを発現する細胞で、それが伝播されている私(LF -ポルI)。LF -ポル私は、複製の忠実度、すなわちI709N(モチーフで)、A759R(モチーフBの)とD424A(校正を不活性化)4,5を減少させるthree変異をコードする変異DNAポリメラーゼです。 LF -ポル私は37優勢活動°のC.の複製になります。LF -ポル私はポルI(polA12)(6)の温度感受性対立遺伝子を持つ大腸菌株、JS200、で表現されるようにランダム変異体ライブラリーの世代で制約条件の結果は下polA12細胞中の標的配列。突然変異飽和培養液4のより効率的であるが。依然として不明である理由から、変異導入が連続していない、突然変異の頻度は数に比例して増加しない、すなわち細胞を新鮮な培地でさらに拡大することを許可されている場合でも、文化が、飽和状態に達するといったん。Therefore世代が、さらにライブラリの突然変異荷重を増加させると変異導入し、プラスミド回収のラウンドの反復が必要です。ここでは、LF -ポルI変異誘発のためのプロトコルを提供する。プロトコルが大幅に所望の変異の負荷(図1)を達成するためのプロセスの繰り返しを容易にするために、当社独自の記述の4に対して簡素化されているここで紹介することに注意してください。
材料
- 細胞:JS200 recA718 polA12(TS)uvrA155 trpE65 LON - 11スーラ
- JS200 WT -ポルI:野生型(WT)はPol Iを発現しているJS200細胞
- JS200 LF -ポルI:低忠実度(LF)はPol Iを発現しているJS200
- 読み出しのひずみ:JS200 WT -ポルIまたは(相補用)特定の活性を欠く菌株
- プラスミドターゲット
- にクローニングされた標的遺伝子を持つ複製のColE1起点を含むプラスミド
1。エレクトロコンピテントJS200 LF -ポルI細胞の調製:変異導入前
- 一晩プラスミドベアリングLF -ポルI(0.03mg / mLのクロラムフェニコール)のための適切な抗生物質の選択を含む30℃(許容条件)で生育したLBプレートから単一JS200 LF -ポル私のコロニーを採取し、試験にコロニーを配置クロラムフェニコールを含むLBの8 mLの入ったチューブ。 30℃及び250rpmで一晩振とうして文化を育てる。
- 午前中は、私はクロラムフェニコールと400mlのLBを含むフラスコにJS200 LF - Polの8mlを注ぐことによって文化を展開します。それは0.4から0.7までの600(通常3 - 4H)に達するまで250rpmで振とうしながら培養を30℃で成長しましょう。
- 一度0.4から0.7までの600℃、15分間氷上で文化を冷やします。
- 遠心分離のための適切なコンテナに冷やした文化を転送する。 4℃で遠心分離により細胞をペレット化℃の上清を捨て、その後血清ピペットを使用してコンテナと再サスペンド細胞に滅菌し、チルド(氷上で)10%グリセロール10mlを加え。
- 50 mLコニカルチューブに再懸濁した細胞を移す。 4℃で15分間遠心分離後、10%グリセロールを45mlのマークにコニカルチューブをいっぱいにし、℃、4000rpm。
- 、上清を捨て、コニカルチューブに10%グリセロールのかつての10 mLを加え、および血清学的または通常のピペットを用いて細胞を再懸濁する。もう一度、4℃で15分間、10%グリセロールおよび遠心℃、4000rpmで45 mLのマークにコニカルチューブを埋める。倍以上の塩の痕跡をすべて削除するには、この手順を繰り返します。
- 最後のスピンの後に、(すなわち、10%グリセロール、2 mLで細胞を2 mLを再サスペンド)に等しい部分10%グリセロールで細胞のペレットを再懸濁する。
- 100μLといくつかのストレージチューブに細胞懸濁液の500μLの間に分注し。ドライアイス上で細胞を急速凍結し、-80保管℃に
- エレクトロコンピテント変換のために細胞を使用する前に、ゆっくりと氷上で細胞を解凍。
2。突然変異導入:目的プラスミドの変換
- エレクトロコンピテントJS200 LF -ポルI細胞のと2mmのギャップのエレクトロポレーションキュベットにターゲットプラスミドDNAの30 - 250ngの間にピペット40μL。
#注1:ColE1プラスミドを含むGFPは、制御などの標的遺伝子と並行して変異誘発によって行うことができます。読み出し工程の終了後に、GFPは、LB寒天プレートに播種することができますし、変異導入のために可視化した。暗い場所や薄暗い見えるコロニーは不活化変異を含んでいます。 - 1800Vでエレクトロで混合物をパルス。各サンプルのために均一なエレクトロポレーション条件を確保するために時定数を(T C)をチェックし、理想的にはT C = 5〜6秒。
- 37 ° C(解像度で40分間のLB培養液1mL中に細胞/ DNA混合物を回復する250 rpmで振盪trictive条件)。
- 100ミリメートルLB寒天ペトリ皿上でリカバリー文化のプレート50μLを37に予め温めておいた° Cクロラムフェニコールおよびプラスミドターゲットの選択抗生物質の適切な濃度の両方を含む。
注:第2位:"近くの芝生"の濃度でプレートに細胞をすることを目的。 "近くの芝生"の濃度は、コロニーの異なる、しかし無数(> 1000コロニー/ 100mmディッシュ)として定義されています。メッキ希釈は、もしあれば、エレクトロコンピテントセルはどのように依存します。細胞は非常に電気有能ではないと"の近くに芝生は""きちんとした"、次に50で再び中断、細胞を上清を取り除き、4000rpmで2分間回復の文化を遠心回収の文化をメッキすることにより達成されていない場合LBブロスとプレート文化のμL。 - 37℃で一晩ペトリdishe(S)℃にインキュベートする。
3。変異誘発:プラスミド回収
- 翌日、細胞上のLBブロス2 mLをピペットでペトリ皿を洗う。滅菌三角形の形をしたガラス棒でプレートを離れてそれらを"スクラブ"でLBブロスにLB寒天ペトリ皿からの細菌コロニーを移す。 、最初のLBブロス1 mLを加え洗浄を収集し、LBブロスの第二液を使用して手順を繰り返します。
- プレートの洗浄からプラスミドDNAを単離する。 (このプラスミドDNAは、ライブラリを構成している)。
#注3:LBプレートから採取した洗浄液は、その全体のミニプレップにあまりに濃いかもしれません。このような場合は、ミニプレップの最大は、ユーザーのミニプレップキット(一般的に、これはOD = 1にして洗濯物を希釈し、希釈した培養の〜3mLのを準備中関与)によって金額を割り当てたり、マキシプレップにスケールアップ
4。繰り返し
- LF -ポル私はプラスミドを直線化するが、(補足図1)目的プラスミドを切断しない制限酵素を単離したプラスミドDNAの1μgのを制限する。
- DNA精製キットを使用して制限消化をクリーンアップします。
#注4:このステップでは、制限酵素とそのバッファのすべてのトレースを削除します。このステップでは、その後の電気有能な変換のために塩濃度を低く保つことが不可欠である。 - 制限されたターゲットプラスミド変異導入のその後のラウンドを通してライブラリを置くために戻って新鮮なJS200 LF -ポルI細胞へのライブラリの30 - 250ngを再変換。
#注5:制限酵素を使用して、私はプラスミドポルを線形化プラスミドターゲットのみが変換されるようにします。 - セクション2と3を繰り返します。
5。読み出し
- 目的プラスミドと私はプラスミドポル両方を直線化する制限酵素(S)で分離されたプラスミドDNAを制限する。プラスミドの量と質を確保するために1%アガロースゲル上でダイジェストを実行します。 〜単離したプラスミドDNAの400ngを制限すると、通常の分析で十分です。
- LF -ポル私はプラスミドを直線化する制限酵素で単離したプラスミドDNAの1μgのを制限するが、あなたの目的プラスミドをカットしていません。
- DNA精製キットを使用して制限消化をクリーンアップします。
- 変異を特徴づけるために読み出し株に限定されたターゲットプラスミドライブラリーを変換する。
II。グラデーションの成長板を用いた変異画面および特性解析。
私たちのライブラリに存在する膨大な遺伝的多様性が、機能を選択的に結合する方法を説明するために、ここではE.のin vivoでの薬剤ベースの機能を選択するためのプロトコルを提供する大腸菌 。このメソッドは、固形寒天上で薬剤の勾配に沿って成長に基づいています。これは、単一の薬物治療よりも広いダイナミックレンジを提供し、濃度の範囲で複数(最大12)の試料の同時特性評価が可能になります。もう一つの利点は、このアッセイの非線形読み出しが2倍の範囲内で、実行可能性の中等度の違いをバッファリングすることです。従って、この細胞毒性 - 抵抗性検定は、変異体ライブラリーを選択すると個々の変異体の表現型のプロファイルを決定するために、堅牢かつ迅速な手段を提供します。図。 2は、これらの用途のそれぞれの例を示しています。パネル、人間の酸化の脱メチル化酵素ABH2ライブラリから個々の変異体の示す選択。 WTしきい値を超えて成長しているコロニーは、メチル化剤メチルメタンスルホネート(MMS)7によって引き起こされる細胞毒性からの保護を強化するために選択されています。パネルBは、個々のクローンの特性評価に使用するグラデーションの例を示しています。第三世代セファロスポリン系抗生物質セフォタキシムに耐性のレベルは、WTβ-ラクタマーゼに対する2つの拡張型変異体、R164HとE104K R164S G267R 4の寒天の勾配で示されています。単板よりも、観察された効果の強さに応じてする十分な定量のために必要となる場合があることに注意してください:0.4mg/ml勾配は対照クローンへの直接比較、最も強力な変異体の抵抗のレベルを可能にしながらできるだけより高い濃度を使用して確立するセフォタキシム(4mg/mL)のtration。
材料
- 機器
- 100x100x15mm平方ペトリ皿(フィッシャー科学#0875711A)
- 100ミリメートルラウンドペトリ皿
- 25x75x1mmガラスの顕微鏡スライド(フィッシャー科学#1255015)
- 50 mlチューブは、卒業
- メディアの
- LB寒天培地:56水浴中で溶融し、平衡化° C
#注6:メディアの温度は安定性とそのため検査されている薬剤または化合物の活性に影響を与える可能性があります。 - 軟寒天:42〜溶融し、水浴中で平衡° C
- LB寒天培地:56水浴中で溶融し、平衡化° C
1。勾配の建設
- 正方形のペトリ皿の底の一辺に均等に間隔をあけマークten車線、。
- ボトムマークエッジは、7mm上昇しているように、傾斜に皿を置きます。
厚い草などの平らなオブジェクトは、皿を高めるための支援として使用することができます。 25mlを注ぐ暖かい(〜56 ° C)傾斜皿に選択剤の適切な濃度とよく混合LB寒天。これは、勾配の下部層である。 LB寒天が均一にコートディッシュの上昇、著しいエンドはLB寒天の〜1mm前方に含まれており、低下の部分が含まれている〜LB寒天の8mmのように、ペトリ皿を確認してください。その後、寒天は10〜15分に設定することができます。
#7の点に注意してください。疎水性の選択エージェントの場合、0.1%の界面活性剤(消泡剤Bエマルジョンが)懸濁液および薬剤の均一な分布を容易にするために、LB寒天培地に添加することができる。精力的に選択剤を添加する前に振とうしながら暖かい滅菌LB寒天に界面活性剤を追加。界面活性剤は、小さな液滴の微細ヘイズとして、大きな液滴が媒体が熱すぎると被験薬の均一な分布を抑制する可能性があることを示す一時停止してください。 - LB寒天培地の最初の25 mLのが硬化した後に、皿が平らな面に移動されます。次に、選択したエージェントなしのLB寒天培地25mLを、最初のLB寒天の表面にオーバーレイする注がれています。これは、勾配の最上位層です。 LB寒天は底層の表面全体を覆っていることを確認します。換気用の蓋を斜めにしてカバーし、寒天は10〜15分に設定することができます。
#注8:エアロゾル危険と試験化合物の潜在的な揮発に注意して、化学物質の安全性の要件によって規定された場合、化学的または生物学的安全性のフードで勾配を注ぐ。
#9の点に注意してください。グラデーションの料理は、薬または試験化合物濃度の勾配を維持するために4時間以内にご使用ください。
2。細菌の転送をスタンプ
- 軟寒天は42℃に平衡化する必要があります100ミリメートルラウンドペトリ皿の蓋または底部に液体の軟寒天2mLを転送する。その後ピペット軟寒天に細菌培養の40μLとプレートを揺らして混合します。
#10の点に注意してください。細菌培養の成長段階は、薬または試験化合物への応答に影響を与える可能性があります。対数増殖期または定常期で一晩培養における培養は、均一な結果を得るために一貫して使用する必要があります。細胞密度はまた、スキューの相対的な結果ができる、したがって、すべての文化は、600の濃度値と一致したために希釈してください。一晩培養は、600密度1.0未満を持つように希釈してください - 軟寒天の混合物とガラスの顕微鏡スライドの長辺コート。その後、勾配の皿の一番下のマーク(高濃度の低いから)とスライドのコーティングされたエッジを合わせ、寒天の表面にスライドをタッチします。ソフトタッチは、勾配の表面に軟寒天のリボンを転送するのに十分です。スライドはその後洗浄して再利用するために確保されています。
- 細菌サンプルの残りの部分については、このプロセスを繰り返します。複数の勾配が実行されている場合、参照サンプルは、各勾配の皿に含まれている必要があります。
- ダウン一晩37℃勾配皿の上をインキュベート℃をインキュベーションの時間および温度は37℃で異なる読み出し細菌株が一晩ごとに異なる場合があります° Cは、通常、目に見える成長のために十分です。
3。イメージングと成長の分析
- イメージング:一晩増殖させた後、グラデーションが直接イメージングまたは固定され、95%エタノールで0.2mg / mLのアクリジンオレンジ溶液で染色することができる、コントラストを強調する。板が染色液に、5分間室温でインキュベートされ、その後95%EtOHで洗浄し、UVライトボックスの上に画像化。
#11に注目してください:プレートからコロニーをフラッシュではなく、板の上に染色液と洗浄液を揺すると、コーナーからソリューションを削除しないように注意してください。 - 個々の変異体プラスミドの表現型解析のために、濃度勾配に逆らって成長の距離は、各勾配上の標準に正規化されています。これらの相対値は、グラデーションの間で比較することができます。
#12の点に注意してください。細胞毒性効果の性質、鋭いエッジ以上のびまん性のエッジにもよりますが(図2の例のパネルAおよびBのための比較)を観察することができます。びまん性のエッジの場合には、それはエッジOを測定することをお勧めします個々のコロニーが増加した変動を示す傾向にあるようにfを連続的な成長、。 - ライブラリの選択については、親の野生型のコントロールよりも高い濃度で成長する個々のコロニーを単離し、より強力な保護に寄与する変異を同定するために配列されています。
III。代表的な結果:
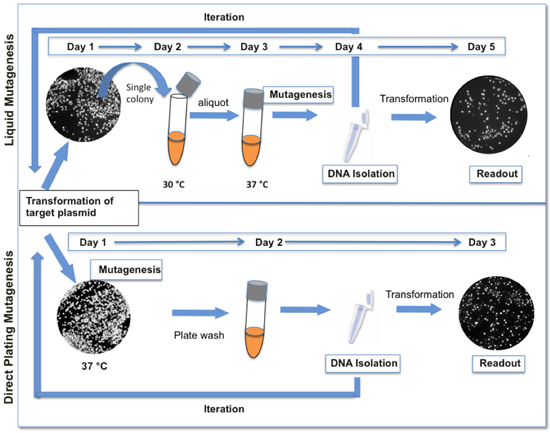
図1。 (下)ここで紹介する液体との直接メッキ突然変異誘発プロトコル間の比較。ダイレクトメッキの変異誘発のプロトコルが高速ですし、私たちのオリジナルの液体の突然変異誘発のプロトコル(上)よりも少ない手順が必要になります。 GFPをレポーターとして使用される場合、蛍光の変化は、ライブラリ内の遺伝的多様性の存在を示すものである。一般的に、蛍光のかなりの減少レベル12から18パーセントのコロニーにおける変異誘発の結果の1サイクル。
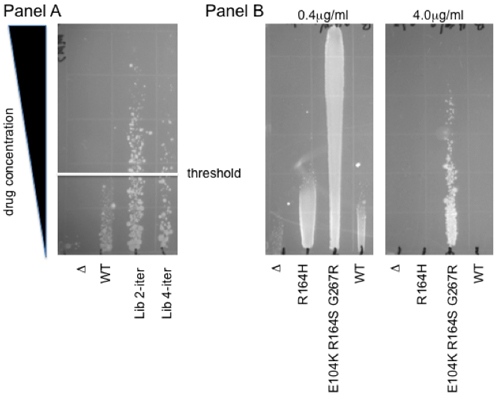
図2。勾配抵抗アッセイ。人間の酸化的脱メチル化酵素ABH2のパネルメチルメタンスルホン(MMS)への抵抗の増加のための選択。プラスミドライブラリーは、MMSへの抵抗の増加のために選択した。変異誘発のプロトコルの2つのと4回の繰り返しを表す2つのようなライブラリは、親の野生型(WT)と空のベクター(Δ)と比較して示されています。白い線は、個々の突然変異体コロニーがさらに表現型解析のために隔離されたしきい値を示します。 拡張型β-ラクタマーゼ活性を示すパネルBセフォタキシムの保護は、。R164HとE104K R164H G267R、以前に同定されたβ-ラクタマーゼの2つの変異体は、次のLF -アズトレオナムの選択4に結合さPOL私の突然変異誘発は、0.4μg/mLと4μg/mLセフォタキシムの勾配で示されています。野生型β-ラクタマーゼ酵素は空のベクトル、Δを発現する細胞からの相対には保護を付与するものではありませんので注意してください。したがって、これらの変異体は、新たな生化学的活性8,9の進化を表しています。
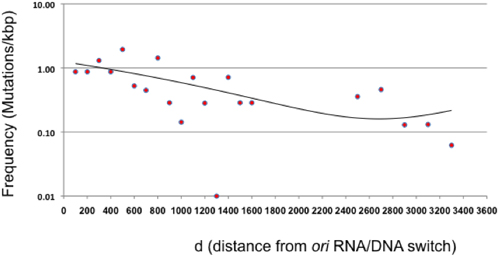
図3。オリ(D)からの距離の関数としての変異頻度は。ダイレクトメッキの突然変異誘発の単一サイクルは、次の変異頻度は、複製のColE1由来のRNA / DNAスイッチへの相対は100bp間隔で表示されます。 β-ラクタマーゼは、中立的な目標を表していないので、1600と2400の間の領域も表示されません。 β-ラクタマーゼ超えた点は、この領域の変異の全体的な低周波を与えられた200塩基対の間隔を表します。 (R 2 = 0.41の二項式、)傾向は線として表示されます。

補足図1。私はプラスミドLFポル私含有ポル。シーケンス (FASTA形式)。繰り返し(ランダム変異ライブラリの手順4の生成)または読み出し(ステップ5)のいずれか私はプラスミドポルを線形化するときに使用する適切な制限酵素(s)を決定するための配列情報。B一般的な機能とプラスミドの制限酵素地図。複製のpSC101起源、クロラムフェニコール耐性マーカー(CAT)とLF -ポルI遺伝子の位置が表示されます。単一の制限部位の位置も同様に示されています。
| 図書館 | ダイレクトめっき | 液体 (1日) | 液体 (3日) | |
| 突然変異(#) | 95 | 40 | 142 | |
| クローンは、配列を決定 | 288 | 96 | 190 | |
| 合計カバレッジ(BP) | 182000 | 102000 | 213000 | |
| 突然変異周波数(× 10 3塩基) | 0.52 | 0.39 | 0.67 | |
| 周波数D <1000(X10 3塩基) | 0.92 | 0.41 | 0.70 |
表1。突然変異の頻度 D <1000用周波数(#突然変異/ BPのように表される)、という3つの突然変異誘発のプロトコルのためのRNA / DNAスイッチに隣接する1000塩基、内:ダイレクトメッキ、液体飽和度(1日)、および液体hypersaturation( 3日間)。
| ダイレクトめっき | 液体 | ||
| 突然変異(#) | 95 | 182 | |
| スペクトラム(%) | |||
| Gへ | Gへ | 6.3 | 19.2 |
| CのT | 4.2 | 3.8 | |
| TへのC | Gへ | 27.4 | 13.7 |
| TへのC | 35.8 | 35.2 | |
| Tへ | Tへ | 5.3 | 8.2 |
| にT | 5.3 | 7.1 | |
| GのT | GのT | 1.1 | 1.1 |
| Cへ | 0.0 | 2.2 | |
| G Tへ | G Tへ | 1.1 | 2.7 |
| にC | 2.1 | 2.7 | |
| GのC | GのC | 2.1 | 1.1 |
| CにG | 5.3 | 2.7 | |
| indelsの | イン | 3.2 | 0.0 |
| デル | 1.1 | 0.0 | |
| Nへ | 11.6 | 29.7 | |
| NにG | 33.7 | 19.2 | |
| NのT | 10.5 | 12.1 | |
| NへのC | 40.0 | 39.0 | |
| TS | 73.7 | 72.0 | |
| TV | 22.1 | 28.0 | |
| indelsの | 4.2 | 0 |
表2。ダイレクトプレーティングと液体変異誘発のための突然変異のメトリック。表では、変異誘発の単一サイクル後に観察突然変異の数(数の)と突然変異のスペクトルを(%で)提示。スペクトルは、相補的なペアで、ヌクレオチドの変化によって、及び変異の種類により分類されます。
ディスカッション
この記事では、クローニングまたはPCRを必要とせずに大規模なランダム変異体ライブラリーの生成を可能にする突然変異誘発プロトコールを示します。このメソッドは、コードするプラスミド目的の配列のエラーが発生しやすいのレプリケーションに基づいています。理論的には、突然変異の大部分はRNA / DNAスイッチのすぐ下流に位置する100から300 bpに制限しなければならない、リーダー鎖の中間の大きさは、ポル私2,10によって生産。我々は、プラスミドのoriが増加する(図3)からの距離と周波数の減少が、このプロトコルで提示条件の下で、ポル私の変異は、すべてのプラスミド上で発生することがわかった。この知見は、転移やColE1プラスミド複製中にはPol IIIにはPol Iから"スイッチが"少なくとも我々の実験条件2の下に、はるかに緩やかな以前の報告よりであることを意味し、そしてポル私とポルとの間の機能的な冗長性を示唆する以前の研究と一致III 11。
当社独自のプロトコルでは、液体培養(4)に変異を説明。このプロトコルは、RNA / DNAスイッチ(表1)に隣接する1000塩基の中で、すなわち、D <1000 0.41突然変異/ kbを得られます。どんな新鮮な培地を添加せずに3日間振盪機で液体培養を残すことHypersaturationは0.70突然変異/ kbに、非常に貧しいプラスミド収量の結果(1%未満1日目と比較すると、データは示していない)への変異頻度を発生させます(表1)。ここでは、直接37 ° C(図1)における固体寒天上で目的プラスミドの形質転換をめっきに基づいて簡易プロトコルを提示する。この手順では、変異誘発の突然変異/サイクル(0.92突然変異/ D <1000 KB)の最大周波数を生成し、非常に反復を容易にします。固体培地に培養条件を変更すると、突然変異のスペクトル(表2)に影響します。ダイレクトメッキの突然変異誘発は、マークは(C→T対G→AとA→GとT→Cを比較)液体培地で見られる相補的塩基対の置換の間に非対称性が減少。一方、直接めっきはより多くのindelsの(0.5%未満から4%へ)生産され、3倍で→G変異の数を減少し、G / Cの変異(74%)のoverrepresentationにつながる。全体的に、我々はここで紹介するダイレクトプレーティングプロトコルのより簡潔さと効率性の向上が液体変異導入により生成少しよりバランスのとれた突然変異スペクトルのメリットを上回ると信じています。
プラスミドターゲット内に、私たちのメソッドによって生成される変異が所望の標的配列に限定されるものではない。それは定性的ではなく定量的な変化を表しているしかし、小説生化学的活動の進化は、標的遺伝子内の変異に依存する必要があります。従って、勾配プレート上の変異体のスクリーニングとのプラスミド変異を組み合わせることで新たな生化学的性質の進化のための私たちのシステム(大規模なライブラリや選択の可用性)の強みを利用しています。このような既存の酵素活性の最適化や遺伝子の特定の領域をランダム化するようなランダム変異誘発の他のアプリケーションでは、ランダム変異誘発は、次のクローニングを必要としません。この場合、PCRの増幅産物とは対照的に、プラスミドでライブラリを持つことは、増幅し、制限を容易にすることにより、クローニングの効率を向上させます。
要するに、我々は、そのシンプルさのために、生成されたライブラリの多様性のため目立つ所定の標的遺伝子のランダム変異体ライブラリーを作成する単純なプロトコルを示しています。我々は、このメソッドは新しい生化学的活動の効率的な発展のための機能的な選択と結合することができる方法を示します。さらに、私たちは、 生体内で生成されたライブラリ内の既存の活動の部位特異的変異誘発または最適化を可能に、容易にクローニングすることができる。
開示事項
謝辞
この作品は、K08 MCへの賞CA116429 - 04と今コンカーがんからの助成金によって(懸念)基礎#8501によってサポートされています
資料
| Name | Company | Catalog Number | Comments |
| carbenicillin | Cellgro | 46100R6 | 0.1mg/ml final |
| tetracycline | Fisher Scientific | BP7640 | 0.05mg/ml final |
| chloramphenicol | Genlantis | M120100 | 0.03mg/ml final |
| LB Agar Miller | Fisher Scientific | BP1425 | |
| LB Broth Miller | Difco Laboratories | 244620 | |
| Soft Agar | Difco Laboratories | 214580 | Made in house |
| Acridine Orange | Sigma-Aldrich | A38401-1 | |
| Antifoam B emulsion | Sigma-Aldrich | A5757 | |
| Glycerol | Acros Organics | 332030025 | |
| 100x100x15mm sq dish | Fisher Scientific | 0875711A | |
| 100mm rnd dish | Fisher Scientific | 0875712A | |
| Microscope slide 25x75x1mm | Gold Seal | 3048 | |
| Electroporator 2510 | Eppendorf | ||
| Electroporator 2510 | Eppendorf | ||
| 2mm gap tubes | Molecular BioProducts | 5520 | |
| Zippy mini prep kit | Zymo Research Corp. | D4020 |
参考文献
- Camps, M. Modulation of ColE1-like plasmid replication for recombinant gene expression. Recent Pat DNA Gene Seq. 4, 58-73 (2010).
- Itoh, T., Tomizawa, J. Initiation of replication of plasmid ColE1 DNA by RNA polymerase, ribonuclease H, and DNA polymerase I. Cold Spring Harb Symp Quant Biol. 43 Pt 1, 409-417 (1979).
- Polisky, B. ColE1 replication control circuitry: sense from antisense. Cell. 55, 929-932 (1988).
- Camps, M., Naukkarinen, J., Johnson, B. P., Loeb, L. A. Targeted gene evolution in Escherichia coli using a highly error-prone DNA polymerase I. Proc Natl Acad Sci U S A. 100, 9727-9732 (2003).
- Shinkai, A., Loeb, L. A. In vivo mutagenesis by Escherichia coli DNA polymerase I. Ile(709) in motif A functions in base selection. J Biol Chem. 276, 46759-46764 (2001).
- Uyemura, D., Lehman, I. R. Biochemical characterization of mutant forms of DNA polymerase I from Escherichia coli. I. The polA12 mutation. J Biol Chem. 251, 4078-4084 (1976).
- Sedgwick, B., Robins, P., Lindahl, T. Direct removal of alkylation damage from DNA by AlkB and related DNA dioxygenases. Methods Enzymol. 408, 108-120 (2006).
- Aharoni, A., Gaidukov, L., Khersonsky, O., Mc, Q. G. S., Roodveldt, C., Tawfik, D. S. The 'evolvability' of promiscuous protein functions. Nat Genet. 37, 73-76 (2005).
- Elena, S. F., Lenski, R. E. Evolution experiments with microorganisms: the dynamics and genetic bases of adaptation. Nat Rev Genet. 4, 457-469 (2003).
- Itoh, T., Tomizawa, J. FoFormation of an RNA primer for initiation of replication of ColE1 DNA by ribonuclease H. Proc Natl Acad Sci U S A. 77, 2450-2454 (1980).
- Bryan, S. K., Moses, R. E. Sufficiency of the Klenow fragment for survival of polC(Ts) pcbA1 Escherichia coli at 43 degrees. C. J Bacteriol. 170, 456-458 (1988).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved