Method Article
Мутагенеза и функциональные Выбор протоколов для направленной эволюции белков в Е. палочки
В этой статье
Резюме
Здесь мы показываем, простой протокол для создания случайных мутантов библиотека для данной целевой последовательности. Мы покажем, как этот метод, который проводится в естественных условиях в кишечной палочки, могут быть связаны с функциональными выбор развиваться новые ферментативной деятельности.
Аннотация
Эффективной генерации генетического разнообразия представляет бесценный молекулярной инструмент, который может быть использован для обозначения синтеза ДНК, чтобы создать уникальные молекулярные подписи или развиваться белки в лаборатории. Здесь мы приводим протокол, который позволяет поколение больших (> 10 11) мутант библиотеки для данной целевой последовательности. Этот метод основан на репликации ColE1 плазмиды, кодирующей желаемой последовательности по низким верности вариант ДНК-полимеразы I (LF-Pol I). Целевой плазмиды превращается в мутатор штамма E. палочки и высевали на твердые среды, что дает от 0,2 до 1 мутации / кб, в зависимости от расположения гена-мишени. Более высокие частоты мутаций достигается путем перебора этот процесс мутагенеза. По сравнению с альтернативными методами мутагенеза, наш протокол выделяется своей простотой, так как не клонирование или ПЦР участвуют. Таким образом, наш метод идеально подходит для маркировки мутационные плазмид или других шаблонов я Pol или исследовать большие участки последовательности пространство для развития деятельности, не присутствующие в первоначальной цели. Жесткие пространственные управления, ПЦР или рандомизированных олигонуклеотидных методов, основанных на предложение также может быть достигнуто за счет последующего клонирования отдельных разделов библиотеки. Здесь мы предлагаем протоколов, показывающий, как создать случайный мутант библиотеки и как установить наркотиков основе выбора в E. палочки для выявления мутантов выставке новых биохимических деятельности.
протокол
И. Генерация случайных Мутант библиотека
Pol I посредником начала ColE1 плазмидной репликации (см. обзор (1-3). Наш метод мутагенеза основана на размещении последовательности-мишени в ColE1 плазмиды, прилегающих к происхождению или репликации и распространения его в клетках, экспрессирующих низкой точности ДНК-полимеразы I (LF-Pol I). LF-Pol I является мутантом ДНК-полимеразы I кодирования три мутации, которые снижают точность репликации, а именно I709N (в мотив), A759R (в мотиве Б) и D424A (инактивации корректура) 4,5 . LF-Pol I выражается в штамм E.coli, JS200, которая чувствительных к температуре аллель Pol I (polA12) (6) так, что LF-Pol I становится преобладающей активности при 37 ° C. Репликация последовательности-мишени в клетках под polA12 ограничительных условиях приводит генерации случайного мутант библиотеки. мутагенеза является более эффективным в насыщенном культур 4. По причинам, которые до сих пор неясно, мутагенез не является непрерывным, то есть частота мутаций не увеличивается линейно с увеличением числа поколений, когда-то культура достигает насыщения, даже если клетки допускаются к дальнейшему расширению в свежей информации. Таким образом, дальнейшее увеличение нагрузки мутации библиотеки требует итерационных раундов мутагенеза и плазмиды восстановления. Здесь мы предлагаем протоколов для LF-Pol мутагенеза я. Обратите внимание, что протоколы, представленные здесь была значительно упрощена по сравнению с нашей первоначальной 4 описание в целях содействия итерации процесса для достижения желаемого мутации нагрузки (рис. 1).
Материалы
- Клетки: JS200 recA718 polA12 (TS) uvrA155 trpE65 LON-11-Сула
- JS200 WT-Pol I: JS200 клеток, экспрессирующих дикого типа (WT) Pol I
- JS200 LF-Pol I: JS200 выражения низкой точностью (LF) Pol I
- Считывание деформации: JS200 WT-Pol I или (для дополнения) напряжение отсутствует специфическая активность
- Целевая плазмиды
- Плазмиды, содержащей ColE1 начала репликации с целевой ген клонирован в
1. Перед Мутагенез: Подготовка электрокомпетентных JS200 LF-Pol клетки я
- Выберите одну JS200 LF-Pol I колонии от LB пластины, выращенных при 30 ° C (разрешительной условиях) в течение ночи содержащей соответствующий антибиотик выбора для плазмиды подшипников LF-Pol I (0.03mg / мл хлорамфеникола) и место колонии в тестовую пробирку, содержащую 8 мл LB с хлорамфениколом. Рост культуры при 30 ° С и встряхивании при 250rpm ночь.
- Утром, расширить культуру, вливая 8 мл JS200 LF-Pol I в колбу, содержащую 400 мл LB с хлорамфениколом. Давайте культуры растут при температуре 30 ° C при встряхивании на 250rpm, пока не достигнет 600 из 0,4-0,7 (обычно 3-4 ч).
- Как-то на 600 из 0.4-0.7, озноб культуры на льду в течение 15 минут.
- Передача охлажденного культуры контейнер для центрифугирования. Гранул клетки центрифугированием при 4 ° C. Слейте надосадочную жидкость, а затем добавить 10 мл стерильного и охлажденную (на льду) 10% глицерина в контейнер и повторно приостанавливать ячеек с помощью серологических пипетки.
- Передача повторно приостановил клеток в 50 мл коническую трубку. Заполните конической трубе до 45 мл марки с 10% глицерина, а затем центрифуги в течение 15 минут при температуре 4 ° С и 4000rpm.
- Слейте надосадочную жидкость, добавить еще раз 10 мл 10% глицерина в конической трубе, и вновь приостановить ячеек с помощью серологических или нормальной пипетки. Опять же, заполняют коническую трубку с 45 мл марки с 10% глицерина и центрифуги в течение 15 минут при температуре 4 ° С и 4000rpm. Повторите эту процедуру еще дважды, чтобы удалить все следы соли.
- После окончательного отжима, вновь приостановить гранул клеток в равных долях 10% глицерина (то есть повторно приостанавливать 2 мл клеток с 2 мл 10% глицерина).
- Алиготе от 100 мкл и 500 мкл приостановлено клеток в нескольких труб хранения. Быстрый заморозки клеток на сухой лед, а затем хранить их при температуре -80 ° C.
- Перед использованием клеток для электро-компетентных преобразований, оттепель клетки медленно на льду.
2. Мутагенез: Преобразование целевой плазмиды
- Внесите 40 мкл электрокомпетентных JS200 LF-Pol клетки я и между 30-250ng целевой плазмиды ДНК в электропорации кюветы зазор 2 мм.
Примечание # 1: ColE1 плазмиды, содержащей GFP может быть осуществлена через мутагенеза параллельно с целевого гена в качестве контроля. После завершения считывания шаг, GFP может быть покрытие на пластинах LB агар и визуализировать для мутагенеза. Колонии, которые появляются темным или тусклым содержат инактивирующих мутаций. - Импульсный смеси в electroporator на 1800V. Проверьте постоянная времени (T c) для обеспечения единых условий электропорации для каждого образца, в идеале T c = 5-6 сек.
- Восстановление клеток / ДНК смесь в 1 мл LB бульоне в течение 40 минут при 37 ° С (ВИЭtrictive условиях) тряски при 250 оборотах в минуту.
- Пластина 50 мкл восстановления культуры на 100 мм блюдо Петри агар LB предварительно нагревают до 37 ° С, содержащий как хлорамфеникол и соответствующей концентрации антибиотика выбора для целевой плазмиды.
Примечание: # 2: цель заключается в пластине клеток в "ближнем газон" концентрации. "Возле газона" концентрация определяется как различные, но несчетное число колоний (> 1000 колоний / 100 мм блюдо). Разбавления покрытие, если таковые имеются, будет зависеть от того, как электро-компетентные клетки. Если клетки не очень компетентных электро-и "ближнее газон" не достижимо при посеве культуры рекуперации "аккуратной", то центрифуги восстановления культуры в течение 2 минут при 4000rpm, слить супернатант, вновь приостановить клеток в 50 мкл бульон LB и пластины культуры. - Инкубируйте Петри dishe (ы) в течение ночи при температуре 37 ° C.
3. Мутагенез: плазмиды восстановления
- На следующий день, мыть чашки Петри с помощью пипетки 2 мл LB бульоне по ячейкам. Передача бактериальных колоний от LB агар в чашках Петри Б. бульона "очистка" их от пластины с стерилизовать треугольной стеклянной палочкой. Добавить 1 мл LB бульоне во-первых, собирать мыть и повторите процедуру со второй мл LB бульоне.
- Изолировать плазмидной ДНК из пластины стирки. (Это плазмидной ДНК представляет собой библиотеку).
Примечание № 3: мыть собраны из LB пластины может быть слишком плотным, чтобы мини-приготовительные в полном объеме. Если это так, мини-приготовительные максимальная сумма выделенных на вашей мини-приготовительные комплект (как правило, это связано с разбавлением вашего мыть с OD = 1 и Prepping ~ 3 мл разбавленного культуры) или масштабироваться до макси-приготовительные
4. Итерация
- Ограничить 1 мкг на изолированные плазмиды ДНК с ограничением фермента, который линеаризует LF-Pol I плазмиды, но не сокращает вашу целевую плазмиды (дополнительные рис. 1).
- Очистка ограничение переварить с помощью набора очистки ДНК.
Примечание № 4: На этом этапе удаляет все следы фермента ограничений и ее буфера. Этот шаг необходим, чтобы поддерживать низкие концентрации соли для последующей электро-компетентных преобразований. - Re-преобразования 30-250ng ограниченной целевой плазмиды библиотеки обратно в свежем JS200 LF-Pol I клетки поставить библиотеки через последующих раундов мутагенеза.
Примечание № 5: Линеаризуя Pol I плазмиды использованием рестрикции гарантирует, что только целевой плазмиды преобразуется. - Повторите разделах 2 и 3.
5. Считывание
- Ограничить изолированной ДНК плазмиды с ограничением фермента (ы), которые линеаризует как целевой плазмиды и Pol I плазмиды. Выполнить переваривать на 1% агарозном геле для обеспечения количества и качества плазмид. Ограничение ~ 400ng из изолированной ДНК плазмиды обычно достаточно для анализа.
- Ограничить 1 мкг на изолированные плазмиды ДНК с ограничением фермента, который линеаризует LF-Pol I плазмиды, но не режет вашей целевой плазмиды.
- Очистка ограничение переварить с помощью набора очистки ДНК.
- Преобразование ограниченной целевой плазмиды библиотеки в считывания напрягаться, чтобы охарактеризовать мутаций.
II. Мутант экрана и черт анализ с помощью пластины градиент роста.
Для того, чтобы проиллюстрировать, как огромное генетическое разнообразие присутствует в нашей библиотеки могут быть связаны с функциональной отбора, здесь мы предоставляем протокол для наркотиков основе функционального выбора в естественных условиях в E. палочки. Этот метод основан на рост вдоль градиента наркотиков на твердом агаре. Это позволяет одновременную характеристику нескольких (до 12) образцов в диапазоне концентраций, что обеспечивает более широкий динамический диапазон, чем один лечения наркозависимости. Еще одним преимуществом является то, что нелинейные считывание этого анализа буферов умеренные различия в жизнеспособности, в течение 2-кратный диапазон. Таким образом, этот цитотоксичность сопротивления препарат обеспечивает надежный и быстрый способ, чтобы выбрать мутант библиотек и определить фенотипические профиля отдельных мутантов. Рис. 2 показан пример каждого из этих применений: панель показывает, подбор индивидуальных мутантов человека окислительного деметилазы ABH2 библиотеки. Колоний, растущих над WT порог выбраны для усиления защиты от цитотоксичности вызванных метилирующих агент метил метан сульфонат (MMS) 7. Группа B показывает пример того, градиенты для отдельных характеристик клона. Уровень сопротивления третьего поколения цефалоспоринов антибиотик цефотаксим показано на агар градиент для WT β-лактамаз и в течение двух расширенного спектра мутантов, R164H и E104K R164S G267R 4. Обратите внимание, что в зависимости от силы наблюдаемых эффектов, более чем одной пластиной может быть необходимо для адекватной количественной: в то время 0.4mg/ml градиента позволяет прямое сравнение с контрольной клонов, уровень сопротивления из самых мощных мутантов можно только устанавливается с помощью более высокой концентрацииконцентрация цефотаксима (4mg/mL).
Материалы
- Оборудование
- 100x100x15mm квадратные чашки Петри (Fisher Научно # 0875711A)
- 100 мм круглые чашки Петри
- 25x75x1mm стекло стекло микроскопа (Fischer Научно # 1255015)
- 50 мл трубки окончил
- Средства массовой информации
- LB агар расплавляют и уравновешенной в водяной бане при температуре 56 ° C
Обратите внимание, # 6: температура СМИ могут повлиять на стабильность и, таким образом активность препарата или соединения рассматривается. - Мягкие агар: плавится и уравновешенной на водяной бане до 42 ° C
- LB агар расплавляют и уравновешенной в водяной бане при температуре 56 ° C
1. Строительство градиент
- Марк десять полос, расположенных равномерно по одному краю нижней части площади чашки Петри.
- Место блюдо на склоне так, что нижний край отмечен повышенный 7 мм;
густой траве или другой плоский объект может быть использован в качестве поддержки, чтобы поднять блюдо. Налейте 25 мл теплой (~ 56 ° C), LB агар тщательно перемешивают с соответствующей концентрации выборе агента в наклонном блюдо. Это нижний слой градиента. Убедитесь, что LB агар равномерно пальто чашке Петри, что повышенный, отмеченные конце блюдо содержит ~ 1 мм ЛБ-агар и пониженной части содержит ~ 8 мм ЛБ-агар. Тогда позвольте агар для установки на 10-15 минут.
Обратите внимание, № 7: Для выбора гидрофобных агентов, 0,1% поверхностно-активного вещества (антипенные B эмульсии) могут быть добавлены к LB агар для облегчения подвески и равномерного распределения препарата. Добавить поверхностно теплой стерильной агар LB с энергичного встряхивания перед добавлением выборе агента. Поверхностно-активного вещества следует приостановить в виде штрафа дымке маленькие капельки, больших капель, указывают СМИ слишком горяч и может препятствовать равномерному распределению испытаний препарата. - После первых 25 мл LB агар затвердеет, блюдо переехал в плоскую поверхность. Далее, 25 мл LB агар без выбора агента заливают наложения первой поверхности агара LB. Это верхний слой градиента. Убедитесь, что LB агар охватывает всю поверхность нижнего слоя. Накрыть крышкой косо для вентиляции, и позволяют агар для установки на 10-15 минут.
Обратите внимание, № 8: Будьте в курсе аэрозоля опасностей и потенциальных испарения испытуемого соединения, разлить градиентов в капюшон безопасности химических или биологических, если это предусмотрено требованиями химической безопасности.
Примечание # 9: Градиент блюд следует использовать в течение 4 часов, чтобы сохранить градиент концентрации препарата или тестируемого соединения.
2. Stamp передачи бактерий
- Мягкие агар должны быть доведены до 42 ° C. Передача 2 мл жидкости мягком агаре в крышку или нижней части 100 мм круглые чашки Петри. Внесите 40 мкл бактериальной культуры в мягком агаре, а затем смешайте качалки пластины.
Примечание # 10: стадии роста бактериальной культуры может повлиять на его реакции на лекарства или испытуемого соединения. Культур в фазе журнале или на ночь культур в стационарной фазы должны быть использованы с достаточной последовательностью для равномерного результата. Сотовые плотности также может исказить относительные результаты, таким образом, все культуры должны быть разбавлены иметь соответствует 600 значений плотности. Ночь культуры должны быть разбавлены иметь 600 плотности менее 1,0 - Шерсть длинная предметное стекло микроскопа с мягкой смеси агара. Затем, совместив покрытием край слайда с нижней отметки (от низкой до высокой концентрации) на градиент блюдо, сенсорный слайдов на поверхность агара. Мягкие прикосновения достаточно для передачи лента мягком агаре с градиентом поверхности. Слайд, затем, предназначенные для очистки и повторного использования.
- Повторите этот процесс, на оставшуюся часть бактериальных образцов. Ссылка образцы должны быть включены на каждом градиент блюдо, если несколько градиенты запускаются.
- Инкубируйте верхней градиент блюдо до ночи при 37 ° C. Время и температуру инкубации может отличаться для разных считывания бактериальных штаммов, но в течение ночи при 37 ° С, как правило, достаточным для видимого роста.
3. Работа с изображениями и анализа роста
- Получение изображений: После ночи роста, градиенты могут быть непосредственно отображаемого или фиксированных и окрашенных раствором 0,2 мг / мл акридинового оранжевого в 95% этанола, для повышения контрастности. Пластины выдерживают при комнатной температуре в течение 5 мин, в красящим раствором, затем промывают 95% этанолом, а затем отображаемого на УФ окне свет.
Примечание # 11: Будьте осторожны, не заподлицо колоний от пластины, а скорее рок решение окрашивания и омывает пластины и удалять решения из углов. - Для фенотип анализ отдельных мутант плазмиды, расстояние роста против градиента концентрации нормирована на стандартный на каждом градиента. Эти относительные величины могут быть сопоставлены между градиентами.
Примечание # 12: В зависимости от характера цитотоксический эффект, острые края или более размытым краем можно наблюдать (см., например, панели и В на рис 2). В случае с размытыми краями, целесообразно измерять края ое непрерывного роста, а отдельные колонии, как правило, указывают на увеличение изменчивости. - Для библиотеки отбора, отдельные колонии, которые растут при концентрации выше, чем родительские дикий тип управления изолированы и секвенированы для выявления мутаций, способствует расширению защиты.
III. Представитель Результаты:
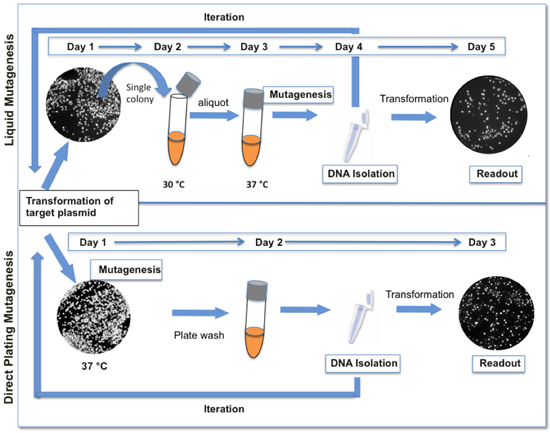
Рисунок 1. Сравнение между жидкостью и прямое покрытие протоколов мутагенеза. Прямого протокол мутагенеза покрытий, представленные здесь (внизу) быстрее и требует меньше шагов, чем наши оригинальные жидкости протокол мутагенеза (сверху). Когда GFP используется в качестве репортера, изменения флуоресценции указывают на генетическое разнообразие настоящее время в библиотеке. Как правило, один цикл мутагенеза приводит к 12-18% колоний заметно снижение уровня флуоресценции.
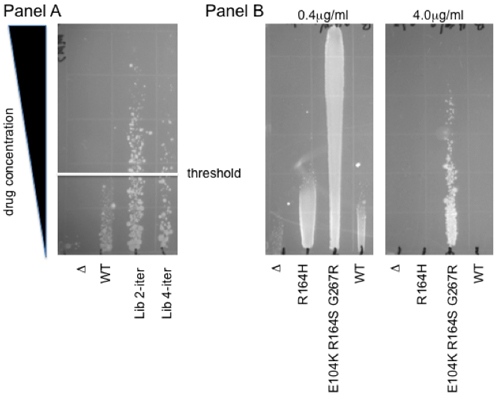
Рисунок 2. Анализы Градиент сопротивления. Группа выбора для повышения устойчивости к метил-метансульфонат (MMS). Плазмиды библиотеки человека окислительного деметилазы ABH2 были отобраны для повышенной устойчивостью к MMS. Два таких библиотек, представляющих два и четыре итерации мутагенеза протокола приведены в сравнении с родительскими дикого типа (WT) и пустой вектор (Δ). Белая линия обозначает порог, выше которого отдельные мутантов колонии были изолированы для дальнейшей фенотипического анализа. Группа B Цефотаксим защиты, что свидетельствует о расширенного спектра β-лактамазы деятельности. R164H и E104K R164H G267R, двух мутантов бета-лактамазы ранее выявленных следующие LF- Pol I мутагенеза связаны с азтреонам выбора 4, показаны на 0.4μg/mL и 4μg/mL градиент цефотаксим. Обратите внимание, что дикого типа β-лактамазы фермента дает никакой защиты по отношению к клеток, экспрессирующих пустой вектор, Δ. Таким образом, эти мутанты представляют собой эволюцию нового биохимической активностью 8,9.
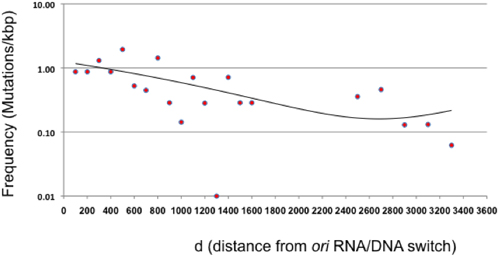
Рисунок 3. Мутация частоты в зависимости от расстояния от ориентации (г). Частота мутаций после одного цикла прямого мутагенеза покрытия показана на 100 б.п. интервалы по отношению к РНК / ДНК выключатель ColE1 начала репликации. Области между 1600 и 2400 не представлен, поскольку β-лактамаз не является нейтральным цели. Пункты за пределами β-лактамазы представляют 200 б.п. интервалы с учетом общей низкой частоты мутаций в этой области. Тренд (биномиального уравнения с R 2 = 0,41) показан в виде линии.

Дополнительное рисунке 1. LF Pol I-содержащих Pol I плазмиды. Последовательность (FASTA формате). Информация о последовательности для определения соответствующего фермента ограничения (ы) для использования при линеаризации Pol I плазмиды либо для итерации (генерация случайного шага библиотеки мутации 4) или считывания (шаг 5). B Общие характеристики и ограничения карта плазмиды. Расположение pSC101 начала репликации, хлорамфеникол маркером устойчивости (КПП) и LF-Pol I гена представлены. Расположения одного сайты рестрикции указывается также.
| Библиотека | Прямое покрытие | Жидкость (1 день) | Жидкость (3 дня) | |
| Мутации (#) | 95 | 40 | 142 | |
| Клоны последовательно | 288 | 96 | 190 | |
| Всего покрытия (б.п.) | 182000 | 102000 | 213000 | |
| Мутация частота (x10 3 б.п.) | 0,52 | 0,39 | 0,67 | |
| Freq г <1000 (x10 3 б.п.) | 0,92 | 0,41 | 0,70 |
Таблица 1. Мутация частот Частоты (в виде # мутаций / б.п.) для й <1000, то есть в 1000 б.п., прилегающих к РНК / ДНК выключатель, в течение трех мутагенеза протоколов. Прямого покрытия, жидком насыщения (1 день), и жидкие hypersaturation ( 3 дня).
| Прямое покрытие | Жидкость | ||
| Мутации (#) | 95 | 182 | |
| Спектр (%) | |||
| К G | К G | 6,3 | 19,2 |
| Т-С | 4,2 | 3,8 | |
| С до Т | G к | 27,4 | 13,7 |
| С до Т | 35,8 | 35,2 | |
| Т | Т | 5,3 | 8,2 |
| Т к | 5,3 | 7,1 | |
| T в G | T в G | 1,1 | 1,1 |
| А до С | 0,0 | 2,2 | |
| G Т | G Т | 1,1 | 2,7 |
| С до | 2,1 | 2,7 | |
| С до G | С до G | 2,1 | 1,1 |
| G на С | 5,3 | 2,7 | |
| Indels | Ins | 3,2 | 0,0 |
| Дель | 1,1 | 0,0 | |
| К N | 11,6 | 29,7 | |
| G на N | 33,7 | 19,2 | |
| Т к N | 10,5 | 12,1 | |
| С до N | 40,0 | 39,0 | |
| Ц. | 73,7 | 72,0 | |
| Телевизор | 22,1 | 28,0 | |
| Indels | 4,2 | 0 |
Таблица 2. Метрики мутации для прямого покрытия и жидких мутагенеза. Таблице представлены число наблюдаемых мутаций (в номер) и мутации спектра (в%) после одного цикла мутагенеза. Спектр разбивается на комплементарных пар, по нуклеотидных изменений, а также тип мутации.
Обсуждение
В этой статье представлены мутагенеза протокол, который позволяет генерировать большие случайные мутант библиотек без необходимости для клонирования или ПЦР. Этот метод основан на подверженных ошибкам репликации плазмиды, кодирующей последовательности интерес. В теории, мутации должны быть в значительной степени ограничена 100-300 б.п. расположен непосредственно за РНК / ДНК переключателя, размер лидер прядь промежуточных производства Pol I 2,10. Мы обнаружили, что в условиях, представленные в этом протоколе, Pol I мутации происходят по всей плазмиды, хотя уменьшение частоты по мере удаления от плазмиды увеличивает ориентацию (рис. 3). Это открытие означает, что переход или "переключение" с Pol I к Pol III во время репликации плазмиды ColE1 гораздо более постепенным, чем сообщалось ранее, по крайней мере в условиях нашего эксперимента 2, и согласуется с ранее исследованиям, функциональной избыточности между Pol I и Пол III 11.
Наш первоначальный протокол, описанный мутагенеза в жидких культурах (4). Этот протокол дает 0,41 мутации / KB для й <1000, то есть в 1000 б.п., прилегающих к РНК / ДНК переключатель (табл. 1). Hypersaturation, оставив жидкость культуры в шейкере в течение 3 дней, без добавления каких-либо свежих СМИ повышает частоту мутаций до 0,70 мутации / кб, но приводит к очень плохим плазмиды доходность (менее 1% по сравнению с 1-й день; данные не приведены) ( Таблица 1). Здесь мы приводим упрощенный протокол, основанный на покрытие непосредственно преобразования целевой плазмиды на твердом агаре при температуре 37 ° С (рис. 1). Эта процедура производит крупнейших частота мутаций / цикл мутагенеза (0,92 мутации / KB для й <1000) и значительно облегчает итерации. Изменение условий культивирования на твердых средах также влияет на мутации спектра (табл. 2). Прямая мутагенеза покрытие уменьшает резкая асимметрия между комплементарным основанием пару замен видел в культуральной жидкости (сравните C → T по сравнению с G → и → G по сравнению с T → C). С другой стороны, прямое покрытие произведено более indels (от менее чем 0,5% до 4%) и снижение числа мутаций → G на 3 раза, что привело к чрезмерной долей G / C мутации (74%). В целом, мы считаем, что большей простотой и повышение эффективности прямой протокол покрытия, представленные здесь перевешивает выгоды от несколько более сбалансированный спектр мутаций производства жидкого мутагенеза.
В рамках целевой плазмиды, мутации порожденных наш метод не ограничены желаемой последовательности-мишени. Однако, развитие новых биохимических деятельности должно зависеть от мутаций в ген-мишень, так как она представляет качественный, а не количественные изменения. Таким образом, объединяя наши плазмиды мутагенеза с скрининг мутантов на градиент пластин капитализирует на сильные стороны нашей системы (крупные библиотеки и наличие выбора) для эволюции новых биохимических свойств. Другие приложения случайного мутагенеза таких как оптимизация существующих ферментативной деятельности или случайной конкретных областях гена требуют клонирования следующие случайные мутагенеза. В этом случае, имея библиотеку в плазмиды, в отличие от продуктов ПЦР-амплификации повышает эффективность клонирования путем содействия усиления и ограничения.
В общем, мы демонстрируем простой протокол для создания случайных мутантов библиотека для данной целевой ген, который выделяется своей простотой и для разнообразия библиотеки генерируется. Мы покажем, как этот метод может использоваться в сочетании с функциональной выбор для эффективного развития новых биохимических деятельности. Кроме того, наши в естественных условиях генерируемых библиотеки могут быть легко клонирована, позволяя сайт-специфического мутагенеза или оптимизации существующих видов деятельности.
Раскрытие информации
Благодарности
Эта работа была поддержана K08 награду CA116429-04 к МС и грантом властвуй Рак Теперь (КОНЦЕРН) учредительные # 8501
Материалы
| Name | Company | Catalog Number | Comments |
| carbenicillin | Cellgro | 46100R6 | 0.1mg/ml final |
| tetracycline | Fisher Scientific | BP7640 | 0.05mg/ml final |
| chloramphenicol | Genlantis | M120100 | 0.03mg/ml final |
| LB Agar Miller | Fisher Scientific | BP1425 | |
| LB Broth Miller | Difco Laboratories | 244620 | |
| Soft Agar | Difco Laboratories | 214580 | Made in house |
| Acridine Orange | Sigma-Aldrich | A38401-1 | |
| Antifoam B emulsion | Sigma-Aldrich | A5757 | |
| Glycerol | Acros Organics | 332030025 | |
| 100x100x15mm sq dish | Fisher Scientific | 0875711A | |
| 100mm rnd dish | Fisher Scientific | 0875712A | |
| Microscope slide 25x75x1mm | Gold Seal | 3048 | |
| Electroporator 2510 | Eppendorf | ||
| Electroporator 2510 | Eppendorf | ||
| 2mm gap tubes | Molecular BioProducts | 5520 | |
| Zippy mini prep kit | Zymo Research Corp. | D4020 |
Ссылки
- Camps, M. Modulation of ColE1-like plasmid replication for recombinant gene expression. Recent Pat DNA Gene Seq. 4, 58-73 (2010).
- Itoh, T., Tomizawa, J. Initiation of replication of plasmid ColE1 DNA by RNA polymerase, ribonuclease H, and DNA polymerase I. Cold Spring Harb Symp Quant Biol. 43 Pt 1, 409-417 (1979).
- Polisky, B. ColE1 replication control circuitry: sense from antisense. Cell. 55, 929-932 (1988).
- Camps, M., Naukkarinen, J., Johnson, B. P., Loeb, L. A. Targeted gene evolution in Escherichia coli using a highly error-prone DNA polymerase I. Proc Natl Acad Sci U S A. 100, 9727-9732 (2003).
- Shinkai, A., Loeb, L. A. In vivo mutagenesis by Escherichia coli DNA polymerase I. Ile(709) in motif A functions in base selection. J Biol Chem. 276, 46759-46764 (2001).
- Uyemura, D., Lehman, I. R. Biochemical characterization of mutant forms of DNA polymerase I from Escherichia coli. I. The polA12 mutation. J Biol Chem. 251, 4078-4084 (1976).
- Sedgwick, B., Robins, P., Lindahl, T. Direct removal of alkylation damage from DNA by AlkB and related DNA dioxygenases. Methods Enzymol. 408, 108-120 (2006).
- Aharoni, A., Gaidukov, L., Khersonsky, O., Mc, Q. G. S., Roodveldt, C., Tawfik, D. S. The 'evolvability' of promiscuous protein functions. Nat Genet. 37, 73-76 (2005).
- Elena, S. F., Lenski, R. E. Evolution experiments with microorganisms: the dynamics and genetic bases of adaptation. Nat Rev Genet. 4, 457-469 (2003).
- Itoh, T., Tomizawa, J. FoFormation of an RNA primer for initiation of replication of ColE1 DNA by ribonuclease H. Proc Natl Acad Sci U S A. 77, 2450-2454 (1980).
- Bryan, S. K., Moses, R. E. Sufficiency of the Klenow fragment for survival of polC(Ts) pcbA1 Escherichia coli at 43 degrees. C. J Bacteriol. 170, 456-458 (1988).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены