このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
クリーンルーム環境と細胞療法のための微生物制御およびモニタリング戦略
要約
このプロトコルは、クリーンルーム環境で微生物のバイオバーデンを最小限に抑えるためのベストプラクティスを要約し、環境モニタリング、プロセスモニタリング、製品無菌試験などの戦略が含まれています。これは、現在の適正組織慣行基準および現在の適正製造基準を満たす必要がある製造および試験施設に関連しています。
要約
堅牢なガウン、クリーニング、環境モニタリング、および人員モニタリング対策を組み込んだ十分に検証された全体的なプログラムは、細胞療法製造スイートおよび対応する試験所の微生物バイオバーデンを最小限に抑えて、施設が管理状態で稼働していることを確認するために重要です。無菌試験などの品質管理手段 による 製品の安全性の確保は、最小限の操作(セクション361)と最小限の操作(セクション351)の両方のヒト細胞、組織、および細胞および組織ベースの製品(HCT / Ps)の規制要件です。このビデオでは、米国薬局方(USP<71>)および国立衛生研究所(NIH)の代替無菌試験方法が提供する、ガウン、洗浄、材料のステージング、環境モニタリング、プロセスモニタリング、直接接種を使用した製品無菌試験など、クリーンルーム環境で操作するための最良の無菌プラクティスを開発および組み込む方法についての段階的なガイドを提供します。このプロトコルは、現在の適正組織基準(cGTP)および現在の適正製造基準(cGMP)を満たすことが期待される施設向けのリファレンスガイドとして意図されています。
概要
環境モニタリング(EM)、プロセスモニタリング、および製品無菌試験を通じて強力な微生物モニタリングプログラムを実施することは、細胞療法ラボにおける現在の適正組織慣行(cGTP)および現在の適正製造基準(cGMP)の規制要件です1。さらに、米国食品医薬品局(FDA)は、製品の品質管理(QC)テストを実施する研究所も、無菌充填作業に使用されるものに匹敵する施設と管理を採用する必要があることを期待しています2。
このプロトコルには4つの主要なセクションがあります:1)人員のガウン、クリーニング、および材料のステージングを含む無菌慣行。2)生存可能な空気および表面培養および非生存粒子空気モニタリングを含むEM。3)セトリングプレートや手袋をはめた指先のサンプリングを含むプロセスモニタリング。4)公定書米国薬局方(USP)<71>方法3またはNIH代替無菌試験方法4による製品無菌試験。これらの対策を一緒に使用すると、施設を管理状態に保つための効果的な方法になります。
ここで説明する手法は目新しいものではありません。しかし、規制当局や専門機関からの現在の基準には詳細が欠けているため、特に現場での製造と製品の無菌性試験が急速に出現している学術センターでは、微生物モニタリングや標準化されていない慣行の実施が行われていません1,5,6。.このプロトコルは、エンドユーザーの検証およびリスク評価と組み合わせて使用 すると、規制要件を満たす微生物モニタリングおよび制御プログラムを作成するためのガイドとして使用できます。
プロトコル
1.無菌の慣行
- クリーンルームスペースの人員ガウン
注:この手順は、未分類のスペースでの最初のガウン、その後の国際標準化機構(ISO)8エリア、次にISO7エリアへの入場に基づいています。この手順は、既存のスペースをクリーンルーム機能に変換しようとするラボに関連しています。理想的には、すべての初期ガウンはISO8分類スペースで行われます(未分類スペースではありません)。- ゆるい髪を固定します。手を洗い、スクラブに着替えます(長袖のスクラブトップとフルレングスのスクラブパンツが望ましい)。靴カバーをかぶったクリーンルームの靴に集まって着替えます。
- アルコールベースの手指消毒剤を使用して手を消毒し、次に次の各ステップの間にもう一度消毒します:非滅菌手袋を着用し、該当する場合はあごひげカバー(目に見える顔の毛の量)を着用します。非滅菌のブーファンを着用し、長袖のスクラブトップが使用されていない場合は、前腕を非滅菌スリーブで覆います。
- 靴カバーを外した後、ISO8控室のドアの前にある粘着性のあるマットに足を踏み入れて、靴カバーを取り外します。入る前に、足全体が粘着性のあるマットに接触していることを確認してください。靴カバーを廃棄し、手袋とドアハンドルを70%滅菌イソプロピルアルコール(sIPA)で除染します。ISO8控室に入ります。
- 滅菌フード、滅菌フェイスマスク、滅菌つなぎ服、滅菌ブーツカバー、および安全メガネを収集します。70%のsIPAで手袋を除染します。安全メガネを着用し、手順1.5に従って、材料をきれいな表面にステージングします。
- 専用のクリーンルームシューズの上に新しい非滅菌シューズカバーを着用し、セカンダリ控室の前の粘着性のあるマットに足を踏み入れます。各足全体が粘着性のあるマットに接触していることを確認してください。70%のsIPAで手袋を除染します。段階的なガウン用品を集め、境界線の汚れた側に残っている二次ISO7控室に入ります。
- 滅菌フードと滅菌カバーオールを着用し、ガウン素材の内側にのみ触れ、フードの首がカバーオールの内側に押し込まれて完全なシールを作成します。二次滅菌ブーツカバーを着用します。各着用ステップの間に70%のsIPAで手袋を除染します。
- ガウンが適切に着用されていることを確認し、70%sIPAで手袋を除染し、ISO7スペースに入ります。
注意: ガウン素材の完全性を定期的に検査してください。危険にさらされた場合は、すぐにクリーンルームを出て、ガウンを着直してください。
- 生物学的安全キャビネット(BSC)の着用
- 上記のステップ1.1に従って、これらの追加のプラクティスを備えたガウン。
- 滅菌手袋と滅菌スリーブを集めます。ステップ1.4に従ってBSCをクリーニングし、ステップ1.5に従って材料をステージングします。70%のsIPAで手袋を除染します。
- つなぎ服の上に滅菌スリーブを無菌的に着用し、存在する場合は親指ループを使用します。.既存の手袋の上に滅菌手袋を着用し、手袋の袖口が滅菌スリーブの上に伸びていることを確認します。各ステップの間に70%のsIPAで手袋を除染します。BSC を入力します。
注意: ガウン素材の完全性を定期的に検査してください。危険にさらされた場合は、すぐにクリーンルームを出て、ガウンを着直してください。
- ガウン材のドッフィング
- BSCを出て、上部の手袋と滅菌スリーブを慎重に取り外します。インナーグローブを70%sIPAで除染します。
- セカンダリ、次にプライマリ控室に入り、各ステップの間にドアが完全に閉じるのを待ちます。次の順序で材料を取り除きます:外側の滅菌ブーツカバー、つなぎ服、フード、フェイスマスク。
- 一次控室を出て、非滅菌ガウンを取り外します。
注: 未分類のスペースでの削除の順序は重要ではありません。ただし、内側の非滅菌靴カバーは、分類されていないスペースに保管するためにクリーンルームの靴に残しておく必要があります。 - アルコールベースの手指消毒剤を使用して手を消毒し、ストリートウェアに戻します。
- クリーンルームの表面とBSCのクリーニング
- ハンドヘルドクリーニングモップを組み立てるか、清潔な糸くずの少ないワイプを入手してください。糸くずの少ないワイプを使用する場合は、ワイプを四分の一に折り、各表面間で回転させます。モップヘッドまたは糸くずの少ないワイプを承認された消毒剤で飽和させます。
- HEPAディフューザーグリル(BSCの上部)、BSCの後壁、BSCの両側壁、サッシ、および作業面の順序で、重なり合うワイプを使用してBSCを清掃します。最後に、70%sIPAを使用してBSCのサッシを拭き、残留消毒剤を取り除きます。一般的なBSCクリーニングパターンについては、 図1 を参照してください。
- 機密環境への材料と機器のステージング
- 微生物の移動を最小限に抑えるために、非分類または下位分類領域から高分類領域(ISO8からISO7空間など)への移動を必要とするすべての材料を除染(すなわち、段階)します。同じISO分類レベルの領域間での品目の転送には、ステージングは必要ありません。
注意: 材料が最終滅菌され、複数のバッグに入っている場合は、外袋/ポーチを取り外し、材料を分類されたスペースに移動します。内部のバッグ/ポーチの拭き取りは必要ありません。 - 糸くずの少ないワイプを入手し、ワイプが汚れたときにワイプを四分の一に折りたたんできれいな側に回転させます。70%sIPAまたは承認された消毒剤でワイプを飽和させます。
- 重なり合うワイプを使用して、材料/機器の外側を拭きます。引き離されたパッケージシールの内側や、機器やその他の不規則な形状の消耗品の隅/くぼみなど、アイテムのすべての領域が拭かれていることを確認してください。車輪付きの機器の場合は、ステージングプロセス中にホイール全体が拭かれていることを確認してください(ホイールを回転させるために機器をそっと傾ける必要がある場合があります)。
- 微生物の移動を最小限に抑えるために、非分類または下位分類領域から高分類領域(ISO8からISO7空間など)への移動を必要とするすべての材料を除染(すなわち、段階)します。同じISO分類レベルの領域間での品目の転送には、ステージングは必要ありません。

図1:BSCクリーニングパターンの例。 HEPAディフューザーグリル(BSCの上部)、BSCの後壁、BSCの両側壁、サッシ、および作業面の順序で、重なり合うワイプを使用してBSCを清掃します。最後に、70%sIPAを使用してBSCのサッシを拭き、残留消毒剤を取り除きます。 この図の拡大版を表示するには、ここをクリックしてください。
2. 環境モニタリング(EM)
- 実行可能な表面サンプリング
- ステップ1.5に従ってサンプリングセッションに必要な材料をステージングし、セクション1に従って分類されたスペースにガウンを着ます。
注意: 表面サンプリングは、指定された場所での空気サンプリングの前に実行する必要があります。複数のプレートを使用して領域を表面サンプリングする場合は、まったく同じ場所をサンプリングしないでください。接触プレートを使用して平らな表面をサンプリングするのは、完全に接触し、寒天への潜在的な損傷を避けるためにのみ使用してください。 - サンプリングサイトごとに、レシチナーゼとトゥイーン(TSALT)プレートを含むトリプシン大豆寒天培地1つと、レシチナーゼとトゥイーン(SABLT)プレートを含むサブローデキストロース寒天培地1つを収集してラベル付けします。片手でプレートの底を持ち、隆起した寒天表面に触れないように注意しながら、蓋を無菌的に取り外します。
- 隆起した寒天をサンプリングする表面に接触させ、表面全体が接触していることを確認して、プレートにしっかりと圧力をかけます。プレートを少なくとも5秒間表面に接触させたままにします。
- クリティカル:プレートをサンプリングする表面上で横方向に動かさないでください。これは、潜在的な成長を表面積に広げ、個々のコロニーの分離を困難にする可能性があるためです。サンプリング中は、寒天表面にひびが入る可能性があるため、コンタクトプレートに無理な力を加えないでください。
- 隆起した寒天表面に触れないように注意しながら、カバーを無菌的に交換します。コンタクトプレートにロックシステムがある場合は、カバーを所定の位置にロックします。サンプリングエリアを70%sIPAで洗浄し、表面から残留媒体を取り除きます。プレートをゆるく袋に入れ、 表1に記載のように培養物をインキュベートする。TSALT表面サンプリングプレート上での2つの異なるコロニー形態を有する3つのコロニー形成単位(CFU)の成長を示す代表的な画像を 図2に示す。 図3は、サンプル収集中の無菌技術が不十分であることに起因する、プレートの端での成長を伴うTSALTプレートの汚染を示しています。
- ステップ1.5に従ってサンプリングセッションに必要な材料をステージングし、セクション1に従って分類されたスペースにガウンを着ます。
- 実行可能な空気サンプリング
- ステップ1.5に従ってサンプリングセッションに必要な材料をステージングし、セクション1に従って分類されたスペースにガウンを着ます。
- サンプリングサイトごとに、トリプシン大豆寒天(TSA)プレート1枚とサブローデキストロース寒天培地(SAB)プレート1枚を収集してラベルを付けます。ヘッドの汚染を避けるために、外側の端のみをつかんでサンプリングヘッドを無菌的に取り外して、エアサンプラーを準備します。
- サンプリングヘッドを片手で持ち、培地をサンプラーのプレートホルダーに無菌的に置きます。他のプロングよりも長いプロングがある場合は、最初に長いプロングにメディアを挿入し、次にプレートを残りのプロングに押し下げてプレートを固定します。
- プレートの蓋を無菌的に取り外し、サンプリングが完了するまで邪魔にならないようにきれいにした面に置きます。サンプリングヘッドを無菌的に交換して固定し、ヘッドの汚染を防ぐために外側の端のみをつかみます。マルチヘッドエアサンプラーを使用している場合は、残りの媒体に対して手順2.2.2〜2.2.4を繰り返します。
- サンプリングヘッドが気流の動きの主な方向を向くように、エアサンプラーをサンプリング位置に配置します。実行不可能なエアサンプラーからの排気(同時にサンプリングする場合)が実行可能なサンプラーに干渉しないことを確認してください。エアサンプラーが検証済みの設定に設定されていることを確認し、サンプリングサイクルを開始します。
- サンプリングサイクルが完了したら、ヘッドの汚染を避けるために、外側の端のみをつかんで、サンプリングヘッドをサンプラーから無菌的に取り外します。サンプリングヘッドを片手で持ち、寒天プレートの蓋を無菌的に交換します。プレートホルダーからプレートを取り外します。プレートをゆるく袋に入れ、 表1に記載のように培養物をインキュベートする。
- サンプリングヘッドとプレートホルダーの周囲を70%sIPAで消毒します。サンプリングヘッドを無菌的に固定し、外側の端のみをつかみます。マルチヘッドエアサンプラーを使用している場合は、残りの媒体に対して手順2.2.6と手順2.2.7を繰り返します。
注: 図4は、汚染されたサンプリングヘッドによって引き起こされる成長を伴うTSAアクティブエアサンプリング培養を示しています。逆に、 図5は、成長のないTSAアクティブエアサンプリング培養を表しています。サンプリングヘッドからの空気衝撃のくぼみが画像に見られます。
- 実行不可能なサンプリング
- 各使用日のサンプリング活動の前に、レーザー粒子カウンターでゼロチェックを実行します。等速性ヘッドをパーティクルカウンターのサンプリングポートに直接取り付けるか、サンプリング場所の必要に応じてチューブの長さに貼り付けます。
- チューブを適用する場合は、長さ>1 mのチューブは≥1 μmの粒子の列挙に問題を引き起こし、チューブ内で不必要な曲がりを引き起こす可能性があるため、短い長さを使用してください。パーティクル カウンターが検証済みの設定に設定されていることを確認します。サンプリング中の気流の乱れを避けるために、サンプリングエリアから出られるように、約30秒の遅延を設定することをお勧めします。
- レーザーパーティクルカウンターのアイソキネティックヘッドをサンプリング位置に配置し、アイソキネティックヘッドを気流の動きの主な方向に向けて配置します。実行可能なエアサンプラーからの排気(同時にサンプリングする場合)が実行不可能なサンプラーに干渉しないことを確認してください。気流が一方向ではない、または気流パターンが不明な領域では、等速性ヘッドが垂直に上を向いていることを確認してください。
注意: 回転消毒剤または70%sIPAがエアサンプラーの近くでエアロゾル化されている場合は、サンプリングサイクルを開始する前に少なくとも5分待ってください。 - サンプリングサイクルを開始し、空気の流れが妨げられないように、サンプリングエリアをゆっくりと出ます。
重要:サンプリングサイクル中にエアサンプラーの近くで液体をエアロゾル化しないでください。 - サンプリングが完了したら、レーザーパーティクルカウンターを取得します。0.5 μmの平均粒子数を記録します。一部の施設では、5.0μmを追跡して傾向を示す場合もあります。
- 次のサンプリング場所に対して手順 2.3.3-2.3.6 を繰り返します。部屋またはBSC間を移動する場合は、生存不可能な粒子サンプラーの外側を70%sIPAまたは承認された消毒剤で拭いてください。等速性ヘッド内に消毒剤が入ると、粒子数が不正確になる可能性があるため、避けてください。
| カテゴリ | メディア | 培養条件 | 培養観察 | 業績 | ||||||
| 環境モニタリング | TSA (生存可能な空気) | 30°C-35°C、空気、少なくとも3日間 | インキュベーション終了 | 各施設のQAグループは、サンプリングタイプと場所ごとにアラートとアクションの制限を設定する必要があります。ISO分類に基づく生菌サンプルのアクション制限は、PIC/S 009-16(附属書)18およびISO-14644-1 7を使用してガイドできます。 生存不可能な空気サンプルのアクション制限は、通常、ISO制限のパーセンテージ(99%など)に設定されます。実行可能なサンプルのアラート制限は、通常、アクション制限またはISO制限のパーセンテージ(95%など)に設定されます。アラートおよびアクションレベルの確立と選択した培養条件の検証の詳細については、PDA TR-13およびUSP<1116>を参照してください8、9。 | ||||||
| SAB (生存可能な空気) | 20 °C-25 °C, 空気, 少なくとも 7 日間 | |||||||||
| TSALT(生存可能な表面) | 30°C-35°C、空気、少なくとも3日間 | EMプレートの代表的な画像を図 2、図 3、図 4、 および図5に示します。 | ||||||||
| SABLT(生存可能な表面) | 20 °C-25 °C, 空気, 少なくとも 7 日間 | |||||||||
| プロセス監視 | TSA (セトリングプレート) | 30°C-35°C、空気、少なくとも3日間 | 情報提供のみを目的としています。失敗した製品無菌性テストに応じてOOS調査が発生した場合に役立つ情報を提供します。 | |||||||
| SAB (セトリングプレート) | 20 °C-25 °C, 空気, 少なくとも 7 日間 | 正の沈降プレートの例については、 図6 を参照してください。 | ||||||||
| 手袋をはめた指先のサンプリング | ティッカー | 30°C-35°C、空気、少なくとも48時間、続いて20°C-25°Cで少なくとも5日間 19。 | GFSの許容基準は、PIC/S 009-16(附属書) 18に従って<1 CFU /プレート(すなわち、成長なし)です。受け入れ基準は、施設QAの裁量で変更される場合があります。 | |||||||
| 製品無菌試験 | TSB (USP<71>) | 20 °C-25 °C, 空気, 少なくとも 14 日間 | 潜伏期間を通して定期的に(3、5、7、および14日目) | 成長はありません。 | ||||||
| FTM (USP<71>) | 30 °C-35 °C, 空気, 少なくとも 14 日間 | |||||||||
| iFA+(NIHメソッド) | 30 °C-35 °C, 空気, 少なくとも 14 日間 | BacT/ALERTデュアルT機器による自動モニタリング。モールドボールのインキュベーション終了時に各ボトルを目視で確認することを強くお勧めします。 | BacT/ALERTによって自動的に検出されなかった目に見えるモールドボールの例については、 図8 を参照してください。 | |||||||
| iFN+ (NIHメソッド) | ||||||||||
| SAB (NIHメソッド) | 20°C-25°Cで少なくとも14日間 | 潜伏期間を通して定期的に(3、5、7、および14日目) | ||||||||
表1:推奨される培養条件と期待される結果の概要。 ここで説明する培養条件は、NIHで使用されている検証済みプログラムに基づく推奨事項です。各エンドユーザーは、独自の微生物検査プログラムを検証する必要があります。微生物管理および試験戦略は、施設の設計、施設の植物相、製品リスク分類などの変数に応じて、機関間で異なる場合があります。
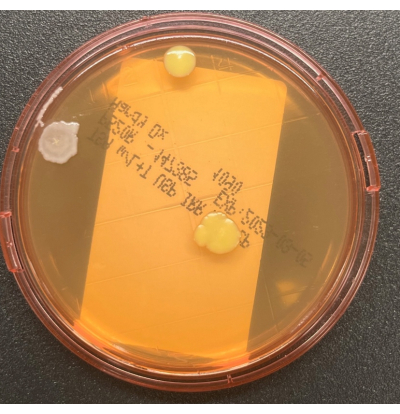
図2:TSALTプレート上での成長。 2つの異なるコロニー形態の3つのCFUを示すTSALT表面サンプリングプレート。 この図の拡大版を表示するには、ここをクリックしてください。
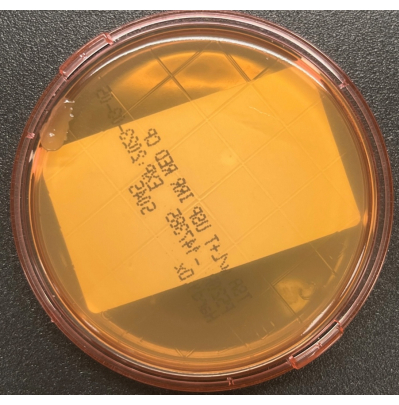
図3:収集中のTSALTプレートの汚染。 プレートの端に単一のコロニーを示すTSALT表面培養は、サンプリングプロセス中の無菌処理が不十分であることを示す。 この図の拡大版を表示するには、ここをクリックしてください。

図4:汚染空気サンプリングヘッドを用いて得られた培養物。 混合形態の>100コロニー形成単位(CFU)を示すTSAアクティブエアサンプリング培養の例。成長のパターンは、サンプリングヘッドの汚染を示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図5:TSAアクティブ実行可能エアプレート上に成長なし。 TSA活性生存エアプレートは、インキュベーション後に成長しないことを示す。アクティブエアサンプラーヘッドからのくぼみが画像に見られます。 この図の拡大版を表示するには、ここをクリックしてください。
3.プロセス監視
- セトリングプレート(パッシブエアモニタリング)
- ラベルの付いたTSAおよびSABプレートを作業エリアの近くに置きますが、テストを妨げないエリアに配置します。サンプリング開始時間を記録し、両方のプレートを無菌的に開き、作業領域から離れたBSCのきれいな表面に蓋を置きます。
- 沈降プレートは、寒天が乾燥するのを防ぐために、最大4時間開いてもよい。処理の最後にプレートの蓋を閉めます。プレートをゆるく袋に入れ、 表1に記載のように培養物をインキュベートする。 図6は、TSA空気沈降プレート上の単一コロニー汚染物質を示しています。
- 手袋をはめた指先サンプリング(GFS)
- 2つの標識TSALTプレートを入手します。1枚のプレートの蓋を無菌的に取り外し、サンプリングエリアから離れた清潔な作業面に置きます。
- 片方の手の各指と親指のパッドをプレートの表面にそっと転がします(図7)。先端ではなく、各指/親指の最大表面積をサンプリングします。寒天表面にひびが入ることなく寒天にわずかなくぼみを作るのに十分な力を使用してください。
- 蓋を無菌的にプレートに戻し、もう一方の手で手順3.2.2を繰り返します。サンプリングの完了時に70%のsIPAで手を消毒します。プレートをゆるく袋に入れ、 表1に記載のように培養物をインキュベートする。
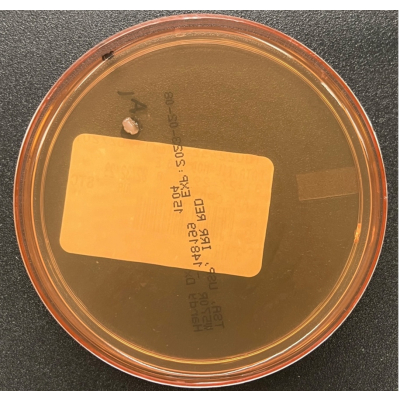
図6:TSAエアセトリングプレートの成長。 BSCでのパッシブエアプロセスモニタリング中に培養された汚染物質の単一コロニーを示すTSA空気沈降プレート。 この図の拡大版を表示するには、ここをクリックしてください。

図7:手袋をはめた指先のサンプリング。 各指/親指の最大表面積(またはパッド)を使用して手袋をはめた指先サンプルを取得する正しい方法を左側に示します。指先のみをサンプリングする誤った処理を右側に示します。 この図の拡大版を表示するには、ここをクリックしてください。
4. 製品直接接種による無菌試験
- USP<71後の直接接種>
- 提出された試験品ごとに1つのラベル付きトリプシン大豆ブロス(TSB)ボトルと1つのラベル付き液体チオグリコレート培地(FTM)ボトルを入手します。テストセッションでは、実行可能な表面サンプリング用に1つのTSALTプレートと1つのSABLT、セトリングプレート用に1つのTSAプレートと1つのSABプレート、GFS用に2つのTSALTプレートを入手します。
- ステップ1.2に従ってBSC内で作業するためのガウン。手順 1.4 に従って BSC をクリーニングします。ステップ 1.5 に従って、材料を BSC にステージングします。ステップ2.1に従って重要な作業領域の接触サンプリングを実行し、サンプリング後に70%sIPAで表面を拭きます。ステップ3.1に従って、作業エリアの近くにTSAおよびSABセトリングプレートを準備します。
- テスト記事と関連するTSBおよびFTMボトルを入手します。TSBボトルとFTMボトルにセプタムがある場合は、各ボトルから保護キャップを取り外し、滅菌アルコールワイプでセプタムを拭きます。TSBボトルとFTMボトルの上部にネジがある場合は、ボトルからキャップを緩めます(ただし、キャップは取り外さないでください)。
- 試験品をボルテックスして、均質な懸濁液を確保します。滅菌注射器と皮下注射針(セプタムキャップの場合)またはピペッター(スクリューキャップの場合)を使用して、検証された量の試験品(最大10 mL /ボトル)をボトルに接種します。
- 接種後、滅菌アルコールワイプでセプタムを拭き、滅菌ベントユニットを挿入して、インキュベーション中の空気交換を可能にします。スクリュートップボトルの場合は、ボトルを閉じますが、インキュベーション中の空気交換を可能にするために、キャップを1/4〜1/2回転緩めたままにします。そのセッション内でテストするテスト記事ごとに、手順 4.1.3-4.1.5 を繰り返します。
- TSAおよびSABセトリングプレートを無菌的に閉じ、サンプリング終了時間を文書化します。ステップ3.2に従ってGFSを実行し、サンプリング後に70%sIPAで手袋を拭きます。プレートをゆるく袋に入れ、 表1に記載のように培養物をインキュベートする。
- すべての試験材料をBSCから移し、ステップ1.4に従ってBSCを清掃します。
- NIH代替無菌試験法に従った直接接種
- 各試験品について、1つの標識i FA+、1つの標識iFN+、および1つのSABプレートを入手します。テストセッションでは、実行可能な表面サンプリング用に1つのTSALTプレートと1つのSABLT、セトリングプレート用に1つのTSAプレートと1つのSABプレート、GFS用に2つのTSALTプレートを入手します。
- ステップ1.2に従ってBSC内で作業するためのガウン。手順 1.4 に従って BSC をクリーニングします。ステップ 1.5 に従って、材料を BSC にステージングします。ステップ2.1に従って重要な作業領域の接触サンプリングを実行し、サンプリング後に70%sIPAで表面を拭きます。ステップ3.1に従って、作業エリアの近くにTSAおよびSABセトリングプレートを準備します。
- テスト品と関連するiFA+、iFN+、およびSABプレートを入手します。i FA +およびiFN +ボトルから保護キャップを取り外し、滅菌アルコールワイプでセプタムを拭きます。
- 試験品をボルテックスして、均質な懸濁液を確保します。滅菌注射器と皮下注射針を使用して、検証された量の試験品(最大10 mL /ボトル)をボトルに接種します。接種後、滅菌アルコールワイプでセプタムを拭いてください。 表1の説明に従って、BacT/ALERTデュアルT装置でボトルをインキュベートします。
- ピペッターを使用して、検証された量の試験品(500 μL/プレート以下)をSABプレートに接種し、滅菌ループを使用して単離のためにストリークします。インキュベーションのために反転したときにサンプルがプレートの蓋に流れ込まないように、10分間放置します。試験品を接種した各SABプレートをビニール袋に入れ、ゆるく結び、 表1に記載のようにインキュベートする。
- TSAおよびSABセトリングプレートを無菌的に閉じ、サンプリング終了時間を文書化します。ステップ3.2の説明に従ってGFSを実行し、サンプリング後に70%sIPAで手袋を拭きます。プレートをゆるく袋に入れ、 表1に記載のように培養物をインキュベートする。インキュベーション期間終了時のBacT/ALERTボトルの目視検査は、装置によって検出されなかった可能性のあるモールドボールを検出するために不可欠です(図8)。
- すべての試験材料をBSCから移し、ステップ1.4に従ってBSCを清掃します。
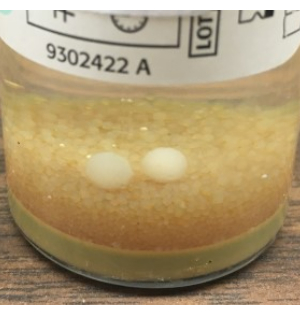
図8:BacT/ALERTで検出できなかったカビの成長。肉眼で見えるモールドボールの例で、BacT/ALERTシステムによる自動検出に失敗したもの。これらの調査結果に基づいて、すべてのBacT/ALERTボトルの最終目視検査と、NIH代替無菌試験法を使用した真菌培養用のSABプレートの追加をお勧めします。 この図の拡大版を表示するには、ここをクリックしてください。
結果
期待される結果を 表1に示します。EMデータを確認し、適切な調査を行い、アクション、アラート、またはISO制限の逸脱に対応する必要があります。生存不可能な粒子の逸脱が発生した場合は、ISO 14644-Annex A、sec A.5.57に従って進める必要があります。エクスカーションがすぐに識別可能な異常発生に起因する可能性がある場合は、元のサンプリング結果を文書化?...
ディスカッション
このプロトコルには、クリーンルームやBSC内の無菌技術や一方向の気流の維持など、いくつかの重要な領域があります。 ベストプラクティスには、乱気流を最小限に抑えるためにゆっくりと慎重に移動することが含まれます。無菌操作は、上からではなく、製品の側面から実行する必要があります。クローズドシステム処理と最終滅菌原料の使用が推奨されます。重要な場所で話したり、壁...
開示事項
著者は利益相反を宣言しません。
謝辞
この研究は、国立衛生研究所臨床センターの学内研究プログラムによってサポートされました。内容は著者の責任であり、国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| 20-25°C Incubator | Lab preference | ||
| 30-35°C Incubator | Lab preference | ||
| Alcohol-based hand sanitizer | Lab preference | ||
| BacT/ALERT Dual-T instrument | BioMerieux Industry | ||
| Beard cover | Lab preference | ||
| Biosafety cabinet (BSC) | Lab preference | ||
| Cleanroom shoes | Lab preference | ||
| Fluidthioglycollate medium (FTM) | Hardy Diagnostics | U84 | USP |
| Handheld cleaning mop | Contec | 2665LF | |
| Hypodermic needle | Lab preference | ||
| iFA+ BacT/ALERT bottle | Biomerieux | 412990 | |
| iFN+ BacT/ALERT bottle | Biomerieux | 412991 | |
| Isokinetic head | Lab preference | ||
| Laser particle counter | TSI Incorporated | 9500-01 | |
| LpH III | Steris | 1S16CX | |
| Mirror | Lab preference | ||
| Non-sterile bouffant | Lab preference | ||
| Non-sterile gloves | Lab preference | ||
| Non-sterile shoe covers | Lab preference | ||
| Non-sterile sleeve covers | Lab preference | ||
| Parafilm | Lab preference | ||
| Peridox RTU | Contec | CR85335IR | |
| Plastic bag | Lab preference | ||
| Sabouraud Dextrose Agar with Lecithinase and Tween (SABLT) | Hardy Diagnostics | P595 | USP, irradiated |
| Sabouraurd Dextrose Agar (SAB) | Hardy Diagnostics | W565 | USP, irradiated |
| Safety glasses | Lab preference | ||
| Scrubs (top and bottom) | Lab preference | ||
| Spor-Klenx RTU | Steris | 6525M2 | |
| Sterile 70% isopropyl alcohol (IPA) | Decon CiDehol | 8316 | |
| Sterile alcohol wipe | Lab preference | ||
| Sterile boot covers | Kimberly Clark | Cat# varies based on size | |
| Sterile coveralls | Kimberly Clark | Cat# varies based on size | |
| Sterile face mask | Lab preference | ||
| Sterile gloves | Lab preference | ||
| Sterile hood | Kimberly Clark | Cat# varies based on size | |
| Sterile low-lint wipes | Texwipe | TX3210 | |
| Sterile mop cleaning pads | Contec | MEQT0002SZ | |
| Sterile sleeve covers | Kimberly Clark | 36077 | |
| Sterile spreading rod | Fisher Scientific | 14665231 | |
| Sterile syringe | Lab preference | ||
| Tacky mats | Lab preference | ||
| Tryptic Soy Agar (TSA) | Hardy Diagnostics | W570R | USP, irradiated |
| Tryptic Soy Agar with Lecithinase and Tween (TSALT) | Hardy Diagnostics | P520R | USP, irradiated |
| Tryptic Soy Broth (TSB) | Hardy Diagnostics | U46 | USP |
| Tubing | Lab preference | ||
| Vesphene III | Steris | 1S15CX | |
| Viable air sampler | Hardy Diagnostics | BAS22K | |
| Vortex | Lab preference |
参考文献
- Cundell, T., Atkins, J. W., Lau, A. F. Sterility testing for hematopoietic stem cells. Journal of Clinical Microbiology. , (2023).
- United States Food and Drug Administration. Guidance for Industry. Sterile Drug Products Produced by Aseptic Processing - Current Good Manufacturing Practice. United States Food and Drug Administration. , (2004).
- United States Pharmacopeia - National Formulary. USP<71> Sterility Tests in USP43-NF38. United States Pharmacopeia - National Formulary. , (2022).
- England, M. R., Stock, F., Gebo, J. E. T., Frank, K. M., Lau, A. F. Comprehensive evaluation of compendial USP<71>, BacT/Alert Dual-T, and Bactec FX for detection of product sterility testing contaminants. Journal of Clinical Microbiology. 57 (2), 01548 (2019).
- Gebo, J. E. T., East, A. D., Lau, A. F. A side-by-side comparison of clinical versus current good manufacturing practices (cGMP) microbiology laboratory requirements for sterility testing of cellular and gene therapy products. Clinical Microbiology Newsletter. 43 (21), 181-191 (2021).
- Gebo, J. E. T., Lau, A. F. Sterility testing for cellular therapies: What is the role of the clinical microbiology laboratory. Journal of Clinical Microbiology. 58 (7), 01492 (2020).
- International Organization for Standardization. ISO 14644-1:2015 Cleanrooms and associated controlled environments - Part 1: Classification of air cleanliness by particle concentration. International Organization for Standardization. , (2015).
- Parenteral Drug Association. PDA Technical Report No. 13 Revised 2022 (TR 13) Fundamentals of an Environmental Monitoring Program. Parenteral Drug Association, Inc. , (2022).
- United States Pharmacopeia - National Formulary. USP<1116> Microbiological Evaluation of Cleanrooms and Other Controlled Environments in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Guinet, R., et al. Multicenter study on incubation conditions for environmental monitoring and aseptic process simulation. PDA journal of pharmaceutical science and technology. 71 (1), 43-49 (2017).
- Gordon, O., Berchtold, M., Staerk, A., Roesti, D. Comparison of different incubation conditions for microbiological environmental monitoring. PDA Journal of Pharmaceutical Science and Technology. 68 (5), 394-406 (2014).
- Anders, H. J., et al. Multisite qualification of an automated incubator and colony counter for environmental and bioburden applications in pharmaceutical microbiology. PDA Journal of Pharmaceutical Science and Technology. , (2022).
- United States Pharmacopeia - National Formulary. USP<1072> Disinfectants and Antiseptics. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. USP<1071> Rapid Microbial Tests for Release of Sterile Short-Life Products: A Risk-Based Approach in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. PUSP<1223> Validation of Alternative Microbiological Methods in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Parenteral Drug Association. PDA Technical Report No. 33, Revised 2013 (TR 33) Evaluation, Validation and Implementation of Alternative and Rapid Microbiological Methods. Parenteral Drug Association, Inc. , (2013).
- Putnam, N. E., Lau, A. F. Comprehensive study identifies a sensitive, low-risk, closed-system model for detection of fungal contaminants in cell and gene therapy products. Journal of Clinical Microbiology. 59 (11), 0135721 (2021).
- Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation. Guide to Good Manufacturing Practice for Medicinal Products Annexes (PE 009-16 (Annexes)). Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation Scheme. , (2022).
- United States Pharmacopeia - National Formulary. USP<825> Radiopharmaceuticals - Preparation, Compounding, Dispensing, and Repackaging in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved