È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Controllo microbico e strategie di monitoraggio per ambienti di camere bianche e terapie cellulari
In questo articolo
Riepilogo
Il protocollo riassume le migliori pratiche per ridurre al minimo la carica microbica in un ambiente di camera bianca e include strategie come il monitoraggio ambientale, il monitoraggio dei processi e i test di sterilità del prodotto. È rilevante per gli impianti di produzione e collaudo che sono tenuti a soddisfare gli attuali standard di buona pratica dei tessuti e gli attuali standard di buona pratica di fabbricazione.
Abstract
Un programma ben convalidato e olistico che incorpora robuste misure di camicia, pulizia, monitoraggio ambientale e monitoraggio del personale è fondamentale per ridurre al minimo la carica microbica nelle suite di produzione di terapie cellulari e nei corrispondenti laboratori di test per garantire che le strutture operino in uno stato di controllo. Garantire la sicurezza del prodotto attraverso misure di controllo della qualità, come i test di sterilità, è un requisito normativo sia per le cellule umane, i tessuti e i prodotti cellulari e tissutali (HCT/Ps) minimamente manipolati (sezione 361) che per quelli minimamente manipolati (sezione 351). In questo video, forniamo una guida graduale su come sviluppare e incorporare le migliori pratiche asettiche per operare in un ambiente di camera bianca, tra cui vestizione, pulizia, stadiazione dei materiali, monitoraggio ambientale, monitoraggio dei processi e test di sterilità del prodotto utilizzando l'inoculazione diretta, fornita dalla Farmacopea degli Stati Uniti (USP<71>) e dal metodo alternativo di test di sterilità del National Institutes of Health (NIH). Questo protocollo è inteso come guida di riferimento per gli stabilimenti che dovrebbero soddisfare le attuali buone pratiche sui tessuti (cGTP) e le attuali buone pratiche di fabbricazione (cGMP).
Introduzione
L'implementazione di un forte programma di monitoraggio microbico attraverso il monitoraggio ambientale (EM), il monitoraggio dei processi e i test di sterilità del prodotto è un requisito normativo per le attuali buone pratiche tissutali (cGTP) e le attuali buone pratiche di fabbricazione (cGMP) nei laboratori di terapia cellulare1. Inoltre, la Food and Drug Administration (FDA) degli Stati Uniti prevede che il laboratorio che esegue i test di controllo qualità (QC) del prodotto dovrebbe anche impiegare strutture e controlli paragonabili a quelli utilizzati per le operazioni di riempimento asettico2.
Questo protocollo ha quattro sezioni principali: 1) Pratiche asettiche, tra cui la vestizione del personale, la pulizia e la messa in scena dei materiali; 2) EM, comprese le colture vitali di aria e superficie e il monitoraggio dell'aria delle particelle non vitali; 3) monitoraggio del processo, compreso il campionamento delle piastre di decantazione e dei guanti con la punta delle dita; e 4) test di sterilità del prodotto tramite il metodo 3 della farmacopea compendiale degli Stati Uniti (USP) <71> o il metodo 4 del NIH Alternative Sterility Test. Se utilizzate insieme, queste misure possono essere un metodo efficace per garantire che una struttura rimanga in uno stato di controllo.
Le tecniche qui descritte non sono nuove; Tuttavia, gli attuali standard delle autorità di regolamentazione e delle organizzazioni professionali mancano di dettagli, il che ha portato all'assenza di monitoraggio microbico o all'implementazione di pratiche non standardizzate, in particolare nei centri accademici in cui la produzione in loco e i test di sterilità dei prodotti stanno emergendo a un ritmo rapido 1,5,6 . Questo protocollo può essere utilizzato come guida per creare un programma di monitoraggio e controllo microbico che soddisfi i requisiti normativi se utilizzato in combinazione con la convalida dell'utente finale e le valutazioni del rischio.
Protocollo
1. Pratiche asettiche
- Camice personale per uno spazio camera bianca
NOTA: Questa procedura si basa sull'adescamento iniziale in uno spazio non classificato, seguito dall'ingresso in un'area ISO 8 dell'Organizzazione internazionale per la standardizzazione (ISO) e quindi in un'area ISO7. Questa procedura è rilevante per i laboratori che tentano di convertire lo spazio esistente in una funzione di camera bianca. Idealmente, tutti i vestiti iniziali dovrebbero avvenire in uno spazio classificato ISO8 (non in uno spazio non classificato).- Proteggi i capelli sciolti. Lavarsi le mani e cambiarsi in scrub (sono preferibili top scrub a maniche lunghe e pantaloni scrub a tutta lunghezza). Raccogli e cambia in scarpe da camera bianca con copriscarpe.
- Disinfettare le mani utilizzando inizialmente un disinfettante per le mani a base di alcol e poi di nuovo tra ciascuno dei seguenti passaggi: indossare guanti non sterili e quindi una copertura per la barba (per qualsiasi quantità di peli facciali visibili), se applicabile. Indossare un bouffant non sterile e coprire gli avambracci con maniche non sterili se non sono state utilizzate magliette a maniche lunghe.
- Rimuovere i copriscarpe, calpestando il tappetino appiccicoso di fronte alla porta dell'anticamera ISO8 con ogni piede dopo che il copriscarpe è stato rimosso. Assicurarsi che l'intero piede entri in contatto con il tappetino appiccicoso prima dell'ingresso. Eliminare i copriscarpe e decontaminare i guanti e la maniglia della porta con alcool isopropilico sterile al 70% (sIPA). Entra nell'anticamera ISO8.
- Raccogli un cappuccio sterile, una maschera facciale sterile, tute sterili, copristivali sterili e occhiali di sicurezza. Decontaminare i guanti con il 70% di alcool isopropilico. Indossare occhiali di sicurezza e posizionare i materiali su una superficie pulita, come da passaggio 1.5.
- Indossa un nuovo paio di copriscarpe non sterili sopra le scarpe dedicate alla camera bianca e sali sul tappetino di cattivo gusto di fronte all'anticamera secondaria. Assicurati che la totalità di ogni piede entri in contatto con il tappetino appiccicoso. Decontaminare i guanti con il 70% di alcool isopropilico. Raccogli le forniture di abiti da toga ed entra nell'anticamera secondaria ISO7, rimanendo sul lato sporco della linea di demarcazione.
- Indossare il cappuccio sterile e la tuta sterile, toccando solo l'interno del materiale della toeca e assicurandosi che il collo del cappuccio sia nascosto all'interno della tuta per creare una tenuta completa. Indossare i copristivali sterili secondari. Decontaminare i guanti con il 70% di sipa tra ogni fase di indossazione.
- Verificare che il camice sia stato indossato in modo appropriato, decontaminare i guanti con il 70% di sipa ed entrare nello spazio ISO7.
NOTA: ispezionare periodicamente il materiale del camice per verificarne l'integrità. In caso di compromissione, uscire immediatamente dalla camera bianca e rivestirla.
- Indossare un armadio di sicurezza biologica (BSC)
- Camice come da passaggio 1.1 sopra con queste pratiche aggiuntive.
- Raccogli guanti sterili e maniche sterili. Pulire il BSC come da punto 1.4 e mettere in scena i materiali come da punto 1.5. Decontaminare i guanti con il 70% di alcool isopropilico.
- Indossare asetticamente maniche sterili sulla tuta, utilizzando passanti per il pollice se presenti. Indossare guanti sterili sui guanti esistenti, assicurandosi che il polsino del guanto si estenda sulla manica sterile. Decontaminare i guanti con il 70% di sipa tra ogni passaggio. Inserisci il BSC.
NOTA: ispezionare periodicamente il materiale del camice per verificarne l'integrità. In caso di compromissione, uscire immediatamente dalla camera bianca e rivestirla.
- Rimozione dei materiali di toga
- Uscire dal BSC e rimuovere con attenzione il paio di guanti superiori e le maniche sterili. Decontaminare i guanti interni con il 70% di sipisopropilità.
- Entra nell'anticamera secondaria e poi primaria, aspettando che la porta si chiuda completamente tra ogni passaggio. Rimuovere i materiali nel seguente ordine: copristivali sterili esterni, tuta, cappuccio e maschera facciale.
- Uscire dall'anticamera principale e rimuovere il camice non sterile.
NOTA: l'ordine di rimozione nello spazio non classificato non è importante; Tuttavia, i copriscarpe interni non sterili devono rimanere sulle scarpe della camera bianca per la conservazione in spazi non classificati. - Igienizzare le mani con un disinfettante per le mani a base di alcol e tornare agli abiti da strada.
- Pulizia delle superfici della camera bianca e del BSC
- Montare una scopa per la pulizia portatile o ottenere una salvietta pulita a basso contenuto di lanugine. Se si utilizza una salvietta a basso contenuto di lanugine, piegare la salvietta in quarti e ruotare tra ciascuna superficie. Saturare la testa della scopa o la salvietta a basso contenuto di lanugine con un disinfettante approvato.
- Lavorando da dietro a davanti (o dall'alto verso il basso), pulire il BSC utilizzando salviette sovrapposte nel seguente ordine: la griglia del diffusore HEPA (la parte superiore del BSC), la parete posteriore del BSC, entrambe le pareti laterali del BSC, l'anta e il piano di lavoro. Infine, pulire l'anta del BSC utilizzando il 70% di sipa per rimuovere eventuali residui di disinfettante. Fare riferimento alla Figura 1 per un tipico schema di pulizia BSC.
- Materiali e attrezzature di staging in ambienti classificati
- Decontaminare (cioè stadio) tutti i materiali che richiedono il trasferimento da un'area non classificata o classificata inferiore a un'area classificata superiore (ad esempio, da uno spazio ISO8 a ISO7) per ridurre al minimo il trasferimento di microbi. Il trasferimento di materiali tra aree dello stesso livello di classificazione ISO non richiede la messa in scena.
NOTA: Se i materiali sono stati sterilizzati terminalmente e si trovano in più sacchetti, rimuovere la sacca/sacca esterna e spostare il materiale nello spazio classificato; Non è necessario pulire la borsa/sacchetto interno. - Ottenere una salvietta a basso contenuto di lanugine e piegare la salvietta in quarti per ruotare su un lato pulito man mano che la salvietta si sporca. Saturare la salvietta con alcool isopropilico al 70% o con un disinfettante approvato.
- Pulire l'esterno del materiale/attrezzatura utilizzando salviette sovrapposte. Assicurarsi che tutte le aree dell'articolo siano pulite, compresi gli interni delle guarnizioni estraibili della confezione e gli angoli/rientranze sull'attrezzatura e altre forniture di forma irregolare. Per le attrezzature su ruote, assicurarsi che l'intera ruota sia stata pulita durante il processo di stadiazione (potrebbe essere necessario inclinare delicatamente l'attrezzatura per consentire la rotazione delle ruote).
- Decontaminare (cioè stadio) tutti i materiali che richiedono il trasferimento da un'area non classificata o classificata inferiore a un'area classificata superiore (ad esempio, da uno spazio ISO8 a ISO7) per ridurre al minimo il trasferimento di microbi. Il trasferimento di materiali tra aree dello stesso livello di classificazione ISO non richiede la messa in scena.

Figura 1: Esempio di un modello di pulizia BSC. Lavorando da dietro a davanti (o dall'alto verso il basso), pulire il BSC utilizzando salviette sovrapposte nel seguente ordine: la griglia del diffusore HEPA (la parte superiore del BSC), la parete posteriore del BSC, entrambe le pareti laterali del BSC, l'anta e il piano di lavoro. Infine, pulire l'anta del BSC utilizzando il 70% di sipa per rimuovere eventuali residui di disinfettante. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Monitoraggio ambientale (EM)
- Campionamento superficiale praticabile
- Mettere in scena i materiali necessari per la sessione di campionamento come da fase 1.5 e vestire lo spazio classificato come da sezione 1.
NOTA: Il campionamento superficiale deve essere eseguito prima del campionamento dell'aria in qualsiasi luogo specificato. Se si utilizzano più piastre per campionare una superficie, non campionare esattamente la stessa posizione. Utilizzare piastre di contatto per campionare superfici piane solo per garantire il contatto completo ed evitare potenziali danni all'agar. - Raccogliere ed etichettare un agar di soia triptico con piastra di lecithinase e tween (TSALT) e un agar destrosio Sabouraud con piastra di lecithinase e tween (SABLT) per ciascun sito di campionamento. Tenendo il fondo del piatto con una mano, rimuovere asetticamente il coperchio, facendo attenzione a non toccare la superficie dell'agar sollevata.
- Toccare l'agar sollevato sulla superficie da campionare, assicurandosi che l'intera superficie sia in contatto, e applicare una pressione decisa sulla piastra. Lasciare la piastra a contatto con la superficie per almeno 5 s.
- CRITICO: Non spostare la placca lateralmente sulla superficie da campionare, in quanto ciò può diffondere la crescita potenziale sulla superficie, rendendo difficile la risoluzione delle singole colonie. Non esercitare una forza eccessiva sulla piastra di contatto durante il campionamento, poiché la superficie dell'agar potrebbe rompersi.
- Sostituire asetticamente il coperchio, facendo attenzione a non toccare la superficie dell'agar rialzata. Bloccare il coperchio in posizione se la piastra di contatto ha un sistema di bloccaggio. Pulire l'area di campionamento con alcool isopropilico al 70% per rimuovere qualsiasi mezzo residuo dalla superficie. Insaccare liberamente le piastre e incubare le colture come descritto nella Tabella 1. Un'immagine rappresentativa che mostra la crescita di tre unità formanti colonie (CFU) con due distinte morfologie di colonie su una piastra di campionamento superficiale TSALT è illustrata nella Figura 2. La figura 3 mostra la contaminazione di una piastra TSALT con crescita sul bordo della piastra, attribuibile alla scarsa tecnica asettica durante la raccolta del campione.
- Mettere in scena i materiali necessari per la sessione di campionamento come da fase 1.5 e vestire lo spazio classificato come da sezione 1.
- Campionamento dell'aria praticabile
- Mettere in scena i materiali necessari per la sessione di campionamento come da fase 1.5 e vestire lo spazio classificato come da sezione 1.
- Raccogliere ed etichettare una piastra di agar di soia triptica (TSA) e una piastra di agar destrosio Sabouraud (SAB) per ciascun sito di campionamento. Preparare il campionatore d'aria rimuovendo asetticamente la testina di campionamento afferrando solo il bordo esterno per evitare di contaminare la testa.
- Tenendo la testina di campionamento in una mano, posizionare asetticamente il mezzo nel supporto della piastra sul campionatore. Se c'è un polo più lungo degli altri, inserire prima il mezzo contro il polo più lungo, quindi spingere la piastra verso il basso nei rebbi rimanenti per fissare la piastra.
- Rimuovere asetticamente il coperchio della piastra e posizionarlo su una superficie pulita fino al completamento del campionamento. Sostituire e fissare asetticamente la testa di campionamento, afferrando solo il bordo esterno per evitare di contaminare la testa. Ripetere i passaggi 2.2.2-2.2.4 per il mezzo rimanente se si utilizza un campionatore d'aria a più teste.
- Posizionare il campionatore d'aria nella posizione di campionamento con le teste di campionamento rivolte nella direzione predominante del movimento del flusso d'aria. Assicurarsi che lo scarico del campionatore d'aria non vitale (se il campionamento simultaneo) non interferisca con il campionatore valido. Assicurarsi che il campionatore d'aria sia impostato sulle impostazioni convalidate e avviare il ciclo di campionamento.
- Quando il ciclo di campionamento è stato completato, rimuovere asetticamente la testa di campionamento dal campionatore afferrando solo il bordo esterno per evitare di contaminare la testa. Tenere la testina di campionamento in una mano e sostituire asetticamente il coperchio della piastra di agar. Rimuovere la piastra dal portapiatti. Insaccare liberamente le piastre e incubare le colture come descritto nella Tabella 1.
- Disinfettare la testina di campionamento e l'area intorno al portapiastre con alcool isopropilico al 70%. Fissare asetticamente la testa di campionamento, afferrando solo il bordo esterno. Ripetere i punti 2.2.6 e 2.2.7 per il mezzo rimanente se si utilizza un campionatore d'aria a più teste.
NOTA: La figura 4 mostra una coltura di campionamento attivo dell'aria TSA con crescita causata da una testina di campionamento contaminata. Al contrario, la Figura 5 rappresenta una coltura di campionamento attivo dell'aria TSA senza crescita. I rientri dell'impatto dell'aria dalla testa di campionamento possono essere visti sull'immagine.
- Campionamento non vitale
- Eseguire un controllo zero sul contatore di particelle laser prima delle attività di campionamento per ogni giorno di utilizzo. Collegare la testa isocinetica alla porta di campionamento del contatore di particelle direttamente o fissata a una lunghezza di tubo secondo necessità per la posizione di campionamento.
- Se viene applicato un tubo, utilizzare una lunghezza ridotta, poiché tubi lunghi >1 m possono causare problemi con l'enumerazione di particelle di ≥1 μm e possono anche portare a curve non necessarie nel tubo. Assicurarsi che il contatore di particelle sia impostato sulle impostazioni convalidate. Si raccomanda di impostare un ritardo di circa 30 s per consentire l'uscita dall'area di campionamento per evitare interruzioni del flusso d'aria durante il campionamento.
- Posizionare la testa isocinetica del contatore di particelle laser nella posizione di campionamento con la testa isocinetica rivolta nella direzione predominante del movimento del flusso d'aria. Assicurarsi che lo scarico del campionatore d'aria vitale (se il campionamento contemporaneamente) non interferisca con il campionatore non vitale. Per le aree in cui il flusso d'aria non è unidirezionale o il modello del flusso d'aria è sconosciuto, assicurarsi che la testa isocinetica sia rivolta verticalmente verso l'alto.
NOTA: Se il disinfettante rotazionale o il 70% di sipa sono stati aerosolizzati vicino al campionatore d'aria, attendere almeno 5 minuti prima di iniziare il ciclo di campionamento. - Avviare il ciclo di campionamento e uscire lentamente dall'area di campionamento per evitare di interrompere il flusso d'aria.
CRITICO: Non aerosolizzare liquidi vicino al campionatore d'aria durante un ciclo di campionamento, poiché ciò causerebbe un elevato numero di persone non vitali. - Quando il campionamento è stato completato, recuperare il contatore di particelle laser. Registrare il conteggio medio delle particelle per 0,5 μm. Alcune strutture possono anche tracciare e tendere 5,0 μm.
- Ripetere i passaggi 2.3.3-2.3.6 per la successiva posizione di campionamento. Se ci si sposta tra stanze o BSC, pulire l'esterno del campionatore di particelle non vitali con il 70% di sipa o un disinfettante approvato. Evitare di ottenere disinfettante all'interno della testa isocinetica, in quanto ciò potrebbe portare a conteggi delle particelle imprecisi.
| Categoria | Media | Condizioni colturali | Osservazione della cultura | Risultati | ||||||
| Monitoraggio ambientale | TSA (aria vitale) | 30 °C-35 °C, aria, per almeno 3 giorni | Fine dell'incubazione | Il gruppo QA di ciascun impianto dovrebbe stabilire limiti di allarme e di azione per ciascun tipo di campionamento e posizione. I limiti di azione per i campioni vitali basati sulla classificazione ISO possono essere guidati utilizzando PIC/S 009-16 (allegati) 18 e ISO-14644-1 7. I limiti di azione per i campioni di aria non vitali sono in genere impostati su una percentuale del limite ISO (ad esempio, 99%). I limiti di allerta per i campioni vitali sono in genere impostati su una percentuale del limite di azione o del limite ISO (ad esempio, 95%). Fare riferimento a PDA TR-13 e USP<1116> per maggiori dettagli riguardanti la definizione dei livelli di allerta e azione e la convalida delle condizioni di coltura selezionate 8,9. | ||||||
| RFA (aria vitale) | 20 °C-25 °C, aria, per almeno 7 giorni | |||||||||
| TSALT (superficie vitale) | 30 °C-35 °C, aria, per almeno 3 giorni | Le immagini rappresentative delle piastre EM sono mostrate in Figura 2, Figura 3, Figura 4 e Figura 5. | ||||||||
| SABLT (superficie vitale) | 20 °C-25 °C, aria, per almeno 7 giorni | |||||||||
| Monitoraggio dei processi | TSA (piastra di sedimentazione) | 30 °C-35 °C, aria, per almeno 3 giorni | Solo a scopo informativo. Fornisce informazioni utili in caso di indagine OOS in risposta a un test di sterilità del prodotto non riuscito. | |||||||
| BRS (piatto di decantazione) | 20 °C-25 °C, aria, per almeno 7 giorni | Vedere la Figura 6 per un esempio di piatto di sedimentazione positiva. | ||||||||
| Campionamento della punta delle dita guantate | SALATO | 30 °C-35 °C, aria, per almeno 48 ore giorni seguiti da 20 °C-25 °C per almeno 5 giorni 19. | Il criterio di accettabilità per GFS è <1 CFU/piastra (cioè nessuna crescita) come da PIC/S 009-16 (Allegati) 18. I criteri di accettabilità possono essere modificati a discrezione del QA della struttura. | |||||||
| Test di sterilità del prodotto | TSB (USP<71>) | 20 °C-25 °C, aria, per almeno 14 giorni | Periodicamente durante il periodo di incubazione (giorni 3, 5, 7 e 14) | Nessuna crescita. | ||||||
| FTM (USP<71>) | 30 °C-35 °C, aria, per almeno 14 giorni | |||||||||
| iFA+ (metodo NIH) | 30 °C-35 °C, aria, per almeno 14 giorni | Monitoraggio automatico tramite lo strumento BacT/ALERT Dual-T. Si raccomanda vivamente il controllo visivo di ogni bottiglia alla fine dell'incubazione per le palline di stampo. | Vedere la Figura 8 per un esempio di sfere di stampo visibili che non sono state rilevate automaticamente da BacT/ALERT. | |||||||
| iFN+ (metodo NIH) | ||||||||||
| SAB (metodo NIH) | 20 °C-25 °C per almeno 14 giorni | Periodicamente durante il periodo di incubazione (giorni 3, 5, 7 e 14) | ||||||||
Tabella 1: Riepilogo delle condizioni colturali raccomandate e dei risultati attesi. Le condizioni colturali qui descritte sono raccomandazioni basate su un programma convalidato utilizzato presso il NIH. Ogni utente finale è tenuto a convalidare il proprio programma di test microbiologici. Le strategie di controllo e test microbico possono differire tra gli istituti a seconda delle variabili, tra cui la progettazione della struttura, la flora della struttura e la classificazione del rischio del prodotto.
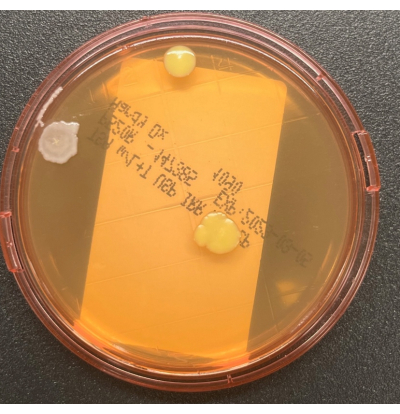
Figura 2: Crescita sulla piastra TSALT. La piastra di campionamento superficiale TSALT mostra tre CFU di due distinte morfologie di colonie. Fare clic qui per visualizzare una versione ingrandita di questa figura.
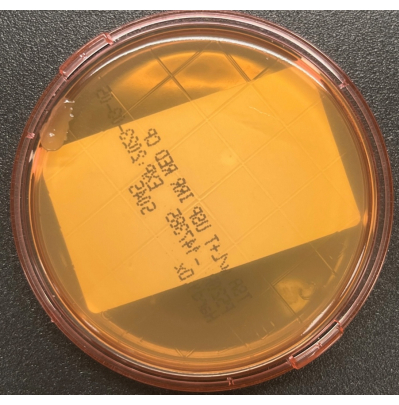
Figura 3: Contaminazione della piastra TSALT durante la raccolta. La coltura superficiale TSALT mostra una singola colonia sul bordo della piastra, indicativa di una scarsa manipolazione asettica durante il processo di campionamento. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Coltura ottenuta utilizzando una testa di campionamento dell'aria contaminata. Esempio di una coltura di campionamento attivo dell'aria TSA che mostra >100 unità formanti colonie (CFU) di morfologie miste. Il modello di crescita indica la contaminazione della testa di campionamento. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Nessuna crescita su una piastra d'aria attiva vitale TSA. Piastra d'aria attiva vitale TSA che illustra nessuna crescita dopo l'incubazione. Nell'immagine sono visibili i rientri della testa del campionatore d'aria attivo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Monitoraggio dei processi
- Piastre di decantazione (monitoraggio passivo dell'aria)
- Posizionare le piastre etichettate TSA e SAB vicino all'area di lavoro ma in un'area che non interferisca con i test. Documentare l'ora di inizio del campionamento e aprire asetticamente entrambe le piastre, posizionando i coperchi su una superficie pulita nel BSC lontano dall'area di lavoro.
- Le piastre di decantazione possono essere aperte per una durata massima di 4 ore per evitare che l'agar si secchi. Chiudere i coperchi delle piastre alla fine della lavorazione. Insaccare liberamente le piastre e incubare le colture come descritto nella Tabella 1. La figura 6 mostra un singolo contaminante di colonia su una piastra di sedimentazione dell'aria TSA.
- Campionamento della punta delle dita guantate (GFS)
- Procuratevi due piastre TSALT etichettate. Rimuovere asetticamente il coperchio di una piastra e posizionarlo su una superficie di lavoro pulita lontano dall'area di campionamento.
- Arrotolare delicatamente il cuscinetto di ciascun dito e il pollice di una mano sulla superficie del piatto (Figura 7). Campionare la superficie più grande di ogni dito / pollice piuttosto che la punta. Utilizzare una forza sufficiente per creare lievi depressioni sull'agar senza rompere la superficie dell'agar.
- Riposizionare asetticamente il coperchio sulla piastra e ripetere il punto 3.2.2 per l'altra mano. Igienizzare le mani con il 70% di sipa al termine del campionamento. Insaccare liberamente le piastre e incubare le colture come descritto nella Tabella 1.
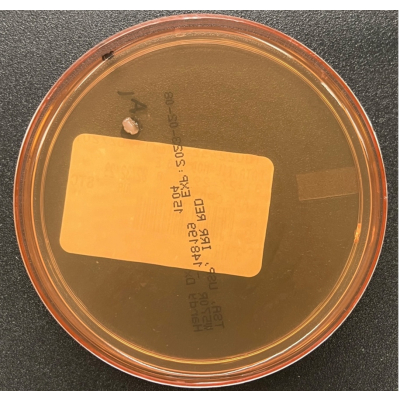
Figura 6: Crescita su una piastra di sedimentazione dell'aria TSA. Una piastra di sedimentazione dell'aria TSA che illustra una singola colonia di un contaminante coltivato durante il monitoraggio del processo passivo dell'aria nella BSC. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 7: Campionamento della punta delle dita guantate. Il metodo corretto per ottenere campioni di punta delle dita guantate utilizzando la superficie più ampia (o cuscinetto) di ciascun dito / pollice è mostrato a sinistra. Il processo errato in cui viene campionata solo la punta del dito è mostrato sulla destra. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Test di sterilità mediante inoculazione diretta del prodotto
- Inoculazione diretta dopo USP<71>
- Ottenere una bottiglia di brodo di soia triptico (TSB) etichettata e una bottiglia di mezzo tioglicolato fluido (FTM) etichettata per ogni articolo di prova inviato. Per la sessione di prova, procurarsi un TSALT e un SABLT per il campionamento superficiale praticabile, una piastra TSA e una piastra SAB per le piastre di decantazione e due piastre TSALT per GFS.
- Camice per il lavoro all'interno della BSC come da punto 1.2. Pulire il BSC come da punto 1.4. Inserire i materiali nella BSC come da punto 1.5. Eseguire il campionamento a contatto dell'area di lavoro critica come da passaggio 2.1, pulendo la superficie con un sipa al 70% dopo il campionamento. Preparare le piastre di decantazione TSA e SAB vicino all'area di lavoro come da punto 3.1.
- Ottenere l'articolo di prova e le bottiglie TSB e FTM associate. Se le bottiglie TSB e FTM hanno un setto, rimuovere i cappucci protettivi da ciascuna bottiglia e pulire il setto con una salvietta sterile al alcool. Se le bottiglie TSB e FTM hanno un tappo a vite, allentare il tappo dalle bottiglie (ma non rimuovere il tappo).
- Vortice l'articolo di prova per garantire una sospensione omogenea. Inoculare i flaconi con il volume convalidato dell'articolo in esame (fino a 10 ml/flacone) utilizzando una siringa sterile e un ago ipodermico (per i tappi del setto) o un pipettor (per i tappi a vite).
- Dopo l'inoculazione, pulire il setto con una salvietta sterile al alcool e inserire un'unità di ventilazione sterile per consentire lo scambio d'aria durante l'incubazione. Per le bottiglie con tappo a vite, chiudere il flacone ma lasciare il tappo da 1/4 a 1/2 giro sciolto per consentire il ricambio d'aria durante l'incubazione. Ripetere i passaggi 4.1.3-4.1.5 per ogni articolo di prova da testare all'interno di quella sessione.
- Chiudere asetticamente le piastre di decantazione TSA e SAB e documentare l'ora finale del campionamento. Eseguire GFS come da passaggio 3.2, pulendo i guanti con il 70% di sipa dopo il campionamento. Insaccare liberamente le piastre e incubare le colture come descritto nella Tabella 1.
- Trasferire tutti i materiali di prova fuori dal BSC e pulire il BSC come da punto 1.4.
- Inoculazione diretta secondo il metodo di test di sterilità alternativo NIH
- Ottenere una targa i FA+, una etichettata iFN+ e una piastra SAB per ogni articolo di prova. Per la sessione di prova, procurarsi un TSALT e un SABLT per il campionamento superficiale praticabile, una piastra TSA e una piastra SAB per le piastre di decantazione e due piastre TSALT per GFS.
- Camice per il lavoro all'interno della BSC come da punto 1.2. Pulire il BSC come da punto 1.4. Inserire i materiali nella BSC come da punto 1.5. Eseguire il campionamento a contatto dell'area di lavoro critica come da passaggio 2.1, pulendo la superficie con un sipa al 70% dopo il campionamento. Preparare le piastre di decantazione TSA e SAB vicino all'area di lavoro come da punto 3.1.
- Ottenere l'articolo di prova e la relativa piastrai FA+, iFN+ e SAB. Rimuovere i cappucci protettivi dai flaconi i FA+ e iFN+ e pulire il setto con una salvietta sterile al alcool.
- Vortice l'articolo di prova per garantire una sospensione omogenea. Inoculare i flaconi con il volume convalidato dell'articolo in esame (fino a 10 ml/flacone) utilizzando una siringa sterile e un ago ipodermico. Pulire il setto con una salvietta sterile con alcool dopo l'inoculazione. Incubare i flaconi sullo strumento BacT/ALERT Dual-T come descritto nella Tabella 1.
- Utilizzando un pipettatore, inoculare la piastra SAB con la quantità convalidata dell'articolo di prova (non più di 500 μL/piastra) e strisciare per l'isolamento utilizzando un anello sterile. Lasciare riposare per 10 minuti per assicurarsi che il campione non finisca sul coperchio della piastra quando viene capovolto per l'incubazione. Introdurre ciascuna piastra SAB inoculata con l'articolo in esame in un sacchetto di plastica, legare liberamente e incubare come descritto nella tabella 1.
- Chiudere asetticamente le piastre di decantazione TSA e SAB e documentare l'ora finale del campionamento. Eseguire GFS come descritto al punto 3.2, pulendo i guanti con il 70% di sipa dopo il campionamento. Insaccare liberamente le piastre e incubare le colture come descritto nella Tabella 1. L'ispezione visiva delle bottiglie BacT/ALERT alla fine del periodo di incubazione è essenziale per rilevare le sfere di stampo che potrebbero non essere state rilevate dallo strumento (Figura 8).
- Trasferire tutti i materiali di prova fuori dal BSC e pulire il BSC come da punto 1.4.
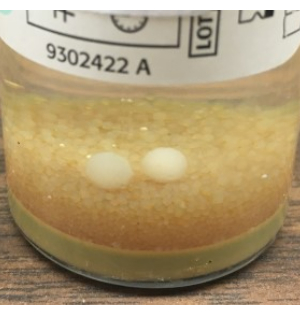
Figura 8: Crescita di muffe che non sono state rilevate dal BacT/ALERT. Esempio di palline di muffa, visibili ad occhio nudo, che non sono state rilevate automaticamente dal sistema BacT/ALERT. Sulla base di questi risultati, raccomandiamo l'ispezione visiva terminale di tutte le bottiglie BacT / ALERT e l'aggiunta della piastra SAB per la coltura fungina utilizzando il metodo di test di sterilità alternativo NIH. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
I risultati attesi sono descritti nella Tabella 1. I dati EM dovrebbero essere rivisti e seguiti con un'indagine appropriata e una risposta all'azione, all'allarme o alle escursioni limite ISO. Se si verifica un'escursione per particelle non vitali, si dovrebbe procedere secondo ISO 14644-Annex A, sez. A.5.57. Se l'escursione può essere attribuita a un evento anomalo immediatamente identificabile, i risultati originali del campionamento devono essere documentati, deve essere aggi...
Discussione
Ci sono diverse aree critiche in questo protocollo, tra cui il mantenimento della tecnica asettica e del flusso d'aria unidirezionale all'interno delle camere bianche e delle BSC. Le migliori pratiche includono muoversi lentamente e deliberatamente per ridurre al minimo la turbolenza. Le manipolazioni asettiche devono essere eseguite dal lato del prodotto, non dall'alto. Si raccomanda la lavorazione a sistema chiuso e l'uso di materie prime sterilizzate terminalmente. Parlare in aree critiche e appoggiarsi a pareti o att...
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questo lavoro è stato supportato dal programma di ricerca intramurale del National Institutes of Health Clinical Center. Il contenuto è di esclusiva responsabilità degli autori e non rappresenta le opinioni ufficiali del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| 20-25°C Incubator | Lab preference | ||
| 30-35°C Incubator | Lab preference | ||
| Alcohol-based hand sanitizer | Lab preference | ||
| BacT/ALERT Dual-T instrument | BioMerieux Industry | ||
| Beard cover | Lab preference | ||
| Biosafety cabinet (BSC) | Lab preference | ||
| Cleanroom shoes | Lab preference | ||
| Fluidthioglycollate medium (FTM) | Hardy Diagnostics | U84 | USP |
| Handheld cleaning mop | Contec | 2665LF | |
| Hypodermic needle | Lab preference | ||
| iFA+ BacT/ALERT bottle | Biomerieux | 412990 | |
| iFN+ BacT/ALERT bottle | Biomerieux | 412991 | |
| Isokinetic head | Lab preference | ||
| Laser particle counter | TSI Incorporated | 9500-01 | |
| LpH III | Steris | 1S16CX | |
| Mirror | Lab preference | ||
| Non-sterile bouffant | Lab preference | ||
| Non-sterile gloves | Lab preference | ||
| Non-sterile shoe covers | Lab preference | ||
| Non-sterile sleeve covers | Lab preference | ||
| Parafilm | Lab preference | ||
| Peridox RTU | Contec | CR85335IR | |
| Plastic bag | Lab preference | ||
| Sabouraud Dextrose Agar with Lecithinase and Tween (SABLT) | Hardy Diagnostics | P595 | USP, irradiated |
| Sabouraurd Dextrose Agar (SAB) | Hardy Diagnostics | W565 | USP, irradiated |
| Safety glasses | Lab preference | ||
| Scrubs (top and bottom) | Lab preference | ||
| Spor-Klenx RTU | Steris | 6525M2 | |
| Sterile 70% isopropyl alcohol (IPA) | Decon CiDehol | 8316 | |
| Sterile alcohol wipe | Lab preference | ||
| Sterile boot covers | Kimberly Clark | Cat# varies based on size | |
| Sterile coveralls | Kimberly Clark | Cat# varies based on size | |
| Sterile face mask | Lab preference | ||
| Sterile gloves | Lab preference | ||
| Sterile hood | Kimberly Clark | Cat# varies based on size | |
| Sterile low-lint wipes | Texwipe | TX3210 | |
| Sterile mop cleaning pads | Contec | MEQT0002SZ | |
| Sterile sleeve covers | Kimberly Clark | 36077 | |
| Sterile spreading rod | Fisher Scientific | 14665231 | |
| Sterile syringe | Lab preference | ||
| Tacky mats | Lab preference | ||
| Tryptic Soy Agar (TSA) | Hardy Diagnostics | W570R | USP, irradiated |
| Tryptic Soy Agar with Lecithinase and Tween (TSALT) | Hardy Diagnostics | P520R | USP, irradiated |
| Tryptic Soy Broth (TSB) | Hardy Diagnostics | U46 | USP |
| Tubing | Lab preference | ||
| Vesphene III | Steris | 1S15CX | |
| Viable air sampler | Hardy Diagnostics | BAS22K | |
| Vortex | Lab preference |
Riferimenti
- Cundell, T., Atkins, J. W., Lau, A. F. Sterility testing for hematopoietic stem cells. Journal of Clinical Microbiology. , (2023).
- United States Food and Drug Administration. Guidance for Industry. Sterile Drug Products Produced by Aseptic Processing - Current Good Manufacturing Practice. United States Food and Drug Administration. , (2004).
- United States Pharmacopeia - National Formulary. USP<71> Sterility Tests in USP43-NF38. United States Pharmacopeia - National Formulary. , (2022).
- England, M. R., Stock, F., Gebo, J. E. T., Frank, K. M., Lau, A. F. Comprehensive evaluation of compendial USP<71>, BacT/Alert Dual-T, and Bactec FX for detection of product sterility testing contaminants. Journal of Clinical Microbiology. 57 (2), 01548 (2019).
- Gebo, J. E. T., East, A. D., Lau, A. F. A side-by-side comparison of clinical versus current good manufacturing practices (cGMP) microbiology laboratory requirements for sterility testing of cellular and gene therapy products. Clinical Microbiology Newsletter. 43 (21), 181-191 (2021).
- Gebo, J. E. T., Lau, A. F. Sterility testing for cellular therapies: What is the role of the clinical microbiology laboratory. Journal of Clinical Microbiology. 58 (7), 01492 (2020).
- International Organization for Standardization. ISO 14644-1:2015 Cleanrooms and associated controlled environments - Part 1: Classification of air cleanliness by particle concentration. International Organization for Standardization. , (2015).
- Parenteral Drug Association. PDA Technical Report No. 13 Revised 2022 (TR 13) Fundamentals of an Environmental Monitoring Program. Parenteral Drug Association, Inc. , (2022).
- United States Pharmacopeia - National Formulary. USP<1116> Microbiological Evaluation of Cleanrooms and Other Controlled Environments in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Guinet, R., et al. Multicenter study on incubation conditions for environmental monitoring and aseptic process simulation. PDA journal of pharmaceutical science and technology. 71 (1), 43-49 (2017).
- Gordon, O., Berchtold, M., Staerk, A., Roesti, D. Comparison of different incubation conditions for microbiological environmental monitoring. PDA Journal of Pharmaceutical Science and Technology. 68 (5), 394-406 (2014).
- Anders, H. J., et al. Multisite qualification of an automated incubator and colony counter for environmental and bioburden applications in pharmaceutical microbiology. PDA Journal of Pharmaceutical Science and Technology. , (2022).
- United States Pharmacopeia - National Formulary. USP<1072> Disinfectants and Antiseptics. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. USP<1071> Rapid Microbial Tests for Release of Sterile Short-Life Products: A Risk-Based Approach in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. PUSP<1223> Validation of Alternative Microbiological Methods in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Parenteral Drug Association. PDA Technical Report No. 33, Revised 2013 (TR 33) Evaluation, Validation and Implementation of Alternative and Rapid Microbiological Methods. Parenteral Drug Association, Inc. , (2013).
- Putnam, N. E., Lau, A. F. Comprehensive study identifies a sensitive, low-risk, closed-system model for detection of fungal contaminants in cell and gene therapy products. Journal of Clinical Microbiology. 59 (11), 0135721 (2021).
- Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation. Guide to Good Manufacturing Practice for Medicinal Products Annexes (PE 009-16 (Annexes)). Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation Scheme. , (2022).
- United States Pharmacopeia - National Formulary. USP<825> Radiopharmaceuticals - Preparation, Compounding, Dispensing, and Repackaging in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon