Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Стратегии микробного контроля и мониторинга для чистых помещений и клеточной терапии
В этой статье
Резюме
В протоколе обобщены передовые методы минимизации микробной бионагрузки в чистых помещениях и включены такие стратегии, как мониторинг окружающей среды, мониторинг процесса и тестирование стерильности продукта. Это актуально для производственных и испытательных предприятий, которые должны соответствовать текущим стандартам надлежащей практики в отношении тканей и текущим стандартам надлежащей производственной практики.
Аннотация
Хорошо проверенная и целостная программа, которая включает в себя надежные меры по ношению одежды, уборке, мониторингу окружающей среды и мониторингу персонала, имеет решающее значение для минимизации микробной бионагрузки в производственных помещениях клеточной терапии и соответствующих испытательных лабораториях, чтобы гарантировать, что объекты работают в состоянии контроля. Обеспечение безопасности продукции с помощью мер контроля качества, таких как тестирование на стерильность, является нормативным требованием как для минимально обработанных (раздел 361), так и для более чем минимальных манипуляций (раздел 351) человеческих клеток, тканей, а также клеточных и тканевых продуктов (HCT/P). В этом видео мы предоставляем пошаговое руководство о том, как разработать и внедрить лучшие асептические методы для работы в чистых помещениях, включая халатность, очистку, постановку материалов, мониторинг окружающей среды, мониторинг процесса и тестирование стерильности продукта с использованием прямой инокуляции, предоставленное Фармакопеей США (USP<71>) и Альтернативным методом тестирования стерильности Национального института здравоохранения (NIH). Этот протокол предназначен в качестве справочного руководства для предприятий, которые, как ожидается, будут соответствовать текущим передовым методам производства в тканях (cGTP) и текущим передовым производственным практикам (cGMP).
Введение
Внедрение эффективной программы микробного мониторинга посредством мониторинга окружающей среды (ЭМ), мониторинга процессов и тестирования стерильности продукции является нормативным требованием для текущей надлежащей практики тканей (cGTP) и текущей надлежащей производственной практики (cGMP) в лабораториях клеточной терапии1. Кроме того, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) ожидает, что лаборатория, проводящая испытания контроля качества (КК) продукта, также должна использовать средства и средства контроля, сопоставимые с теми, которые используются для операций асептического розлива2.
Этот протокол состоит из четырех основных разделов: 1) Асептические практики, включая одежду персонала, очистку и постановку материалов; 2) ЭМ, включая жизнеспособные воздушные и поверхностные культуры и мониторинг воздуха нежизнеспособных частиц; 3) контроль технологического процесса, включая отбор проб отстойников и перчаток кончиками пальцев; и 4) тестирование продукта на стерильность с помощью компендиального метода3 Фармакопеи США (USP) <71> или альтернативного метода тестирования стерильностиNIH 4. При совместном использовании эти меры могут быть эффективным методом обеспечения того, чтобы объект оставался в состоянии контроля.
Методы, описанные здесь, не новы; Однако в действующих стандартах регулирующих органов и профессиональных организаций отсутствует детализация, что привело к отсутствию микробного мониторинга или внедрению нестандартизированных методов, особенно в академических центрах, где производство на месте и тестирование стерильности продукции появляются быстрыми темпами 1,5,6 . Этот протокол может быть использован в качестве руководства для создания программы микробного мониторинга и контроля, отвечающей нормативным требованиям при использовании в сочетании с валидацией конечных пользователей и оценкой рисков.
протокол
1. Асептические практики
- Одежда для персонала в чистом помещении
ПРИМЕЧАНИЕ: Эта процедура основана на первоначальном ношении одежды в неклассифицированном помещении с последующим входом в зону Международной организации по стандартизации (ИСО) 8, а затем в зону ИСО7. Эта процедура актуальна для лабораторий, пытающихся превратить существующее пространство в чистую комнату. В идеале, все первоначальные наряды должны происходить в классифицированном пространстве ISO8 (а не в неклассифицированном пространстве).- Закрепите распущенные волосы. Вымойте руки и переоденьтесь в скрабы (предпочтительны топы для скраба с длинными рукавами и штаны для скраба по всей длине). Соберитесь и переоденьтесь в обувь для чистых помещений в бахилах.
- Сначала продезинфицируйте руки с помощью дезинфицирующего средства для рук на спиртовой основе, а затем еще раз между каждым из следующих шагов: надевайте нестерильные перчатки, а затем покрывало для бороды (для любого количества видимых волос на лице), если применимо. Наденьте нестерильный накидку и прикройте предплечья нестерильными рукавами, если не использовались топы с длинными рукавами.
- Снимите бахилы, наступая на липкий коврик перед дверью прихожей ISO8 каждой ногой после снятия бахилы. Перед входом убедитесь, что вся стопа соприкасается с липким ковриком. Выбросьте бахилы и обеззаразьте перчатки и дверную ручку 70% стерильным изопропиловым спиртом (sIPA). Войдите в прихожую ISO8.
- Возьмите стерильный капюшон, стерильную маску для лица, стерильный комбинезон, стерильные бахилы и защитные очки. Обеззаразьте перчатки 70% sIPA. Наденьте защитные очки и положите материалы на чистую поверхность в соответствии с шагом 1.5.
- Наденьте новую пару нестерильных бахил поверх специальной обуви для чистых помещений и встаньте на липкий коврик перед дополнительной прихожей. Убедитесь, что вся нога соприкасается с липким ковриком. Обеззаразьте перчатки 70% sIPA. Соберите постановочные принадлежности для одежды и войдите во вторичную прихожую ISO7, оставаясь на грязной стороне демаркационной линии.
- Наденьте стерильный капюшон и стерильный комбинезон, касаясь только внутренней части материала халата и следя за тем, чтобы горловина капюшона была заправлена внутрь комбинезона, чтобы создать полную герметичность. Наденьте вторичные стерильные бахилы. Обеззараживайте перчатки 70% sIPA между каждым этапом надевания.
- Убедитесь, что халат был надет надлежащим образом, обеззаразьте перчатки 70% sIPA и войдите в пространство ISO7.
ПРИМЕЧАНИЕ: Периодически проверяйте материал халата на целостность. В случае компрометации немедленно выйдите из чистой комнаты и снова оденьтесь.
- Надевание шкафа биологической безопасности (BSC)
- Оденьтесь в соответствии с шагом 1.1 выше с этими дополнительными практиками.
- Соберите стерильные перчатки и стерильные рукава. Очистите BSC в соответствии с шагом 1.4 и разместите материалы в соответствии с шагом 1.5. Обеззаразьте перчатки 70% sIPA.
- Асептически наденьте стерильные рукава поверх комбинезона, используя петли для большого пальца, если таковые имеются. Наденьте стерильные перчатки поверх существующих перчаток, убедившись, что манжета перчатки налегает на стерильный рукав. Обеззараживайте перчатки 70% sIPA между каждым шагом. Войдите в BSC.
ПРИМЕЧАНИЕ: Периодически проверяйте материал халата на целостность. В случае компрометации немедленно выйдите из чистой комнаты и снова оденьтесь.
- Отказ от материалов для одежды
- Выйдите из BSC и осторожно снимите верхнюю пару перчаток и стерильные рукава. Обеззараживайте внутренние перчатки 70% sIPA.
- Войдите во второстепенную, а затем в основную прихожую, ожидая, пока дверь полностью закроется между каждым шагом. Удалите материалы в следующем порядке: внешние стерильные бахилы, комбинезон, капюшон и маска для лица.
- Выйдите из основной прихожей и снимите нестерильный халат.
ПРИМЕЧАНИЕ: Порядок удаления в неклассифицированном пространстве не важен; Однако внутренние нестерильные бахилы должны оставаться на обуви в чистых помещениях для хранения в неклассифицированных помещениях. - Продезинфицируйте руки дезинфицирующим средством для рук на спиртовой основе и вернитесь к уличной одежде.
- Очистка поверхностей чистых помещений и BSC
- Соберите ручную чистящую швабру или приобретите чистую салфетку с низким ворсом. Если вы используете салфетку с низким ворсом, сложите салфетку на четвертинки и чередуйте каждую поверхность. Пропитайте головку швабры или салфетку с низким содержанием ворса одобренным дезинфицирующим средством.
- Работая сзади вперед (или сверху вниз), очистите BSC с помощью перекрывающихся салфеток в следующем порядке: решетка диффузора HEPA (верхняя часть BSC), задняя стенка BSC, обе боковые стенки BSC, створка и рабочая поверхность. Наконец, протрите створку BSC, используя 70% sIPA, чтобы удалить остатки дезинфицирующего средства. На рисунке 1 показана типичная схема очистки BSC.
- Размещение материалов и оборудования в классифицированных средах
- Обеззараживание (т.е. стадирование) всех материалов, требующих переноса из неклассифицированной или менее классифицированной области в зону с более высокой классификацией (например, из пространства ISO8 в ISO7), чтобы свести к минимуму перенос микробов. Перенос материалов между областями одного и того же уровня классификации ISO не требует постановки.
ПРИМЕЧАНИЕ: Если материалы были окончательно стерилизованы и находятся в нескольких пакетах, снимите внешний пакет/пакет и переместите материал в классифицированное пространство; Протирание внутренней сумки/сумки не требуется. - Приобретите салфетку с низким ворсом и сложите салфетку на четвертинки, чтобы повернуть на чистую сторону, когда салфетка испачкается. Пропитайте салфетку 70% sIPA или одобренным дезинфицирующим средством.
- Протрите внешнюю поверхность материала/оборудования с помощью салфеток внахлест. Убедитесь, что все области предмета протерты, включая внутреннюю часть раздвижных уплотнений упаковки и углубления / углубления на оборудовании и других расходных материалах неправильной формы. Для оборудования на колесах убедитесь, что все колесо было протерто в процессе этапирования (возможно, потребуется аккуратно опрокинуть оборудование, чтобы колеса можно было вращать).
- Обеззараживание (т.е. стадирование) всех материалов, требующих переноса из неклассифицированной или менее классифицированной области в зону с более высокой классификацией (например, из пространства ISO8 в ISO7), чтобы свести к минимуму перенос микробов. Перенос материалов между областями одного и того же уровня классификации ISO не требует постановки.

Рисунок 1: Пример схемы очистки BSC. Работая сзади вперед (или сверху вниз), очистите BSC с помощью перекрывающихся салфеток в следующем порядке: решетка диффузора HEPA (верхняя часть BSC), задняя стенка BSC, обе боковые стенки BSC, створка и рабочая поверхность. Наконец, протрите створку BSC, используя 70% sIPA, чтобы удалить остатки дезинфицирующего средства. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Экологический мониторинг (ЭМ)
- Жизнеспособный отбор проб поверхности
- Разместите материалы, необходимые для сеанса отбора проб в соответствии с шагом 1.5, и поместите в классифицированное пространство в соответствии с разделом 1.
ПРИМЕЧАНИЕ: Отбор проб с поверхности должен быть выполнен до отбора проб воздуха в любом указанном месте. Если вы используете несколько планшетов для отбора проб поверхности, не отбирайте пробы в одном и том же месте. Используйте контактные пластины для отбора проб плоских поверхностей только для того, чтобы обеспечить полный контакт и избежать возможного повреждения агара. - Соберите и пометьте одну пластину триптического соевого агара с лецитиназой и твином (TSALT) и одну пластину с декстрозой Сабуро с лецитиназой и твином (SABLT) для каждого участка отбора проб. Придерживая дно тарелки одной рукой, асептически снимите крышку, стараясь не задеть приподнятую поверхность агара.
- Прикоснитесь поднятым агаром к поверхности, на которую идет проба, убедившись, что вся поверхность соприкасается, и сильно надавите на пластину. Оставьте пластину в контакте с поверхностью не менее чем на 5 с.
- КРИТИЧЕСКИ: Не перемещайте пластину вбок по отбираемой поверхности, так как это может распространить потенциальный рост по площади поверхности, что затруднит разрешение отдельных колоний. Не прикладывайте чрезмерных усилий к контактной пластине во время отбора проб, так как поверхность агара может треснуть.
- Асептически замените крышку, стараясь не касаться приподнятой поверхности агара. Зафиксируйте крышку на месте, если контактная пластина имеет систему блокировки. Очистите зону отбора проб 70% sIPA, чтобы удалить с поверхности остатки среды. Неплотно упакуйте тарелки и инкубируйте культуры, как описано в таблице 1. Репрезентативное изображение, показывающее рост трех колониеобразующих единиц (КОЕ) с двумя различными морфологиями колоний на планшете для отбора проб поверхности TSALT, проиллюстрировано на рисунке 2. На рисунке 3 показано загрязнение пластины TSALT с ростом на краю пластины, что связано с плохой асептической техникой во время отбора проб.
- Разместите материалы, необходимые для сеанса отбора проб в соответствии с шагом 1.5, и поместите в классифицированное пространство в соответствии с разделом 1.
- Жизнеспособный отбор проб воздуха
- Разместите материалы, необходимые для сеанса отбора проб в соответствии с шагом 1.5, и поместите в классифицированное пространство в соответствии с разделом 1.
- Соберите и промаркируйте одну пластину триптического соевого агара (TSA) и одну пластину с декстрозным агаром Сабуро (SAB) для каждого участка отбора проб. Подготовьте пробоотборник воздуха, асептически сняв пробоотборную головку, взявшись только за внешний край, чтобы избежать загрязнения головки.
- Держа пробоотборную головку в одной руке, асептически поместите среду в пластинчатый держатель на пробоотборнике. Если есть зубец, который длиннее других, сначала вставьте среду в более длинный зубец, а затем вставьте пластину в оставшиеся зубцы, чтобы закрепить пластину.
- Асептически снимите крышку пластины и поместите ее на очищенную поверхность в стороне, пока отбор проб не будет завершен. Асептически замените и закрепите пробоотборную головку, держась только за внешний край, чтобы избежать загрязнения головки. Повторите шаги 2.2.2-2.2.4 для оставшейся среды, если используется многоголовый пробоотборник воздуха.
- Поместите пробоотборник воздуха в место отбора проб так, чтобы пробоотборные головки были направлены в преобладающем направлении движения воздушного потока. Убедитесь, что выхлопные газы из нежизнеспособного пробоотборника воздуха (при одновременном отборе проб) не мешают жизнеспособному пробоотборнику. Убедитесь, что пробоотборник воздуха настроен на проверенные настройки, и запустите цикл отбора проб.
- Когда цикл отбора проб будет завершен, асептически извлеките пробоотборную головку из пробоотборника, взявшись только за внешний край, чтобы избежать загрязнения головки. Держите пробоотборную головку в одной руке и асептически закройте крышку агаровой пластины. Извлеките тарелку из держателя тарелки. Неплотно упакуйте тарелки и инкубируйте культуры, как описано в таблице 1.
- Продезинфицируйте пробоотборную головку и область вокруг держателя пластины 70% sIPA. Асептически закрепите пробоотборную головку, взявшись только за внешний край. Повторите шаги 2.2.6 и 2.2.7 для оставшейся среды при использовании многоголового пробоотборника воздуха.
ПРИМЕЧАНИЕ: На рисунке 4 показана активная культура отбора проб воздуха TSA, рост которой вызван загрязненной пробоотборной головкой. И наоборот, на рисунке 5 представлена активная культура отбора проб воздуха TSA без роста. На изображении видны углубления от удара воздуха от пробоотборной головки.
- Нежизнеспособный отбор проб
- Выполняйте нулевую проверку на лазерном счетчике частиц перед отбором проб для каждого дня использования. Прикрепите изокинетическую головку к отверстию для отбора проб счетчика частиц либо непосредственно, либо прикреплите к отрезку трубки по мере необходимости для места отбора проб.
- Если применяется трубка, используйте короткую длину, потому что трубка длиной >1 м может вызвать проблемы с перечислением частиц размером ≥1 мкм, а также может привести к ненужным изгибам трубки. Убедитесь, что счетчик частиц настроен на проверенные параметры. Рекомендуется установить задержку примерно в 30 с, чтобы обеспечить выход из зоны отбора проб во избежание нарушения воздушного потока во время отбора проб.
- Расположите изокинетическую головку лазерного счетчика частиц в месте отбора проб так, чтобы изокинетическая головка была обращена в преобладающее направление движения воздушного потока. Убедитесь, что выхлопные газы из жизнеспособного пробоотборника воздуха (при одновременном отборе проб) не мешают нежизнеспособному пробоотборнику. Для областей, где воздушный поток не является однонаправленным или схема воздушного потока неизвестна, убедитесь, что изокинетическая головка обращена вертикально вверх.
ПРИМЕЧАНИЕ: Если ротационное дезинфицирующее средство или 70% sIPA были распылены рядом с пробоотборником воздуха, подождите не менее 5 минут перед началом цикла отбора проб. - Запустите цикл отбора проб и медленно выйдите из зоны отбора проб, чтобы не нарушить воздушный поток.
КРИТИЧЕСКИ: Не распыляйте жидкости рядом с пробоотборником воздуха во время цикла отбора проб, так как это приведет к большому количеству нежизнеспособных веществ. - Когда отбор проб будет завершен, извлеките лазерный счетчик частиц. Запишите среднее количество частиц для 0,5 мкм. Некоторые объекты также могут отслеживать и отслеживать тренд 5,0 мкм.
- Повторите шаги 2.3.3-2.3.6 для следующего места отбора проб. При перемещении между помещениями или BSC протрите нежизнеспособный пробоотборник частиц снаружи 70% sIPA или одобренным дезинфицирующим средством. Избегайте попадания дезинфицирующего средства внутрь изокинетической головки, так как это может привести к неточному подсчету частиц.
| Категория | Медиа | Условия выращивания | Наблюдение за культурой | Результаты | ||||||
| Экологический мониторинг | TSA (жизнеспособный воздух) | 30 °C -35 °C, воздух, не менее 3 дней | Окончание инкубации | Группа контроля качества каждого объекта должна установить пределы оповещения и действий для каждого типа и места отбора проб. Предельные значения действия жизнеспособных образцов на основе классификации ИСО можно определить с помощью PIC/S 009-16 (Приложения) 18 и ISO-14644-1 7. Предельные значения действия для нежизнеспособных проб воздуха обычно устанавливаются в процентах от предела ISO (например, 99%). Предельные значения предупреждений для жизнеспособных образцов обычно устанавливаются в процентах от предела действия или предела ISO (например, 95%). Обратитесь к PDA TR-13 и USP<1116> для получения более подробной информации об установлении уровней оповещения и действий, а также о проверке выбранных условий культуры 8,9. | ||||||
| SAB (жизнеспособный воздух) | 20 °C -25 °C, воздух, не менее 7 дней | |||||||||
| ТСОЛЬ (жизнеспособная поверхность) | 30 °C -35 °C, воздух, не менее 3 дней | Репрезентативные изображения ЭМ-пластин показаны на рисунках 2, 3, 4 и 5. | ||||||||
| SABLT (жизнеспособная поверхность) | 20 °C -25 °C, воздух, не менее 7 дней | |||||||||
| Мониторинг технологического процесса | TSA (отстойная плита) | 30 °C -35 °C, воздух, не менее 3 дней | Только для информации. Предоставляет полезную информацию в случае расследования OOS в ответ на неудачный тест продукта на стерильность. | |||||||
| SAB (отстойная плита) | 20 °C -25 °C, воздух, не менее 7 дней | На рисунке 6 приведен пример положительной отстойной пластины. | ||||||||
| Отбор проб кончиками пальцев в перчатках | ТСОЛЬ | 30 °C -35 °C, воздух, не менее 48 часов в день, а затем 20 °C -25 °C в течение не менее 5 дней 19. | Критерием приемлемости для СГФ является <1 КОЕ/тарелка (т.е. без роста) в соответствии с PIC/S 009-16 (Приложения) 18. Критерии приемлемости могут быть изменены по усмотрению ОК. | |||||||
| Тестирование продукта на стерильность | БСЭ (USP<71>) | 20 °C -25 °C, воздух, не менее 14 дней | Периодически в течение инкубационного периода (дни 3, 5, 7 и 14) | Никакого роста. | ||||||
| FTM (USP<71>) | 30 °C -35 °C, воздух, не менее 14 дней | |||||||||
| iFA+ (метод NIH) | 30 °C -35 °C, воздух, не менее 14 дней | Автоматический мониторинг с помощью прибора BacT/ALERT Dual-T. Настоятельно рекомендуется визуальная проверка каждой бутылки в конце инкубации на наличие шариков плесени. | На рисунке 8 приведен пример видимых шариков формы, которые не были автоматически обнаружены BacT/ALERT. | |||||||
| iFN+ (метод NIH) | ||||||||||
| SAB (метод NIH) | 20 °C -25 °C в течение не менее 14 дней | Периодически в течение инкубационного периода (дни 3, 5, 7 и 14) | ||||||||
Таблица 1: Краткое изложение рекомендуемых условий культивирования и ожидаемых результатов. Условия культуры, описанные здесь, являются рекомендациями, основанными на утвержденной программе, используемой в NIH. Каждый конечный пользователь должен утвердить свою собственную программу микробиологического тестирования. Стратегии микробного контроля и тестирования могут различаться в разных институтах в зависимости от переменных, включая конструкцию объекта, флору объекта и классификацию риска продукта.
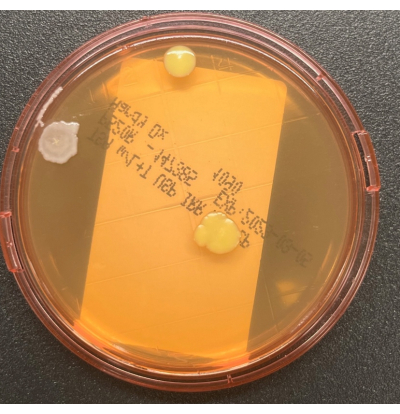
Рисунок 2: Рост на пластине TSALT. Планшет для отбора проб поверхности TSALT, показывающий три КОЕ двух различных морфологий колоний. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
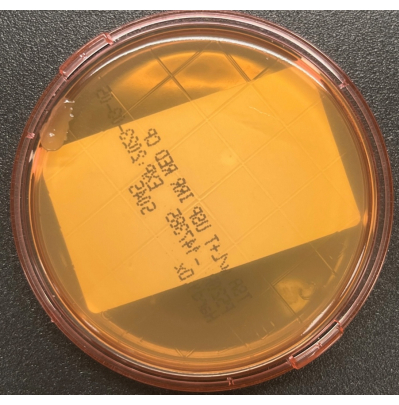
Рисунок 3: Загрязнение пластины TSALT во время сбора. Поверхностная культура TSALT показывает одну колонию на краю пластины, что свидетельствует о плохой асептической обработке во время процесса отбора проб. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Культура, полученная с помощью головки для отбора проб загрязненного воздуха. Пример культуры активного отбора проб воздуха TSA, показывающий >100 колониеобразующих единиц (КОЕ) смешанной морфологии. Характер роста указывает на загрязнение пробоотборной головки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Отсутствие роста на активной жизнеспособной воздушной пластине TSA. Активная жизнеспособная воздушная пластина TSA, иллюстрирующая отсутствие роста после инкубации. На изображении видны отступы от активной головки пробоотборника воздуха. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Мониторинг процесса
- Отстойники (пассивный контроль воздуха)
- Разместите таблички с маркировкой TSA и SAB рядом с рабочей зоной, но в зоне, которая не будет мешать тестированию. Задокументируйте время начала отбора проб и асептически откройте обе пластины, положив крышки на чистую поверхность в BSC вдали от рабочей зоны.
- Отстойники могут быть открыты в течение максимум 4 часов, чтобы предотвратить высыхание агара. Закройте крышки тарелок по окончании обработки. Неплотно упакуйте тарелки и инкубируйте культуры, как описано в таблице 1. На рисунке 6 показана одна колония загрязняющих веществ на пластине для отстаивания воздуха TSA.
- Отбор проб кончиками пальцев в перчатках (GFS)
- Приобретите две тарелки TSALT с маркировкой. Осторожно снимите крышку одной пластины и поместите ее на чистую рабочую поверхность вдали от зоны отбора проб.
- Аккуратно проведите подушечкой каждого пальца и большим пальцем одной руки по поверхности тарелки (рисунок 7). Возьмите образец наибольшей площади поверхности каждого пальца / большого пальца, а не кончика. Приложите достаточную силу, чтобы сделать небольшие углубления на агаре, не растрескивая поверхность агара.
- Асептически поместите крышку обратно на тарелку и повторите шаг 3.2.2 для другой стороны. Продезинфицируйте руки 70% sIPA по завершении отбора проб. Неплотно упакуйте тарелки и инкубируйте культуры, как описано в таблице 1.
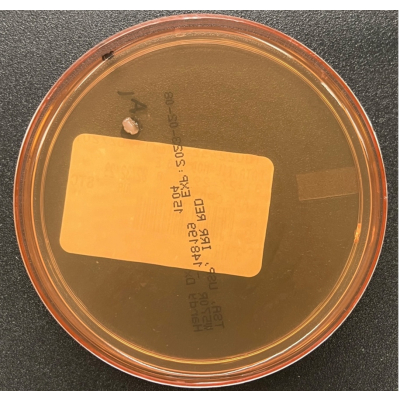
Рисунок 6: Рост на пластине для отстаивания воздуха TSA. Пластина для отстаивания воздуха TSA, иллюстрирующая одну колонию загрязняющего вещества, культивируемого во время пассивного мониторинга воздушного процесса в BSC. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7: Отбор проб кончиками пальцев в перчатках. Правильный метод получения образцов кончиков пальцев в перчатках с использованием наибольшей площади поверхности (или подушечки) каждого пальца / большого пальца показан слева. Справа показан неправильный процесс, при котором отбирается только кончик пальца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Испытание на стерильность путем прямой инокуляции продукта
- Прямая инокуляция после USP<71>
- Приобретите одну маркированную бутылку триптического соевого бульона (TSB) и одну бутылку с меченой жидкой тиогликолатной средой (FTM) для каждого представленного тестового изделия. Для сеанса тестирования приобретите одну пластину TSALT и одну SABLT для жизнеспособного отбора проб поверхности, одну пластину TSA и одну пластину SAB для отстойных пластин и две пластины TSALT для GFS.
- Халат для работы внутри BSC в соответствии с шагом 1.2. Очистите BSC в соответствии с шагом 1.4. Поместите материалы в BSC в соответствии с шагом 1.5. Выполните контактный отбор проб критической рабочей зоны в соответствии с шагом 2.1, протерев поверхность 70% sIPA после отбора проб. Подготовьте отстойники TSA и SAB рядом с рабочей зоной в соответствии с шагом 3.1.
- Получите тестовое изделие и связанные с ним бутылки TSB и FTM. Если на бутылках TSB и FTM есть перегородка, снимите защитные колпачки с каждой бутылки и протрите перегородку стерильной спиртовой салфеткой. Если бутылки TSB и FTM имеют завинчивающуюся крышку, ослабьте крышку бутылок (но не снимайте крышку).
- Вихрите испытуемое изделие, чтобы обеспечить однородную суспензию. Инокулируйте флаконы утвержденным объемом исследуемого изделия (до 10 мл/флакон) с помощью стерильного шприца и иглы для подкожных инъекций (для колпачков перегородки) или пипетки (для завинчивающихся крышек).
- После инокуляции протрите перегородку стерильной спиртовой салфеткой и вставьте стерильный вентиляционный блок, чтобы обеспечить воздухообмен во время инкубации. Для бутылок с завинчивающейся крышкой закройте бутылку, но оставьте крышку от 1/4 до 1/2 открытой, чтобы обеспечить воздухообмен во время инкубации. Повторите шаги 4.1.3-4.1.5 для каждого тестового изделия, которое будет тестироваться в рамках этого сеанса.
- Асептически закройте отстойники TSA и SAB и задокументируйте время окончания отбора проб. Выполните GFS в соответствии с шагом 3.2, протирая перчатки 70% sIPA после отбора проб. Неплотно упакуйте тарелки и инкубируйте культуры, как описано в таблице 1.
- Перенесите все тестовые материалы из BSC и очистите BSC в соответствии с шагом 1.4.
- Прямая инокуляция в соответствии с альтернативным методом тестирования стерильности NIH
- Получите одну маркировку i FA+, одну маркировку iFN+ и одну пластину SAB для каждого испытуемого изделия. Для сеанса тестирования приобретите одну пластину TSALT и одну SABLT для жизнеспособного отбора проб поверхности, одну пластину TSA и одну пластину SAB для отстойных пластин и две пластины TSALT для GFS.
- Халат для работы внутри BSC в соответствии с шагом 1.2. Очистите BSC в соответствии с шагом 1.4. Поместите материалы в BSC в соответствии с шагом 1.5. Выполните контактный отбор проб критической рабочей зоны в соответствии с шагом 2.1, протерев поверхность 70% sIPA после отбора проб. Подготовьте отстойники TSA и SAB рядом с рабочей зоной в соответствии с шагом 3.1.
- Получите тестовое изделие и связанную с ним пластинуi FA+, iFN+ и SAB. Снимите защитные колпачки с флаконов i FA+ и iFN+ и протрите перегородку стерильной спиртовой салфеткой.
- Вихрите испытуемое изделие, чтобы обеспечить однородную суспензию. Инокулируйте флаконы утвержденным объемом исследуемого изделия (до 10 мл/флакон) с помощью стерильного шприца и иглы для подкожных инъекций. После прививки протрите перегородку стерильной спиртовой салфеткой. Инкубируйте бутылки на приборе BacT/ALERT Dual-T, как описано в таблице 1.
- С помощью пипеттора инокулируйте планшет SAB утвержденным количеством исследуемого изделия (не более 500 мкл / планшет) и сделайте полосу для изоляции с помощью стерильной петли. Дайте постоять 10 минут, чтобы убедиться, что образец не попадет на крышку пластины при переворачивании для инкубации. Поместите каждую пластину SAB, инокулированную испытуемым изделием, в полиэтиленовый пакет, неплотно завяжите и инкубируйте, как описано в таблице 1.
- Асептически закройте отстойники TSA и SAB и задокументируйте время окончания отбора проб. Выполните GFS, как описано в шаге 3.2, протерев перчатки 70% sIPA после отбора проб. Неплотно упакуйте тарелки и инкубируйте культуры, как описано в таблице 1. Визуальный осмотр бутылок BacT/ALERT в конце инкубационного периода необходим для обнаружения шариков плесени, которые могли остаться незамеченными прибором (рис. 8).
- Перенесите все тестовые материалы из BSC и очистите BSC в соответствии с шагом 1.4.
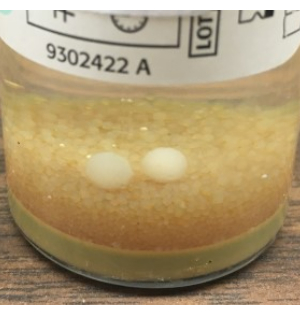
Рисунок 8: Рост плесени, который не был обнаружен BacT/ALERT. Пример шариков плесени, видимых невооруженным глазом, которые не были автоматически обнаружены системой BacT/ALERT. Основываясь на этих результатах, мы рекомендуем окончательный визуальный осмотр всех бутылок BacT / ALERT и добавление пластины SAB для грибковой культуры с использованием альтернативного метода тестирования стерильности NIH. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Ожидаемые результаты описаны в таблице 1. Данные EM должны быть проанализированы и сопровождаться соответствующим расследованием и реакцией на действия, оповещения или отклонения от ограничений ISO. Если происходит отклонение для нежизнеспособных частиц, следует действовать в...
Обсуждение
В этом протоколе есть несколько критических областей, в том числе поддержание асептической техники и однонаправленного воздушного потока в чистых помещениях и BSC. Лучшие практики включают в себя медленное и преднамеренное движение, чтобы свести к минимуму турбулентность. Асептически?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана Программой внутренних исследований Клинического центра Национального института здравоохранения. Содержание является исключительной ответственностью авторов и не отражает официальную точку зрения Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| 20-25°C Incubator | Lab preference | ||
| 30-35°C Incubator | Lab preference | ||
| Alcohol-based hand sanitizer | Lab preference | ||
| BacT/ALERT Dual-T instrument | BioMerieux Industry | ||
| Beard cover | Lab preference | ||
| Biosafety cabinet (BSC) | Lab preference | ||
| Cleanroom shoes | Lab preference | ||
| Fluidthioglycollate medium (FTM) | Hardy Diagnostics | U84 | USP |
| Handheld cleaning mop | Contec | 2665LF | |
| Hypodermic needle | Lab preference | ||
| iFA+ BacT/ALERT bottle | Biomerieux | 412990 | |
| iFN+ BacT/ALERT bottle | Biomerieux | 412991 | |
| Isokinetic head | Lab preference | ||
| Laser particle counter | TSI Incorporated | 9500-01 | |
| LpH III | Steris | 1S16CX | |
| Mirror | Lab preference | ||
| Non-sterile bouffant | Lab preference | ||
| Non-sterile gloves | Lab preference | ||
| Non-sterile shoe covers | Lab preference | ||
| Non-sterile sleeve covers | Lab preference | ||
| Parafilm | Lab preference | ||
| Peridox RTU | Contec | CR85335IR | |
| Plastic bag | Lab preference | ||
| Sabouraud Dextrose Agar with Lecithinase and Tween (SABLT) | Hardy Diagnostics | P595 | USP, irradiated |
| Sabouraurd Dextrose Agar (SAB) | Hardy Diagnostics | W565 | USP, irradiated |
| Safety glasses | Lab preference | ||
| Scrubs (top and bottom) | Lab preference | ||
| Spor-Klenx RTU | Steris | 6525M2 | |
| Sterile 70% isopropyl alcohol (IPA) | Decon CiDehol | 8316 | |
| Sterile alcohol wipe | Lab preference | ||
| Sterile boot covers | Kimberly Clark | Cat# varies based on size | |
| Sterile coveralls | Kimberly Clark | Cat# varies based on size | |
| Sterile face mask | Lab preference | ||
| Sterile gloves | Lab preference | ||
| Sterile hood | Kimberly Clark | Cat# varies based on size | |
| Sterile low-lint wipes | Texwipe | TX3210 | |
| Sterile mop cleaning pads | Contec | MEQT0002SZ | |
| Sterile sleeve covers | Kimberly Clark | 36077 | |
| Sterile spreading rod | Fisher Scientific | 14665231 | |
| Sterile syringe | Lab preference | ||
| Tacky mats | Lab preference | ||
| Tryptic Soy Agar (TSA) | Hardy Diagnostics | W570R | USP, irradiated |
| Tryptic Soy Agar with Lecithinase and Tween (TSALT) | Hardy Diagnostics | P520R | USP, irradiated |
| Tryptic Soy Broth (TSB) | Hardy Diagnostics | U46 | USP |
| Tubing | Lab preference | ||
| Vesphene III | Steris | 1S15CX | |
| Viable air sampler | Hardy Diagnostics | BAS22K | |
| Vortex | Lab preference |
Ссылки
- Cundell, T., Atkins, J. W., Lau, A. F. Sterility testing for hematopoietic stem cells. Journal of Clinical Microbiology. , (2023).
- United States Food and Drug Administration. Guidance for Industry. Sterile Drug Products Produced by Aseptic Processing - Current Good Manufacturing Practice. United States Food and Drug Administration. , (2004).
- United States Pharmacopeia - National Formulary. USP<71> Sterility Tests in USP43-NF38. United States Pharmacopeia - National Formulary. , (2022).
- England, M. R., Stock, F., Gebo, J. E. T., Frank, K. M., Lau, A. F. Comprehensive evaluation of compendial USP<71>, BacT/Alert Dual-T, and Bactec FX for detection of product sterility testing contaminants. Journal of Clinical Microbiology. 57 (2), 01548 (2019).
- Gebo, J. E. T., East, A. D., Lau, A. F. A side-by-side comparison of clinical versus current good manufacturing practices (cGMP) microbiology laboratory requirements for sterility testing of cellular and gene therapy products. Clinical Microbiology Newsletter. 43 (21), 181-191 (2021).
- Gebo, J. E. T., Lau, A. F. Sterility testing for cellular therapies: What is the role of the clinical microbiology laboratory. Journal of Clinical Microbiology. 58 (7), 01492 (2020).
- International Organization for Standardization. ISO 14644-1:2015 Cleanrooms and associated controlled environments - Part 1: Classification of air cleanliness by particle concentration. International Organization for Standardization. , (2015).
- Parenteral Drug Association. PDA Technical Report No. 13 Revised 2022 (TR 13) Fundamentals of an Environmental Monitoring Program. Parenteral Drug Association, Inc. , (2022).
- United States Pharmacopeia - National Formulary. USP<1116> Microbiological Evaluation of Cleanrooms and Other Controlled Environments in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Guinet, R., et al. Multicenter study on incubation conditions for environmental monitoring and aseptic process simulation. PDA journal of pharmaceutical science and technology. 71 (1), 43-49 (2017).
- Gordon, O., Berchtold, M., Staerk, A., Roesti, D. Comparison of different incubation conditions for microbiological environmental monitoring. PDA Journal of Pharmaceutical Science and Technology. 68 (5), 394-406 (2014).
- Anders, H. J., et al. Multisite qualification of an automated incubator and colony counter for environmental and bioburden applications in pharmaceutical microbiology. PDA Journal of Pharmaceutical Science and Technology. , (2022).
- United States Pharmacopeia - National Formulary. USP<1072> Disinfectants and Antiseptics. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. USP<1071> Rapid Microbial Tests for Release of Sterile Short-Life Products: A Risk-Based Approach in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. PUSP<1223> Validation of Alternative Microbiological Methods in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Parenteral Drug Association. PDA Technical Report No. 33, Revised 2013 (TR 33) Evaluation, Validation and Implementation of Alternative and Rapid Microbiological Methods. Parenteral Drug Association, Inc. , (2013).
- Putnam, N. E., Lau, A. F. Comprehensive study identifies a sensitive, low-risk, closed-system model for detection of fungal contaminants in cell and gene therapy products. Journal of Clinical Microbiology. 59 (11), 0135721 (2021).
- Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation. Guide to Good Manufacturing Practice for Medicinal Products Annexes (PE 009-16 (Annexes)). Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation Scheme. , (2022).
- United States Pharmacopeia - National Formulary. USP<825> Radiopharmaceuticals - Preparation, Compounding, Dispensing, and Repackaging in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены