É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Estratégias de Controle e Monitoramento Microbiano para Ambientes de Salas Limpas e Terapias Celulares
Neste Artigo
Resumo
O protocolo resume as melhores práticas para minimizar a carga biológica microbiana em um ambiente de sala limpa e inclui estratégias como monitoramento ambiental, monitoramento de processo e teste de esterilidade do produto. É relevante para instalações de fabricação e teste que são necessárias para atender aos padrões atuais de boas práticas de tecidos e aos padrões atuais de boas práticas de fabricação.
Resumo
Um programa bem validado e holístico que incorpore medidas robustas de avental, limpeza, monitoramento ambiental e monitoramento de pessoal é fundamental para minimizar a carga biológica microbiana em suítes de fabricação de terapia celular e nos laboratórios de teste correspondentes para garantir que as instalações estejam operando em um estado de controle. Garantir a segurança do produto por meio de medidas de controle de qualidade, como testes de esterilidade, é um requisito regulatório tanto para células, tecidos e produtos à base de células celulares e tecidos (seção 361) minimamente manipulados (seção 361) e mais do que minimamente manipulados (seção 351) de células, tecidos e produtos à base de células e tecidos (HCT/Ps). Neste vídeo, fornecemos um guia passo a passo sobre como desenvolver e incorporar as melhores práticas assépticas para operar em um ambiente de sala limpa, incluindo avental, limpeza, estadiamento de materiais, monitoramento ambiental, monitoramento de processos e testes de esterilidade de produtos usando inoculação direta, fornecidos pela Farmacopeia dos Estados Unidos (USP<71>) e pelo Método de Teste de Esterilidade Alternativa do National Institutes of Health (NIH). Este protocolo pretende ser um guia de referência para estabelecimentos que se espera que atendam às atuais boas práticas teciduais (cGTP) e boas práticas de fabricação atuais (cGMP).
Introdução
A implementação de um forte programa de monitoramento microbiano por meio de monitoramento ambiental (ME), monitoramento de processos e testes de esterilidade de produtos é um requisito regulatório para as atuais boas práticas teciduais (cGTP) e boas práticas de fabricação atuais (cGMP) em laboratórios de terapia celular1. Além disso, a Food and Drug Administration (FDA) dos Estados Unidos espera que o laboratório que realiza os testes de controle de qualidade (CQ) do produto também empregue instalações e controles comparáveis aos utilizados para operações de enchimento asséptico2.
Esse protocolo tem quatro seções principais: 1) Práticas assépticas, incluindo avental de pessoal, limpeza e preparação de materiais; 2) EM, incluindo culturas de ar e superfície viáveis e monitoramento do ar de partículas não viáveis; 3) monitoramento do processo, incluindo placas de assentamento e amostragem da ponta do dedo enluvado; e 4) teste de esterilidade do produto através do compêndio United States Pharmacopeia (USP) <71> método3 ou do NIH Alternative Sterility Testing Method4. Quando usadas em conjunto, essas medidas podem ser um método eficaz para garantir que uma instalação permaneça em estado de controle.
As técnicas aqui descritas não são novas; No entanto, os padrões atuais de reguladores e organizações profissionais carecem de detalhes, o que tem levado à ausência de monitoramento microbiano ou à implementação de práticas não padronizadas, particularmente em centros acadêmicos onde a fabricação no local e os testes de esterilidade do produto estão surgindo em um ritmo rápido 1,5,6 . Esse protocolo pode ser usado como um guia para criar um programa de monitoramento e controle microbiano que atenda aos requisitos regulatórios quando usado em conjunto com a validação do usuário final e avaliações de risco.
Protocolo
1. Práticas assépticas
- Vestido de pessoal para um espaço de sala limpa
NOTA: Este procedimento baseia-se na colocação inicial de batas num espaço não classificado, seguido da entrada numa área da International Organization for Standardization (ISO) 8 e, em seguida, numa área ISO7. Este procedimento é relevante para laboratórios que tentam converter o espaço existente em uma função de sala limpa. Idealmente, todo o vestido inicial ocorreria em um espaço classificado ISO8 (não em um espaço não classificado).- Fixe os cabelos soltos. Lave as mãos e transforme-se em esfoliantes (esfoliantes de manga comprida e calças de esfoliação de comprimento total são preferíveis). Reúna e troque em sapatos de sala limpa com capas de sapatos.
- Higienizar as mãos usando um desinfetante para as mãos à base de álcool inicialmente e depois novamente entre cada uma das seguintes etapas: usar luvas não estéreis e, em seguida, uma capa para barba (para qualquer quantidade de pelos faciais visíveis), se aplicável. Don um bufante não estéril e cubra os antebraços com mangas não estéreis se não tiverem sido usados tops de manga comprida.
- Remova as capas do sapato, pisando no tapete pegajoso em frente à porta da antessala ISO8 com cada pé depois que a capa do sapato tiver sido removida. Certifique-se de que todo o pé faça contato com o tapete pegajoso antes da entrada. Descarte as capas dos sapatos e descontamine as luvas e maçanetas com álcool isopropílico (sIPA) 70% estéril. Entre na antessala ISO8.
- Reúna um capuz estéril, máscara facial estéril, macacões estéreis, capas de botas estéreis e óculos de segurança. Descontaminar as luvas com 70% de sIPA. Use óculos de segurança e coloque os materiais em uma superfície limpa, conforme etapa 1.5.
- Use um novo par de capas de sapatos não estéreis sobre os sapatos dedicados à sala limpa e pise no tapete cafona em frente à antessala secundária. Certifique-se de que a totalidade de cada pé faz contato com o tapete pegajoso. Descontaminar as luvas com 70% de sIPA. Reúna os suprimentos de vestimenta encenados e entre na antessala secundária ISO7, permanecendo no lado sujo da linha de demarcação.
- Use o capuz estéril e o macacão estéril, tocando apenas o interior do material do vestido e garantindo que o pescoço do capuz esteja enfiado dentro do capote para criar uma vedação completa. Don as tampas de bota estéreis secundárias. Descontaminar as luvas com 70% de sIPA entre cada etapa de doação.
- Verifique se o avental foi vestido adequadamente, descontamine as luvas com 70% de sIPA e entre no espaço ISO7.
NOTA: Inspecione periodicamente o material do vestido quanto à integridade. Se comprometido, saia imediatamente da sala limpa e volte a vestir.
- Donning para um gabinete de segurança biológica (BSC)
- Vestido conforme etapa 1.1 acima com essas práticas adicionais.
- Reúna luvas estéreis e mangas estéreis. Limpe o BSC conforme o passo 1.4 e prepare os materiais conforme o passo 1.5. Descontaminar as luvas com 70% de sIPA.
- Utilize assepticamente mangas estéreis sobre o macacão, usando alças de polegar, se houver. Don luvas estéreis sobre as luvas existentes, garantindo que o manguito da luva se estenda sobre a manga estéril. Descontaminar as luvas com 70% de sIPA entre cada etapa. Entre no BSC.
NOTA: Inspecione periodicamente o material do vestido quanto à integridade. Se comprometido, saia imediatamente da sala limpa e volte a vestir.
- Doffing dos materiais do revestimento
- Saia do BSC e retire cuidadosamente o par superior de luvas e mangas estéreis. Descontaminar as luvas internas com 70% de sIPA.
- Entre na antessala secundária e depois primária, esperando que a porta se feche totalmente entre cada passo. Remova os materiais na seguinte ordem: tampas de botas estéreis externas, macacão, capuz e máscara facial.
- Saia da antessala primária e remova o avental não estéril.
NOTA: A ordem de remoção no espaço não classificado não é importante; no entanto, as capas internas não estéreis devem permanecer sobre os sapatos da sala limpa para armazenamento em espaços não classificados. - Higienize as mãos usando um desinfetante para as mãos à base de álcool e volte às roupas de rua.
- Limpeza das superfícies da sala limpa e do BSC
- Monte um esfregão de limpeza portátil ou obtenha um lenço limpo com fiapos baixos. Se estiver usando um lenço de fiapos baixos, dobre o lenço em quartos e gire entre cada superfície. Sature a cabeça do esfregão ou o lenço de fiapos baixos com um desinfetante aprovado.
- Trabalhando de trás para a frente (ou de cima para baixo), limpe o BSC usando lenços sobrepostos na seguinte ordem: a grade do difusor HEPA (a parte superior do BSC), a parede traseira do BSC, as duas paredes laterais do BSC, a faixa e a superfície de trabalho. Finalmente, limpe a faixa do BSC usando 70% de sIPA para remover qualquer desinfetante residual. Consulte a Figura 1 para obter um padrão típico de limpeza do BSC.
- Preparação de materiais e equipamentos em ambientes classificados
- Descontaminar (ou seja, estagiar) todos os materiais que requerem transferência de uma área não classificada ou de classificação inferior para uma área de classificação superior (por exemplo, de um espaço ISO8 para ISO7) para minimizar a transferência de micróbios. A transferência de materiais entre áreas de mesmo nível de classificação ISO não requer estadiamento.
OBS: Se os materiais tiverem sido esterilizados terminalmente e estiverem em múltiplos sacos, retirar o saco/bolsa externa e mover o material para o espaço classificado; Não é necessária a limpeza do saco/bolsa interna. - Obtenha um lenço de fiapos baixo e dobre o lenço em quartos para girar para um lado limpo à medida que o lenço fica sujo. Sature o lenço com 70% de sIPA ou um desinfetante aprovado.
- Limpe o exterior do material/equipamento usando lenços sobrepostos. Certifique-se de que todas as áreas do item sejam limpas, incluindo o interior de lacres de embalagem de retirada e recantos/recuos no equipamento e outros suprimentos de formato irregular. Para equipamentos sobre rodas, certifique-se de que toda a roda foi limpa durante o processo de preparação (o equipamento pode precisar ser suavemente inclinado para permitir que as rodas sejam giradas).
- Descontaminar (ou seja, estagiar) todos os materiais que requerem transferência de uma área não classificada ou de classificação inferior para uma área de classificação superior (por exemplo, de um espaço ISO8 para ISO7) para minimizar a transferência de micróbios. A transferência de materiais entre áreas de mesmo nível de classificação ISO não requer estadiamento.

Figura 1: Exemplo de um padrão de limpeza do BSC. Trabalhando de trás para a frente (ou de cima para baixo), limpe o BSC usando lenços sobrepostos na seguinte ordem: a grade do difusor HEPA (a parte superior do BSC), a parede traseira do BSC, as duas paredes laterais do BSC, a faixa e a superfície de trabalho. Finalmente, limpe a faixa do BSC usando 70% de sIPA para remover qualquer desinfetante residual. Clique aqui para ver uma versão maior desta figura.
2. Monitoramento ambiental (EM)
- Amostragem de superfície viável
- Colocar os materiais necessários para a sessão de amostragem, de acordo com o passo 1.5, e vestir para o espaço classificado, de acordo com o ponto 1.
NOTA: A amostragem de superfície deve ser realizada antes da amostragem do ar em qualquer local especificado. Se estiver usando várias placas para amostrar uma área, não faça uma amostragem exata do mesmo local. Use placas de contato para amostrar superfícies planas apenas para garantir o contato total e evitar possíveis danos ao ágar. - Coletar e rotular um ágar tríptico de soja com placa de lecitinase e tween (TSALT) e um ágar Sabouraud dextrose com placa de lecitinase e tween (SABLT) para cada local de amostragem. Segurando o fundo da placa com uma mão, remova assepticamente a tampa, tomando cuidado para não tocar na superfície de ágar levantada.
- Toque o ágar elevado na superfície a ser amostrada, garantindo que toda a superfície esteja em contato, e aplique pressão firme na placa. Deixe a placa em contato com a superfície por pelo menos 5 s.
- CRÍTICO: Não mover a placa lateralmente sobre a superfície a ser amostrada, pois isso pode espalhar o crescimento potencial sobre a área de superfície, dificultando a resolução de colônias individuais. Não exerça força excessiva sobre a placa de contato durante a amostragem, pois a superfície do ágar pode rachar.
- Substitua assepticamente a tampa, tomando cuidado para não tocar na superfície elevada do ágar. Bloqueie a tampa no lugar se a placa de contato tiver um sistema de travamento. Limpar a área de amostragem com 70% de sIPA para remover qualquer meio residual da superfície. Ensacar as placas com folga e incubar as culturas conforme descrito na Tabela 1. Uma imagem representativa mostrando o crescimento de três unidades formadoras de colônias (UFCs) com duas morfologias de colônias distintas em uma placa de amostragem de superfície TSALT é ilustrada na Figura 2. A Figura 3 mostra a contaminação de uma placa TSALT com crescimento na borda da placa, atribuível à má técnica asséptica durante a coleta da amostra.
- Colocar os materiais necessários para a sessão de amostragem, de acordo com o passo 1.5, e vestir para o espaço classificado, de acordo com o ponto 1.
- Amostragem de ar viável
- Colocar os materiais necessários para a sessão de amostragem, de acordo com o passo 1.5, e vestir para o espaço classificado, de acordo com o ponto 1.
- Coletar e rotular uma placa de ágar tríptico de soja (TSA) e uma placa de ágar Sabouraud dextrose (SAB) para cada local de amostragem. Prepare o amostrador de ar removendo assepticamente a cabeça de recolha de amostras, agarrando apenas a aresta exterior para evitar a contaminação da cabeça.
- Segurando a cabeça de recolha de amostras com uma das mãos, coloque assepticamente o meio no suporte da placa no amostrador. Se houver um pino mais longo do que os outros, insira o meio contra o pino mais longo primeiro e, em seguida, empurre a placa para baixo nas pontas restantes para prender a placa.
- Retire assepticamente a tampa da placa e coloque-a numa superfície limpa até que a amostragem esteja concluída. Substitua e fixe assepticamente a cabeça de amostragem, segurando apenas a borda externa para evitar a contaminação da cabeça. Repita as etapas 2.2.2-2.2.4 para o meio restante se estiver usando um amostrador de ar com várias cabeças.
- Colocar o amostrador de ar no local de recolha de amostras com as cabeças de recolha viradas para a direcção predominante do movimento do fluxo de ar. Certifique-se de que os gases de escape do amostrador de ar não viável (se a amostragem for efectuada simultaneamente) não interfiram com o amostrador viável. Certifique-se de que o amostrador de ar esteja definido para as configurações validadas e inicie o ciclo de amostragem.
- Quando o ciclo de recolha de amostras tiver sido concluído, remova assepticamente a cabeça de recolha do amostrador, agarrando apenas a aresta exterior para evitar a contaminação da cabeça. Segure a cabeça de amostragem em uma das mãos e substitua assepticamente a tampa da placa de ágar. Retire a placa do suporte da placa. Ensacar as placas com folga e incubar as culturas conforme descrito na Tabela 1.
- Desinfetar a cabeça de amostragem e a área ao redor do suporte da placa com 70% de sIPA. Fixe assepticamente a cabeça de amostragem, segurando apenas a borda externa. Repita as etapas 2.2.6 e 2.2.7 para o meio restante se estiver usando um amostrador de ar com várias cabeças.
NOTA: A Figura 4 mostra uma cultura de amostragem de ar ativa TSA com crescimento causado por uma cabeça de amostragem contaminada. Por outro lado, a Figura 5 representa uma cultura de coleta de ar ativa TSA sem crescimento. Recuos de impacto de ar da cabeça de amostragem podem ser vistos na imagem.
- Amostragem não viável
- Realizar uma verificação zero no contador de partículas a laser antes das atividades de amostragem para cada dia de uso. Fixar a cabeça isocinética à porta de recolha de amostras do contador de partículas, quer directamente quer afixada num comprimento de tubo, conforme necessário para o local de amostragem.
- Se a tubulação for aplicada, use um comprimento curto, porque a tubulação de >1 m de comprimento pode causar problemas com a enumeração de partículas de ≥1 μm e também pode levar a curvas desnecessárias no tubo. Verifique se o contador de partículas está definido para as configurações validadas. Recomenda-se definir um atraso de aproximadamente 30 s para permitir a saída da área de amostragem para evitar a interrupção do fluxo de ar durante a amostragem.
- Posicione a cabeça isocinética do contador de partículas do laser no local de amostragem com a cabeça isocinética voltada para a direção predominante do movimento do fluxo de ar. Certifique-se de que os gases de escape do amostrador de ar viável (se a amostragem for efectuada simultaneamente) não interfiram com o amostrador não viável. Para áreas onde o fluxo de ar não é unidirecional ou o padrão de fluxo de ar é desconhecido, certifique-se de que a cabeça isocinética esteja voltada verticalmente para cima.
NOTA: Se o desinfetante rotacional ou o sIPA a 70% tiver sido aerossolizado perto do amostrador de ar, aguarde pelo menos 5 minutos antes de iniciar o ciclo de amostragem. - Inicie o ciclo de amostragem e saia lentamente da área de amostragem para evitar interromper o fluxo de ar.
CRÍTICO: Não aerossolize líquidos perto do amostrador de ar durante um ciclo de amostragem, pois isso causará altas contagens inviáveis. - Quando a amostragem tiver sido concluída, recupere o contador de partículas a laser. Registre as contagens médias de partículas para 0,5 μm. Algumas instalações também podem rastrear e tende a 5,0 μm.
- Repita as etapas 2.3.3-2.3.6 para o próximo local de amostragem. Se estiver se movendo entre salas ou BSCs, limpe a parte externa do amostrador de partículas não viável com 70% de sIPA ou um desinfetante aprovado. Evite obter desinfetante dentro da cabeça isocinética, pois isso pode levar a contagens de partículas imprecisas.
| Categoria | Mídia | Condições de cultura | Observação da cultura | Resultados | ||||||
| Monitoramento ambiental | TSA (ar viável) | 30 °C-35 °C, ar, por pelo menos 3 dias | Fim da incubação | O grupo de GQ de cada instalação deve estabelecer limites de alerta e ação para cada tipo e local de amostragem. Os limites de ação para amostras viáveis com base na classificação ISO podem ser guiados usando PIC/S 009-16 (Anexos) 18 e ISO-14644-1 7. Os limites de ação para amostras de ar não viáveis são normalmente definidos como uma porcentagem do limite ISO (por exemplo, 99%). Os limites de alerta para amostras viáveis são normalmente definidos como uma porcentagem do limite de ação ou limite ISO (por exemplo, 95%). Consulte PDA TR-13 e USP<1116> para obter mais detalhes sobre o estabelecimento de níveis de alerta e ação e validação de condições de cultura selecionadas 8,9. | ||||||
| SAB (ar viável) | 20 °C-25 °C, ar, por pelo menos 7 dias | |||||||||
| TSALT (superfície viável) | 30 °C-35 °C, ar, por pelo menos 3 dias | Imagens representativas das placas EM são mostradas na Figura 2, Figura 3, Figura 4 e Figura 5. | ||||||||
| SABLT (superfície viável) | 20 °C-25 °C, ar, por pelo menos 7 dias | |||||||||
| Monitoramento de processos | TSA (placa de decantação) | 30 °C-35 °C, ar, por pelo menos 3 dias | Apenas para informação. Fornece informações úteis no caso de uma investigação de OOS em resposta a um teste de esterilidade do produto com falha. | |||||||
| SAB (placa de decantação) | 20 °C-25 °C, ar, por pelo menos 7 dias | Consulte a Figura 6 para obter um exemplo de uma placa de decantação positiva. | ||||||||
| Amostragem da ponta do dedo enluvada | TSAL | 30 °C-35 °C, ar, por pelo menos 48 horas dias seguidos de 20 °C-25 °C por pelo menos 5 dias 19. | O critério de aceitabilidade para GFS é <1 UFC/placa (ou seja, sem crescimento), de acordo com PIC/S 009-16 (Anexos) 18. Os critérios de aceitabilidade podem ser modificados a critério do controle de qualidade da instalação. | |||||||
| Teste de esterilidade do produto | TSB (USP<71>) | 20 °C-25 °C, ar, por pelo menos 14 dias | Periodicamente durante todo o período de incubação (dias 3, 5, 7 e 14) | Sem crescimento. | ||||||
| FTM (USP<71>) | 30 °C-35 °C, ar, por pelo menos 14 dias | |||||||||
| iFA+ (método NIH) | 30 °C-35 °C, ar, por pelo menos 14 dias | Monitoramento automático pelo instrumento BacT/ALERT Dual-T. A verificação visual de cada frasco no final da incubação para bolas de mofo é altamente recomendada. | Consulte a Figura 8 para obter um exemplo de bolas de molde visíveis que não foram detectadas automaticamente pelo BacT/ALERT. | |||||||
| iFN+ (método NIH) | ||||||||||
| SAB (método NIH) | 20 °C-25 °C durante pelo menos 14 dias | Periodicamente durante todo o período de incubação (dias 3, 5, 7 e 14) | ||||||||
Tabela 1: Resumo das condições de cultura recomendadas e resultados esperados. As condições de cultura aqui descritas são recomendações baseadas em um programa validado usado no NIH. Cada usuário final é obrigado a validar seu próprio programa de testes de microbiologia. As estratégias de controle microbiano e teste podem diferir entre os institutos dependendo de variáveis, incluindo o projeto da instalação, a flora da instalação e a classificação de risco do produto.
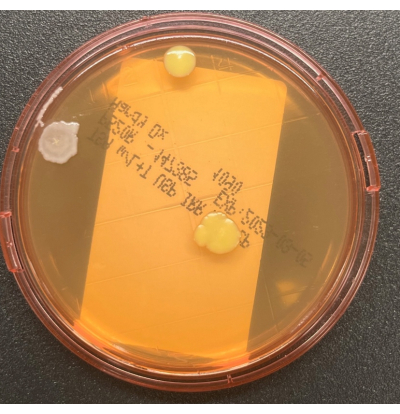
Figura 2: Crescimento na placa TSALT. A placa de amostragem da superfície TSALT mostrando três UFCs de duas morfologias de colônias distintas. Clique aqui para ver uma versão maior desta figura.
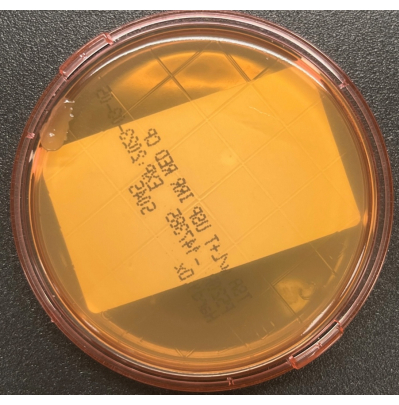
Figura 3: Contaminação da placa TSALT durante a coleta. A cultura de superfície TSALT mostrou uma única colônia na borda da placa, indicando mau manuseio asséptico durante o processo de amostragem. Clique aqui para ver uma versão maior desta figura.

Figura 4: Cultura obtida usando uma cabeça de amostragem de ar contaminado. Exemplo de uma cultura de amostragem de ar ativa TSA mostrando >100 unidades formadoras de colônias (UFC) de morfologias mistas. O padrão de crescimento indica contaminação da cabeça de amostragem. Clique aqui para ver uma versão maior desta figura.

Figura 5: Sem crescimento em uma placa de ar viável ativa TSA. Placa de ar viável ativa TSA que ilustra nenhum crescimento após a incubação. Recuos da cabeça ativa do amostrador de ar podem ser vistos na imagem. Clique aqui para ver uma versão maior desta figura.
3. Monitoramento de processos
- Placas de decantação (monitoramento passivo do ar)
- Coloque placas TSA e SAB etiquetadas perto da área de trabalho, mas em uma área que não interfira nos testes. Documente a hora de início da amostragem e abra assepticamente ambas as placas, colocando as tampas em uma superfície limpa no BSC, longe da área de trabalho.
- As placas de decantação podem ser abertas por um período máximo de 4 h para evitar que o ágar seque. Feche as tampas das placas ao final do processamento. Ensacar as placas com folga e incubar as culturas conforme descrito na Tabela 1. A Figura 6 mostra um contaminante de colônia única em uma placa de decantação de ar TSA.
- Amostragem da ponta do dedo enluvada (GFS)
- Obter duas placas TSALT marcadas. Retire assepticamente a tampa de uma placa e coloque-a numa superfície de trabalho limpa, longe da área de amostragem.
- Enrole suavemente a almofada de cada dedo e o polegar de uma mão sobre a superfície da placa (Figura 7). Prove a maior área de superfície de cada dedo/polegar em vez da ponta. Use força suficiente para fazer ligeiras depressões no ágar sem rachar a superfície do ágar.
- Colocar assepticamente a tampa de volta na placa e repetir o passo 3.2.2 para a outra mão. Higienizar as mãos com 70% de sIPA ao término da amostragem. Ensacar as placas com folga e incubar as culturas conforme descrito na Tabela 1.
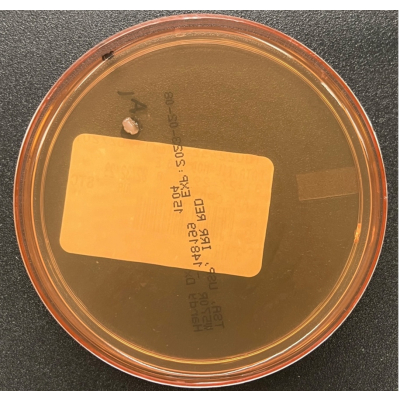
Figura 6: Crescimento em uma placa de decantação de ar TSA. Uma placa de decantação de ar TSA ilustrando uma única colônia de um contaminante cultivado durante o monitoramento passivo do processo de ar no BSC. Clique aqui para ver uma versão maior desta figura.

Figura 7: Amostragem da ponta do dedo enluvado. O método correto para obter amostras enluvadas da ponta do dedo usando a maior área de superfície (ou almofada) de cada dedo/polegar é mostrado à esquerda. O processo incorreto em que apenas a ponta do dedo é amostrada é mostrado à direita. Clique aqui para ver uma versão maior desta figura.
4. Teste de esterilidade por inoculação direta do produto
- Inoculação direta após USP<71>
- Obter um frasco rotulado de caldo de soja tríptico (TSB) e um frasco rotulado de meio de tioglicolato fluido (FTM) para cada artigo de teste submetido. Para a sessão de teste, obter um TSALT e um SABLT para amostragem de superfície viável, uma placa TSA e uma placa SAB para placas de assentamento e duas placas TSALT para GFS.
- Vestido para trabalho dentro do BSC conforme etapa 1.2. Limpe o BSC conforme etapa 1.4. Colocar os materiais no BSC conforme etapa 1.5. Realizar amostragem de contato da área crítica de trabalho conforme etapa 2.1, limpando a superfície com 70% de sIPA após a amostragem. Prepare as placas de assentamento TSA e SAB próximas à área de trabalho conforme etapa 3.1.
- Obter o artigo de teste e os frascos TSB e FTM associados. Se os frascos de TSB e FTM tiverem um septo, remova as tampas protetoras de cada frasco e limpe o septo com um lenço de álcool estéril. Se as garrafas TSB e FTM tiverem uma tampa de rosca, solte a tampa das garrafas (mas não remova a tampa).
- Vórtice o artigo de teste para garantir uma suspensão homogênea. Inocular os frascos com o volume validado do artigo teste (até 10 mL/frasco) usando uma seringa estéril e uma agulha hipodérmica (para tampas de septo) ou um pipetador (para tampas de rosca).
- Após a inoculação, limpe o septo com um lenço de álcool estéril e insira uma unidade de ventilação estéril para permitir a troca de ar durante a incubação. Para frascos rosqueados, feche o frasco, mas deixe a tampa de 1/4 a 1/2 solta para permitir a troca de ar durante a incubação. Repita as etapas 4.1.3-4.1.5 para cada artigo de teste a ser testado nessa sessão.
- Feche assepticamente as placas de decantação TSA e SAB e documente a hora de término da amostragem. Execute GFS conforme a etapa 3.2, limpando as luvas com 70% de sIPA após a amostragem. Ensacar as placas com folga e incubar as culturas conforme descrito na Tabela 1.
- Transfira todos os materiais de teste para fora do BSC e limpe o BSC de acordo com a etapa 1.4.
- Inoculação direta seguindo o Método de Teste de Esterilidade Alternativo do NIH
- Obter uma placa rotuladai FA+, uma rotulada iFN+ e uma placa SAB para cada artigo de teste. Para a sessão de teste, obter um TSALT e um SABLT para amostragem de superfície viável, uma placa TSA e uma placa SAB para placas de assentamento e duas placas TSALT para GFS.
- Vestido para trabalho dentro do BSC conforme etapa 1.2. Limpe o BSC conforme etapa 1.4. Colocar os materiais no BSC conforme etapa 1.5. Realizar amostragem de contato da área crítica de trabalho conforme etapa 2.1, limpando a superfície com 70% de sIPA após a amostragem. Prepare as placas de assentamento TSA e SAB próximas à área de trabalho conforme etapa 3.1.
- Obtenha o artigo de teste e as placas i FA+, iFN+ e SAB associadas. Retire as tampas protetoras dos frascos i FA+ e iFN+ e limpe o septo com um lenço de álcool estéril.
- Vórtice o artigo de teste para garantir uma suspensão homogênea. Inocular os frascos com o volume validado do artigo teste (até 10 mL/frasco) usando uma seringa estéril e agulha hipodérmica. Limpe o septo com um lenço de álcool estéril após a inoculação. Incubar os frascos no instrumento BacT/ALERT Dual-T, conforme descrito na Tabela 1.
- Usando um pipetador, inocular a placa SAB com a quantidade validada do artigo de teste (não mais de 500 μL/placa) e estriar para isolamento usando uma alça estéril. Deixe descansar por 10 minutos para garantir que a amostra não corra para a tampa da placa quando invertida para incubação. Coloque cada placa SAB inoculada com o artigo de teste em um saco plástico, amarre soltamente e incube conforme descrito na Tabela 1.
- Feche assepticamente as placas de decantação TSA e SAB e documente a hora de término da amostragem. Realizar GFS conforme descrito na etapa 3.2, limpando as luvas com 70% de sIPA após a amostragem. Ensacar as placas com folga e incubar as culturas conforme descrito na Tabela 1. A inspeção visual dos frascos BacT/ALERT ao final do período de incubação é essencial para detectar bolas de mofo que podem não ter sido detectadas pelo instrumento (Figura 8).
- Transfira todos os materiais de teste para fora do BSC e limpe o BSC de acordo com a etapa 1.4.
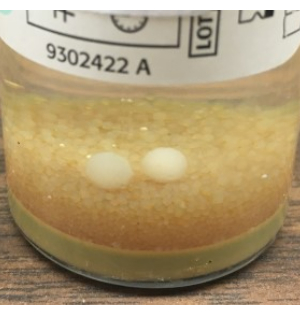
Figura 8: Crescimento do bolor que não foi detectado pelo BacT/ALERT. Exemplo de bolas de mofo, visíveis a olho nu, que não foram detectadas automaticamente pelo sistema BacT/ALERT. Com base nesses achados, recomendamos a inspeção visual terminal de todos os frascos de BacT/ALERT e a adição da placa SAB para cultura fúngica usando o Método de Teste Alternativo de Esterilidade do NIH. Clique aqui para ver uma versão maior desta figura.
Resultados
Os resultados esperados estão descritos na Tabela 1. Os dados EM devem ser revistos e acompanhados com uma investigação e resposta apropriadas a excursões de ação, alerta ou limite ISO. Se ocorrer uma excursão para partículas não viáveis, deve-se proceder de acordo com a norma ISO 14644-Anexo A, seção A.5.57. Se a excursão puder ser atribuída a uma ocorrência anormal imediatamente identificável, os resultados originais da amostragem devem ser documentados, uma nota...
Discussão
Existem várias áreas críticas neste protocolo, incluindo a manutenção da técnica asséptica e do fluxo de ar unidirecional dentro de salas limpas e dos BSCs. As melhores práticas incluem mover-se lenta e deliberadamente para minimizar a turbulência. As manipulações assépticas devem ser realizadas do lado do produto, não de cima. Recomenda-se o processamento em sistema fechado e o uso de matérias-primas esterilizadas terminais. Falar em áreas críticas e encostar-se em paredes ou equipamentos deve ser evitad...
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado pelo Programa de Pesquisa Intramuros do National Institutes of Health Clinical Center. O conteúdo é de responsabilidade exclusiva dos autores e não representa a opinião oficial do National Institutes of Health.
Materiais
| Name | Company | Catalog Number | Comments |
| 20-25°C Incubator | Lab preference | ||
| 30-35°C Incubator | Lab preference | ||
| Alcohol-based hand sanitizer | Lab preference | ||
| BacT/ALERT Dual-T instrument | BioMerieux Industry | ||
| Beard cover | Lab preference | ||
| Biosafety cabinet (BSC) | Lab preference | ||
| Cleanroom shoes | Lab preference | ||
| Fluidthioglycollate medium (FTM) | Hardy Diagnostics | U84 | USP |
| Handheld cleaning mop | Contec | 2665LF | |
| Hypodermic needle | Lab preference | ||
| iFA+ BacT/ALERT bottle | Biomerieux | 412990 | |
| iFN+ BacT/ALERT bottle | Biomerieux | 412991 | |
| Isokinetic head | Lab preference | ||
| Laser particle counter | TSI Incorporated | 9500-01 | |
| LpH III | Steris | 1S16CX | |
| Mirror | Lab preference | ||
| Non-sterile bouffant | Lab preference | ||
| Non-sterile gloves | Lab preference | ||
| Non-sterile shoe covers | Lab preference | ||
| Non-sterile sleeve covers | Lab preference | ||
| Parafilm | Lab preference | ||
| Peridox RTU | Contec | CR85335IR | |
| Plastic bag | Lab preference | ||
| Sabouraud Dextrose Agar with Lecithinase and Tween (SABLT) | Hardy Diagnostics | P595 | USP, irradiated |
| Sabouraurd Dextrose Agar (SAB) | Hardy Diagnostics | W565 | USP, irradiated |
| Safety glasses | Lab preference | ||
| Scrubs (top and bottom) | Lab preference | ||
| Spor-Klenx RTU | Steris | 6525M2 | |
| Sterile 70% isopropyl alcohol (IPA) | Decon CiDehol | 8316 | |
| Sterile alcohol wipe | Lab preference | ||
| Sterile boot covers | Kimberly Clark | Cat# varies based on size | |
| Sterile coveralls | Kimberly Clark | Cat# varies based on size | |
| Sterile face mask | Lab preference | ||
| Sterile gloves | Lab preference | ||
| Sterile hood | Kimberly Clark | Cat# varies based on size | |
| Sterile low-lint wipes | Texwipe | TX3210 | |
| Sterile mop cleaning pads | Contec | MEQT0002SZ | |
| Sterile sleeve covers | Kimberly Clark | 36077 | |
| Sterile spreading rod | Fisher Scientific | 14665231 | |
| Sterile syringe | Lab preference | ||
| Tacky mats | Lab preference | ||
| Tryptic Soy Agar (TSA) | Hardy Diagnostics | W570R | USP, irradiated |
| Tryptic Soy Agar with Lecithinase and Tween (TSALT) | Hardy Diagnostics | P520R | USP, irradiated |
| Tryptic Soy Broth (TSB) | Hardy Diagnostics | U46 | USP |
| Tubing | Lab preference | ||
| Vesphene III | Steris | 1S15CX | |
| Viable air sampler | Hardy Diagnostics | BAS22K | |
| Vortex | Lab preference |
Referências
- Cundell, T., Atkins, J. W., Lau, A. F. Sterility testing for hematopoietic stem cells. Journal of Clinical Microbiology. , (2023).
- United States Food and Drug Administration. Guidance for Industry. Sterile Drug Products Produced by Aseptic Processing - Current Good Manufacturing Practice. United States Food and Drug Administration. , (2004).
- United States Pharmacopeia - National Formulary. USP<71> Sterility Tests in USP43-NF38. United States Pharmacopeia - National Formulary. , (2022).
- England, M. R., Stock, F., Gebo, J. E. T., Frank, K. M., Lau, A. F. Comprehensive evaluation of compendial USP<71>, BacT/Alert Dual-T, and Bactec FX for detection of product sterility testing contaminants. Journal of Clinical Microbiology. 57 (2), 01548 (2019).
- Gebo, J. E. T., East, A. D., Lau, A. F. A side-by-side comparison of clinical versus current good manufacturing practices (cGMP) microbiology laboratory requirements for sterility testing of cellular and gene therapy products. Clinical Microbiology Newsletter. 43 (21), 181-191 (2021).
- Gebo, J. E. T., Lau, A. F. Sterility testing for cellular therapies: What is the role of the clinical microbiology laboratory. Journal of Clinical Microbiology. 58 (7), 01492 (2020).
- International Organization for Standardization. ISO 14644-1:2015 Cleanrooms and associated controlled environments - Part 1: Classification of air cleanliness by particle concentration. International Organization for Standardization. , (2015).
- Parenteral Drug Association. PDA Technical Report No. 13 Revised 2022 (TR 13) Fundamentals of an Environmental Monitoring Program. Parenteral Drug Association, Inc. , (2022).
- United States Pharmacopeia - National Formulary. USP<1116> Microbiological Evaluation of Cleanrooms and Other Controlled Environments in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Guinet, R., et al. Multicenter study on incubation conditions for environmental monitoring and aseptic process simulation. PDA journal of pharmaceutical science and technology. 71 (1), 43-49 (2017).
- Gordon, O., Berchtold, M., Staerk, A., Roesti, D. Comparison of different incubation conditions for microbiological environmental monitoring. PDA Journal of Pharmaceutical Science and Technology. 68 (5), 394-406 (2014).
- Anders, H. J., et al. Multisite qualification of an automated incubator and colony counter for environmental and bioburden applications in pharmaceutical microbiology. PDA Journal of Pharmaceutical Science and Technology. , (2022).
- United States Pharmacopeia - National Formulary. USP<1072> Disinfectants and Antiseptics. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. USP<1071> Rapid Microbial Tests for Release of Sterile Short-Life Products: A Risk-Based Approach in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. PUSP<1223> Validation of Alternative Microbiological Methods in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Parenteral Drug Association. PDA Technical Report No. 33, Revised 2013 (TR 33) Evaluation, Validation and Implementation of Alternative and Rapid Microbiological Methods. Parenteral Drug Association, Inc. , (2013).
- Putnam, N. E., Lau, A. F. Comprehensive study identifies a sensitive, low-risk, closed-system model for detection of fungal contaminants in cell and gene therapy products. Journal of Clinical Microbiology. 59 (11), 0135721 (2021).
- Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation. Guide to Good Manufacturing Practice for Medicinal Products Annexes (PE 009-16 (Annexes)). Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation Scheme. , (2022).
- United States Pharmacopeia - National Formulary. USP<825> Radiopharmaceuticals - Preparation, Compounding, Dispensing, and Repackaging in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados