Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrobielle Kontroll- und Überwachungsstrategien für Reinraumumgebungen und zelluläre Therapien
In diesem Artikel
Zusammenfassung
Das Protokoll fasst die Best Practices zur Minimierung der mikrobiellen Keimbelastung in einer Reinraumumgebung zusammen und umfasst Strategien wie Umweltüberwachung, Prozessüberwachung und Produktsterilitätsprüfung. Sie ist relevant für Produktions- und Prüfeinrichtungen, die die aktuellen Standards der guten Gewebepraxis und die aktuellen Standards der guten Herstellungspraxis erfüllen müssen.
Zusammenfassung
Ein gut validiertes und ganzheitliches Programm, das robuste Kittel-, Reinigungs-, Umweltüberwachungs- und Personalüberwachungsmaßnahmen umfasst, ist entscheidend für die Minimierung der mikrobiellen Keimbelastung in den Produktionsstätten für Zelltherapien und den entsprechenden Testlabors, um sicherzustellen, dass die Einrichtungen in einem Zustand der Kontrolle arbeiten. Die Gewährleistung der Produktsicherheit durch Qualitätskontrollmaßnahmen, wie z. B. Sterilitätstests, ist eine regulatorische Anforderung sowohl für minimal manipulierte (§ 361) als auch für mehr als minimal manipulierte (§ 351) menschliche Zellen, Gewebe und zelluläre und gewebebasierte Produkte (HCT/Ps). In diesem Video bieten wir eine schrittweise Anleitung zur Entwicklung und Integration der besten aseptischen Praktiken für den Betrieb in einer Reinraumumgebung, einschließlich Ankleiden, Reinigen, Bereitstellen von Materialien, Umgebungsüberwachung, Prozessüberwachung und Produktsterilitätsprüfung mit direkter Inokulation, die von der United States Pharmacopeia (USP<71>) und der alternativen Sterilitätstestmethode der National Institutes of Health (NIH) bereitgestellt werden. Dieses Protokoll ist als Referenzleitfaden für Betriebe gedacht, von denen erwartet wird, dass sie die aktuellen guten Gewebepraktiken (cGTP) und die aktuellen guten Herstellungspraktiken (cGMP) erfüllen.
Einleitung
Die Implementierung eines starken mikrobiellen Überwachungsprogramms durch Umweltüberwachung (EM), Prozessüberwachung und Produktsterilitätstests ist eine regulatorische Anforderung für die aktuelle gute Gewebepraxis (cGTP) und die aktuelle gute Herstellungspraxis (cGMP) in Zelltherapielabors1. Darüber hinaus erwartet die US-amerikanische Food and Drug Administration (FDA), dass das Labor, das die Qualitätskontrolle (QC) des Produkts durchführt, auch Einrichtungen und Kontrollen einsetzt, die mit denen vergleichbar sind, die für aseptische Abfüllvorgänge verwendet werden2.
Dieses Protokoll besteht aus vier Hauptabschnitten: 1) Aseptische Praktiken, einschließlich Personalkleidung, Reinigung und Bereitstellung von Materialien; 2) EM, einschließlich lebensfähiger Luft- und Oberflächenkulturen und Überwachung nicht lebensfähiger Partikel in der Luft; 3) Prozessüberwachung, einschließlich Absetzplatten und Probenahme mit behandschuhten Fingerspitzen; und 4) Produktsterilitätsprüfung über die kompendiale United States Pharmacopeia (USP) <71> Methode3 oder die NIH Alternative Sterility Testing Method4. Wenn diese Maßnahmen zusammen eingesetzt werden, können sie eine wirksame Methode sein, um sicherzustellen, dass eine Anlage in einem Zustand der Kontrolle bleibt.
Die hier beschriebenen Techniken sind nicht neu; Den derzeitigen Standards von Aufsichtsbehörden und Berufsverbänden mangelt es jedoch an Details, was dazu geführt hat, dass es keine mikrobielle Überwachung oder die Implementierung nicht standardisierter Praktiken gibt, insbesondere in akademischen Zentren, in denen Vor-Ort-Herstellungs- und Produktsterilitätstests in rasantem Tempo entstehen 1,5,6 . Dieses Protokoll kann als Leitfaden verwendet werden, um ein mikrobielles Überwachungs- und Kontrollprogramm zu erstellen, das die gesetzlichen Anforderungen erfüllt, wenn es in Verbindung mit der Validierung und Risikobewertung durch Endbenutzer verwendet wird.
Protokoll
1. Aseptische Praktiken
- Personalkleidung für einen Reinraumraum
HINWEIS: Dieses Verfahren basiert auf dem anfänglichen Anziehen in einem nicht klassifizierten Raum, gefolgt vom Eintritt in einen Bereich der Internationalen Organisation für Normung (ISO) 8 und dann in einen ISO7-Bereich. Dieses Verfahren ist relevant für Labore, die versuchen, bestehende Räume in eine Reinraumfunktion umzuwandeln. Im Idealfall würden alle anfänglichen Kleider in einem ISO8-klassifizierten Raum (nicht in einem nicht klassifizierten Raum) stattfinden.- Sichere lose Haare. Waschen Sie sich die Hände und ziehen Sie sich ein Peeling an (langärmelige Peeling-Oberteile und lange Peeling-Hosen sind vorzuziehen). Sammeln Sie sich und ziehen Sie Reinraumschuhe mit Überschuhen an.
- Desinfizieren Sie die Hände zunächst mit einem Händedesinfektionsmittel auf Alkoholbasis und dann zwischen jedem der folgenden Schritte: Anziehen unsteriler Handschuhe und dann einer Bartbedeckung (für jede Menge sichtbarer Gesichtsbehaarung), falls zutreffend. Ziehen Sie ein unsteriles Bouffant an und bedecken Sie die Unterarme mit unsterilen Ärmeln, wenn keine langärmeligen Oberteile verwendet wurden.
- Entfernen Sie die Überschuhe und treten Sie mit jedem Fuß auf die klebrige Matte vor der ISO8-Vorraumtür, nachdem der Überschuh entfernt wurde. Stellen Sie sicher, dass der gesamte Fuß vor dem Betreten Kontakt mit der klebrigen Matte hat. Entsorgen Sie die Überschuhe und dekontaminieren Sie die Handschuhe und den Türgriff mit 70% sterilem Isopropylalkohol (sIPA). Betreten Sie den ISO8-Vorraum.
- Besorge dir eine sterile Kapuze, eine sterile Gesichtsmaske, einen sterilen Overall, eine sterile Stiefelabdeckung und eine Schutzbrille. Dekontaminieren Sie die Handschuhe mit 70% sIPA. Setzen Sie eine Schutzbrille auf und stellen Sie die Materialien gemäß Schritt 1.5 auf eine saubere Oberfläche.
- Ziehen Sie ein neues Paar unsterile Überschuhe über die speziellen Reinraumschuhe und treten Sie auf die klebrige Matte vor dem sekundären Vorraum. Achte darauf, dass jeder Fuß in seiner Gesamtheit mit der klebrigen Matte in Kontakt kommt. Dekontaminieren Sie die Handschuhe mit 70% sIPA. Sammeln Sie die bereitgestellten Kleidervorräte und betreten Sie den sekundären ISO7-Vorraum, wobei Sie auf der schmutzigen Seite der Demarkationslinie bleiben.
- Ziehen Sie die sterile Kapuze und den sterilen Overall an, berühren Sie nur die Innenseite des Kleidermaterials und stellen Sie sicher, dass der Hals der Kapuze in den Overall gesteckt wird, um eine vollständige Abdichtung zu schaffen. Setzen Sie die sekundären sterilen Stiefelabdeckungen auf. Dekontaminieren Sie die Handschuhe zwischen jedem Anziehschritt mit 70 % sIPA.
- Vergewissern Sie sich, dass der Kittel ordnungsgemäß angelegt wurde, dekontaminieren Sie die Handschuhe mit 70 % sIPA und betreten Sie den ISO7-Raum.
Anmerkungen: Überprüfen Sie das Kleidermaterial regelmäßig auf Unversehrtheit. Wenn Sie kompromittiert sind, verlassen Sie sofort den Reinraum und ziehen Sie sich um.
- Anlegen für eine biologische Sicherheitswerkbank (BSC)
- Kleiden Sie sich wie in Schritt 1.1 oben beschrieben mit diesen zusätzlichen Praktiken.
- Sammeln Sie sterile Handschuhe und sterile Ärmel. Reinigen Sie die BSC gemäß Schritt 1.4 und stellen Sie die Materialien gemäß Schritt 1.5 ein. Dekontaminieren Sie die Handschuhe mit 70% sIPA.
- Ziehen Sie aseptisch sterile Ärmel über den Overall und verwenden Sie Daumenschlaufen, falls vorhanden. Ziehen Sie sterile Handschuhe über vorhandene Handschuhe und stellen Sie sicher, dass die Manschette des Handschuhs über den sterilen Ärmel hinausragt. Dekontaminieren Sie die Handschuhe zwischen jedem Schritt mit 70 % sIPA. Geben Sie die BSC ein.
Anmerkungen: Überprüfen Sie das Kleidermaterial regelmäßig auf Unversehrtheit. Wenn Sie kompromittiert sind, verlassen Sie sofort den Reinraum und ziehen Sie sich um.
- Ausziehen der Kleiderstoffe
- Verlassen Sie das BSC und entfernen Sie vorsichtig das obere Paar Handschuhe und sterile Ärmel. Dekontaminieren Sie die Innenhandschuhe mit 70% sIPA.
- Betreten Sie den sekundären und dann den primären Vorraum und warten Sie, bis sich die Tür zwischen den einzelnen Schritten vollständig geschlossen hat. Entfernen Sie die Materialien in der folgenden Reihenfolge: äußere sterile Stiefelüberzüge, Overall, Kapuze und Gesichtsmaske.
- Verlassen Sie den primären Vorraum und entfernen Sie den unsterilen Kittel.
HINWEIS: Die Reihenfolge der Entfernung im nicht klassifizierten Bereich ist nicht wichtig. Die inneren unsterilen Überschuhe sollten jedoch auf den Reinraumschuhen verbleiben, um sie in nicht klassifizierten Räumen zu lagern. - Desinfizieren Sie die Hände mit einem Händedesinfektionsmittel auf Alkoholbasis und kehren Sie zu Straßenkleidung zurück.
- Reinigung der Reinraumoberflächen und des BSC
- Stellen Sie einen handgeführten Reinigungsmopp zusammen oder besorgen Sie sich ein sauberes, fusselarmes Wischtuch. Wenn Sie ein fusselarmes Tuch verwenden, falten Sie das Tuch in Viertel und drehen Sie es zwischen den einzelnen Oberflächen. Tränken Sie den Moppkopf oder das fusselarme Tuch mit einem zugelassenen Desinfektionsmittel.
- Arbeiten Sie von hinten nach vorne (oder von oben nach unten) und reinigen Sie den BSC mit überlappenden Tüchern in der folgenden Reihenfolge: das HEPA-Diffusorgitter (die Oberseite des BSC), die Rückwand des BSC, beide Seitenwände des BSC, den Flügel und die Arbeitsfläche. Zum Schluss wischen Sie den Flügel des BSC mit 70 % sIPA ab, um Desinfektionsmittelreste zu entfernen. In Abbildung 1 finden Sie ein typisches BSC-Reinigungsmuster.
- Bereitstellen von Materialien und Geräten in klassifizierten Umgebungen
- Dekontaminieren (d. h. Stufen) aller Materialien, die von einem nicht klassifizierten oder niedriger klassifizierten Bereich in einen höher klassifizierten Bereich (z. B. von einem ISO8- in einen ISO7-Bereich) transferiert werden müssen, um die Übertragung von Mikroben zu minimieren. Der Transfer von Materialien zwischen Bereichen der gleichen ISO-Klassifizierungsstufe erfordert keine Kommissionierung.
Anmerkungen: Wenn die Materialien endgültig sterilisiert wurden und sich in mehreren Beuteln befinden, entfernen Sie den äußeren Beutel/Beutel und bringen Sie das Material in den klassifizierten Raum. Ein Abwischen des Innenbeutels/-beutels ist nicht erforderlich. - Besorge dir ein fusselarmes Tuch und falte das Tuch in Viertel, um es auf eine saubere Seite zu drehen, wenn das Tuch verschmutzt ist. Tränken Sie das Tuch mit 70 % sIPA oder einem zugelassenen Desinfektionsmittel.
- Wischen Sie die Außenseite des Materials/der Ausrüstung mit überlappenden Tüchern ab. Stellen Sie sicher, dass alle Bereiche des Artikels abgewischt sind, einschließlich der Innenseiten von abziehbaren Verpackungssiegeln und Ecken/Vertiefungen am Gerät und anderen unregelmäßig geformten Verbrauchsmaterialien. Stellen Sie bei Geräten auf Rädern sicher, dass das gesamte Rad während des Bereitstellungsvorgangs abgewischt wurde (das Gerät muss möglicherweise vorsichtig gekippt werden, damit die Räder gedreht werden können).
- Dekontaminieren (d. h. Stufen) aller Materialien, die von einem nicht klassifizierten oder niedriger klassifizierten Bereich in einen höher klassifizierten Bereich (z. B. von einem ISO8- in einen ISO7-Bereich) transferiert werden müssen, um die Übertragung von Mikroben zu minimieren. Der Transfer von Materialien zwischen Bereichen der gleichen ISO-Klassifizierungsstufe erfordert keine Kommissionierung.

Abbildung 1: Beispiel für ein BSC-Reinigungsmuster. Arbeiten Sie von hinten nach vorne (oder von oben nach unten) und reinigen Sie den BSC mit überlappenden Tüchern in der folgenden Reihenfolge: das HEPA-Diffusorgitter (die Oberseite des BSC), die Rückwand des BSC, beide Seitenwände des BSC, den Flügel und die Arbeitsfläche. Zum Schluss wischen Sie den Flügel des BSC mit 70 % sIPA ab, um Desinfektionsmittelreste zu entfernen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Umweltmonitoring (EM)
- Machbare Oberflächenprobenahme
- Stellen Sie die für die Probenahme benötigten Materialien gemäß Schritt 1.5 bereit und legen Sie sie gemäß Abschnitt 1 in den klassifizierten Raum.
Anmerkungen: Die Oberflächenprobenahme sollte vor der Luftprobenahme an einem bestimmten Ort durchgeführt werden. Wenn Sie mehrere Platten verwenden, um einen Bereich an der Oberfläche zu beproben, nehmen Sie keine exakt dieselbe Stelle. Verwenden Sie Kontaktplatten nur für flache Oberflächen, um einen vollständigen Kontakt zu gewährleisten und mögliche Schäden am Agar zu vermeiden. - Sammeln und etikettieren Sie für jede Probenahmestelle einen tryptischen Soja-Agar mit Lecithinase und Tween-Platte (TSALT) und einen Sabouraud-Dextrose-Agar mit Lecithinase und Tween-Platte (SABLT). Halten Sie den Boden der Platte mit einer Hand fest, entfernen Sie den Deckel aseptisch und achten Sie darauf, die erhabene Agaroberfläche nicht zu berühren.
- Berühren Sie den erhabenen Agar mit der zu beprobenden Oberfläche, achten Sie darauf, dass die gesamte Oberfläche in Kontakt ist, und üben Sie festen Druck auf die Platte aus. Lassen Sie die Platte mindestens 5 s lang in Kontakt mit der Oberfläche.
- KRITISCH: Bewegen Sie die Platte nicht seitlich über die zu beprobende Oberfläche, da dies das potenzielle Wachstum über die Oberfläche verteilen kann, was die Auflösung einzelner Kolonien erschwert. Üben Sie während der Probenahme keine übermäßige Kraft auf die Kontaktplatte aus, da die Agaroberfläche reißen kann.
- Setzen Sie die Abdeckung aseptisch wieder auf und achten Sie darauf, die erhabene Agaroberfläche nicht zu berühren. Verriegeln Sie die Abdeckung, wenn die Kontaktplatte über ein Verriegelungssystem verfügt. Reinigen Sie den Probenahmebereich mit 70 % sIPA, um alle Medienreste von der Oberfläche zu entfernen. Verpacken Sie die Platten locker und inkubieren Sie die Kulturen wie in Tabelle 1 beschrieben. Ein repräsentatives Bild, das das Wachstum von drei koloniebildenden Einheiten (KBE) mit zwei unterschiedlichen Koloniemorphologien auf einer TSALT-Oberflächenprobenahmeplatte zeigt, ist in Abbildung 2 dargestellt. Abbildung 3 zeigt eine Kontamination einer TSALT-Platte mit Wachstum am Rand der Platte, die auf eine schlechte aseptische Technik während der Probenentnahme zurückzuführen ist.
- Stellen Sie die für die Probenahme benötigten Materialien gemäß Schritt 1.5 bereit und legen Sie sie gemäß Abschnitt 1 in den klassifizierten Raum.
- Rentable Luftprobenahme
- Stellen Sie die für die Probenahme benötigten Materialien gemäß Schritt 1.5 bereit und legen Sie sie gemäß Abschnitt 1 in den klassifizierten Raum.
- Sammeln und beschriften Sie für jede Probenahmestelle eine Platte mit tryptischem Soja-Agar (TSA) und eine Platte mit Sabouraud-Dextrose-Agar (SAB). Bereiten Sie den Luftkeimsammler vor, indem Sie den Probenahmekopf aseptisch entfernen, indem Sie nur die Außenkante greifen, um eine Kontamination des Kopfes zu vermeiden.
- Halten Sie den Probenahmekopf in einer Hand und legen Sie das Medium aseptisch in den Plattenhalter des Probenehmers. Wenn es einen Stift gibt, der länger ist als die anderen, führen Sie das Medium zuerst gegen den längeren Stift ein und drücken Sie dann die Platte nach unten in die verbleibenden Zinken, um die Platte zu sichern.
- Entfernen Sie den Plattendeckel aseptisch und legen Sie ihn auf eine gereinigte Oberfläche, bis die Probenahme abgeschlossen ist. Tauschen Sie den Probenahmekopf aseptisch aus und sichern Sie ihn, wobei Sie nur die Außenkante greifen, um eine Kontamination des Kopfes zu vermeiden. Wiederholen Sie die Schritte 2.2.2-2.2.4 für das restliche Medium, wenn Sie einen Mehrkopf-Luftkeimsammler verwenden.
- Platzieren Sie den Luftkeimsammler an der Probenahmestelle mit den Probenahmeköpfen in der vorherrschenden Richtung der Luftstrombewegung. Stellen Sie sicher, dass die Abluft des nicht lebensfähigen Luftkeimsammlers (bei gleichzeitiger Probenahme) den lebensfähigen Probenehmer nicht stört. Stellen Sie sicher, dass der Luftkeimsammler auf die validierten Einstellungen eingestellt ist, und starten Sie den Probenahmezyklus.
- Wenn der Probenahmezyklus abgeschlossen ist, entfernen Sie den Probenahmekopf aseptisch aus dem Probenehmer, indem Sie nur die Außenkante greifen, um eine Kontamination des Kopfes zu vermeiden. Halten Sie den Probenahmekopf in einer Hand und setzen Sie den Deckel der Agarplatte aseptisch wieder auf. Entfernen Sie die Platte aus dem Plattenhalter. Verpacken Sie die Platten locker und inkubieren Sie die Kulturen wie in Tabelle 1 beschrieben.
- Desinfizieren Sie den Probenahmekopf und den Bereich um den Plattenhalter mit 70 % sIPA. Befestigen Sie den Probenahmekopf aseptisch und greifen Sie nur die Außenkante. Wiederholen Sie die Schritte 2.2.6 und 2.2.7 für das restliche Medium, wenn Sie einen Mehrkopf-Luftkeimsammler verwenden.
HINWEIS: Abbildung 4 zeigt eine aktive TSA-Luftprobenahmekultur mit Wachstum, das durch einen kontaminierten Probenahmekopf verursacht wird. Umgekehrt zeigt Abbildung 5 eine TSA-aktive Luftprobenahmekultur ohne Wachstum. Auf dem Bild sind Lufteindrücke des Probenahmekopfes zu sehen.
- Nicht lebensfähige Probenahme
- Führen Sie vor der Probenahme für jeden Tag eine Nullprüfung des Laserpartikelzählers durch. Befestigen Sie den isokinetischen Kopf entweder direkt an der Probenahmeöffnung des Partikelzählers oder befestigen Sie ihn an einem Schlauch, der für die Probenahmestelle erforderlich ist.
- Wenn Schläuche verwendet werden, verwenden Sie eine kurze Länge, da Schläuche mit einer Länge von >1 m Probleme bei der Zählung von Partikeln von ≥1 μm verursachen und auch zu unnötigen Biegungen im Rohr führen können. Stellen Sie sicher, dass der Partikelzähler auf die validierten Einstellungen eingestellt ist. Es wird empfohlen, eine Verzögerung von ca. 30 s einzustellen, um den Austritt aus dem Probenahmebereich zu ermöglichen und eine Unterbrechung des Luftstroms während der Probenahme zu vermeiden.
- Positionieren Sie den isokinetischen Kopf des Laserpartikelzählers an der Probenahmestelle, wobei der isokinetische Kopf in die vorherrschende Richtung der Luftstrombewegung zeigt. Stellen Sie sicher, dass die Abluft des lebensfähigen Luftkeimsammlers (bei gleichzeitiger Probenahme) den nicht lebensfähigen Probenehmer nicht stört. In Bereichen, in denen der Luftstrom nicht unidirektional ist oder das Luftstrommuster unbekannt ist, stellen Sie sicher, dass der isokinetische Kopf senkrecht nach oben zeigt.
Anmerkungen: Wenn Rotationsdesinfektionsmittel oder 70 % sIPA in der Nähe des Luftkeimsammlers versprüht wurden, warten Sie mindestens 5 Minuten, bevor Sie mit dem Probenahmezyklus beginnen. - Starten Sie den Probenahmezyklus und verlassen Sie den Probenahmebereich langsam, um eine Unterbrechung des Luftstroms zu vermeiden.
KRITISCH: Aerosolisieren Sie während eines Probenahmezyklus keine Flüssigkeiten in der Nähe des Luftkeimsammlers, da dies zu hohen nicht lebensfähigen Zahlen führt. - Wenn die Probenahme abgeschlossen ist, rufen Sie den Laserpartikelzähler ab. Zeichnen Sie die durchschnittliche Partikelzahl für 0,5 μm auf. Einige Einrichtungen können auch 5,0 μm verfolgen und einen Trend aufweisen.
- Wiederholen Sie die Schritte 2.3.3-2.3.6 für die nächste Probenahmestelle. Wenn Sie sich zwischen Räumen oder BSCs bewegen, wischen Sie die Außenseite des nicht lebensfähigen Partikelsammlers mit 70 % sIPA oder einem zugelassenen Desinfektionsmittel ab. Vermeiden Sie es, Desinfektionsmittel in den isokinetischen Kopf zu gelangen, da dies zu ungenauen Partikelzählungen führen kann.
| Kategorie | Medien | Kulturelle Bedingungen | Beobachtung der Kultur | Befund | ||||||
| Umweltüberwachung | TSA (lebensfähige Luft) | 30 °C-35 °C, Luft, für mindestens 3 Tage | Ende der Inkubation | Die QS-Gruppe jeder Einrichtung sollte Alarm- und Aktionsgrenzen für jeden Probenahmetyp und -standort festlegen. Die Auslösegrenzen für lebensfähige Proben auf der Grundlage der ISO-Klassifizierung können anhand von PIC/S 009-16 (Anhänge) 18 und ISO-14644-1 7 festgelegt werden. Die Auslösegrenzen für nicht lebensfähige Luftproben werden in der Regel auf einen Prozentsatz des ISO-Grenzwerts (z. B. 99 %) festgelegt. Alarmgrenzen für brauchbare Proben werden in der Regel auf einen Prozentsatz der Auslöse- oder ISO-Grenze (z. B. 95 %) festgelegt. Weitere Informationen zur Festlegung von Alarm- und Aktionsstufen und zur Validierung ausgewählter Kulturbedingungen finden Sie unter PDA TR-13 und USP<1116> 8,9. | ||||||
| SAB (lebensfähige Luft) | 20 °C-25 °C, Luft, mindestens 7 Tage | |||||||||
| TSALT (lebensfähige Oberfläche) | 30 °C-35 °C, Luft, für mindestens 3 Tage | Repräsentative Bilder von EM-Platten sind in Abbildung 2, Abbildung 3, Abbildung 4 und Abbildung 5 dargestellt. | ||||||||
| SABLT (lebensfähige Oberfläche) | 20 °C-25 °C, Luft, mindestens 7 Tage | |||||||||
| Prozessüberwachung | TSA (Absetzplatte) | 30 °C-35 °C, Luft, für mindestens 3 Tage | Nur zur Information. Liefert nützliche Informationen im Falle einer OOS-Untersuchung als Reaktion auf einen fehlgeschlagenen Produktsterilitätstest. | |||||||
| SAB (Absetzplatte) | 20 °C-25 °C, Luft, mindestens 7 Tage | In Abbildung 6 finden Sie ein Beispiel für eine positive Absetzplatte. | ||||||||
| Probenahme mit behandschuhten Fingerspitzen | TSALT | 30 °C-35 °C, Luft, für mindestens 48 Stunden an Tagen, gefolgt von 20 °C-25 °C für mindestens 5 Tage 19. | Das Akzeptanzkriterium für GFS ist <1 KBE/Platte (d. h. kein Wachstum) gemäß PIC/S 009-16 (Anhänge) 18. Die Akzeptanzkriterien können nach Ermessen der Qualitätssicherung der Einrichtung geändert werden. | |||||||
| Sterilitätsprüfung des Produkts | TSB (USP<71>) | 20 °C-25 °C, Luft, mindestens 14 Tage | Periodisch während der gesamten Inkubationszeit (Tage 3, 5, 7 und 14) | Kein Wachstum. | ||||||
| FTM (USP<71>) | 30 °C-35 °C, Luft, mindestens 14 Tage | |||||||||
| iFA+ (NIH-Methode) | 30 °C-35 °C, Luft, mindestens 14 Tage | Automatische Überwachung durch das BacT/ALERT Dual-T-Gerät. Eine Sichtkontrolle jeder Flasche am Ende der Inkubation auf Schimmelkugeln wird dringend empfohlen. | In Abbildung 8 finden Sie ein Beispiel für sichtbare Formkugeln, die vom BacT/ALERT nicht automatisch erkannt wurden. | |||||||
| iFN+ (NIH-Methode) | ||||||||||
| SAB (NIH-Methode) | 20 °C-25 °C für mindestens 14 Tage | Periodisch während der gesamten Inkubationszeit (Tage 3, 5, 7 und 14) | ||||||||
Tabelle 1: Zusammenfassung der empfohlenen Kulturbedingungen und der erwarteten Ergebnisse. Bei den hier beschriebenen Kulturbedingungen handelt es sich um Empfehlungen, die auf einem validierten Programm basieren, das am NIH verwendet wird. Jeder Endbenutzer muss sein eigenes mikrobiologisches Testprogramm validieren. Die mikrobiellen Kontroll- und Teststrategien können von Institut zu Institut unterschiedlich sein, abhängig von Variablen wie dem Design der Anlage, der Flora der Anlage und der Klassifizierung des Produktrisikos.
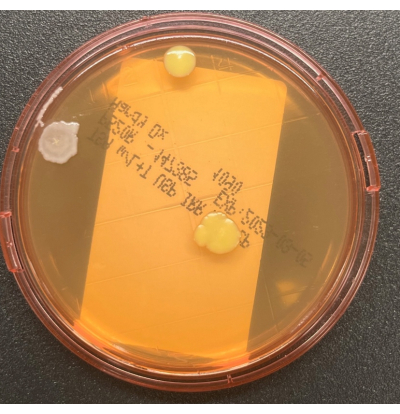
Abbildung 2: Wachstum auf der TSALT-Platte. Die TSALT-Oberflächenprobenahmeplatte zeigt drei KBE von zwei unterschiedlichen Koloniemorphologien. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
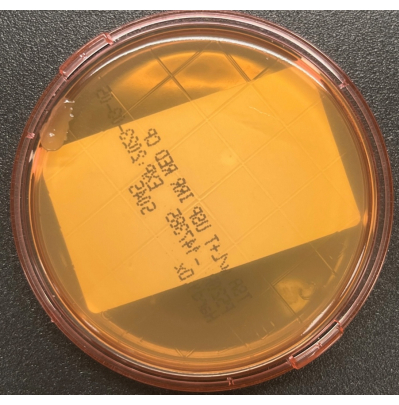
Abbildung 3: Verschmutzung der TSALT-Platte während der Entnahme. Die TSALT-Oberflächenkultur zeigt eine einzelne Kolonie am Rand der Platte, was auf eine schlechte aseptische Handhabung während des Probenahmeprozesses hinweist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Kultur, die mit einem Probenahmekopf für kontaminierte Luft gewonnen wurde. Beispiel einer aktiven TSA-Luftprobenahmekultur mit >100 koloniebildenden Einheiten (KBE) gemischter Morphologien. Das Wachstumsmuster deutet auf eine Kontamination des Probenahmekopfes hin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Kein Wachstum auf einer TSA-aktiven, lebensfähigen Luftplatte. TSA-aktive, lebensfähige Luftplatte, die nach der Inkubation kein Wachstum zeigt. Im Bild sind Einkerbungen des aktiven Luftkeimsammlerkopfes zu sehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Prozessüberwachung
- Absetzplatten (passive Luftüberwachung)
- Platzieren Sie beschriftete TSA- und SAB-Schilder in der Nähe des Arbeitsbereichs, jedoch in einem Bereich, der die Prüfung nicht beeinträchtigt. Dokumentieren Sie die Startzeit der Probenahme und öffnen Sie beide Platten aseptisch, indem Sie die Deckel auf eine saubere Oberfläche im BSC abseits des Arbeitsbereichs stellen.
- Die Absetzplatten dürfen maximal 4 h geöffnet sein, um ein Austrocknen des Agars zu verhindern. Schließen Sie die Deckel der Platten am Ende der Verarbeitung. Verpacken Sie die Platten locker und inkubieren Sie die Kulturen wie in Tabelle 1 beschrieben. Abbildung 6 zeigt eine einzelne Kolonieverunreinigung auf einer TSA-Luftabsetzplatte.
- Probenahme mit behandschuhten Fingerspitzen (GFS)
- Besorgen Sie sich zwei beschriftete TSALT-Platten. Entfernen Sie aseptisch den Deckel einer Platte und legen Sie sie auf eine saubere Arbeitsfläche, die vom Probenahmebereich entfernt ist.
- Rollen Sie vorsichtig die Fingerkuppe und den Daumen einer Hand auf der Oberfläche der Platte (Abbildung 7). Beproben Sie die größte Oberfläche jedes Fingers/Daumens und nicht die Spitze. Verwenden Sie genügend Kraft, um leichte Vertiefungen auf dem Agar zu machen, ohne die Agaroberfläche zu reißen.
- Setzen Sie den Deckel aseptisch wieder auf den Teller und wiederholen Sie Schritt 3.2.2 für die andere Hand. Desinfizieren Sie die Hände nach Abschluss der Probenahme mit 70 % sIPA. Verpacken Sie die Platten locker und inkubieren Sie die Kulturen wie in Tabelle 1 beschrieben.
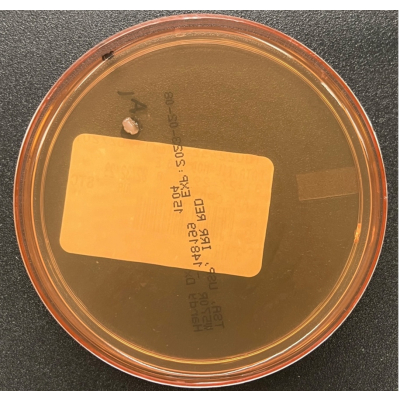
Abbildung 6: Wachstum auf einer TSA-Luftabsetzplatte. Eine TSA-Luftabsetzplatte, die eine einzelne Kolonie eines Schadstoffs darstellt, der während der passiven Luftprozessüberwachung im BSC kultiviert wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 7: Probenahme der Fingerkuppe mit Handschuhen. Die korrekte Methode zur Gewinnung von Proben aus behandschuhten Fingerspitzen unter Verwendung der größten Oberfläche (oder des größten Polsters) jedes Fingers/Daumens ist auf der linken Seite dargestellt. Der fehlerhafte Prozess, bei dem nur die Fingerspitze abgetastet wird, ist auf der rechten Seite dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Sterilitätsprüfung durch direkte Produktinokulation
- Direkte Inokulation nach USP<71>
- Besorgen Sie sich für jeden eingereichten Testartikel eine etikettierte Flasche mit tryptischer Sojabrühe (TSB) und eine Flasche mit etikettiertem flüssigem Thioglykolatmedium (FTM). Besorgen Sie sich für die Testsitzung eine TSALT- und eine SABLT-Platte für die Probenahme von brauchbaren Oberflächen, eine TSA- und eine SAB-Platte für die Absetzplatten und zwei TSALT-Platten für GFS.
- Kittel für Arbeiten innerhalb des BSC gemäß Schritt 1.2. Reinigen Sie die BSC gemäß Schritt 1.4. Stellen Sie die Materialien gemäß Schritt 1.5 in die BSC ein. Führen Sie eine Kontaktprobenahme des kritischen Arbeitsbereichs gemäß Schritt 2.1 durch und wischen Sie die Oberfläche nach der Probenahme mit 70 % sIPA ab. Bereiten Sie die TSA- und SAB-Absetzplatten in der Nähe des Arbeitsbereichs gemäß Schritt 3.1 vor.
- Besorgen Sie sich den Testartikel und die dazugehörigen TSB- und FTM-Flaschen. Wenn die TSB- und FTM-Flaschen ein Septum haben, entfernen Sie die Schutzkappen von jeder Flasche und wischen Sie das Septum mit einem sterilen Alkoholtuch ab. Wenn die TSB- und FTM-Flaschen einen Schraubverschluss haben, lösen Sie den Verschluss von den Flaschen (aber entfernen Sie den Verschluss nicht).
- Wirbeln Sie den Prüfling, um eine homogene Suspension zu gewährleisten. Beimpfen Sie die Flaschen mit dem validierten Volumen des Prüflings (bis zu 10 ml/Flasche) mit einer sterilen Spritze und einer Injektionsnadel (für Septumkappen) oder einer Pipette (für Schraubverschlüsse).
- Wischen Sie das Septum nach der Inokulation mit einem sterilen Alkoholtuch ab und setzen Sie eine sterile Entlüftungseinheit ein, um den Luftaustausch während der Inkubation zu ermöglichen. Bei Flaschen mit Schraubverschluss schließen Sie die Flasche, aber lassen Sie den Verschluss 1/4 bis 1/2 Umdrehung locker, um den Luftaustausch während der Inkubation zu ermöglichen. Wiederholen Sie die Schritte 4.1.3 bis 4.1.5 für jeden Testartikel, der innerhalb dieser Sitzung getestet werden soll.
- Verschließen Sie die TSA- und SAB-Absetzplatten aseptisch und dokumentieren Sie die Endzeit der Probenahme. Führen Sie GFS gemäß Schritt 3.2 durch und wischen Sie die Handschuhe nach der Probenahme mit 70 % sIPA ab. Verpacken Sie die Platten locker und inkubieren Sie die Kulturen wie in Tabelle 1 beschrieben.
- Übertragen Sie alle Prüfmaterialien aus dem BSC und reinigen Sie den BSC gemäß Schritt 1.4.
- Direkte Inokulation nach der alternativen NIH-Sterilitätstestmethode
- Besorgen Sie sich für jeden Prüfartikel eine mit der Bezeichnung i FA+, eine mit derBezeichnung iFN+ und eine SAB-Platte. Besorgen Sie sich für die Testsitzung eine TSALT- und eine SABLT-Platte für die Probenahme von brauchbaren Oberflächen, eine TSA- und eine SAB-Platte für die Absetzplatten und zwei TSALT-Platten für GFS.
- Kittel für Arbeiten innerhalb des BSC gemäß Schritt 1.2. Reinigen Sie die BSC gemäß Schritt 1.4. Stellen Sie die Materialien gemäß Schritt 1.5 in die BSC ein. Führen Sie eine Kontaktprobenahme des kritischen Arbeitsbereichs gemäß Schritt 2.1 durch und wischen Sie die Oberfläche nach der Probenahme mit 70 % sIPA ab. Bereiten Sie die TSA- und SAB-Absetzplatten in der Nähe des Arbeitsbereichs gemäß Schritt 3.1 vor.
- Besorgen Sie sich den Prüfling und die zugehörige iFA+, iFN+ und SAB-Platte. Entfernen Sie die Schutzkappen von den iFA+ und iFN+ Flaschen und wischen Sie das Septum mit einem sterilen Alkoholtuch ab.
- Wirbeln Sie den Prüfling, um eine homogene Suspension zu gewährleisten. Beimpfen Sie die Flaschen mit dem validierten Volumen des Prüflings (bis zu 10 ml/Flasche) mit einer sterilen Spritze und einer Injektionsnadel. Wischen Sie das Septum nach der Impfung mit einem sterilen Alkoholtuch ab. Inkubieren Sie die Flaschen auf dem BacT/ALERT Dual-T-Gerät wie in Tabelle 1 beschrieben.
- Beimpfen Sie die SAB-Platte mit einer Pipette mit der validierten Menge des Testartikels (nicht mehr als 500 μl/Platte) und streifen Sie sie mit einer sterilen Schlaufe zur Isolierung ein. 10 Minuten stehen lassen, um sicherzustellen, dass die Probe nicht auf den Plattendeckel läuft, wenn sie zur Inkubation umgedreht wird. Legen Sie jede mit dem Prüfling beimpfte SAB-Platte in eine Plastiktüte, binden Sie sie locker zusammen und inkubieren Sie sie wie in Tabelle 1 beschrieben.
- Verschließen Sie die TSA- und SAB-Absetzplatten aseptisch und dokumentieren Sie die Endzeit der Probenahme. Führen Sie die GFS wie in Schritt 3.2 beschrieben durch und wischen Sie die Handschuhe nach der Probenahme mit 70 % sIPA ab. Verpacken Sie die Platten locker und inkubieren Sie die Kulturen wie in Tabelle 1 beschrieben. Die visuelle Inspektion der BacT/ALERT-Flaschen am Ende der Inkubationszeit ist unerlässlich, um Formkugeln zu erkennen, die vom Gerät möglicherweise nicht erkannt wurden (Abbildung 8).
- Übertragen Sie alle Prüfmaterialien aus dem BSC und reinigen Sie den BSC gemäß Schritt 1.4.
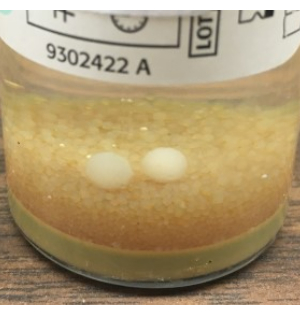
Abbildung 8: Wachstum von Schimmelpilzen, die vom BacT/ALERT nicht erkannt wurden. Beispiel für mit bloßem Auge sichtbare Formkugeln, die vom BacT/ALERT-System nicht automatisch erkannt wurden. Basierend auf diesen Erkenntnissen empfehlen wir eine terminale Sichtprüfung aller BacT/ALERT-Flaschen und die Hinzufügung der SAB-Platte für Pilzkulturen mit der alternativen NIH-Sterilitätstestmethode. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Die erwarteten Ergebnisse sind in Tabelle 1 beschrieben. Die EM-Daten sollten überprüft und mit einer geeigneten Untersuchung und Reaktion auf Maßnahmen, Warnungen oder Abweichungen von ISO-Grenzwerten nachverfolgt werden. Tritt eine Abweichung bei nicht lebensfähigen Partikeln auf, sollte nach ISO 14644-Anhang A, Abschnitt A.5.57 vorgegangen werden. Wenn die Abweichung auf ein sofort erkennbares abnormales Ereignis zurückzuführen ist, sollten die ursprünglichen Probenahmee...
Diskussion
Es gibt mehrere kritische Bereiche in diesem Protokoll, darunter die Aufrechterhaltung der aseptischen Technik und des unidirektionalen Luftstroms in Reinräumen und den BSCs. Zu den Best Practices gehört das langsame und bewusste Handeln, um Turbulenzen zu minimieren. Aseptische Manipulationen sollten von der Seite des Produkts durchgeführt werden, nicht von oben. Empfohlen werden eine Closed-System-Verarbeitung und die Verwendung von endsterilisierten Rohstoffen. Das Sprechen in kritischen Bereichen und das Anlehnen ...
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Diese Arbeit wurde durch das Intramurale Forschungsprogramm des National Institutes of Health Clinical Center unterstützt. Der Inhalt liegt in der alleinigen Verantwortung der Autoren und stellt nicht die offizielle Meinung der National Institutes of Health dar.
Materialien
| Name | Company | Catalog Number | Comments |
| 20-25°C Incubator | Lab preference | ||
| 30-35°C Incubator | Lab preference | ||
| Alcohol-based hand sanitizer | Lab preference | ||
| BacT/ALERT Dual-T instrument | BioMerieux Industry | ||
| Beard cover | Lab preference | ||
| Biosafety cabinet (BSC) | Lab preference | ||
| Cleanroom shoes | Lab preference | ||
| Fluidthioglycollate medium (FTM) | Hardy Diagnostics | U84 | USP |
| Handheld cleaning mop | Contec | 2665LF | |
| Hypodermic needle | Lab preference | ||
| iFA+ BacT/ALERT bottle | Biomerieux | 412990 | |
| iFN+ BacT/ALERT bottle | Biomerieux | 412991 | |
| Isokinetic head | Lab preference | ||
| Laser particle counter | TSI Incorporated | 9500-01 | |
| LpH III | Steris | 1S16CX | |
| Mirror | Lab preference | ||
| Non-sterile bouffant | Lab preference | ||
| Non-sterile gloves | Lab preference | ||
| Non-sterile shoe covers | Lab preference | ||
| Non-sterile sleeve covers | Lab preference | ||
| Parafilm | Lab preference | ||
| Peridox RTU | Contec | CR85335IR | |
| Plastic bag | Lab preference | ||
| Sabouraud Dextrose Agar with Lecithinase and Tween (SABLT) | Hardy Diagnostics | P595 | USP, irradiated |
| Sabouraurd Dextrose Agar (SAB) | Hardy Diagnostics | W565 | USP, irradiated |
| Safety glasses | Lab preference | ||
| Scrubs (top and bottom) | Lab preference | ||
| Spor-Klenx RTU | Steris | 6525M2 | |
| Sterile 70% isopropyl alcohol (IPA) | Decon CiDehol | 8316 | |
| Sterile alcohol wipe | Lab preference | ||
| Sterile boot covers | Kimberly Clark | Cat# varies based on size | |
| Sterile coveralls | Kimberly Clark | Cat# varies based on size | |
| Sterile face mask | Lab preference | ||
| Sterile gloves | Lab preference | ||
| Sterile hood | Kimberly Clark | Cat# varies based on size | |
| Sterile low-lint wipes | Texwipe | TX3210 | |
| Sterile mop cleaning pads | Contec | MEQT0002SZ | |
| Sterile sleeve covers | Kimberly Clark | 36077 | |
| Sterile spreading rod | Fisher Scientific | 14665231 | |
| Sterile syringe | Lab preference | ||
| Tacky mats | Lab preference | ||
| Tryptic Soy Agar (TSA) | Hardy Diagnostics | W570R | USP, irradiated |
| Tryptic Soy Agar with Lecithinase and Tween (TSALT) | Hardy Diagnostics | P520R | USP, irradiated |
| Tryptic Soy Broth (TSB) | Hardy Diagnostics | U46 | USP |
| Tubing | Lab preference | ||
| Vesphene III | Steris | 1S15CX | |
| Viable air sampler | Hardy Diagnostics | BAS22K | |
| Vortex | Lab preference |
Referenzen
- Cundell, T., Atkins, J. W., Lau, A. F. Sterility testing for hematopoietic stem cells. Journal of Clinical Microbiology. , (2023).
- United States Food and Drug Administration. Guidance for Industry. Sterile Drug Products Produced by Aseptic Processing - Current Good Manufacturing Practice. United States Food and Drug Administration. , (2004).
- United States Pharmacopeia - National Formulary. USP<71> Sterility Tests in USP43-NF38. United States Pharmacopeia - National Formulary. , (2022).
- England, M. R., Stock, F., Gebo, J. E. T., Frank, K. M., Lau, A. F. Comprehensive evaluation of compendial USP<71>, BacT/Alert Dual-T, and Bactec FX for detection of product sterility testing contaminants. Journal of Clinical Microbiology. 57 (2), 01548 (2019).
- Gebo, J. E. T., East, A. D., Lau, A. F. A side-by-side comparison of clinical versus current good manufacturing practices (cGMP) microbiology laboratory requirements for sterility testing of cellular and gene therapy products. Clinical Microbiology Newsletter. 43 (21), 181-191 (2021).
- Gebo, J. E. T., Lau, A. F. Sterility testing for cellular therapies: What is the role of the clinical microbiology laboratory. Journal of Clinical Microbiology. 58 (7), 01492 (2020).
- International Organization for Standardization. ISO 14644-1:2015 Cleanrooms and associated controlled environments - Part 1: Classification of air cleanliness by particle concentration. International Organization for Standardization. , (2015).
- Parenteral Drug Association. PDA Technical Report No. 13 Revised 2022 (TR 13) Fundamentals of an Environmental Monitoring Program. Parenteral Drug Association, Inc. , (2022).
- United States Pharmacopeia - National Formulary. USP<1116> Microbiological Evaluation of Cleanrooms and Other Controlled Environments in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Guinet, R., et al. Multicenter study on incubation conditions for environmental monitoring and aseptic process simulation. PDA journal of pharmaceutical science and technology. 71 (1), 43-49 (2017).
- Gordon, O., Berchtold, M., Staerk, A., Roesti, D. Comparison of different incubation conditions for microbiological environmental monitoring. PDA Journal of Pharmaceutical Science and Technology. 68 (5), 394-406 (2014).
- Anders, H. J., et al. Multisite qualification of an automated incubator and colony counter for environmental and bioburden applications in pharmaceutical microbiology. PDA Journal of Pharmaceutical Science and Technology. , (2022).
- United States Pharmacopeia - National Formulary. USP<1072> Disinfectants and Antiseptics. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. USP<1071> Rapid Microbial Tests for Release of Sterile Short-Life Products: A Risk-Based Approach in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. PUSP<1223> Validation of Alternative Microbiological Methods in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Parenteral Drug Association. PDA Technical Report No. 33, Revised 2013 (TR 33) Evaluation, Validation and Implementation of Alternative and Rapid Microbiological Methods. Parenteral Drug Association, Inc. , (2013).
- Putnam, N. E., Lau, A. F. Comprehensive study identifies a sensitive, low-risk, closed-system model for detection of fungal contaminants in cell and gene therapy products. Journal of Clinical Microbiology. 59 (11), 0135721 (2021).
- Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation. Guide to Good Manufacturing Practice for Medicinal Products Annexes (PE 009-16 (Annexes)). Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation Scheme. , (2022).
- United States Pharmacopeia - National Formulary. USP<825> Radiopharmaceuticals - Preparation, Compounding, Dispensing, and Repackaging in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten