需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
洁净室环境和细胞疗法的微生物控制和监测策略
摘要
该协议总结了在洁净室环境中最大限度地减少微生物生物负荷的最佳实践,并包括环境监测、过程监控和产品无菌测试等策略。它与需要满足当前良好组织规范标准和当前良好生产规范标准的制造和测试设施相关。
摘要
一个经过充分验证的整体计划,包括强大的防护服、清洁、环境监测和人员监测措施,对于最大限度地减少细胞疗法制造套件和相应测试实验室中的微生物生物负荷至关重要,以确保设施在受控状态下运行。通过质量控制措施(如无菌测试)确保产品安全是最低限度操纵(第361条)和超过最低限度操纵(第351条)人体细胞、组织以及细胞和组织产品 ( HCT/Ps)的监管要求。在本视频中,我们提供了有关如何开发和整合在洁净室环境中操作的最佳无菌实践的逐步指南,包括穿衣、清洁、材料分期、环境监测、过程监控和使用直接接种的产品无菌测试,由美国药典 (USP<71>) 和美国国立卫生研究院 (NIH) 替代无菌测试方法提供。该协议旨在作为预计符合当前良好组织规范(cGTP)和当前良好生产规范(cGMP)的企业的参考指南。
引言
通过环境监测 (EM)、过程监测和产品无菌测试实施强大的微生物监测计划是细胞治疗实验室当前良好组织规范 (cGTP) 和当前良好生产规范 (cGMP) 的监管要求1。此外,美国食品和药物管理局 (FDA) 预计,对产品进行质量控制 (QC) 测试的实验室还应采用与无菌灌装操作相当的设施和控制措施2。
该协议有四个主要部分:1)无菌实践,包括人员穿长袍,清洁和分期材料;2)EM,包括活性空气和表面培养物以及非活性颗粒空气监测;3)过程监控,包括沉降板和戴手套的指尖取样;4)通过药典美国药典(USP)<71>方法3或NIH替代无菌测试方法4进行产品无菌测试。当结合使用时,这些措施可以成为确保设施保持控制状态的有效方法。
这里描述的技术并不新颖;然而,监管机构和专业组织的现行标准缺乏细节,导致缺乏微生物监测或实施非标准化实践,特别是在现场制造和产品无菌测试迅速出现的学术中心1,5,6.该协议可用作创建微生物监测和控制程序的指南,该程序与最终用户验证和风险评估结合使用时符合法规要求。
研究方案
1. 无菌实践
- 洁净室空间的人员防护服
注意:此过程基于在未分类空间中初始穿上防护服,然后进入国际标准化组织 (ISO) 8 区域,然后进入 ISO7 区域。该程序与试图将现有空间转换为洁净室功能的实验室相关。理想情况下,所有初始防护服都将在 ISO8 分类空间(而不是非分类空间)中进行。- 固定松散的头发。洗手,换上磨砂膏(最好穿长袖磨砂上衣和全长磨砂裤)。收集并换上带鞋套的洁净室鞋。
- 首先使用含酒精的洗手液消毒双手,然后在以下每个步骤之间再次消毒:如果适用,请戴上非无菌手套,然后戴上胡须套(适用于任何数量的可见面部毛发)。穿上非无菌的蓬松剂,如果未使用长袖磨砂上衣,则用非无菌袖子覆盖前臂。
- 取下鞋套,取下鞋套后,每只脚踩在 ISO8 前厅门前的粘性垫子上。在进入之前,确保整个脚都与粘性垫接触。丢弃鞋套,并用 70% 无菌异丙醇 (sIPA) 对手套和门把手进行净化。进入ISO8前厅。
- 收集无菌头罩、无菌口罩、无菌工作服、无菌靴套和安全眼镜。用 70% sIPA 对手套进行净化。戴上安全眼镜,按照步骤1.5将材料放在干净的表面上。
- 在专用的洁净室鞋上穿上一双新的非无菌鞋套,然后踏上二级前厅前的粘性垫子。确保每只脚的整个都与粘性垫接触。用 70% sIPA 对手套进行净化。收拾好分阶段的礼服用品,进入二级ISO7前厅,留在分界线的肮脏一侧。
- 戴上无菌兜帽和无菌工作服,仅接触防护服材料的内部,并确保兜帽的颈部塞入工作服内以形成完全密封。戴上辅助无菌靴套。在每个穿衣步骤之间用 70% 的 sIPA 对手套进行净化。
- 验证是否正确穿上了防护服,用 70% sIPA 对手套进行净化,然后进入 ISO7 空间。
注意:定期检查防护服材料的完整性。如果受到损害,请立即退出洁净室并重新穿上防护服。
- 穿上生物安全柜 (BSC)
- 按照上面的步骤1.1穿礼服,并采取这些额外的做法。
- 收集无菌手套和无菌套筒。按照步骤1.4清洁平衡计分卡,并按照步骤1.5分阶段材料。用 70% sIPA 对手套进行净化。
- 无菌地将无菌袖子套在工作服上,如果存在,请使用拇指环。在现有手套上戴上无菌手套,确保手套的袖口延伸到无菌套管上。在每一步之间用70%的sIPA对手套进行消毒。输入平衡计分卡。
注意:定期检查防护服材料的完整性。如果受到损害,请立即退出洁净室并重新穿上防护服。
- 礼服材料的脱落
- 退出平衡计分卡,小心地取下顶部的一副手套和无菌套筒。用 70% sIPA 净化内手套。
- 进入次要前厅,然后进入主前厅,等待门在每一步之间完全关闭。按以下顺序取出材料:外部无菌靴套、工作服、头罩和面罩。
- 离开主前厅,脱下非无菌礼服。
注意:未分类空间中的删除顺序并不重要;但是,内部非无菌鞋套应保留在洁净室鞋上,以便存放在非机密空间中。 - 使用含酒精的洗手液消毒双手,然后穿上街头服装。
- 清洁洁净室表面和平衡计分卡
- 组装手持式清洁拖把,或获得干净的低绒湿巾。如果使用低绒擦拭布,请将湿巾折叠成四等份,并在每个表面之间旋转。用经批准的消毒剂浸透拖把头或低绒湿巾。
- 从后到前(或从上到下)使用重叠的湿巾按以下顺序清洁平衡计分卡:HEPA扩散格栅(平衡计分卡的顶部),平衡计分卡的后壁,平衡计分卡的两侧壁,窗扇和工作台面。最后,使用70%sIPA擦拭平衡计分卡的窗扇,以去除任何残留的消毒剂。有关典型的平衡计分卡清洁模式,请参阅 图1 。
- 将材料和设备转移到分类环境中
- 对所有需要从非分类或较低分类区域转移到较高分类区域(例如,从 ISO8 到 ISO7 空间)的材料进行净化(即分阶段),以尽量减少微生物的转移。在相同ISO分类级别的区域之间转移材料不需要暂存。
注意:如果材料已经过最终灭菌并且装在多个袋子中,请取下外袋/袋子,然后将材料移入分类空间;无需擦拭内部袋子/袋子。 - 获取低绒湿巾,将湿巾折叠成四等份,以便在湿巾变脏时旋转到干净的一侧。用 70% sIPA 或经批准的消毒剂浸透湿巾。
- 使用重叠的湿巾擦拭材料/设备的外部。确保擦拭物品的所有区域,包括拉开包装密封件的内部以及设备上的角落/凹痕以及其他形状不规则的耗材。对于带轮子的设备,请确保在暂存过程中擦拭整个轮子(可能需要轻轻倾斜设备以允许轮子旋转)。
- 对所有需要从非分类或较低分类区域转移到较高分类区域(例如,从 ISO8 到 ISO7 空间)的材料进行净化(即分阶段),以尽量减少微生物的转移。在相同ISO分类级别的区域之间转移材料不需要暂存。

图 1:平衡计分卡清理模式示例。 从后到前(或从上到下)使用重叠的湿巾按以下顺序清洁平衡计分卡:HEPA扩散格栅(平衡计分卡的顶部),平衡计分卡的后壁,平衡计分卡的两侧壁,窗扇和工作台面。最后,使用70%sIPA擦拭平衡计分卡的窗扇,以去除任何残留的消毒剂。 请点击此处查看此图的大图。
2. 环境监测
- 可行的表面采样
- 按照步骤1.5分阶段采样所需的材料,并按照第1节进入分类空间。
注意:应在任何指定位置的空气采样之前进行表面采样。如果使用多个板对一个区域进行表面采样,请不要对完全相同的位置进行采样。仅使用接触板对平坦表面进行采样,以确保完全接触并避免对琼脂造成潜在损坏。 - 为每个采样点收集并标记一个含有卵磷脂酶和吐温 (TSALT) 平板的胰蛋白酶大豆琼脂和一个带有卵磷脂酶和吐温 (SABLT) 平板的 Sabouraud 葡萄糖琼脂。用一只手握住盘子的底部,无菌地取下盖子,小心不要触摸凸起的琼脂表面。
- 将凸起的琼脂接触被采样的表面,确保整个表面接触,并对平板施加牢固的压力。让板与表面接触至少 5 秒。
- 关键:不要在被采样的表面上横向移动板,因为这会将潜在的生长分散到表面积上,使单个菌落的分离变得困难。取样过程中不要对接触板施加过大的力,因为琼脂表面可能会破裂。
- 无菌更换盖子,小心不要接触凸起的琼脂表面。如果接触板具有锁定系统,请将盖子锁定到位。用 70% sIPA 清洁采样区域,以去除表面的任何残留介质。松散地装袋板,并如 表1所述孵育培养物。 图2显示了TSALT表面采样板上具有两种不同菌落形态的三个菌落形成单位(CFU)生长的代表性图像。 图3显示了TSALT板的污染,板边缘生长,这是由于样品收集过程中无菌技术不佳造成的。
- 按照步骤1.5分阶段采样所需的材料,并按照第1节进入分类空间。
- 可行的空气采样
- 按照步骤1.5分阶段采样所需的材料,并按照第1节进入分类空间。
- 为每个采样点收集并标记一个胰蛋白酶大豆琼脂 (TSA) 平板和一个萨伯罗葡萄糖琼脂 (SAB) 平板。通过仅夹住外边缘无菌取下采样头来准备空气采样器,以避免污染头部。
- 一只手握住采样头,无菌地将培养基放入采样器上的板架中。如果有一个插脚比其他插脚长,请先将介质插入较长的插脚上,然后将板向下推入其余的插脚以固定板。
- 无菌取下板盖,并将其放在清洁的表面上,直到采样完成。无菌更换并固定取样头,仅夹住外边缘以避免污染取样头。如果使用多头空气采样器,则对剩余介质重复步骤2.2.2-2.2.4。
- 将空气采样器放置在采样位置,采样头朝向气流运动的主要方向。确保来自非可行空气采样器的废气(如果同时采样)不会干扰可行的采样器。确保空气采样器设置为经过验证的设置,然后开始采样周期。
- 取样周期完成后,仅夹住外边缘,将取样头从取样器上取下,以免污染取样头。一只手握住采样头,无菌更换琼脂平板的盖子。从板架上取下板。松散地装袋板,并如 表1所述孵育培养物。
- 用70%sIPA对采样头和板架周围的区域进行消毒。无菌固定取样头,仅夹住外边缘。如果使用多头空气采样器,则对剩余介质重复步骤2.2.6和步骤2.2.7。
注: 图4显示了TSA活性空气采样培养物,其生长是由受污染的采样头引起的。相反, 图5表示没有增长的TSA主动空气采样培养物。在图像上可以看到来自采样头的空气冲击压痕。
- 非活菌取样
- 在每天使用采样活动之前,对激光粒子计数器进行零检查。将等速头直接连接到粒子计数器的采样端口,或根据需要固定在采样位置的一段管道上。
- 如果使用管子,请使用较短的长度,因为 >1 m 长的管子可能会导致计数 ≥1 μm 颗粒的问题,还可能导致管子中不必要的弯曲。确保粒子计数器设置为已验证的设置。建议设置大约 30 s 的延迟,以允许从采样区域退出,以避免采样期间气流中断。
- 将激光粒子计数器的等速头定位在采样位置,等速头朝向气流运动的主要方向。确保来自可行空气采样器的废气(如果同时采样)不会干扰非可行采样器。对于气流不是单向的或气流模式未知的区域,请确保等速头垂直朝上。
注意:如果旋转消毒剂或 70% sIPA 已在空气采样器附近雾化,请等待至少 5 分钟,然后再开始采样循环。 - 开始采样循环,并缓慢退出采样区域,以免中断气流。
关键:在采样周期内,不要雾化空气采样器附近的液体,因为这会导致高非活性计数。 - 采样完成后,检索激光粒子计数器。记录0.5μm的平均颗粒计数。一些设施还可能跟踪和趋势 5.0 μm。
- 对下一个采样位置重复步骤 2.3.3-2.3.6。如果在房间或平衡计分卡之间移动,请用 70% sIPA 或经批准的消毒剂擦拭无活力颗粒采样器的外部。避免在等速头内接触消毒剂,因为这可能导致颗粒计数不准确。
| 类别 | 媒体 | 培养条件 | 文化观察 | 结果 | ||||||
| 环境监测 | 运输安全管理局(可行空气) | 30°C-35°C,空气,至少3天 | 孵化结束 | 每个设施的质量保证小组应为每个采样类型和位置建立警报和操作限制。基于 ISO 分类的活样品的作用限值可以使用 PIC/S 009-16(附件)18 和 ISO-14644-1 7 进行指导。 非活性空气样品的作用限值通常设置为ISO限值的百分比(例如,99%)。活样品的警报限值通常设置为操作限值或ISO限值的百分比(例如,95%)。有关建立警报和行动级别以及验证所选培养条件的更多详细信息,请参阅 PDA TR-13 和 USP<1116>。 | ||||||
| SAB(可行空气) | 20°C-25°C,空气,至少7天 | |||||||||
| TSALT(活性表面) | 30°C-35°C,空气,至少3天 | EM板的代表性图像如图 2、图 3、 图4和 图5所示。 | ||||||||
| SABLT (活性表面) | 20°C-25°C,空气,至少7天 | |||||||||
| 过程监控 | TSA(沉降板) | 30°C-35°C,空气,至少3天 | 仅供参考。在针对产品无菌测试失败的 OOS 调查时提供有用的信息。 | |||||||
| SAB(沉降板) | 20°C-25°C,空气,至少7天 | 有关正沉降板的示例,请参见 图6 。 | ||||||||
| 戴手套的指尖采样 | 盐 | 30°C-35°C,空气,至少48小时,然后20°C-25°C至少5天 19。 | 根据 PIC/S 009-16(附件) 18,GFS 的可接受标准为 <1 CFU/板(即无生长)。可接受性标准可由设施 QA 自行决定修改。 | |||||||
| 产品无菌测试 | 电信标准化局 (USP<71>) | 20°C-25°C,空气,至少14天 | 在整个潜伏期(第 3、5、7 和 14 天)定期进行 | 没有增长。 | ||||||
| FTM (USP<71>) | 30°C-35°C,空气,至少14天 | |||||||||
| iFA+ (NIH 方法) | 30°C-35°C,空气,至少14天 | 通过 BacT/ALERT 双 T 仪器自动监测。强烈建议在孵育结束时目视检查每个瓶子是否有模具球。 | 有关 BacT/ALERT 无法自动检测到的可见模球示例,请参见 图 8 。 | |||||||
| iFN+ (NIH方法) | ||||||||||
| SAB(美国国立卫生研究院方法) | 20°C-25°C至少14天 | 在整个潜伏期(第 3、5、7 和 14 天)定期进行 | ||||||||
表1:推荐的培养条件和预期结果摘要。 此处描述的培养条件是基于NIH使用的经过验证的程序的建议。每个最终用户都需要验证自己的微生物学测试程序。各机构的微生物控制和检测策略可能因设施设计、设施菌群和产品风险分类等变量而异。
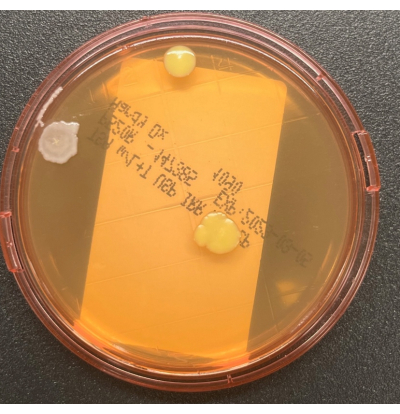
图2:TSALT板上的生长。 TSALT表面采样板显示了两种不同菌落形态的三个CFU。 请点击此处查看此图的大图。
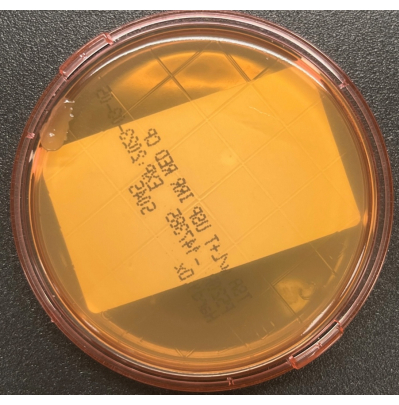
图 3:收集过程中 TSALT 板的污染。 TSALT表面培养物在板边缘显示单个菌落,表明在采样过程中无菌处理不良。 请点击此处查看此图的大图。

图4:使用受污染的空气采样头获得的培养物。 TSA 活性空气采样培养物示例显示混合形态的 >100 个菌落形成单位 (CFU)。生长模式表明取样头受到污染。 请点击此处查看此图的大图。

图 5:TSA 活性活空气板上没有生长。 TSA活性活空气板说明孵育后没有生长。在图像中可以看到主动空气采样器头的压痕。 请点击此处查看此图的大图。
3. 过程监控
- 沉降板(被动空气监测)
- 将贴有标签的 TSA 和 SAB 板放在工作区域附近,但放置在不会干扰测试的区域。记录采样开始时间,并无菌打开两个板,将盖子放在BSC中远离工作区域的干净表面上。
- 沉降板可以打开最长4小时,以防止琼脂变干。在处理结束时关闭板的盖子。松散地装袋板,并如 表1所述孵育培养物。 图6显示了TSA空气沉降板上的单个菌落污染物。
- 戴手套的指尖采样 (GFS)
- 获得两个标记的TSALT板。无菌取下一块板的盖子,并将其放在远离采样区域的干净工作表面上。
- 轻轻地将一只手的每个手指和拇指的垫子滚动在板的表面上(图7)。采样每个手指/拇指的最大表面积,而不是尖端。使用足够的力在琼脂上产生轻微的凹陷,而不会使琼脂表面破裂。
- 无菌地将盖子放回盘子上,另一只手重复步骤3.2.2。取样完成后用70%sIPA消毒双手。松散地装袋板,并如 表1所述孵育培养物。
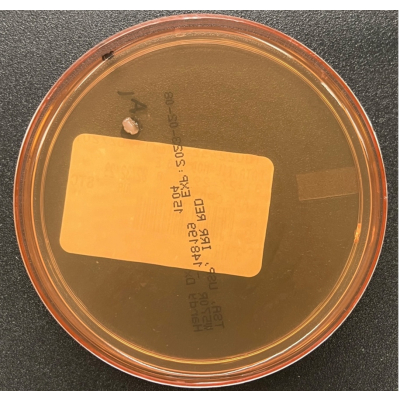
图 6:TSA 空气沉降板上的生长。 TSA 空气沉降板,说明在平衡计分卡中被动空气过程监测期间培养的污染物的单个菌落。 请点击此处查看此图的大图。

图 7:戴手套的指尖采样。 使用每个手指/拇指的最大表面积(或垫)获取戴手套指尖样品的正确方法显示在左侧。右侧显示了仅对指尖进行采样的错误过程。 请点击此处查看此图的大图。
4. 通过直接产品接种进行无菌测试
- USP<71 后直接接种>
- 为提交的每篇测试文章获取一个标记的胰蛋白酶大豆肉汤 (TSB) 瓶和一个标记的巯基乙酸盐液体培养基 (FTM) 瓶。对于测试会话,获取一个用于可行表面采样的TSALT和一个SABLT,一个用于沉降板的TSA和一个SAB板,以及两个用于GFS的TSALT板。
- 按照步骤1.2在平衡计分卡内工作的礼服。按照步骤1.4清洁平衡计分卡。按照步骤1.5将材料分阶段到平衡计分卡中。按照步骤2.1对关键工作区域进行接触采样,采样后用70%sIPA擦拭表面。按照步骤 3.1 在工作区附近准备 TSA 和 SAB 沉降板。
- 获取测试物品以及相关的 TSB 和 FTM 瓶。如果 TSB 和 FTM 瓶有隔膜,请取下每个瓶子的保护盖,然后用无菌酒精湿巾擦拭隔膜。如果 TSB 和 FTM 瓶子有螺旋盖,请松开瓶盖(但不要取下盖子)。
- 涡旋测试物品以确保均匀的悬浮液。使用无菌注射器和皮下注射针头(用于隔膜盖)或移液器(用于螺旋盖)用有效体积的测试物品(最多 10 mL/瓶)接种瓶子。
- 接种后,用无菌酒精湿巾擦拭隔膜,并插入无菌通风装置以允许在孵育期间进行空气交换。对于螺旋盖瓶,关闭瓶子,但将盖子松开 1/4 至 1/2 圈,以便在孵育期间进行空气交换。对要在该会话中测试的每个测试文章重复步骤 4.1.3-4.1.5。
- 无菌关闭 TSA 和 SAB 沉降板,并记录采样结束时间。按照步骤3.2执行GFS,采样后用70%sIPA擦拭手套。松散地装袋板,并如 表1所述孵育培养物。
- 将所有测试材料移出平衡计分卡,并按照步骤1.4清洁平衡计分卡。
- 遵循NIH替代无菌测试方法的直接接种
- 为每个测试物品获得一个标记的i FA +,一个标记的iFN+和一个SAB板。对于测试会话,获取一个用于可行表面采样的TSALT和一个SABLT,一个用于沉降板的TSA和一个SAB板,以及两个用于GFS的TSALT板。
- 按照步骤1.2在平衡计分卡内工作的礼服。按照步骤1.4清洁平衡计分卡。按照步骤1.5将材料分阶段到平衡计分卡中。按照步骤2.1对关键工作区域进行接触采样,采样后用70%sIPA擦拭表面。按照步骤 3.1 在工作区附近准备 TSA 和 SAB 沉降板。
- 获取测试物品和相关的 iFA+、iFN+ 和 SAB 板。取下i FA+和iFN+瓶的保护盖,然后用无菌酒精湿巾擦拭隔膜。
- 涡旋测试物品以确保均匀的悬浮液。使用无菌注射器和皮下注射针头用经过验证的测试物品体积(最多 10 mL/瓶)接种瓶子。接种后用无菌酒精湿巾擦拭隔膜。如 表1所述,在BacT/ALERT双T仪器上孵育瓶子。
- 使用移液器,用验证量的测试物品(不超过 500 μL/板)接种 SAB 板,并使用无菌环划线进行分离。静置10分钟,以确保倒置孵育时样品不会跑到板盖上。将接种有测试物品的每个SAB板放入塑料袋中,松散地扎结,并如 表1中所述孵育。
- 无菌关闭 TSA 和 SAB 沉降板,并记录采样结束时间。按照步骤3.2中所述执行GFS,取样后用70%sIPA擦拭手套。松散地装袋板,并如 表1所述孵育培养物。在孵育期结束时对BacT/ALERT瓶进行目视检查对于检测仪器可能未检测到的模具球至关重要(图8)。
- 将所有测试材料移出平衡计分卡,并按照步骤1.4清洁平衡计分卡。
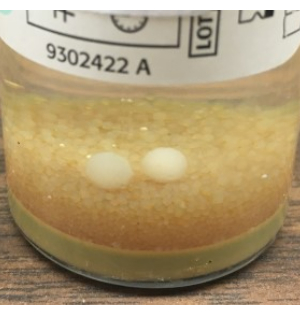
图 8:BacT/ALERT 无法检测到的霉菌生长。BacT/ALERT系统无法自动检测到肉眼可见的模具球示例。基于这些发现,我们建议对所有BacT/ALERT瓶进行终端目视检查,并使用NIH替代无菌测试方法添加用于真菌培养的SAB板。 请点击此处查看此图的大图。
结果
预期结果如 表1所示。应审查 EM 数据,并随访适当的调查和对操作、警报或 ISO 限值偏移的响应。如果非活性颗粒发生偏移,则应按照ISO 14644-附录A,第A.5.5 7节进行。如果偏移可归因于立即可识别的异常事件,则应记录原始采样结果,并应添加注释以忽略原始结果,并应提供异常发生的详细描述。可以在相关地点采集另一个样本。如果偏移不能归因于立即可识别的异...
讨论
该协议中有几个关键领域,包括保持无菌技术和洁净室和平衡计分卡内的单向气流。 最佳做法包括缓慢而有意识地移动,以尽量减少湍流。无菌操作应从产品的侧面进行,而不是从上方进行。建议进行封闭系统处理,并使用经过终端灭菌的原材料。应避免在关键区域说话并靠在墙壁或设备上。同样,在无菌处理完成之前,应避免不必要的触摸非无菌物品和捡起掉落的物品。平衡计分卡中的材料应...
披露声明
作者声明不存在利益冲突。
致谢
这项工作得到了美国国立卫生研究院临床中心的校内研究计划的支持。内容完全由作者负责,不代表美国国立卫生研究院的官方观点。
材料
| Name | Company | Catalog Number | Comments |
| 20-25°C Incubator | Lab preference | ||
| 30-35°C Incubator | Lab preference | ||
| Alcohol-based hand sanitizer | Lab preference | ||
| BacT/ALERT Dual-T instrument | BioMerieux Industry | ||
| Beard cover | Lab preference | ||
| Biosafety cabinet (BSC) | Lab preference | ||
| Cleanroom shoes | Lab preference | ||
| Fluidthioglycollate medium (FTM) | Hardy Diagnostics | U84 | USP |
| Handheld cleaning mop | Contec | 2665LF | |
| Hypodermic needle | Lab preference | ||
| iFA+ BacT/ALERT bottle | Biomerieux | 412990 | |
| iFN+ BacT/ALERT bottle | Biomerieux | 412991 | |
| Isokinetic head | Lab preference | ||
| Laser particle counter | TSI Incorporated | 9500-01 | |
| LpH III | Steris | 1S16CX | |
| Mirror | Lab preference | ||
| Non-sterile bouffant | Lab preference | ||
| Non-sterile gloves | Lab preference | ||
| Non-sterile shoe covers | Lab preference | ||
| Non-sterile sleeve covers | Lab preference | ||
| Parafilm | Lab preference | ||
| Peridox RTU | Contec | CR85335IR | |
| Plastic bag | Lab preference | ||
| Sabouraud Dextrose Agar with Lecithinase and Tween (SABLT) | Hardy Diagnostics | P595 | USP, irradiated |
| Sabouraurd Dextrose Agar (SAB) | Hardy Diagnostics | W565 | USP, irradiated |
| Safety glasses | Lab preference | ||
| Scrubs (top and bottom) | Lab preference | ||
| Spor-Klenx RTU | Steris | 6525M2 | |
| Sterile 70% isopropyl alcohol (IPA) | Decon CiDehol | 8316 | |
| Sterile alcohol wipe | Lab preference | ||
| Sterile boot covers | Kimberly Clark | Cat# varies based on size | |
| Sterile coveralls | Kimberly Clark | Cat# varies based on size | |
| Sterile face mask | Lab preference | ||
| Sterile gloves | Lab preference | ||
| Sterile hood | Kimberly Clark | Cat# varies based on size | |
| Sterile low-lint wipes | Texwipe | TX3210 | |
| Sterile mop cleaning pads | Contec | MEQT0002SZ | |
| Sterile sleeve covers | Kimberly Clark | 36077 | |
| Sterile spreading rod | Fisher Scientific | 14665231 | |
| Sterile syringe | Lab preference | ||
| Tacky mats | Lab preference | ||
| Tryptic Soy Agar (TSA) | Hardy Diagnostics | W570R | USP, irradiated |
| Tryptic Soy Agar with Lecithinase and Tween (TSALT) | Hardy Diagnostics | P520R | USP, irradiated |
| Tryptic Soy Broth (TSB) | Hardy Diagnostics | U46 | USP |
| Tubing | Lab preference | ||
| Vesphene III | Steris | 1S15CX | |
| Viable air sampler | Hardy Diagnostics | BAS22K | |
| Vortex | Lab preference |
参考文献
- Cundell, T., Atkins, J. W., Lau, A. F. Sterility testing for hematopoietic stem cells. Journal of Clinical Microbiology. , (2023).
- United States Food and Drug Administration. Guidance for Industry. Sterile Drug Products Produced by Aseptic Processing - Current Good Manufacturing Practice. United States Food and Drug Administration. , (2004).
- United States Pharmacopeia - National Formulary. USP<71> Sterility Tests in USP43-NF38. United States Pharmacopeia - National Formulary. , (2022).
- England, M. R., Stock, F., Gebo, J. E. T., Frank, K. M., Lau, A. F. Comprehensive evaluation of compendial USP<71>, BacT/Alert Dual-T, and Bactec FX for detection of product sterility testing contaminants. Journal of Clinical Microbiology. 57 (2), 01548 (2019).
- Gebo, J. E. T., East, A. D., Lau, A. F. A side-by-side comparison of clinical versus current good manufacturing practices (cGMP) microbiology laboratory requirements for sterility testing of cellular and gene therapy products. Clinical Microbiology Newsletter. 43 (21), 181-191 (2021).
- Gebo, J. E. T., Lau, A. F. Sterility testing for cellular therapies: What is the role of the clinical microbiology laboratory. Journal of Clinical Microbiology. 58 (7), 01492 (2020).
- International Organization for Standardization. ISO 14644-1:2015 Cleanrooms and associated controlled environments - Part 1: Classification of air cleanliness by particle concentration. International Organization for Standardization. , (2015).
- Parenteral Drug Association. PDA Technical Report No. 13 Revised 2022 (TR 13) Fundamentals of an Environmental Monitoring Program. Parenteral Drug Association, Inc. , (2022).
- United States Pharmacopeia - National Formulary. USP<1116> Microbiological Evaluation of Cleanrooms and Other Controlled Environments in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Guinet, R., et al. Multicenter study on incubation conditions for environmental monitoring and aseptic process simulation. PDA journal of pharmaceutical science and technology. 71 (1), 43-49 (2017).
- Gordon, O., Berchtold, M., Staerk, A., Roesti, D. Comparison of different incubation conditions for microbiological environmental monitoring. PDA Journal of Pharmaceutical Science and Technology. 68 (5), 394-406 (2014).
- Anders, H. J., et al. Multisite qualification of an automated incubator and colony counter for environmental and bioburden applications in pharmaceutical microbiology. PDA Journal of Pharmaceutical Science and Technology. , (2022).
- United States Pharmacopeia - National Formulary. USP<1072> Disinfectants and Antiseptics. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. USP<1071> Rapid Microbial Tests for Release of Sterile Short-Life Products: A Risk-Based Approach in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- United States Pharmacopeia - National Formulary. PUSP<1223> Validation of Alternative Microbiological Methods in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
- Parenteral Drug Association. PDA Technical Report No. 33, Revised 2013 (TR 33) Evaluation, Validation and Implementation of Alternative and Rapid Microbiological Methods. Parenteral Drug Association, Inc. , (2013).
- Putnam, N. E., Lau, A. F. Comprehensive study identifies a sensitive, low-risk, closed-system model for detection of fungal contaminants in cell and gene therapy products. Journal of Clinical Microbiology. 59 (11), 0135721 (2021).
- Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation. Guide to Good Manufacturing Practice for Medicinal Products Annexes (PE 009-16 (Annexes)). Pharmaceutical Inspection Convention & Pharmaceutical Inspection Co-operation Scheme. , (2022).
- United States Pharmacopeia - National Formulary. USP<825> Radiopharmaceuticals - Preparation, Compounding, Dispensing, and Repackaging in USP43-NF38 2S. United States Pharmacopeia - National Formulary. , (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。