JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
DNA 콘텐츠 측정에 의한 포유 동물 복제 타이밍의 게놈 전체의 결정
요약
We describe here a relatively fast and simple approach for mapping genome-wide mammalian replication timing, from cell isolation to the basic analysis of the sequencing results. A genomic map of a representative replication program will be provided following the protocol.
초록
게놈의 복제는 DNA 복제의 정확도를 보장하는 고도 조절 과정에서 세포주기의 S 단계에서 발생한다. 각각의 게놈 영역은 복제의 여러 기원의 동시 활성화를 통해 S 단계에서 고유 한 번에 복제됩니다. 복제 (ToR의)의 시간은 많은 게놈 및 후생 유전 학적 기능과 관련이 돌연변이 속도 암에 연결되어 있습니다. 건강과 질병에 복제 프로그램의 전체 게놈보기를 이해하는 것은 중요한 미래의 목표와 도전이다.
, 포유 동물 세포의 게놈 넓은 Tor를지도 할 수있는 간단한 방법이 문서에서는 구체적으로 (CNR-ToR의 여기라고 함) 방법을 "복제의 게놈 시간을 매핑하기위한 S / G1 복사 수 비율"을 설명합니다. 이 방법은 S 단계 및 G1 세포 상 세포 사이의 카피 수의 차이에 기초한다. CNR-토르 방법은 6 단계로 수행됩니다 요오드화 프로피 듐 (PI)와 세포 염색 1. 준비; 2. 소르팅 G1 및 정렬 형광 - 활성화 된 세포를 사용하여 S 상 세포 (FACS); 3. DNA 정화; 4. 초음파 처리; 5. 도서관 준비 및 순서; 및 (6) 바이오 인포 매틱스 분석. CNR-토르 방법은 상세한 복제지도 결과를 빠르고 쉽게 접근이다.
서문
포유 동물 DNA 복제는 세포주기 동안 회만 각 염색체의 정확한 복제를 보장하기 위해 엄격하게 조절된다. 복제는 매우 통제 된 순서에 따라 발생 - 여러 큰 게놈 영역 (~ 메가가) 다른 게놈 영역이 중간 또는 늦게 S 단계 (중 · 후반 복제 도메인)에서 나중에 복제 반면 1 (초기 도메인 복제) S 단계의 시작 부분에 복제합니다. 게놈의 50 %, 암 변환 5 중 분화 3,4- 중 및 적은 정도로 조직 (2) 사이의 토르 변화 - 게놈의 대부분은 30 % 반면, 모든 조직 (항시 토르 도메인)에서 동시에 복제 . 또한, 특정 게놈 영역 비동기 6, 7, 8, 즉 차이가 복제두 대립 유전자 사이의 토르있다.
토르 전사 수준, GC 함량, 염색질 상태, 유전자 밀도 등 1, 9를 포함하여 많은 게놈 및 에피 지노믹스 기능 상관 관계. 또한 ToR의 돌연변이 레이트 및 유형 10, 11, 따라서 당연히과 관련된 복제 프로그램의 교란은 암 (12, 13)에 연결되어있다. ToR의와 크로 마틴 구조 사이의 인과 관계는 아직 이해되지 않습니다. 열린 염색질 초기 복제를 용이하게하는 것이 가능하다. 그러나, 다른 모델은 14 염색질 복제하는 동안 조립 및 다른 염색질의 시작 부분에 존재하는 규제 및 S 상 리드의 끝이 초기와 후기 복제 영역 1의 포장을 차동 제안 . 우리는 최근 Tor가 다른 게놈 영역 (11)에서 발생하는 돌연변이의 종류에 영향을 미치는하여 GC 함량을 모양 것으로 나타났습니다.
현장 하이브리드 (FISH)의 형광 개별 궤적에서 Tor를 측정하기위한 주요 방법이다. 이것은 단일 FISH 신호 대 특정 대립 유전자 (15, 16)에 대한 이중선의 비율을 나타내는 S 단계에서 세포의 비율을 계산하여 간단히 수행된다. 또 다른 방법은, S 함께 여러 시점에 자신의 DNA의 내용에 따라 세포를 분류, BrdU의와 DNA 라벨 BrdU의를 포함하는 DNA를 immunoprecipitating 및 qPCR에 17 침전 된 DNA의 풍요 로움을 확인 펄스로 구성되어 있습니다.
게놈 토르 매핑은 두 가지 방법에 의해 달성 될 수있다. 첫 번째 방법은 상술의 BrdU-IP 기반 방법의 게놈 버전 인 양의 정량화각 부분에 침전 된 DNA를 마이크로 어레이에 하이브리드를 통해 전체 게놈 또는 깊은 시퀀싱에 의해 동시에 수행된다. 두 번째 방법, CNR-토르, G1 세포의 DNA 함량으로 S 상 세포 정규화 각 게놈 영역의 카피 수를 측정에 기초한다. 이 방법에서는, 세포는 비 복제 (G1 단계) 및 복제 (S 상) 그룹 (그림 1)에 FACS으로 분류되어 있습니다. G1 세포 게놈 영역 모두에서 동일한 카피 수 있고, 따라서 자신의 DNA 함량은 동일해야한다. 한편, S의 DNA의 카피 수는 후기 복제 영역 따라서 그들의 DNA 함량이 경우 대부분 세포를 복제하지 않은 반면, 초기 복제 영역은 대부분의 세포 내에서 복제를 시행하고, 이렇게해서 DNA 함량이 배가되므로, 토르에 따라 G1 세포의 것과 유사하다. 따라서 DNA 함량 G1 비율로 S는 토르 나타낸다. 각 게놈 영역에 대한 DNA의 양에 의해 혼성화를 측정마이크로 어레이 또는 깊은 시퀀싱 (2), (8)에 의해. CNR-토르 방법의 장점은 더 논의 될 것이다.
그림 2에 기술 된 바와 같이 본 논문은 게놈 ToR의 매핑에 사용되는 CNR-토르 방법을 설명합니다. 이 논문은 결과의 기본 분석 및 게놈 ToR의지도를 만들 때까지 세포를 수집에서 전체 공정의 미세한 세부 사항에 대해 설명합니다. 이 문서에서 설명하는 프로토콜은 성공적 문화에서 자란 다양한 세포 유형에 수행되었습니다. 이 프로토콜의 향후 개선은 생체 내에서 토르의 매핑 희귀 세포 유형으로 이어질 수 있습니다.
프로토콜
참고 ToR의 만 성장 동기화 세포에서 측정 할 수있다. 일반적으로 S 단계에서 ~ 1 × 10 5 세포가 발생합니다 2 × 10 6 빠르게 성장하는 세포 (속도 제한 단계) -이 절차는 최소 1로 시작해야합니다. 두 개 또는 세 개의 복제를 이용하여 각 실험을 수행 할 것을 권장한다. CNR-토르 전과정 일주일 이내에 완료 될 수있다 - 2 일 1 ~ 2 일 시퀀싱 필요하며 추가적인 일 초기 데이터 분석에 필요한 라이브러리 제조까지의 모든 단계를 전담한다.
문화의 세포 1. 수집
참고 : 프로토콜 (약 2 포함 - 5 × 10 6 셀) 10cm 플레이트에 문화에서 성장 세포를 대상으로하지만, 쉽게 다른 플랫폼으로 조정할 수 있습니다.
- 정지에서 재배 된 세포의 경우, 고정에 (섹션 2)를 진행합니다.
- 부착 세포, 흡인 및 PL 세척하십시오칼슘과 마그네슘 2+없이 3 mL의 PBS와 함께 먹었다.
- PBS를 폐기하고 세포가 분리 될 때까지 1 mL의 상업 트립신 EDTA와 37 ° C에서 5 분 동안 세포를 배양한다.
주 : 트립신 처리 시간은 각 세포 유형에 따라 조정되어야한다. - 트립신을 중화하고 15 ML 원뿔 튜브 또는 5 ML의 폴리스티렌 튜브에 세포를 수집하기 위해 3 mL의 문화 매체를 추가합니다. 얼음에 보관하십시오.
2. 고정
참고 :이 부분은 모든 단계가 4 ° C에서 수행해야합니다.
- 4 ℃에서 5 분 동안 300 XG에 세포를 원심 분리기.
- 기음과 1 mL의 차가운 PBS로 두 번 세포를 씻으십시오.
- 250 μL (전체) 차가운 PBS에 재현 탁 세포.
- 부드럽게 튜브를 텍싱 동안 천천히 C 100 % 에탄올 -20 °의 적하 800 μL를 추가합니다. 80 % - 70 이것은 최종 에탄올 농도로 이끈다.
참고 : 고순도의 에탄올이 단계에서하는 것이 좋습니다. - FO 얼음에 세포를 품어R 30 분.
참고 :이 단계의 세포를 4 ℃ 또는 -20 ° C에서 몇 달 동안 몇 일 동안 보관이 가능합니다.
3. PI 염색
- 4 ℃에서 10 분 동안 500 XG에서 세포를 원심 분리기.
- 조심스럽게 뜨는을 대기음 1 mL의 차가운 PBS로 두 번 세포를 씻으십시오.
- 대기음은 다음과 혼합물 각 샘플에 재현 탁하고 1 mL의 PBS, 5 μL 10 ㎎ / ㎖ RNaseA, 50 μL 1 ㎎ / ㎖의 프로피 디움 아이오다 이드 (PI를, 사용하기 전에 병을 혼합). ~ 2 × 10 6 세포 / ㎖) 최대 농도를 조정합니다.
주 : 빛이 닿지 않는 곳에 보관 - PI 민감한 빛입니다. - 5 ML의 폴리스티렌 튜브에 35 μm의 메쉬를 필터링하고, 파라 필름과 가깝습니다.
- 30 분 - 15, 어두운 곳에서 실온에서 인큐베이션.
참고 : 셀 지금 FACS 분석을위한 준비가되어 있습니다. 필요한 경우, 염색 된 세포는 어두운 곳에서 4 ℃에서 적어도 24 시간 동안 저장 될 수있다.
4. 정렬
- FACS 기계를 사용하여 정렬 세포. 우리그들의 PI 세기에 기초하여 셀을 구별하기위한 561 nm의 레이저를 전자. 488 나노 미터 또는 532와 같이 535 nm의 여기 최대 근접한 레이저는 FACS 시스템 구성에 따라 사용될 수있다.
- 최적의 결과를 들어, (대부분의 세포 85 μm의 경우) 특정 셀 크기에 권장되는 작은 노즐을 사용합니다. 수율 이상의 순도 모드를 우선 순위. 45 PSI의 외장 압력으로, 일반적으로 최대 300 ~ 500 이벤트 / s의, 정상 느린 흐름을 사용합니다.
- 게이팅을 사용하여, SSC 대 FCS를 플로팅에 의해 죽은 세포와 세포 내 파편 (낮은 FCS 높은 SSC)를 구별. PI는-H (이중선이 같은 H-값을가집니다 대 살아있는 세포에서 FSC-W FSC-H 플롯 대와 PI- W에 의해 다음 SSC-폭 (W) 대 SSC-높이 (H)을 플로팅하여 이중선을 차별 하지만 더 큰 W-값). 단일 생존 세포 세포의 DNA 함량을 나타내는 PI 영역 (A)의 휘도 히스토그램을 그린다.
- 도 1에 도시 된 바와 같이, G1 및 S 상으로 정렬 셀. S에 대한 게이팅은 넓은하고 G1 게이팅 좁은하고 지금까지 S에서 가능합니다 동안 G1 및 G2 단계로 침입한다.
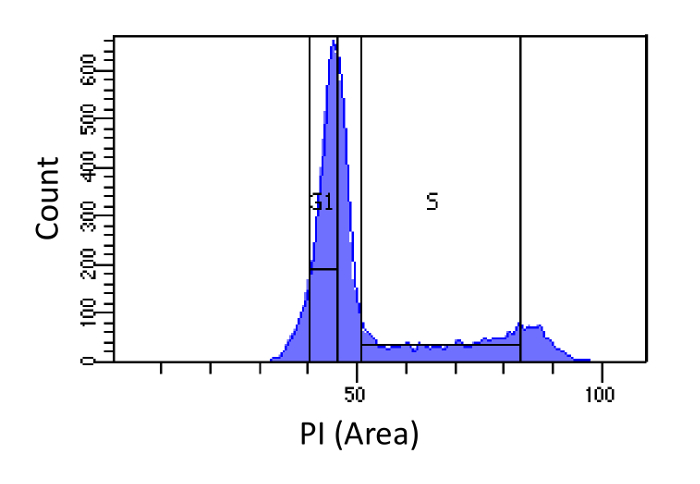
도 1 세포주기 단계의 판정 PI 강도를 기초. 마우스 배아 섬유 아세포 (MEF) 인구 (PI-지역에 의해 측정) 세포 DNA 콘텐츠의 분포를 나타내는 히스토그램. 표시된 영역을 이용하여, 4N DNA 함량 참조) - DNA 함량은 두 개의 하위 집단 I) G1 세포 (2N DNA 함량) 및 ⅱ) S 상 세포 (2N으로 모집단을 정렬하기 위해 사용된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
주 : G1 세포의 수집의 목적은 서로 다른 유전 영역 사이의 서열 효율의 편향을 설명하는 것이다. 또 다른 앱바퀴벌레 동일한 세포 유형에서 G1 체포 셀을 사용하는 것이다. 이 방식은 결과를 제공 클리너 (이 S 상 오염을 최소화 때문에)하지만 구속 셀 및 상기 측정 된 셀 사이의 유전 적 차이에 따른 편향을 초래할 수있다.
- 추운 조건에서 정렬 및 1.5 / 2 ML의 튜브에 정렬 된 세포를 수집합니다. 정렬 다음 얼음에 튜브를 유지합니다.
참고 : 39 ° C에서 3 시간 18 - - 1 5 % BSA DNA 복구를 개선하기 위하여, 낮은 결합 튜브를 사용하여 4로 코팅 된 튜브를 사용하는 것이 좋다.
5. DNA 정제
- 각 샘플 (G1 및 S)에 대해서는, DNA 정제 키트를 사용하여 DNA를 정제.
참고 : 상용 키트를 사용하는 경우 제조업체에서 권장, 높은 수율을위한 2 mL의 튜브에 400 μL 용출 버퍼로 용출. - 형광 분석기를 사용하여 DNA 농도를 확인합니다.
참고 : FACS에 의해 수집 된 10 만 포유 동물 세포에서, 하나는 DNA의 ~ 1 μg의를 얻어야한다. 에이t이 단계의 DNA는 4 ℃에서 저장 또는 긴 -20 ° C에서 몇 일 동안 유지 될 수있다.
6. 초음파 처리
- 사용하는 자기 스탠드와 호환되는 1.7 mL의 튜브에 DNA를 전송합니다.
- 자기 스탠드를 사용하여 제조업체의 지시에 따라 배 SPRI 비드를 사용하여 DNA를 농축하고, 50 μL 용출 완충액 용출.
- 250 bp의 평균 목표 최대 크기 집속 초음파와 전단 DNA. 50 μL의 DNA 샘플에 대해 다음 설정을 사용 : 50 W, 20 % 듀티 팩터, 버스트 당 200 사이클, 20 ° C, 120 초입니다.
- 전기 영동에 의해 전단 된 DNA의 크기를 확인한다. ~ 250 염기쌍에서 피크 700 BP - 권장 크기 분포는 200이다.
참고 :이 단계의 DNA가 4 ° C에서 또는 긴 저장을 위해 -20 ° C에서 며칠 동안 보관이 가능합니다.
7. 도서관 준비 및 시퀀싱
참고 : 다른 많은 라이브러리 준비 키트 및엔트 시퀀싱 플랫폼은 자료 섹션에서 우리가 사용하고 언급 한 것과 유사하게 작동합니다. 실제로 과거에, ToR의지도는 마이크로 어레이 플랫폼 2와 매우 유사한 방법을 사용하여 생성되었다.
- 상업적 라이브러리 준비 키트를 사용하여 라이브러리를 준비합니다.
- BP 800 - 라이브러리 제조의 마지막 300 자성 비드를 사용하여 크기를 선택한다.
- 라이브러리를 제조 한 결과, 형광을 이용하여 DNA 농도를 측정한다.
- 전기 영동을 사용하여 DNA의 크기를 측정한다.
- 모든 플랫폼에서 시퀀싱을 수행합니다.
참고 : 시퀀싱 적어도 10 M 권장 샘플 당 읽습니다. 이 깊이 읽기마다 약 300 bp의 (3 ~위한 기가 크기의 게놈)에 해당하고, (50)의 해상도로 토르 측정을위한 충분한 - 1백킬로바이트 윈도우의 크기가 감소 될 것이다 심도를 증가시키고, 따라서 높은 확실성 해상도를 증가있게된다. 쌍 엔드 시퀀싱에 필요하지 않습니다만 커버리지 정보를 보낸 사람이 프로토콜은 수집됩니다. 이것은, 그러나, 반복되는 시퀀스를 포함하는 판독 위치를 해결하는데 도움이 될 수있다.
8. 분석
참고 : 데이터 분석 A. 코렌 동부 등에 의해 사용 된 방법에 기초한다. 19.
- bowtie2이나 신뢰성 짧은 리드 라이너를 사용하여 상응하는 게놈지도 시퀀싱 데이터. 가변 크기, (200)에 의해 덮여 세그먼트로 동일한 커버리지 염색체 창은 G1 분획 읽고 정의 및 계산 S 단계는 동일한 창에서 읽습니다.
- 각 윈도우의 S / G1 비율을 계산합니다. 이는 유전체 (도 3)를 따라 S / G1 비율에 큰 변동이있는 맵을 생성한다. 토르 측정의 신뢰성에 대한 좋은 컨트롤은 매우 평평해야한다 (G1의 두 개의 별도 측정에서)에 G1 / G1 비율이지도를 비교하는 것입니다.
- 0 데이터가 의미 정상화 각 V에서 뺀 1 SD(X 염색체 제외)의 모든 윈도우의 S / G1의 표준 편차로 나눈 결과를 모든 윈도우의 평균값을 ALUE. 이것은 Z 점수로 변환 및 다른 실험의 비교를 가능하게하기 위해 수행됩니다.
- UCSC 게놈 브라우저뿐만 아니라보다 적은 15 데이터 창을 포함하는 각 나머지 간 격차 조각에 의해 나열된 모든 갭 영역을 제거합니다.
- 10의 매개 변수를 사용하여 matlab에 기능 csaps를 통해 차 평활 스플라인으로 남아있는 조각을 부드럽게 - 16 세트 포인트에서 모든 1백킬로바이트을 보간.
주 : 평활 보간의 파라미터는 데이터의 깊이에 기초하여 조정되어야한다. 적합한 다른 스무딩 방법 및 기능이 존재하고 사용될 수있다. - 시각적 각 복제의 신뢰성을 확인한 후, 모든 읽기 병합이 데이터를 상기와 동일한 과정을 수행하여 해상도 깊이 프로파일을 계산한다.
결과
전형적인 토르지도는 마우스 배아 섬유 아세포 그림 3 (MEFs에)에 표시됩니다. 그것이 기 때문에,이 숫자는 분석 프로세스를 보여 두 개인 창문 (단계 8.3)에 대한 정규화 된 S / G1 비율 인 점뿐만 아니라 입방 평활 보간한다 (단계 8.5)의 결과 라인.
ⅰ) 초기에 동시에 (클릭률 = 일정 토르 지역) 복제 megabase의 순서로 큰...
토론
CNR-토르 (린드 N. 길버트 DM (20)에 의해 평가) S로 FACS 및 G1 단계로 분할 될 수있는 진핵 세포 증식 세포 집단에 원칙적으로 수행 될 수있다. 여기에 기재된 방법은 인간 및 마우스 등 ~ 3 GB가 게놈 크기의 포유 동물 세포로 조정되었다. (전지 제조 및 시퀀싱 깊이)를 CNR-토르 프로토콜의 작은 변화는 다른 진핵 생물로 조정하기 위해 필요하다. 는 속도 제한 단계이기 때문에주의가 S ?...
공개
No conflicts of interest declared.
감사의 말
우리는 수치를 생성에 도움을 오리야어 Vardi 감사합니다. 는 IS 그룹의 작품은 이스라엘 과학 재단 (부여 번호 10분의 567)와 그랜트 (# 281306)를 시작 유럽 연구위원회에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| PBS | BI (Biological Industries) | 02-023-1A | |
| Trypsin-EDTA | BI (Biological Industries) | 03-052-1B | |
| 15 mL conical tube | Corning | 430790 | |
| 5 mL Polystyrene round Bottom tube with cell strainer cap | BD-Falcon | 352235 | |
| Ethanol | Gadot | 64-17-5 | |
| RNAse-A 10 mg/mL | Sigma | R4875 | |
| Propidiom iodide 1 mg/mL | Sigma | P4170 | |
| Parafilm | Parafilm | PM-996 | |
| 1.5 mL DNA LoBind Eppendorf tubes | Eppendorf | 22431021 | |
| BSA | Sigma | A7906 | |
| 1.7 mL MaxyClear tube | Axygen | MCT-175-C | |
| magnetic beads - Agencourt AMPure XP | Beckman Coulter | A63881 | |
| Ultrasonicator | Covaris | M-series -530092 | |
| 50 µL microTUBE AFA Fiber Screw-Cap 6 x 16 mm | Covaris | 520096 | |
| Qubit fluorometer | Invitrogen | ||
| Qubit dsDNA High Sensitivity (HS) Assay Kit | Invitrogen | Q32854 | |
| Electrophoresis 2200 Tape station system | Agilent | D1000 ScreenTape | |
| Seqeuncing - Illumina NextSeq system | Illumina | SY-415-1001 | |
| Dneasy kit for DNA purification | Qiagen | 69504 | |
| PureProteom Magnetic Stand | Millipore | LSKMAGS08 | |
| Anti-BrdU/FITC | DAKO | F7210 | |
| FACS sorter | BD | FACSARIA III | |
| FACS software | BD | FACSDiva v 8.0.1 |
참고문헌
- Farkash-Amar, S., Simon, I. Genome-wide analysis of the replication program in mammals. Chromosome Res. 18 (1), 115-125 (2010).
- Yaffe, E., et al. Comparative analysis of DNA replication timing reveals conserved large-scale chromosomal architecture. PLoS Genet. 6 (7), e1001011 (2010).
- Hiratani, I., et al. Global reorganization of replication domains during embryonic stem cell differentiation. PLoS Biol. 6 (10), (2008).
- Rivera-Mulia, J. C., et al. Dynamic changes in replication timing and gene expression during lineage specification of human pluripotent stem cells. Genome Res. 25 (8), 1091-1103 (2015).
- Ryba, T., et al. Abnormal developmental control of replication-timing domains in pediatric acute lymphoblastic leukemia. Genome Res. 22 (10), 1833-1844 (2012).
- Farkash-Amar, S., et al. Global organization of replication time zones of the mouse genome. Genome Res. 18 (10), 1562-1570 (2008).
- Koren, A., McCarroll, S. A. Random replication of the inactive X chromosome. Genome Res. 24 (1), 64-69 (2014).
- Mukhopadhyay, R., et al. Allele-specific genome-wide profiling in human primary erythroblasts reveal replication program organization. PLoS Genet. 10 (5), e1004319 (2014).
- McNairn, A. J., Gilbert, D. M. Epigenomic replication: linking epigenetics to DNA replication. Bioessays. 25 (7), 647-656 (2003).
- Sima, J., Gilbert, D. M. Complex correlations: replication timing and mutational landscapes during cancer and genome evolution. Curr Opin Genet Dev. 25, 93-100 (2014).
- Kenigsberg, E., et al. The mutation spectrum in genomic late replication domains shapes mammalian GC content. Nucleic Acids Res. 44 (9), 4222-4232 (2016).
- Woo, Y. H., Li, W. H. DNA replication timing and selection shape the landscape of nucleotide variation in cancer genomes. Nat Commun. 3, 1004 (2012).
- Liu, L., De, S., Michor, F. DNA replication timing and higher-order nuclear organization determine single-nucleotide substitution patterns in cancer genomes. Nat Commun. 4, 1502 (2013).
- Goren, A., Cedar, H. Replicating by the clock. Nat Rev Mol Cell Biol. 4 (1), 25-32 (2003).
- Selig, S., Okumura, K., Ward, D. C., Cedar, H. Delineation of DNA replication time zones by fluorescence in situ hybridization. EMBO J. 11 (3), 1217-1225 (1992).
- Smith, L., Thayer, M. Chromosome replicating timing combined with fluorescent in situ hybridization. J Vis Exp. (70), e4400 (2012).
- Simon, I., et al. Asynchronous replication of imprinted genes is established in the gametes and maintained during development. Nature. 401 (6756), 929-932 (1999).
- Phi-Wilson, J. T., Recktenwald, D. J. Coating agents for cell recovery. Google Patents. , (1993).
- Koren, A., et al. Differential relationship of DNA replication timing to different forms of human mutation and variation. Am J Hum Genet. 91 (6), 1033-1040 (2012).
- Rhind, N., Gilbert, D. M. DNA replication timing. Cold Spring Harb Perspect Biol. 5 (8), a010132 (2013).
- Koren, A., et al. Genetic variation in human DNA replication timing. Cell. 159 (5), 1015-1026 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유