JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
스트레칭 중 현장 말초 신경 긴장 측정을 위한 Direct Linear Transformation
요약
이 프로토콜은 직접 선형 변환을 사용하여 보정된 스테레오 이미징 카메라 시스템을 구현하여 늘어난 말초 신경의 3차원 현장 변위를 캡처합니다. 이러한 변위를 포착함으로써 다양한 스트레치 정도에서 유발된 스트레칭 정도에서 유발된 스트레치 손상 임계값을 측정하여 스트레치 의존성 신경 복구의 과학을 발전시킬 수 있습니다.
초록
말초 신경은 발달 과정, 정상적인 관절 운동, 부상 과정에서 생리적 및 비생리적 스트레칭을 겪으며, 최근에는 외과적 복원을 받는 동안에도 스트레칭을 겪습니다. 말초 신경의 신장에 대한 생체역학적 반응을 이해하는 것은 다양한 부하 조건에 대한 말초 신경의 반응을 이해하는 데 매우 중요하며, 따라서 치료 전략 및 외과적 개입을 최적화하는 데 중요합니다. 이 프로토콜은 직접 선형 변환을 통한 스테레오 이미징 카메라 시스템의 캘리브레이션 프로세스와 보정된 스테레오 이미징 카메라 시스템에 의해 캡처된 비디오 파일의 3차원 좌표에서 얻은 스트레치 중 말초 신경의 3차원 현장 조직 변위 추적에 대해 자세히 설명합니다.
얻어진 3차원 좌표로부터, 신경 길이, 신경 길이의 변화, 시간에 대한 긴장률 등을 늘어난 말초 신경에 대해 계산할 수 있다. 스테레오 이미징 카메라 시스템을 사용하면 스트레칭 시 말초 신경의 3차원 변위를 캡처할 수 있는 비침습적 방법을 제공합니다. Direct linear transformation은 스트레칭 중 말초 신경 길이를 3차원으로 재구성하여 변형을 측정할 수 있습니다. 현재로서는 직접 선형 변환을 통해 보정된 스테레오 이미징 카메라 시스템을 사용하여 늘어난 말초 신경의 현장 변형을 연구할 수 있는 방법론이 없습니다. 스트레칭 시 말초 신경의 현장 긴장을 포착하면 임상의가 과도하게 스트레칭될 때 신경 손상의 기저 손상 메커니즘을 이해하는 데 도움이 될 뿐만 아니라 스트레칭 유도 중재에 의존하는 치료 전략을 최적화하는 데 도움이 될 수 있습니다. 논문에 설명된 방법론은 신경 손상 관리 및 재활 분야에서 환자 결과를 개선하기 위해 스트레칭에 대응하여 말초 신경 생체 역학에 대한 이해를 높일 수 있는 잠재력을 가지고 있습니다.
서문
말초 신경(PN)은 발달, 성장, 정상적인 관절 운동, 부상 및 수술 중에 스트레칭을 거칩니다1. PN은 규칙적인 운동 중에 신경을 보호하고 2,3 신경 섬유의 구조적 건강을 유지하기 위해 점탄성 특성을 나타냅니다2. 기계적 스트레칭에 대한 PN 반응은 신경섬유 손상의 유형4, 인접 결합 조직의 손상 2,4 및 테스트 접근 방식(즉, 부하 속도 또는 방향)에 따라 달라지는 것으로 나타났기 때문입니다.5,6,7,8,9,10,11,12,13,14 , 정상 운동 범위와 비생리적 범위 동안 느린 속도와 빠른 스트레치 속도 모두에서 PN의 생체 역학적 반응을 구별하는 것이 중요합니다. 이는 스트레칭에 대한 반응으로 PN 손상 메커니즘에 대한 이해를 심화시키고 시기적절하고 최적화된 중재를 도울 수 있다 1,4,15,16. 물리치료에서는 신경생리학과 생체역학의 관계에 기초하여 평가하고 개입하는 경향이 증가하고 있다17. 다양한 적용 하중에서 PN 생체 역학의 차이점을 이해함으로써 물리 치료사는 현재 중재를 수정할 수 있도록 더 잘 준비할 수 있습니다17.
스트레치에 대한 PN의 사용 가능한 생체 역학 데이터는 가변적이며 테스트 장비 및 절차 및 신장 데이터 분석의 차이에 기인할 수 있습니다 5,6,7,8,9,10,11,12,13,14,16. 더욱이, 3차원(3D) in-situ 신경 변위를 측정하는 것은 현재 이용 가능한 문헌에 제대로 설명되어 있지 않습니다. 이전 연구에서는 후관절 캡슐의 조직 변위의 3D 재구성의 정확도를 극대화하기 위해 입체 이미징 기술을 사용했습니다18,19. DLT(Direct Linear Transformation) 기술을 사용하면 두 개 이상의 2차원(2D) 보기를 3D 실제 좌표(즉, mm)로 변환할 수 있습니다20,21,22. DLT는 렌즈 왜곡, 카메라 파라미터 및 이미지 좌표를 고려하여 3D 위치를 정밀하게 재구성할 수 있게 하고, 스테레오 이미징 카메라 셋업(20,21,22)에 유연성을 허용하기 때문에 스테레오-이미징 카메라 시스템에 대한 고정밀 캘리브레이션 방법을 제공한다. DLT-캘리브레이션된 스테레오-이미징 카메라 시스템을 사용한 연구는 일반적으로 운동 및 보행 분석을 연구하는 데 사용된다22,23. 이 프로토콜은 DLT-캘리브레이션된 스테레오-이미징 카메라 시스템 및 오픈 소스 추적 소프트웨어(22)를 사용하여 다양한 스트레치 정도에서 PN의 현장 변형률을 결정하기 위한 상세한 방법론을 제공하는 것을 목표로 한다.
프로토콜
설명된 모든 절차는 Drexel University Institutional Animal Care and Use Committee(IACUC)의 승인을 받았습니다. 신생아 새끼 돼지는 미국 펜실베니아에 위치한 미국 농무부(USDA) 승인 농장에서 구입했습니다.
1. 스테레오 이미징 시스템 설정
- 최대 100FPS(Frames/s)를 캡처하는 스테레오 이미징 카메라 시스템을 유틸리티 스탠드에 부착합니다. 이 연구에 사용된 스테레오 이미징 카메라 시스템은 63mm의 기준선으로 분리된 두 개의 수평으로 정렬된 카메라(왼쪽 및 오른쪽 카메라라고 함)가 있는 수동 스테레오 카메라입니다(그림 1).
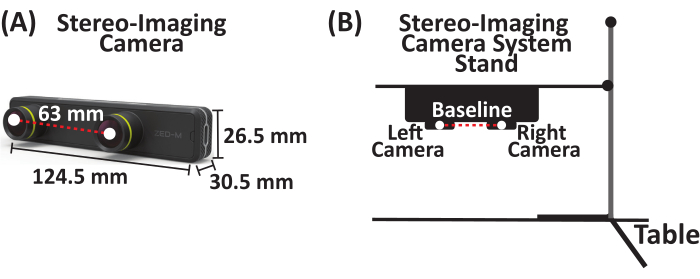
그림 1: 스테레오 이미징 카메라 시스템. (A) 63mm의 기준선으로 분리된 두 대의 카메라(왼쪽 및 오른쪽 카메라)가 있는 병렬 스테레오 이미징 카메라 시스템. (B) 스테레오 이미징 카메라 시스템 및 스탠드 설정의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 입체 이미징 시스템 DLT 캘리브레이션 - 3D 제어 볼륨 디지털화
- 3 개의 투명 아크릴 플렉시 유리 정사각형 시트 (12 인치 x 12 인치 x 0.125 인치)를 얻습니다. 각 시트에 그리드를 배치하고 10개 이상의 점을 그리면 x, y 및 z 좌표 평면의 3D 제어 볼륨에 최소 30개의 점이 분산됩니다. 기록할 내용의 최대 높이를 캡처하기 위해 다양한 높이로 세 장의 시트를 쌓아 3D 제어 볼륨을 구성합니다(그림 2A).
- 풋 페달이 있는 디지타이저를 사용하여 3D 제어 볼륨의 모든 지점을 디지타이징합니다. 3D 컨트롤 큐브에 원점(0, 0, 0)을 설정하고, 양의 x 및 y 방향을 정의하고, 문서를 열어 각 점의 디지털화된 (x, y, z) 좌표(mm)를 저장하고, (x, y, z) 좌표(mm)를 *.csv 파일로 저장하여 x, y 및 z 좌표(mm)를 획득합니다(그림 2B).
참고: (x, y, z) 좌표는 3D 컨트롤 큐브의 설정된 원점을 기준으로 합니다. - 이러한 디지털화된 (x, y, z) 좌표(mm 단위)를 사용하여 스테레오 이미징 카메라 시스템의 왼쪽 및 오른쪽 카메라를 각각 보정합니다.
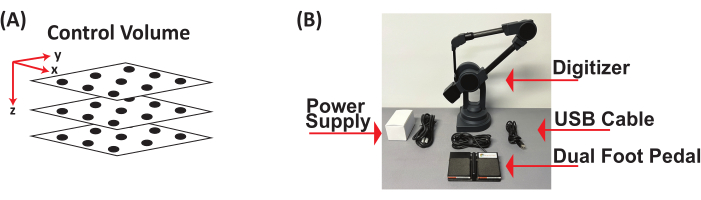
그림 2: 3차원 제어 볼륨과 풋 페달이 있는 디지타이저. (A) 3D 제어 볼륨의 개략도. (B) mm 단위의 (x, y, z) 좌표를 얻기 위해 3D 제어 볼륨을 디지털화하는 데 사용되는 풋 페달이 있는 디지타이저의 구성 요소. 약어: 3D = 3차원. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 직접 선형 변환 계수의 스테레오 이미징 카메라 시스템 보정 - 생성
- 스테레오 이미징 카메라 시스템을 유틸리티 스탠드에 부착합니다(그림 3A).
- 스테레오 이미징 카메라 시스템을 3D 제어 볼륨에서 6cm 위에 배치합니다(그림 3A).
- USB Type-C 케이블을 통해 스테레오 이미징 카메라 시스템을 노트북에 연결합니다.
- 이미징 소프트웨어를 엽니다( 재료 표 참조).
- 3D 제어 볼륨을 이미지화합니다. 출력 이미지(보충 그림 S1)에는 왼쪽 및 오른쪽 카메라 뷰가 모두 포함됩니다(그림 3B).
- 사용자 지정 MATLAB 코드(보충 파일 1)를 실행하여 출력 이미지를 각각 왼쪽과 오른쪽 이미지의 두 이미지(그림 3C, 보충 그림 S2, 보충 그림 S3)로 분리합니다.
- 실행을 클릭하여 DLTcal5.m GUI22(보충 파일 2)를 초기화합니다.
- DLTcal5 컨트롤 창에서 초기화를 클릭하여 디지털화된(x, y, z) 좌표(mm)가 있는 *.csv 파일을 선택합니다(그림 4A 및 추가 파일 3).
- 스테레오 이미징 카메라 시스템의 첫 번째 보기에서 3D 제어 볼륨의 해당 이미지를 선택합니다(보충 그림 S2). 이 스테레오 이미징 카메라 시스템의 경우 왼쪽 카메라 뷰는 첫 번째 카메라 뷰에 해당합니다(그림 4B).
- 첫 번째 카메라 뷰 이미지(즉, 왼쪽 카메라 뷰)가 나타납니다.
- 섹션 2에서 점을 디지타이징한 순서대로 점을 선택하여 왼쪽 카메라 보기에서 2D 픽셀 좌표를 얻습니다(그림 4B).
- DLTcal5 컨트롤 창에서 현재 지점을 설정하고 로드된 첫 번째 카메라 뷰(즉, 왼쪽 카메라 뷰) 이미지에서 해당 현재 지점을 클릭합니다.
- 로드된 첫 번째 카메라 뷰에서 모든 점을 선택한 후 계산 계수 를 클릭하여 왼쪽 카메라 뷰에 대한 11개의 DLT 계수를 생성합니다(그림 4B).
- DLTcal5 컨트롤 창에서 카메라 추가를 클릭하고 3.7.2-3.7.6단계를 반복하여 오른쪽 카메라 보기(즉, 두 번째 카메라 보기)에 대한 11개의 DLT 계수를 생성합니다(그림 4B, C 및 추가 그림 S3).
- DLTcal5 컨트롤 창에서 데이터 저장을 클릭하여 출력 파일이 저장될 폴더를 선택합니다(그림 4D).
- 출력 파일에는 2D(x, y) 픽셀 좌표(보충 파일 4)와 스테레오 이미징 카메라 시스템(그림 4D 및 추가 파일 5)의 왼쪽 및 오른쪽 카메라 뷰에 대한 해당 11개의 DLT 계수가 포함됩니다.
- 스테레오 이미징 카메라 시스템이 보정됩니다.

그림 3: 직접 선형 변환 보정을 위해 스테레오 이미징 카메라 시스템을 사용하여 3차원 제어 볼륨의 이미지를 획득하기 위한 회로도. (A) 스테레오 이미징 카메라 시스템을 스탠드에 부착한 다음 USB Type-C 케이블을 통해 노트북에 연결합니다. 3D 컨트롤 볼륨을 스테레오 이미징 카메라 시스템 아래 6cm에 놓습니다. (B) 이미징 소프트웨어를 사용하여 3D 제어 볼륨의 이미지를 촬영합니다. 출력 이미지는 왼쪽 및 오른쪽 카메라의 결합된 이미지입니다. (C) 사용자 정의 MATLAB 코드를 사용하여 결합된 출력 이미지는 3D 제어 볼륨의 개별 왼쪽 및 오른쪽 이미지로 분리됩니다. 약어: 3D = 3차원. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 스테레오 카메라 이미징 시스템의 왼쪽 및 오른쪽 카메라 보기에 대한 직접 선형 변환 계수를 생성하기 위한 회로도. (A) DLTcal5.m22를 실행하고 제어 창에서 초기화를 클릭한 다음 3D 제어 볼륨의 디지털화된 (x, y, z) 좌표(mm)가 있는 *.csv 파일을 선택합니다. (B) 왼쪽 카메라 뷰의 보정 이미지를 선택합니다. 그런 다음 디지타이징된 순서와 동일한 순서로 이미지에서 점을 선택합니다. 그런 다음 계산 계수를 클릭하여 왼쪽 카메라 보기에 대한 DLT 계수를 생성합니다. 그런 다음 카메라 추가를 클릭하여 올바른 카메라 보기에 대한 단계를 반복합니다. (C) 오른쪽 카메라 뷰의 보정 이미지를 선택합니다. 그런 다음 디지타이징된 순서와 동일한 순서로 이미지에서 점을 선택합니다. 그런 다음 계산 계수를 클릭하여 올바른 카메라 뷰에 대한 DLT 계수를 생성합니다. (D) Save Data(데이터 저장)를 클릭하여 왼쪽 및 오른쪽 카메라 뷰에 대한 DLT 계수를 저장할 디렉토리를 선택합니다. 출력 파일의 이름을 입력하고 확인을 클릭하면 DLT 계수가 *.csv 파일로 저장됩니다. 약어: 3D = 3차원 및 DLT = 직접 선형 변환. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 데이터 수집
- 마취된 신생아 요크셔 새끼 돼지(생후 3-5일)를 앙와위 자세로 놓고 상지를 납치하여 겨드랑이 부위를 노출시킵니다. 기관을 덮고 있는 피부와 근막을 통해 흉골의 위쪽 3분의 1까지 정중선을 절개합니다.
- 둔기 절개를 사용하여 상완신경총 신경을 노출시킵니다.
- 노출된 상완신경총 신경에 식염수를 분사하여 검사 전, 검사 중, 검사 후에 수분을 유지합니다.
- 상완신경총 PN의 말단부를 자르고 기계적 테스트 장치에 고정합니다.
- 스테레오 이미징 카메라 시스템을 유틸리티 스탠드에 부착하고 늘릴 PN에서 최대 6cm 위에 놓은 다음 USB Type-C 케이블을 통해 스테레오 이미징 카메라 시스템을 노트북에 연결합니다(그림 5A).
- 잉크 기반 스킨 마커를 사용하여 삽입 및 클램프 부위에 마커를 배치하고 신경 길이에 따라 PN 길이를 따라 2-4개의 마커를 추가로 배치하여 변위 추적을 수행합니다(그림 5B).
- 캘리브레이션 그리드(즉, 0.5cm x 0.5cm 정사각형의 적층 그리드)와 1cm 눈금자를 데이터 분석을 위해 PN 아래에 평평하게 배치합니다(그림 5B).
- 클램핑 후와 스트레칭 직전에 PN의 초기 길이를 기록합니다.
- 500mm/min의 변위 속도로 PN을 스트레치하여 파손 또는 미리 결정된 스트레치를 수행합니다.

그림 5: 말초 신경 스트레칭의 데이터 수집을 위한 대표적인 개략도. (A) 스테레오 이미징 카메라 시스템을 스탠드에 부착한 다음 USB Type-C 케이블을 통해 노트북에 연결합니다. 스테레오 이미징 카메라 시스템을 말초 신경에서 최대 6cm 위에 배치합니다. (B) 말초 신경은 말단 말단의 기계적 설정에 고정되어 있습니다. 잉크 기반 스킨 마커를 사용하여 삽입 및 클램프 부위에 마커를 배치하고 신경 길이를 따라 2-4개의 마커를 추가로 배치합니다. 식염수는 검사 전, 검사 중, 검사 후에 수분을 유지하기 위해 말초 신경에 분사됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 데이터 분석 - 마커 궤적 추적
- 사용자 지정 MATLAB 코드(보충 파일 6)를 실행하여 출력 비디오 파일(보충 파일 7)을 두 개의 비디오 파일, 즉 왼쪽과 오른쪽 카메라 비디오 파일(각각 보충 파일 8 및 보충 파일 9)로 분리합니다.
- 클릭 달리다 을 초기화하여 DLTdv7.m22 GUI(보충 파일 10).
- DLTdv7 컨트롤 창이 나타나고 새 프로젝트, 프로젝트 로드 및 종료 버튼이 활성화됩니다(그림 6A).
- DLTdv7 컨트롤 창에서 새 프로젝트를 클릭하여 새 프로젝트를 시작합니다.
- 대화 상자가 나타나면 2 를 선택하여 두 개의 비디오 파일(즉, 왼쪽 및 오른쪽 카메라 뷰)을 표시하여 늘어난 말초 신경의 변위 마커 궤적을 추적합니다(그림 6B).
- 첫 번째 비디오 선택 file (즉, 비디오 1), 비디오 file 왼쪽 카메라 보기(보충 파일 8)에서 열기 를 클릭합니다(그림 6C). 그런 다음 두 번째 비디오 파일(즉, 비디오 2)을 선택합니다. 이는 오른쪽 카메라 보기(보충 파일 9)에서 비디오 파일이며 열기 를 클릭합니다(그림 6C).
- 두 개의 비디오 파일을 선택한 후 예를 클릭하여 비디오 파일이 DLT를 통해 보정된 카메라 뷰에서 획득되었음을 나타냅니다.
- 스테레오 이미징 카메라 시스템에 해당하는 DLT 계수 *.csv 파일(보충 파일 5)을 선택하고 열기 를 클릭합니다(그림 6D).
- 초기 비디오 프레임은 두 비디오 파일 모두에서 표시되고 나머지 DLTdv7 컨트롤 창은 활성화됩니다. 새 프로젝트 버튼은 3D 포인트 재계산 버튼으로 바뀌고 프로젝트 로드 버튼은 저장 버튼으로 바뀝니다(그림 6E).
- DLTdv7 컨트롤 창에서 프레임 번호가 1로 설정되어 있고, 현재 포인트가 1로 설정되어 있고, 오토트랙 모드가 꺼져 있고, 모든 비디오, DLT 시각적 피드백을 업데이트하고, 2D 트랙 표시가 선택되어 있는지 확인합니다(그림 6E).
- 삽입 마커가 점 1에 해당하고, 표식 1이 점 2에 해당하며, 클램프 마커가 최종 점이 되도록 추적 점이 PN의 변위 마커에 배치되었는지 확인합니다.
- 비디오 1의 삽입 마커(즉, 왼쪽 카메라 뷰 비디오 파일)에 포인트 1을 배치하여 배치된 포인트가 삽입 마커의 중앙에 오도록 합니다. 키보드 단축키(표 1)를 사용하여 배치된 점을 삽입 마커의 가운데로 이동합니다(그림 7A).
- DLT 시각적 피드백이 확인되기 때문에 비디오 1에 점을 배치하면 비디오 2(즉, 오른쪽 카메라 뷰 비디오 파일)에 파란색 epipolar line이 나타납니다(그림 7). 파란색 epipolar 선을 참조로 사용하여 비디오 2의 삽입 마커에 점 1을 배치합니다. 필요에 따라 키보드 단축키(표 1)를 사용하여 배치된 점을 삽입 마커의 가운데로 이동합니다(그림 7A).
- DLTdv7 컨트롤 창에서 점 추가를 클릭하여 다른 조직 마커에 점을 추가하여 궤적을 추적합니다. DLTdv7 컨트롤 창의 현재 지점을 참조하여 활성 지점을 확인합니다.
- 포인트 추가를 클릭합니다. 비디오 1의 마커 1에 포인트 2를 배치합니다. 파란색 epipolar 선과 키보드 단축키를 사용하여 비디오 2의 마커 1에 포인트 2를 배치합니다. 삽입과 클램프 사이의 신경 길이(즉, 최종 지점)를 따라 모든 변위 마커에 대해 먼저 비디오 1에서, 그 다음 비디오 2에서 점을 계속 추가하고 배치합니다(그림 7B-F).
- 모든 초기 포인트가 비디오 1 및 비디오 2(즉, 각각 왼쪽 및 오른쪽 카메라 비디오 파일)에 배치되면 DLTdv7 컨트롤 창에서 프레임 번호가 1에 있고 현재 포인트가 1로 설정되어 있는지 확인합니다.
- DLTdv7 제어 창의 드롭다운 메뉴에서 자동 진행으로 자동 추적 모드를 변경하고 드롭다운 메뉴에서 확장 Kalman으로 예측 변수를 자동 추적합니다(그림 8A).
- 먼저 비디오 1 에서 배치된 모든 포인트의 추적을 완료한 다음 비디오 2에서 추적을 완료합니다. 실패(즉, 말초 신경의 총 파열 전 프레임) 또는 미리 결정된 스트레치에 대한 비디오 전체가 달성될 때까지 마커의 중심을 프레임별로 마우스 왼쪽 버튼으로 클릭하여 마커 궤적을 추적합니다.
- 비디오 1에서 점 1을 추적하기 시작합니다. 추적이 마커의 중앙에 오도록 원하는 대로 확대 및 축소(표 1)합니다. 비디오가 실패하거나 끝날 때까지 프레임별로 클릭합니다(그림 8B). 비디오 1에서 포인트 1의 추적을 완료한 후 프레임 1로 돌아가서 DLTdv7 컨트롤 창의 드롭다운 메뉴에서 현재 포인트를 포인트 2로 변경합니다. 이전에 추적된 포인트는 연한 파란색으로 바뀌고 궤적은 노란색으로 바뀝니다. 현재 점에는 녹색 다이아몬드와 분홍색 중심이 있습니다.
- 비디오가 실패하거나 끝날 때까지 각 포인트에 대해 프레임별로 마우스 왼쪽 버튼을 클릭하여 비디오 1의 모든 포인트 추적을 완료합니다(그림 8C-G).
- 비디오 2에서 파란색 epipolar 선을 사용하여 비디오 1을 참조하는 점을 추적합니다(그림 9). DLTdv7 컨트롤 창에서 프레임 번호를 1로 되돌리고 현재 지점을 1로 설정한 다음 비디오 2에서 지점 1의 궤적 추적을 시작합니다.
- 동일한 단계(5.2.16-5.2.18)에 따라 비디오 2의 나머지 점을 추적합니다.
- 비디오 1 및 비디오 2에서 추적이 완료된 후 DLTdv7 컨트롤 창에서 점 내보내기를 클릭하여 추적된 점의 (x, y, z) 좌표(mm)를 내보냅니다.
- 출력 파일을 저장할 디렉토리를 선택할 수 있는 대화 상자가 나타납니다. 디렉토리 위치를 클릭합니다.
- 출력 파일의 이름을 설정하는 다른 대화 상자가 나타납니다. 출력 파일의 이름을 설정합니다(예: nerve1_101-Jan-2001videoanalyzed_cal09.30_trial1_).
- 다른 대화 상자가 나타납니다. 저장 형식을 플랫으로 선택합니다.
- 다른 대화 상자가 나타납니다. 95% 신뢰 구간을 계산하려면 아니요를 선택합니다.
- 데이터를 내보내고 저장한 것을 보여주는 마지막 대화 상자가 나타나고 4개의 출력 파일이 선택한 디렉토리 위치(보충 파일 11, 보충 파일 12, 보충 파일 13 및 보충 파일 14)로 내보내집니다.
- DLTdv7 컨트롤 창에서 프로젝트 저장을 클릭하여 현재 프로젝트(추가 파일 15)를 출력 파일과 동일한 디렉터리에 저장합니다.
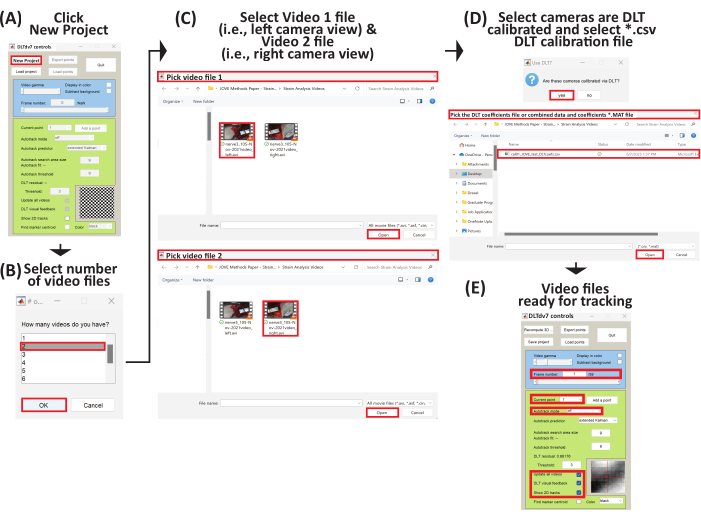
그림 6: 3차원 궤적 추적을 시작하기 위해 새 프로젝트를 설정하기 위한 회로도. (A) DLTdv7.m22 를 실행하고 새 프로젝트를 클릭하여 새 프로젝트를 시작합니다. (B) 비디오 파일 수로 2 를 선택합니다. (C) 비디오 1 파일 (즉, 왼쪽 카메라 보기)을 선택한 다음 비디오 2 파일(즉, 오른쪽 카메라 보기)을 선택합니다. (D) 비디오 파일은 DLT 보정 스테레오 이미징 카메라 시스템에서 가져온 것이므로 예를 선택합니다. 그런 다음 DLT 계수가 포함된 *.csv 파일을 선택합니다. (E) 선택한 비디오 files이제 추적할 준비가 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 키/클릭 | 묘사 |
| 왼쪽 클릭 | 클릭된 프레임의 한 지점의 추적 추적 |
| (+) 열쇠 | arount mosue 포인터 에서 현재 비디오 프레임을 확대/축소합니다. |
| (-) 열쇠 | 현재 비디오 프레임 을 확대 / 축소하여 포인터를 자극합니다. |
| (i) 키 | 점을 위로 이동 |
| (j) 키 | 점을 왼쪽으로 이동 |
| (k) 키 | 점을 오른쪽으로 이동 |
| (m) 키 | 점을 아래로 이동 |
표 1: 포인트 궤적을 추적하기 위한 키보드 및 마우스 단축키.

그림 7: DLTdv7.m22를 사용하여 비디오 1 및 비디오 2의 조직 마커에 초기점을 배치하는 회로도. (A) 현재 점을 1로 설정합니다. 비디오 1의 삽입 마커에 점 1을 놓습니다. 비디오 2의 파란색 epipolar 선을 사용하여 삽입 마커에 점 1을 배치합니다. (B) 현재 지점을 2로 설정합니다. 비디오 1의 마커 1에 포인트 2를 배치합니다. 비디오 2의 파란색 epipolar 선을 사용하여 점 2를 마커 1에 배치합니다. (C) 현재 지점을 3으로 설정합니다. 비디오 1의 마커 2에 포인트 3을 배치합니다. 비디오 2의 파란색 epipolar 선을 사용하여 점 3을 마커 2에 배치합니다. (D) 현재 지점을 4로 설정합니다. 비디오 1의 마커 3에 포인트 4를 배치합니다. 비디오 2의 파란색 epipolar 선을 사용하여 점 4를 마커 3에 배치합니다. (E) 현재 지점을 5로 설정합니다. 비디오 1의 마커 4에 포인트 5를 배치합니다. 비디오 2의 파란색 에피폴라 선을 사용하여 점 5를 마커 4에 배치합니다. (F) 현재 지점을 6으로 설정합니다. 비디오 1의 클램프 마커에 포인트 6을 배치합니다. 비디오 2의 파란색 epipolar 선을 사용하여 클램프 마커에 점 6을 배치합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: DLTdv7.m22를 사용하여 비디오 1의 마커 포인트 궤적을 추적하기 위한 회로도. (A) 프레임 번호를 1로, 현재 지점을 1로, 오토트랙 모드를 자동 진행으로, 오토트랙 예측기를 확장 칼만으로 설정합니다. (B) 현재 지점을 1로 설정합니다. 비디오 1 파일에서 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 삽입 마커(즉, 포인트 1) 변위를 추적하기 시작합니다. (C) 프레임 번호를 1 로 설정하고 현재 지점을 2로 설정합니다. 비디오 1 파일에서 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 마커 1(즉, 포인트 2) 변위를 추적하기 시작합니다. (D) 프레임 번호를 1 로, 현재 지점을 3으로 설정합니다. 비디오 1 파일에서 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 마커 2(즉, 포인트 3) 변위를 추적하기 시작합니다. (E) 프레임 번호를 1 로, 현재 지점을 4로 설정합니다. 비디오 1 파일에서 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 마커 3(즉, 포인트 4) 변위를 추적하기 시작합니다. (F) 프레임 번호를 1 로, 현재 지점을 5로 설정합니다. 비디오 1 파일에서 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 마커 4(즉, 포인트 5) 변위를 추적하기 시작합니다. (G) 프레임 번호를 1 로, 현재 지점을 6으로 설정합니다. 비디오 1 파일에서 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 클램프 마커(즉, 포인트 6) 변위를 추적하기 시작합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 9: DLTdv7.m22를 사용하여 비디오 2의 마커 포인트 궤적을 추적하기 위한 회로도. (A) 프레임 번호를 1로, 현재 지점을 1로, 자동 추적 모드를 자동 진행으로, 자동 추적 예측기를 확장 Kalman으로 설정합니다. (B) 현재 지점을 1로 설정합니다. 비디오 2 파일의 파란색 epipolar line을 사용하여 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 삽입 마커(즉, 포인트 1) 변위를 추적하기 시작합니다. (C) 프레임 번호를 1 로 설정하고 현재 지점을 2로 설정합니다. 비디오 2 파일의 파란색 에피폴라 선을 사용하여 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 마커 1(즉, 포인트 2) 변위를 추적하기 시작합니다. (D) 프레임 번호를 1 로, 현재 지점을 3으로 설정합니다. 비디오 2 파일의 파란색 epipolar 선을 사용하여 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 마커 2(즉, 포인트 3) 변위를 추적하기 시작합니다. (E) 프레임 번호를 1 로, 현재 지점을 4로 설정합니다. 비디오 2 파일의 파란색 에피폴라 라인을 사용하여 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 마커 3(즉, 포인트 4) 변위를 추적하기 시작합니다. (F) 프레임 번호를 1 로, 현재 지점을 5로 설정합니다. 비디오 2 파일의 파란색 에피폴라 라인을 사용하여 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 마커 4(즉, 포인트 5) 변위를 추적하기 시작합니다. (G) 프레임 번호를 1 로, 현재 지점을 6으로 설정합니다. 비디오 2 파일의 파란색 epipolar 선을 사용하여 마지막 프레임까지 프레임별로 마우스 왼쪽 버튼을 클릭하여 클램프 마커(즉, 포인트 6) 변위를 추적하기 시작합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 데이터 분석-변형률 분석
- 사용자 지정 MATLAB 코드(보충 파일 16)를 실행하여 추적된 3D(x, y, z) 마커 궤적(mm)을 가져옵니다.
- MATLAB 명령 창에 다음을 입력합니다.
percentStrain, deltaLi, lengthNi, filename] = PercentStrain_3D - 예를 들어 비디오 파일에 59개의 프레임이 있는 경우 시간은 0.59초입니다. 추적된 점의 수를 입력하고 추적된 3D(x, y, z) 궤적(mm)이 있는 *_xyzpts.csv 파일을 선택합니다.
- 출력 길이 대 시간(보충 그림 S4), 길이 대 시간의 변화(보충 그림 S5), 변형률 대 시간(보충 그림 S6) 플롯과 시간, 길이, 길이 및 변형률 변화(보충 파일 17)가 포함된 *.xls 파일을 저장할 디렉토리를 선택합니다.
- 방정식 1-3을 사용하여 길이(l), 길이 변화(Δl) 및 변형률 백분율을 계산합니다.
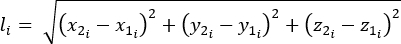 (1)
(1)
여기서 li는임의의 시점에서 두 마커 사이의 거리입니다. x1i, y1i, z1i 는 두 마커 중 하나의 3D 좌표입니다. x2i, y2i, z2i 는 두 번째 마커의 3D 좌표입니다. (2)
(2)
여기서 li는임의의 시점에서 두 마커 사이의 거리이고 lo 는 원래/0 시간 지점에서 두 마커 사이의 거리입니다.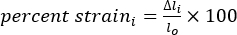 (3)
(3)
여기서 Δli는 임의의 시점에서 두 마커 사이의 길이 변화이고, lo는 원래/0 시점에서의 두 마커 사이의 거리입니다.
결과
설명된 방법론을 사용하여 다양한 출력 파일을 얻을 수 있습니다. DLTdv7.m *_xyzpts.csv(보충 파일 12)에는 각 시간 프레임에서 추적된 각 지점의 (x, y, z) 좌표(밀리미터)가 포함되어 있으며, 이는 추가로 늘어난 PN의 길이, 길이 변화 및 변형률을 계산하는 데 사용됩니다. 스트레치 PN의 대표적인 길이-시간, 길이-시간의 변화 및 변형-시간 플롯이 그림 10에 나와 있습니?...
토론
스트레치 손상으로 인한 말초 신경(PN)의 생체역학적 특성을 보고하는 연구는 다양하며, 이러한 차이는 테스트 장비 및 신장 분석과 같은 테스트 방법에 기인할 수 있습니다 5,6,7,8,9,10,11,12,13,14,16,24
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 유니스 케네디 슈라이버 국립보건원(National Institutes of Health) 산하 국립아동보건인간발달연구소(National Institute of Child Health and Human Development)의 자금 지원을 받아 R15HD093024 및 R01HD104910A 및 NSF CAREER Award 1752513의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Clear Acrylic Plexiglass Square Sheet | W W Grainger Inc | BULKPSACR9 | Construct three-dimensional control volume |
| Stereo-imaging camera system - ZED Mini Stereo Camera | StereoLabs Inc. | N/A | N/A |
| Imaging Software - ZED SDK | StereoLabs Inc. | N/A | N/A |
| Maintence Software - CUDA 12 | StereoLabs Inc. | N/A | Download to run ZED SDK |
| Camera stand - Cast Iron Triangular Support Stand with Rod | Telrose VWR Choice | 76293-346 | N/A |
| MicroSribe G2 Digitizer with Immersion Foot Pedal | SUMMIT Technology Group | N/A | N/A |
| Proramming Software - MATLAB | Mathworks | N/A | version 2019A or newer |
| DLTcal5.m | Hedrick lab | N/A | Open Source |
| DLTdv7.m | Hedrick lab | N/A | Open Source |
참고문헌
- Bueno, F. R., Shah, S. B. Implications of tensile loading for the tissue engineering of nerves. Tissue Engineering Part B: Reviews. 14 (3), 219-233 (2008).
- Grewal, R., Xu, J., Sotereanos, D. G., Woo, S. L. Biomechanical properties of peripheral nerves. Hand Clinics. 12 (2), 195-204 (1996).
- Papagiannis, G., et al. Biomechanical behavior and viscoelastic properties of peripheral nerves subjected to tensile stress: common injuries and current repair techniques. Critical Reviews in Physical and Rehabilitation Medicine. 32 (3), 155-168 (2020).
- Castaldo, J., Ochoa, J. Mechanical injury of peripheral nerves. Fine structure and dysfunction. Clinics in Plastic Surgery. 11 (1), 9-16 (1984).
- Singh, A. Extent of impaired axoplasmic transport and neurofilament compaction in traumatically injured axon at various strains and strain rates. Brain Injury. 31 (10), 1387-1395 (2017).
- Singh, A., Kallakuri, S., Chen, C., Cavanaugh, J. M. Structural and functional changes in nerve roots due to tension at various strains and strain rates: an in-vivo study. Journal of Neurotrauma. 26 (4), 627-640 (2009).
- Singh, A., Lu, Y., Chen, C., Kallakuri, S., Cavanaugh, J. M. A new model of traumatic axonal injury to determine the effects of strain and displacement rates. Stapp Car Crash Journal. 50, 601 (2006).
- Singh, A., Lu, Y., Chen, C., Cavanaugh, J. M. Mechanical properties of spinal nerve roots subjected to tension at different strain rates. Journal of Biomechanics. 39 (9), 1669-1676 (2006).
- Singh, A., Shaji, S., Delivoria-Papadopoulos, M., Balasubramanian, S. Biomechanical responses of neonatal brachial plexus to mechanical stretch. Journal of Brachial Plexus and Peripheral Nerve Injury. 13 (01), e8-e14 (2018).
- Zapałowicz, K., Radek, A. Mechanical properties of the human brachial plexus. Neurologia I Neurochirurgia Polska. 34, 89-93 (2000).
- Zapałowicz, K., Radek, A. . Annales Academiae Medicae Stetinensis. 51 (2), 11-14 (2005).
- Zapałowicz, K., Radek, M. The distribution of brachial plexus lesions after experimental traction: a cadaveric study. Journal of Neurosurgery: Spine. 29 (6), 704-710 (2018).
- Kawai, H., et al. Stretching of the brachial plexus in rabbits. Acta Orthopaedica Scandinavica. 60 (6), 635-638 (1989).
- Marani, E., Van Leeuwen, J., Spoor, C. The tensile testing machine applied in the study of human nerve rupture: a preliminary study. Clinical Neurology and Neurosurgery. 95, 33-35 (1993).
- Lee, S. K., Wolfe, S. W. Peripheral nerve injury and repair. JAAOS-Journal of the American Academy of Orthopaedic Surgeons. 8 (4), 243-252 (2000).
- Rickett, T., Connell, S., Bastijanic, J., Hegde, S., Shi, R. Functional and mechanical evaluation of nerve stretch injury. Journal of Medical Systems. 35, 787-793 (2011).
- Topp, K. S., Boyd, B. S. Structure and biomechanics of peripheral nerves: nerve responses to physical stresses and implications for physical therapist practice. Physical Therapy. 86 (1), 92-109 (2006).
- Lu, Y., Chen, C., Kallakuri, S., Patwardhan, A., Cavanaugh, J. M. Development of an in vivo method to investigate biomechanical and neurophysiological properties of spine facet joint capsules. European Spine Journal. 14 (6), 565-572 (2005).
- Kallakuri, S., et al. Tensile stretching of cervical facet joint capsule and related axonal changes. European Spine Journal. 17 (4), 556-563 (2008).
- Abdel-Aziz, Y. I., Karara, H. M. Direct linear transformation from comparator coordinates into object space coordinates in close-range photogrammetry. Photogrammetric Engineering & Remote Sensing. 81 (2), 103-107 (2015).
- Pourcelot, P., Audigié, F., Degueurce, C., Geiger, D., Denoix, J. M. A method to synchronise cameras using the direct linear transformation technique. Journal of Biomechanics. 33 (12), 1751-1754 (2000).
- Hedrick, T. L. Software techniques for two- and three-dimensional kinematic measurements of biological and biomimetic systems. Bioinspiration & Biomimetics. 3 (3), 034001 (2008).
- Chen, L., Armstrong, C. W., Raftopoulos, D. D. An investigation on the accuracy of three-dimensional space reconstruction using the direct linear transformation technique. Journal of Biomechanics. 27 (4), 493-500 (1994).
- Singh, A., Magee, R., Balasubramanian, S. Methods for in vivo biomechanical testing on brachial plexus in neonatal piglets. Journal of Visualized Experiments. (154), e59860 (2019).
- Black, J., Ellis, T. Multi camera image tracking. Image and Vision Computing. 24 (11), 1256-1267 (2006).
- Cardenas-Garcia, J. F., Yao, H. G., Zheng, S. 3D reconstruction of objects using stereo imaging. Optics and Lasers in Engineering. 22 (3), 193-213 (1995).
- Mahan, M. A., Yeoh, S., Monson, K., Light, A. Rapid stretch injury to peripheral nerves: biomechanical results. Neurosurgery. 85 (1), E137-E144 (2019).
- Rydevik, B. L., et al. An in vitro mechanical and histological study of acute stretching on rabbit tibial nerve. Journal of Orthopaedic Research. 8 (5), 694-701 (1990).
- Mahan, M. A., Warner, W. S., Yeoh, S., Light, A. Rapid-stretch injury to peripheral nerves: implications from an animal model. Journal of Neurosurgery. 133 (5), 1537-1547 (2019).
- Singh, A., Ferry, D., Balasubramanian, S. Efficacy of clinical simulation based training in biomedical engineering education. Journal of Biomechanical Engineering. 141 (12), 121011-121017 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유