É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagens do sistema aéreo não tripulado no nível do solo, juntamente com amostragem espacialmente equilibrada e otimização de rotas para monitorar a vegetação de pastagens
Neste Artigo
Resumo
O protocolo apresentado neste artigo utiliza otimização de rota, amostragem de aceitação balanceada e imagens de sistemas de aeronaves não tripuladas (UAS) no nível do solo para monitorar com eficiência a vegetação em ecossistemas de pastagens. Os resultados das imagens obtidas dos métodos de nível do solo e UAS são comparados.
Resumo
Os ecossistemas de pastagens cobrem 3,6 bilhões de hectares em todo o mundo, com 239 milhões de hectares localizados nos Estados Unidos. Esses ecossistemas são essenciais para a manutenção dos serviços ecossistêmicos globais. O monitoramento da vegetação nesses ecossistemas é necessário para avaliar a saúde das pastagens, avaliar a adequação do habitat para a vida selvagem e o gado doméstico, combater ervas daninhas invasoras e elucidar mudanças ambientais temporais. Embora os ecossistemas de pastagens cubram vastas áreas, as técnicas tradicionais de monitoramento são muitas vezes demoradas e ineficientes, sujeitas a um alto viés de observação e muitas vezes carecem de informações espaciais adequadas. O monitoramento da vegetação baseado em imagens é mais rápido, produz registros permanentes (ou seja, imagens), pode resultar em viés reduzido do observador e inclui inerentemente informações espaciais adequadas. Desenhos amostrais espacialmente equilibrados são benéficos no monitoramento de recursos naturais. Um protocolo é apresentado para implementar um projeto de amostragem espacialmente balanceado conhecido como amostragem de aceitação balanceada (BAS), com imagens adquiridas de câmeras no nível do solo e sistemas aéreos não tripulados (UAS). Além disso, um algoritmo de otimização de rotas é usado para resolver o 'problema do vendedor ambulante' (TSP) para aumentar a eficiência de tempo e custo. Embora as imagens UAS possam ser adquiridas 2 a 3 vezes mais rápido do que as imagens portáteis, ambos os tipos de imagens são semelhantes entre si em termos de exatidão e precisão. Por fim, os prós e contras de cada método são discutidos e exemplos de aplicações potenciais para esses métodos em outros ecossistemas são fornecidos.
Introdução
Os ecossistemas de pastagens abrangem vastas áreas, cobrindo 239 milhões de hectares nos Estados Unidos e 3,6 bilhões de hectares globalmente1. As pastagens fornecem uma ampla gama de serviços ecossistêmicos e o manejo das pastagens envolve vários usos da terra. No oeste dos EUA, as pastagens fornecem habitat para a vida selvagem, armazenamento de água, sequestro de carbono e forragem para o gado doméstico2. As pastagens estão sujeitas a vários distúrbios, incluindo espécies invasoras, incêndios florestais, desenvolvimento de infraestrutura e extração de recursos naturais (por exemplo, petróleo, gás e carvão)3. O monitoramento da vegetação é fundamental para sustentar o manejo de recursos em pastagens e outros ecossistemas em todo o mundo 4,5,6. O monitoramento da vegetação em pastagens é frequentemente usado para avaliar a saúde das pastagens, a adequação do habitat para espécies selvagens e para catalogar mudanças nas paisagens devido a espécies invasoras, incêndios florestais e extração de recursos naturais 7,8,9,10. Embora os objetivos de programas de monitoramento específicos possam variar, programas de monitoramento que atendam às necessidades de várias partes interessadas, sendo estatisticamente confiáveis, repetíveis e econômicos, são desejados 5,7,11. Embora os administradores de terras reconheçam a importância do monitoramento, muitas vezes é visto como não científico, antieconômico e oneroso5.
Tradicionalmente, o monitoramento de pastagens tem sido conduzido com uma variedade de métodos, incluindo estimativa ocular ou visual10, quadros de Daubenmire12, gráficos de plotagem13 e interceptação de ponto de linha ao longo de transectos de vegetação14. Embora a estimativa ocular ou visual seja eficiente em termos de tempo, ela está sujeita a um alto viés do observador15. Outros métodos tradicionais, embora também sujeitos a alto viés de observador, são frequentemente ineficientes devido aos seus requisitos de tempo e custo 6,15,16,17. O tempo necessário para implementar muitos desses métodos tradicionais costuma ser muito oneroso, dificultando a obtenção de tamanhos de amostra estatisticamente válidos, resultando em estimativas populacionais não confiáveis. Esses métodos são frequentemente aplicados com base na conveniência, e não estocásticamente, com os observadores escolhendo onde coletar dados. Além disso, os locais de amostragem relatados e reais frequentemente diferem, causando confusão para os administradores de terras e outras partes interessadas que dependem de dados de monitoramento da vegetação18. Pesquisas recentes demonstraram que o monitoramento da vegetação baseado em imagens é econômico e de tempo 6,19,20. Aumentar a quantidade de dados que podem ser amostrados em uma determinada área em um curto período de tempo deve melhorar a confiabilidade estatística dos dados em comparação com técnicas tradicionais mais demoradas. As imagens são registros permanentes que podem ser analisados por múltiplos observadores após a coleta dos dados de campo6. Além disso, muitas câmeras são equipadas com sistemas de posicionamento global (GPS), para que as imagens possam ser georreferenciadas com um local de coleta18,20. O uso de pontos de amostragem gerados por computador, localizados com precisão no campo, deve reduzir o viés do observador, seja a imagem adquirida com uma câmera portátil ou por um sistema aéreo não tripulado, pois reduz a inclinação de um observador individual para usar sua opinião sobre onde os locais de amostragem devem ser colocados.
Além de ser demorado, caro e sujeito a um alto viés do observador, o monitoramento tradicional de recursos naturais frequentemente falha em caracterizar adequadamente as pastagens heterogêneas devido ao baixo tamanho da amostra e locais de amostragem concentrados21. Desenhos de amostragem espacialmente balanceados distribuem os locais das amostras de maneira mais uniforme em uma área de interesse para melhor caracterizar os recursos naturais 21,22,23,24. Esses desenhos podem reduzir os custos de amostragem, porque tamanhos de amostra menores são necessários para alcançar precisão estatística em relação à amostragem aleatória simples25.
Neste método, um projeto de amostragem espacialmente equilibrado conhecido como amostragem de aceitação balanceada (BAS) 22 , 24 é combinado com monitoramento baseado em imagem para avaliar a vegetação da pastagem. Os pontos BAS são distribuídos de forma otimizada pela área de interesse26. No entanto, isso não garante que os pontos serão ordenados em uma rota ideal para visitação20. Portanto, os pontos BAS são organizados usando um algoritmo de otimização de rota que resolve o problema do vendedor ambulante (TSP)27. Visitar os pontos nesta ordem determina um caminho ideal (ou seja, menor distância) conectando os pontos. Os pontos BAS são transferidos para um programa de software de sistema de informação geográfica (GIS) e, em seguida, para uma unidade portátil de coleta de dados equipada com GPS. Depois que os pontos BAS são localizados, as imagens são tiradas com uma câmera equipada com GPS, bem como um sistema aéreo não tripulado operado usando software de voo. Ao entrar no campo, um técnico caminha até cada ponto para adquirir imagens de câmera montadas em monopé de 1 m2 com distância de amostra de solo (GSD) de 0,3 mm em cada ponto BAS, enquanto um UAS voa para os mesmos pontos e adquire imagens de GSD de 2,4 mm. Posteriormente, os dados de cobertura vegetal são gerados usando 'SamplePoint'28 para classificar manualmente 36 pontos/imagem. Os dados de cobertura vegetal gerados a partir da análise de imagens no nível do solo e UAS são comparados, bem como os tempos de aquisição relatados para cada método. No estudo representativo, foram utilizadas duas parcelas adjacentes de pastagens de 10 acres. Finalmente, outras aplicações deste método e como ele pode ser modificado para projetos futuros ou projetos em outros ecossistemas são discutidos.
Protocolo
1. Definição da área de estudo, geração de pontos amostrais e percurso de deslocamento, e preparação do campo
- Definição da área de estudo
- Use um programa de software GIS para desenhar um gráfico (s) poligonal (s) ao redor da (s) área (s) de interesse. Este estudo foi realizado em dois lotes de 10 acres dentro de um lote de pastagem no condado de Laramie, WY, EUA (Figura 1).
- Certifique-se de que as áreas que não se destinam a estar dentro do quadro de amostra sejam excluídas do polígono (por exemplo, corpos d'água, estruturas de edifícios, estradas, etc.). Isso garantirá que as imagens não sejam tiradas dessas áreas posteriormente.
- Converta o gráfico de polígono em um recurso de shapefile (.shp) no programa de software GIS e certifique-se de que o shapefile seja criado no sistema de coordenadas desejado.
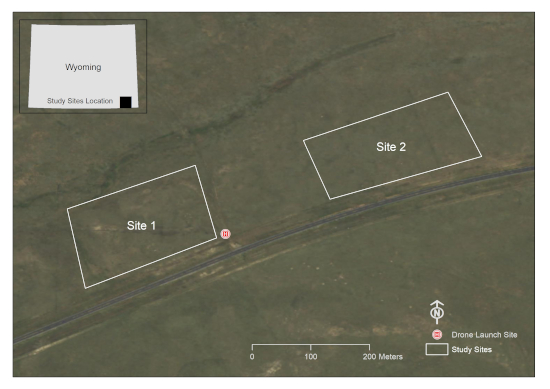
Figura 1: Uma representação das áreas de interesse do estudo. Este local fica em um lote de pastagem ao sul de Cheyenne, no condado de Laramie, WY, EUA (Fonte de imagens: Wyoming NAIP Imagery 2017). Clique aqui para ver uma versão maior desta figura.
- Geração dos pontos BAS e otimização do trajeto de viagem
NOTA: O código está anexado como 'Supplemental_Code.docx'.- Use o pacote R 'rgdal'29 para converter o polígono GIS em um arquivo legível do Programa R.
- Use o pacote R 'SDraw'30 para gerar o número desejado de pontos BAS. Este estudo usou 30 pontos BAS por área de estudo, embora pesquisas futuras devam ser conduzidas para determinar a intensidade de amostragem ideal para áreas de vários tamanhos e composição de vegetação.
- Use o pacote R 'TSP'27 para solicitar os pontos BAS. Visitar os pontos nesta ordem minimiza o tempo necessário para obter amostras nos pontos BAS.
- Preparação para aquisição de imagens portáteis
- Use o pacote R 'rgdal' para transferir os pontos da etapa 1.2.1 de volta para o programa GIS.
- Edite a tabela de atributos do shapefile para que o campo ID do ponto reflita com precisão a ordem do caminho otimizado.
- Transfira o polígono GIS e o arquivo de ponto para o software GIS em execução em uma unidade portátil.
- Certifique-se de que o sistema de coordenadas projetadas correto para a área de interesse esteja em vigor.
- Preparação para aquisição de imagens de UAS
- Use o pacote R 'rgdal' para transferir os pontos da etapa 1.2.1 de volta para o programa de software GIS.
- No programa de software GIS, use a ferramenta Adicionar coordenadas XY para criar e preencher campos de latitude e longitude na tabela de atributos de waypoint.
- Exporte a tabela de atributos de waypoint que contém as colunas Latitude, Longitude e TSP para o formato de arquivo *.csv.
- Abra o arquivo *.csv em um pacote de software apropriado.
- Classifique os waypoints por identificador TSP.
- Abra o aplicativo Mission Hub.
- Crie um waypoint arbitrário no Mission Hub.
- Exporte o waypoint arbitrário como arquivo *.csv.
- Abra o arquivo *.csv em um programa de planilha e exclua os cabeçalhos de coluna de waypoint arbitrário.
- Copie os pares de coordenadas de waypoint classificados por TSP da etapa 1.2.3 em colunas relevantes no arquivo *.csv da etapa 1.4.8.
- Importe o arquivo *.csv da etapa 1.4.10 para o Mission Hub como uma nova missão.
- Defina as configurações.
- Marque a caixa Usar elevação online .
- Especifique o modo de caminho como linhas retas.
- Especifique Concluir ação como RTH para permitir que o drone retorne para casa após a conclusão da missão.
- Clique em waypoints individuais e adicione ações especificando os seguintes parâmetros: Stay: 2 s (para evitar desfoque da imagem); Câmera de inclinação: -90° (Nadir); Tire uma foto.
- Salve a missão com um nome apropriado.
- Repita o processo para sites adicionais.
2. Coleta e pós-processamento de dados de campo
- Registro da vegetação observada ou esperada na área de estudo
- Antes de adquirir imagens, crie uma lista de vegetação observada dentro da área de estudo. Isso pode ser feito em uma folha manuscrita ou em um formulário digital para auxiliar na identificação com foto posteriormente. Pode ser benéfico incluir espécies que provavelmente serão esperadas na área no inventário, mesmo que não sejam observadas no campo (por exemplo, espécies dentro de misturas de sementes de recuperação)18.
- Aquisição de imagens terrestres
- Conecte uma câmera a um monopé vertical e aponte a câmera para baixo aproximadamente 60°. A área da imagem pode ser determinada usando as especificações de lente e resolução (megapixel) da câmera e configurando o monopé para uma altura padrão. A altura do monopé juntamente com as especificações da câmera determinará a distância da amostra do solo (GSD). Neste estudo, uma câmera de 12,1 megapixels foi usada e o monopé foi ajustado a uma constante de 1,3 m acima do solo para obter imagens Nadir em ~ 0,3 mm GSD18.
- Incline o monopé para frente para que a lente da câmera fique na posição Nadir e o monopé angular não seja visível na imagem.
- Ajuste a altura do monopé ou o zoom na lente para obter um tamanho de plotagem sem moldura de 1 m2 (ou outro tamanho de plotagem desejado). Para as câmeras de proporção 4:3 mais comuns, uma largura de plotagem de 115 cm produz um campo de visão de imagem de 1 m2 . Não há necessidade de colocar uma moldura no chão; a imagem inteira é o enredo. Se ajustar o zoom na lente para fazer isso, use fita adesiva para evitar alterações acidentais na configuração de zoom.
- Se possível, defina a câmera para o modo de prioridade ao obturador e defina a velocidade do obturador para pelo menos 1/125 s para evitar desfoque na imagem; mais rápido se estiver ventando.
- Localize o primeiro ponto na ordem do caminho otimizado.
- Coloque o monopé no chão no ponto 1 e incline o monopé até que a câmera esteja na orientação Nadir. Certifique-se de que a sombra do operador não esteja na imagem. Segure a câmera com firmeza para evitar desfoque de movimento. Adquira a imagem.
NOTA: Um cabo de disparo remoto é útil para esta etapa. - Verifique a qualidade da imagem para garantir a captura de dados bem-sucedida.
- Navegue até o próximo ponto na ordem do caminho otimizado e repita as etapas de aquisição.
- Aquisição de imagens de UAS
- Antes de lançar o UAS, faça um breve reconhecimento da área de estudo para garantir que nenhum obstáculo físico esteja dentro da trajetória de voo. Este exercício de reconhecimento também é útil para localizar uma área bastante plana para lançar o UAS.
- Certifique-se de que as condições meteorológicas sejam adequadas para voar no UAS: um dia seco e claro (visibilidade de >4,8 km) com iluminação adequada, vento mínimo (<17 nós) e temperaturas entre 0 °C e 37 °C.
- Siga os protocolos legais. Por exemplo, nos EUA, as políticas da Federal Aviation Administration devem ser seguidas.
- Utilize o software Mission Hub (Figura 2) e um aplicativo de execução de missão acessível por meio de dispositivos móveis (Figura 3).
- Colete imagens de UAS em cada ponto BAS, conforme descrito na etapa 1.4.
- Verifique se todas as imagens foram adquiridas utilizando o dispositivo móvel antes de mudar de local.
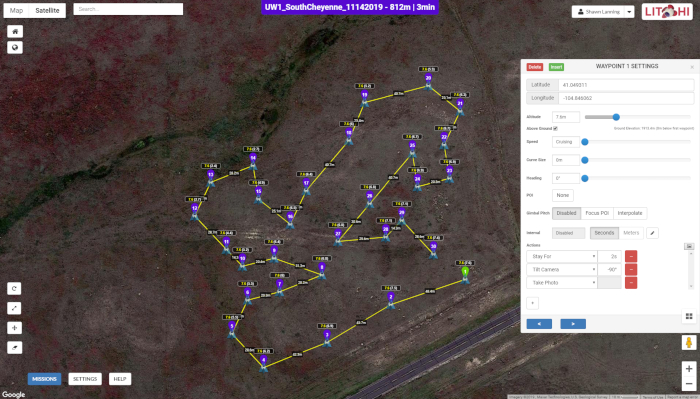
Figura 2: A interface do usuário do Mission Hub. O mapa mostra a trajetória de voo do drone ao longo de uma série de 30 pontos BAS em um dos locais de estudo, enquanto a janela pop-up mostra os parâmetros de aquisição de imagem em cada waypoint. A Figura 2 é específica do Sítio 1, embora seja semelhante em aparência ao Sítio 2. Clique aqui para ver uma versão maior desta figura.
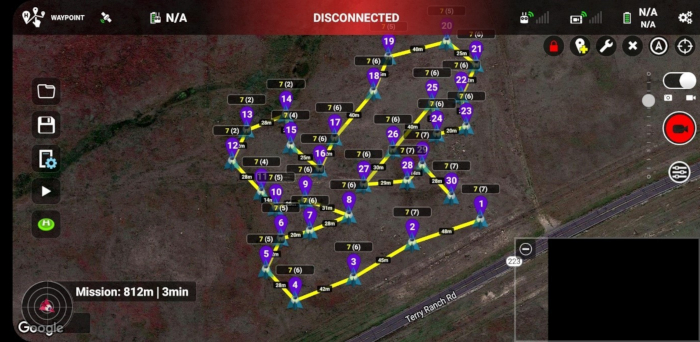
Figura 3: A missão de voo de waypoint no aplicativo de execução de missão da Litchi em execução em um smartphone Android. Os IDs de waypoint exclusivos são mostrados em roxo e representam a ordem relativa em que as imagens foram tiradas em vários pontos da área de estudo. Os números em cada waypoint, como 7(6), indicam os valores inteiros de alturas acima do solo em que as imagens foram tiradas (primeiro número) e alturas acima do ponto inicial ou local de lançamento do drone (segundo número). Observe as distâncias entre waypoints sucessivos que estão rotulados no mapa. A Figura 3 é específica do Sítio 1, embora seja semelhante em aparência ao Sítio 2. Clique aqui para ver uma versão maior desta figura.
- Pós-processamento de imagem no nível do solo.
NOTA: As instruções estão disponíveis em www.SamplePoint.org na seção do tutorial; Um arquivo .pdf suplementar está anexado.- Baixe imagens em um computador com cabo USB ou cartão SD.
- Certifique-se de que as imagens foram tiradas nos locais corretos. Existem vários softwares para colocar imagens no software GIS com base nos metadados das imagens georreferenciadas.
- Se as imagens foram adquiridas em várias áreas de estudo, armazene-as em pastas separadas para análise de imagens.
- Pós-processamento de imagem UAS
- Transfira imagens salvas em um cartão microSD removível do UAS para o computador.
- Repita as etapas 2.4.2 e 2.4.3.
3. Análise de imagem
NOTA: Todas as etapas podem ser encontradas na seção 'tutorial' em www.SamplePoint.org; Um arquivo 'tutorial.pdf' suplementar é anexado.
- No SamplePoint, clique em Opções | Assistente de banco de dados | Criar/Preencher Banco de Dados.
- Nomeie o banco de dados com base na área de estudo.
- Navegue até a pasta que contém as amostras da área de estudo desejada e selecione aquelas a serem classificadas.
- Clique em Concluído.
- Clique em Opções | Selecione Banco de Dados e selecione o arquivo *.xls que o SamplePoint gera com base na seleção da imagem (isso estará na imagem).
- Confirme se o número correto de imagens foi selecionado no banco de dados quando solicitado pelo SamplePoint.
- Selecione o número desejado de pixels a serem analisados em cada imagem. Isso pode ser feito em um padrão de grade ou aleatoriamente. Este estudo usou uma grade de 6 x 6 para selecionar um total de 36 pixels, embora mais ou menos pixels por imagem possam ser classificados dependendo da precisão de medição desejada para classificação. Um estudo recente descobriu que 20 a 30 pixels por imagem é adequado para amostragem de grandes áreas31. A opção de grade garante que os pixels estarão na mesma posição se a imagem for reanalisada, enquanto a opção aleatória gerará pixels aleatoriamente cada vez que uma imagem for recarregada.
- Crie um arquivo de botão personalizado para classificação de espécies. Essa lista pode ser gerada a partir da lista de vegetação registrada no campo antes da aquisição da imagem ou pode ser baseada em outras informações pertinentes à área de estudo (por exemplo, lista de mistura de sementes em locais recuperados ou informações de descrição do local ecológico, etc.). Certifique-se de que um botão seja criado para Solo Nu ou Solo e outros itens potenciais que não sejam vegetativos que possam ser encontrados, como Lixo ou Rocha. Recomenda-se a criação de um botão Desconhecido para permitir que o analista classifique as espécies posteriormente. A caixa de comentários em SamplePoint pode ser usada para anotar os pixels que usaram essa opção. Além disso, se a resolução da imagem não for alta o suficiente para classificar em níveis de espécie, a criação de botões para grupos funcionais (por exemplo, Grama, Forb, Arbusto) é benéfica.
- Comece a analisar as imagens clicando no botão de classificação que descreve o pixel da imagem visado pela mira vermelha. Repita isso até que SamplePoint solicite "Esses são todos os pontos. Clique na próxima imagem." Repita isso para todas as imagens no banco de dados.
NOTA: O recurso Zoom pode ser usado para ajudar na classificação. - Quando todas as imagens no banco de dados forem completamente analisadas, o SamplePoint solicitará "Você esgotou todas as imagens". Neste ponto, selecione OK e clique em Opções | Crie arquivos de estatísticas.
- Vá para a pasta que contém o banco de dados e abra o arquivo *.csv que acabou de ser criado para garantir que os dados de todas as imagens sejam armazenados.
4. Análise estatística
- Análises qui-quadrado para determinar diferenças entre locais
- Como o mesmo número de imagens (unidades primárias de amostragem) e pixels (unidades secundárias de amostragem) são coletados e analisados em ambos os locais, a comparação entre os dois locais pode ser considerada um produto de design multinomial.
- Usando o arquivo *.csv criado na etapa 3.11, calcule a soma dos pontos classificados para cada categoria de classificação.
- Execute a análise qui-quadrado nas somas de pontos. Se o Site 1 e o Site 2 forem semelhantes entre si, um número aproximadamente igual de pixels classificados como cada tipo de cobertura será evidente em ambos os sites18.
- Regressão para comparar imagens UAS versus imagens no nível do solo
- Usando os arquivos *.csv criados na etapa 3.11, copie e cole a porcentagem média de cobertura de cada imagem e alinhe os dados da imagem UAS com os dados da imagem no nível do solo.
- Execute a análise de regressão em um programa de banco de dados.
Resultados
A aquisição de imagens de UAS levou menos da metade do tempo de coleta de imagens terrestres, enquanto o tempo de análise foi um pouco menor com imagens terrestres (Tabela 1). As imagens terrestres tinham resolução mais alta, o que provavelmente é a razão pela qual foram analisadas em menos tempo. As diferenças nos tempos de caminhada entre os locais provavelmente se deveram ao fato de os pontos inicial e final (local de lançamento) estarem localizados mais pert...
Discussão
A importância do monitoramento dos recursos naturais é reconhecida há muito tempo14. Com maior atenção às questões ambientais globais, o desenvolvimento de técnicas de monitoramento confiáveis que sejam eficientes em termos de tempo e custo é cada vez mais importante. Vários estudos anteriores mostraram que a análise de imagens se compara favoravelmente às técnicas tradicionais de monitoramento da vegetação em termos de tempo, custo e fornecimento ...
Divulgações
Os autores declaram não haver conflito de interesses. O software utilizado neste estudo estava disponível para os autores como código aberto ou por meio de autorizações institucionais. Nenhum autor é patrocinado por nenhum software usado neste estudo e reconhece que outros programas de software estão disponíveis que são capazes de fazer pesquisas semelhantes.
Agradecimentos
Esta pesquisa foi financiada principalmente pelo Wyoming Reclamation and Restoration Center e Jonah Energy, LLC. Agradecemos à Warren Resources e à Escelara Resources por financiar a unidade Trimble Juno 5. Agradecemos à Jonah Energy, LLC pelo apoio contínuo para financiar o monitoramento da vegetação em Wyoming. Agradecemos ao Centro de Ciência da Informação Geográfica de Wyoming por fornecer o equipamento UAS utilizado neste estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| ArcGIS | ESRI | GPS Software | |
| DJI Phantom 4 Pro | DJI | UAS | |
| G700SE | Ricoh | GPS-equipped camera | |
| GeoJot+Core | Geospatial Experts | GPS Software | Used to extract image metadata |
| Juno 5 | Trimble | Handheld GPS device | |
| Litchi Mission Hub | Litchi | Mission Hub Software | We chose Litchi for its terrain awareness and its ability to plan robust waypoint missions |
| Program R | R Project | Statistical analysis/programming software | |
| SamplePoint | N/A | Image analysis software |
Referências
- Follett, R. F., Reed, D. A. Soil carbon sequestration in grazing lands: societal benefits and policy implications. Rangeland Ecology & Management. 63, 4-15 (2010).
- Ritten, J. P., Bastian, C. T., Rashford, B. S. Profitability of carbon sequestration in western rangelands of the United States. Rangeland Ecology & Management. 65, 340-350 (2012).
- Stahl, P. D., Curran, M. F. Collaborative efforts towards ecological habitat restoration of a threatened species, Greater Sage-grouse, in Wyoming, USA. Land Reclamation in Ecological Fragile Areas. , 251-254 (2017).
- Stohlgren, T. J., Bull, K. A., Otsuki, Y. Comparison of rangeland vegetation sampling techniques in the central grasslands. Journal of Range Management. 51, 164-172 (1998).
- Lovett, G. M., et al. Who needs environmental monitoring. Frontiers in Ecology and the Environment. 5, 253-260 (2007).
- Cagney, J., Cox, S. E., Booth, D. T. Comparison of point intercept and image analysis for monitoring rangeland transects. Rangeland Ecology & Management. 64, 309-315 (2011).
- Toevs, G. R., et al. Consistent indicators and methods and a scalable sample design to meet assessment, inventory, and monitoring needs across scales. Rangelands. 33, 14-20 (2011).
- Stiver, S. J., et al. Sage-grouse habitat assessment framework: multiscale habitat assessment tool. Bureau of Land Management and Western Association of Fish and Wildlife Agencies Technical Reference. , (2015).
- West, N. E. Accounting for rangeland resources over entire landscapes. Proceedings of the VI Rangeland Congress. , (1999).
- Curran, M. F., Stahl, P. D. Database management for large scale reclamation projects in Wyoming: Developing better data acquisition, monitoring, and models for application to future projects. Journal of Environmental Solutions for Oil, Gas, and Mining. 1, 31-34 (2015).
- International Technology Team (ITT). Sampling vegetation attributes. Interagency Technical Report. , (1999).
- Daubenmire, R. F. A canopy-coverage method of vegetational analysis. Northwest Science. 33, 43-64 (1959).
- Heady, H. F., Gibbens, R. P., Powell, R. W. Comparison of charting, line intercept, and line point methods of sampling shrub types of vegetation. Journal of Range Management. 12, 180-188 (1959).
- Levy, E. B., Madden, E. A. The point method of pasture analysis. New Zealand Journal of Agriculture. 46, 267-269 (1933).
- Morrison, L. W. Observer error in vegetation surveys: a review. Journal of Plant Ecology. 9, 367-379 (2016).
- Kennedy, K. A., Addison, P. A. Some considerations for the use of visual estimates of plant cover in biomonitoring. Journal of Ecology. 75, 151-157 (1987).
- Bergstedt, J., Westerberg, L., Milberg, P. In the eye of the beholder: bias and stochastic variation in cover estimates. Plant Ecology. 204, 271-283 (2009).
- Curran, M. F., et al. Spatially balanced sampling and ground-level imagery for vegetation monitoring on reclaimed well pads. Restoration Ecology. 27, 974-980 (2019).
- Duniway, M. C., Karl, J. W., Shrader, S., Baquera, N., Herrick, J. E. Rangeland and pasture monitoring: an approach to interpretation of high-resolution imagery focused on observer calibration for repeatability. Environmental Monitoring and Assessment. 184, 3789-3804 (2011).
- Curran, M. F., et al. Combining spatially balanced sampling, route optimization, and remote sensing to assess biodiversity response to reclamation practices on semi-arid well pads. Biodiversity. , (2020).
- Stevens, D. L., Olsen, A. R. Spatially balanced sampling of natural resources. Journal of the American Statistical Association. 99, 262-278 (2004).
- Robertson, B. L., Brown, J. A., McDonald, T., Jaksons, P. BAS: Balanced acceptance sampling of natural resources. Biometrics. 69, 776-784 (2013).
- Brown, J. A., Robertson, B. L., McDonald, T. Spatially balanced sampling: application to environmental surveys. Procedia Environmental Sciences. 27, 6-9 (2015).
- Robertson, B. L., McDonald, T., Price, C. J., Brown, J. A. A modification of balanced acceptance sampling. Statistics & Probability Letters. 109, 107-112 (2017).
- Kermorvant, C., D'Amico, F., Bru, N., Caill-Milly, N., Robertson, B. Spatially balanced sampling designs for environmental surveys. Environmental Monitoring and Assessment. 191, 524 (2019).
- Robertson, B. L., McDonald, T., Price, C. J., Brown, J. A. Halton iterative partitioning: spatially balanced sampling via partitioning. Environmental and Ecological Statistics. 25, 305-323 (2018).
- TSP: Traveling Salesperson Problem (TSP). R package version 1.1-7 Available from: https://CRAN.R-project.org/package=TSP (2019)
- Booth, D. T., Cox, S. E., Berryman, R. D. Point sampling imagery with 'SamplePoint'. Environmental Monitoring and Assessment. 123, 97-108 (2006).
- rgdal: bindings for geospatial data abstraction library. R package version 1.2-7 Available from: https://CRAN.R-project.org/package=rgdal (2017)
- SDraw: spatially balanced sample draws for spatial objects. R package version 2.1.3 Available from: https://CRAN.R-project.org/package=SDraw (2016)
- Ancin-Murguzur, F. J., Munoz, L., Monz, C., Fauchald, P., Hausner, V. Efficient sampling for ecosystem service supply assessment at a landscape scale. Ecosystems and People. 15, 33-41 (2019).
- Pilliod, D. S., Arkle, R. S. Performance of quantitative vegetation sampling methods across gradients of cover in Great Basin plant communities. Rangeland Ecology & Management. 66, 634-637 (2013).
- Anderson, K., Gaston, K. J. Lightweight unmanned aerial vehicles will revolutionize spatial ecology. Frontiers in Ecology and the Environment. 11, 138-146 (2013).
- Barnas, A. F., Darby, B. J., Vandeberg, G. S., Rockwell, R. F., Ellis-Felege, S. N. A comparison of drone imagery and ground-based methods for estimating the extent of habitat destruction by lesser snow geese (Anser caerulescens caerulescens) in La Perouse Bay. PLoS One. 14 (8), 0217049 (2019).
- Chabot, D., Carignan, V., Bird, D. M. Measuring habitat quality for leaster bitterns in a created wetland with use of small unmanned aircraft. Wetlands. 34, 527-533 (2014).
- Cruzan, M. B., et al. Small unmanned vehicles (micro-UAVs, drones) in plant ecology. Applications in Plant Sciences. 4 (9), 1600041 (2016).
- Booth, D. T., Cox, S. E. Image-based monitoring to measure ecological change in rangeland. Frontiers in Ecology and the Environment. 6, 185-190 (2008).
- Crimmins, M. A., Crimmins, T. M. Monitoring plant phenology using digital repeat photography. Environmental Management. 41, 949-958 (2008).
- Kermorvant, C., et al. Optimization of a survey using spatially balanced sampling: a single-year application of clam monitoring in the Arcachon Bay (SW France). Aquatic Living Resources. 30, 37-48 (2017).
- Brus, D. J. Balanced sampling: a versatile approach for statistical soil surveys. Geoderma. 253, 111-121 (2015).
- Foster, S. D., Hosack, G. R., Hill, N. A., Barnett, N. S., Lucieer, V. L. Choosing between strategies for designing surveys: autonomous underwater vehicles. Methods in Ecology and Evolution. 5, 287-297 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados