È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Immagini di sistemi aerei senza pilota a livello del suolo abbinate a campionamento spazialmente bilanciato e ottimizzazione del percorso per monitorare la vegetazione dei pascoli
In questo articolo
Riepilogo
Il protocollo presentato in questo documento utilizza l'ottimizzazione del percorso, il campionamento di accettazione bilanciato e le immagini del sistema aereo a livello del suolo e senza pilota (UAS) per monitorare in modo efficiente la vegetazione negli ecosistemi dei pascoli. Vengono confrontati i risultati delle immagini ottenute con i metodi a livello del suolo e UAS.
Abstract
Gli ecosistemi dei pascoli coprono 3,6 miliardi di ettari a livello globale, di cui 239 milioni di ettari situati negli Stati Uniti. Questi ecosistemi sono fondamentali per il mantenimento dei servizi ecosistemici globali. Il monitoraggio della vegetazione in questi ecosistemi è necessario per valutare la salute dei pascoli, per valutare l'idoneità dell'habitat per la fauna selvatica e il bestiame domestico, per combattere le erbacce invasive e per chiarire i cambiamenti ambientali temporali. Sebbene gli ecosistemi dei pascoli coprano vaste aree, le tecniche di monitoraggio tradizionali sono spesso dispendiose in termini di tempo e di costi, soggette a un'elevata distorsione dell'osservatore e spesso prive di informazioni spaziali adeguate. Il monitoraggio della vegetazione basato su immagini è più veloce, produce registrazioni permanenti (ad esempio, immagini), può comportare una riduzione della distorsione dell'osservatore e include intrinsecamente informazioni spaziali adeguate. I disegni di campionamento spazialmente bilanciati sono utili nel monitoraggio delle risorse naturali. Viene presentato un protocollo per l'implementazione di un progetto di campionamento spazialmente bilanciato noto come campionamento di accettazione bilanciato (BAS), con immagini acquisite da telecamere a livello del suolo e sistemi aerei senza pilota (UAS). Un algoritmo di ottimizzazione del percorso viene utilizzato per risolvere il "problema del commesso viaggiatore" (TSP) per aumentare l'efficienza in termini di tempo e costi. Mentre le immagini UAS possono essere acquisite 2-3 volte più velocemente rispetto alle immagini portatili, entrambi i tipi di immagini sono simili tra loro in termini di accuratezza e precisione. Infine, vengono discussi i pro e i contro di ciascun metodo e vengono forniti esempi di potenziali applicazioni di questi metodi in altri ecosistemi.
Introduzione
Gli ecosistemi dei pascoli comprendono vaste aree, che coprono 239 milioni di ettari negli Stati Uniti e 3,6 miliardi di ettari a livello globale1. I pascoli forniscono una vasta gamma di servizi ecosistemici e la gestione dei pascoli comporta molteplici usi del suolo. Negli Stati Uniti occidentali, i pascoli forniscono habitat per la fauna selvatica, stoccaggio dell'acqua, sequestro del carbonio e foraggio per il bestiame domestico2. I pascoli sono soggetti a vari disturbi, tra cui specie invasive, incendi, sviluppo di infrastrutture ed estrazione di risorse naturali (ad esempio, petrolio, gas e carbone)3. Il monitoraggio della vegetazione è fondamentale per sostenere la gestione delle risorse all'interno dei pascoli e di altri ecosistemi in tutto il mondo 4,5,6. Il monitoraggio della vegetazione nei pascoli viene spesso utilizzato per valutare la salute dei pascoli, l'idoneità dell'habitat per le specie selvatiche e per catalogare i cambiamenti nei paesaggi dovuti a specie invasive, incendi boschivi ed estrazione di risorse naturali 7,8,9,10. Sebbene gli obiettivi di specifici programmi di monitoraggio possano variare, sono auspicabili programmi di monitoraggio che si adattino alle esigenze di più parti interessate pur essendo statisticamente affidabili, ripetibili ed economici 5,7,11. Sebbene i gestori del territorio riconoscano l'importanza del monitoraggio, esso è spesso considerato non scientifico, antieconomico e oneroso5.
Tradizionalmente, il monitoraggio dei pascoli è stato condotto con una varietà di metodi, tra cui la stima oculare o visiva10, i fotogrammi di Daubenmire12, la mappatura delle particelle13 e l'intercettazione dei punti di linea lungo i transetti di vegetazione14. Sebbene la stima oculare o visiva sia efficiente in termini di tempo, è soggetta a un'elevata distorsione dell'osservatore15. Altri metodi tradizionali, sebbene anch'essi soggetti a un'elevata distorsione dell'osservatore, sono spesso inefficienti a causa dei loro requisiti di tempo e costi 6,15,16,17. Il tempo necessario per implementare molti di questi metodi tradizionali è spesso troppo oneroso, rendendo difficile ottenere campioni di dimensioni statisticamente valide, con conseguenti stime inaffidabili della popolazione. Questi metodi sono spesso applicati in base alla convenienza piuttosto che in modo stocastico, con gli osservatori che scelgono dove raccogliere i dati. Inoltre, le posizioni dei campioni riportate e quelle effettive spesso differiscono, causando confusione per i gestori del territorio e altre parti interessate che dipendono dai dati di monitoraggio della vegetazione18. Recenti ricerche hanno dimostrato che il monitoraggio della vegetazione basato su immagini è efficace in termini di tempo e costi 6,19,20. L'aumento della quantità di dati che possono essere campionati all'interno di una determinata area in un breve lasso di tempo dovrebbe migliorare l'affidabilità statistica dei dati rispetto alle tecniche tradizionali che richiedono più tempo. Le immagini sono registrazioni permanenti che possono essere analizzate da più osservatori dopo la raccolta dei dati sul campo6. Inoltre, molte telecamere sono dotate di sistemi di posizionamento globale (GPS), quindi le immagini possono essere georeferenziate con un luogo di raccolta18,20. L'uso di punti di campionamento generati al computer, accuratamente posizionati sul campo, dovrebbe ridurre la distorsione dell'osservatore sia che l'immagine venga acquisita con una fotocamera portatile o da un sistema aereo senza equipaggio, perché riduce l'inclinazione di un singolo osservatore a utilizzare la propria opinione su dove dovrebbero essere posizionate le posizioni dei campioni.
Oltre ad essere dispendioso in termini di tempo, costoso e soggetto a un'elevata distorsione dell'osservatore, il monitoraggio tradizionale delle risorse naturali spesso non riesce a caratterizzare adeguatamente i pascoli eterogenei a causa della bassa dimensione del campione e dei luoghi di campionamento concentrati21. I disegni di campionamento spazialmente bilanciati distribuiscono le posizioni dei campioni in modo più uniforme in un'area di interesse per caratterizzare meglio le risorse naturali 21,22,23,24. Questi disegni possono ridurre i costi di campionamento, perché sono necessarie dimensioni del campione più piccole per ottenere un'accuratezza statistica rispetto al campionamento casuale semplice25.
In questo metodo, un disegno di campionamento spazialmente bilanciato noto come campionamento di accettazione bilanciato (BAS)22,24 è combinato con il monitoraggio basato su immagini per valutare la vegetazione dei pascoli. I punti BAS sono distribuiti in modo ottimale sull'area di interesse26. Tuttavia, ciò non garantisce che i punti saranno ordinati in un percorso ottimale per la visita20. Pertanto, i punti BAS sono organizzati utilizzando un algoritmo di ottimizzazione del percorso che risolve il problema del commesso viaggiatore (TSP)27. Visitando i punti in questo ordine si determina un percorso ottimale (cioè la minima distanza) che collega i punti. I punti BAS vengono trasferiti in un programma software GIS (Geographic Information System) e quindi in un'unità di raccolta dati portatile dotata di GPS. Dopo aver individuato i punti BAS, le immagini vengono scattate con una fotocamera dotata di GPS e un sistema aereo senza pilota gestito utilizzando un software di volo. Entrando nel campo, un tecnico si reca in ogni punto per acquisire immagini di telecamere montate su monopiede da 1 m2 con una distanza di campionamento al suolo (GSD) di 0,3 mm in ciascun punto BAS, mentre un UAS vola negli stessi punti e acquisisce immagini GSD da 2,4 mm. Successivamente, i dati sulla copertura vegetale vengono generati utilizzando "SamplePoint"28 per classificare manualmente 36 punti/immagine. Vengono confrontati i dati sulla copertura vegetale generati dall'analisi delle immagini a livello del suolo e UAS, nonché i tempi di acquisizione riportati per ciascun metodo. Nello studio rappresentativo, sono stati utilizzati due appezzamenti di pascolo adiacenti di 10 acri. Infine, vengono discusse altre applicazioni di questo metodo e come potrebbe essere modificato per progetti futuri o progetti in altri ecosistemi.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Definizione dell'area di studio, generazione di punti campione e percorso di viaggio e preparazione sul campo
- Definizione dell'area di studio
- Utilizzare un programma software GIS per disegnare una o più grafiche poligonali attorno all'area o alle aree di interesse. Questo studio è stato condotto su due appezzamenti di 10 acri all'interno di un appezzamento di pascolo nella contea di Laramie, WY, USA (Figura 1).
- Assicurarsi che le aree che non devono essere incluse nel frame del campione siano escluse dal poligono (ad esempio, corpi idrici, strutture edilizie, strade, ecc.). Ciò garantirà che non vengano scattate immagini di queste aree in un secondo momento.
- Converti l'elemento grafico poligonale in una funzione shapefile (.shp) nel programma software GIS e assicurati che lo shapefile venga creato nel sistema di coordinate desiderato.
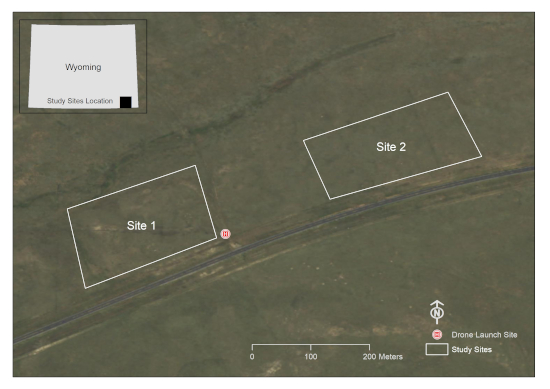
Figura 1: Una rappresentazione delle aree di studio di interesse. Questa posizione si trova su un appezzamento di pascolo a sud di Cheyenne nella contea di Laramie, WY, USA (Fonte immagini: Wyoming NAIP Imagery 2017). Clicca qui per visualizzare una versione più grande di questa figura.
- Generazione dei punti BAS e ottimizzazione del percorso di viaggio
NOTA: Il codice è allegato come 'Supplemental_Code.docx'.- Usa il pacchetto R 'rgdal'29 per convertire il poligono GIS in un file leggibile dal programma R.
- Utilizzare il pacchetto R 'SDraw'30 per generare il numero desiderato di punti BAS. Questo studio ha utilizzato 30 punti BAS per area di studio, anche se dovrebbero essere condotte ricerche future per determinare l'intensità di campionamento ottimale per aree di varie dimensioni e composizione della vegetazione.
- Usa il pacchetto R 'TSP'27 per ordinare i punti BAS. La visita dei punti in questo ordine riduce al minimo il tempo necessario per ottenere i campioni presso i punti BAS.
- Preparazione per l'acquisizione di immagini a mano libera
- Utilizzare il pacchetto R 'rgdal' per trasferire i punti dal passaggio 1.2.1 nel programma GIS.
- Modifica la tabella degli attributi dello shapefile in modo che il campo ID punto rifletta accuratamente l'ordine del percorso ottimizzato.
- Trasferisci il poligono GIS e il file di punti nel software GIS in esecuzione su un'unità portatile.
- Assicurarsi che sia presente il sistema di coordinate proiettato corretto per l'area di interesse.
- Preparazione per l'acquisizione di immagini UAS
- Utilizzare il pacchetto R 'rgdal' per trasferire i punti dal passaggio 1.2.1 nel programma software GIS.
- Nel programma software GIS, utilizzare lo strumento Aggiungi coordinate XY per creare e popolare i campi di latitudine e longitudine nella tabella degli attributi dei waypoint.
- Esportare la tabella degli attributi dei waypoint contenente le colonne Latitudine, Longitudine e TSP in formato file *.csv.
- Aprire il file *.csv in un pacchetto software appropriato.
- Ordina i waypoint in base all'identificatore TSP.
- Apri l'app Mission Hub.
- Crea waypoint arbitrari in Mission Hub.
- Esporta waypoint arbitrario come file *.csv.
- Apri il file *.csv in un foglio di calcolo ed elimina i waypoint arbitrari mantenendo le intestazioni delle colonne.
- Copiare le coppie di coordinate dei waypoint ordinate TSP dal passaggio 1.2.3 nelle colonne pertinenti nel file *.csv dal passaggio 1.4.8.
- Importa il file *.csv dal passaggio 1.4.10 in Mission Hub come nuova missione.
- Definisci le impostazioni.
- Selezionare la casella Usa elevazione online .
- Specificare la modalità Percorso come linee rette.
- Specificare Termina azione su RTH per consentire al drone di tornare a casa al termine della missione.
- Fare clic sui singoli waypoint e aggiungere azioni specificando i seguenti parametri: Permanenza: 2 s (per evitare sfocature dell'immagine); Inclinazione della telecamera: -90° (Nadir); Scatta foto.
- Salva la missione con un nome appropriato.
- Ripetere la procedura per altri siti.
2. Raccolta e post-elaborazione dei dati sul campo
- Registrazione della vegetazione osservata o prevista nell'area di studio
- Prima di acquisire le immagini, creare un elenco della vegetazione osservata all'interno dell'area di studio. Questo può essere fatto su un foglio scritto a mano o su un modulo digitale per facilitare l'identificazione fotografica in un secondo momento. Può essere utile includere nell'inventario le specie che probabilmente ci si aspetta nell'area anche se non vengono osservate sul campo (ad esempio, le specie all'interno di miscele di sementi di recupero)18.
- Acquisizione di immagini da terra
- Collegare una fotocamera a un monopiede verticale e puntare la fotocamera verso il basso di circa 60°. L'area dell'immagine può essere determinata utilizzando le specifiche dell'obiettivo e della risoluzione (megapixel) della fotocamera e impostando il monopiede a un'altezza standard. L'altezza del monopiede accoppiata con le specifiche della fotocamera determinerà il suolo sample distanza (GSD). In questo studio, è stata utilizzata una fotocamera da 12,1 megapixel e il monopiede è stato impostato a una temperatura costante di 1,3 m dal suolo per ottenere immagini al nadir a ~0,3 mm GSD18.
- Inclinare il monopiede in avanti in modo che l'obiettivo della fotocamera sia in posizione Nadir e che il monopiede angolato non sia visibile nell'immagine.
- Regolare l'altezza del monopiede o lo zoom sull'obiettivo per ottenere una dimensione di stampa senza cornice di 1 m2 (o un'altra dimensione di stampa desiderata). Per le più comuni fotocamere con rapporto di aspetto 4:3, una larghezza del tracciato di 115 cm produce un campo visivo di 1 m2 . Non è necessario posizionare un telaio a terra; L'intera immagine è la trama. Se si regola lo zoom sull'obiettivo per ottenere ciò, utilizzare del nastro adesivo per evitare modifiche accidentali nell'impostazione dello zoom.
- Se possibile, impostare la fotocamera sulla modalità priorità tempi e impostare la velocità dell'otturatore su almeno 1/125 sec. per evitare sfocature nell'immagine; più veloce se c'è vento.
- Individua il primo punto nell'ordine del percorso ottimizzato.
- Posizionare il monopiede a terra nel punto 1 e inclinare il monopiede finché la fotocamera non è in orientamento al nadir. Assicurarsi che l'ombra dell'operatore non sia nell'immagine. Tenere ferma la fotocamera per evitare sfocature da movimento. Acquisisci l'immagine.
NOTA: Per questo passaggio è utile un cavo di attivazione remoto. - Controllare la qualità dell'immagine per garantire la corretta acquisizione dei dati.
- Passare al punto successivo nell'ordine del percorso ottimizzato e ripetere i passaggi di acquisizione.
- Acquisizione di immagini UAS
- Prima di lanciare l'UAS, condurre una breve ricognizione dell'area di studio per assicurarsi che non vi siano ostacoli fisici all'interno della traiettoria di volo. Questo esercizio di ricognizione è utile anche per localizzare un'area abbastanza pianeggiante da cui lanciare l'UAS.
- Assicurati che le condizioni meteorologiche siano adatte al volo con l'UAS: una giornata asciutta e limpida (>4,8 km di visibilità) con illuminazione adeguata, vento minimo (<17 nodi) e temperature comprese tra 0 °C e 37 °C.
- Segui i protocolli legali. Ad esempio, negli Stati Uniti, è necessario seguire le politiche della Federal Aviation Administration.
- Utilizzare il software Mission Hub (Figura 2) e un'applicazione per l'esecuzione delle missioni accessibile tramite dispositivi mobili (Figura 3).
- Raccogliere le immagini UAS in ogni punto BAS come descritto nel passaggio 1.4.
- Verificare che tutte le immagini siano state acquisite utilizzando il dispositivo mobile prima di cambiare posizione.
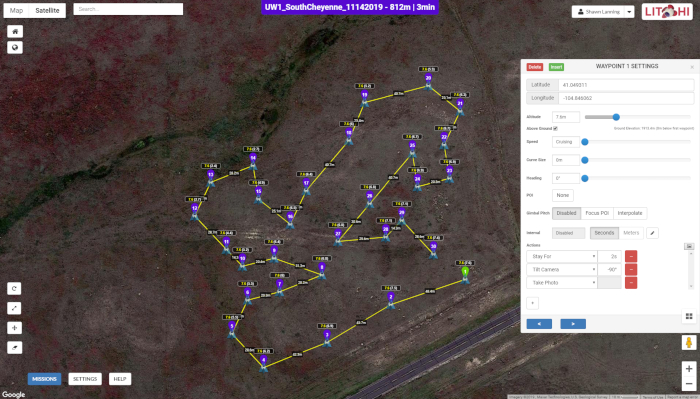
Figura 2: L'interfaccia utente di Mission Hub. La mappa mostra la traiettoria di volo del drone lungo una serie di 30 punti BAS in uno dei siti di studio, mentre la finestra popup mostra i parametri di acquisizione dell'immagine in ogni waypoint. La Figura 2 è specifica del Sito 1, anche se è simile nell'aspetto al Sito 2. Clicca qui per visualizzare una versione più grande di questa figura.
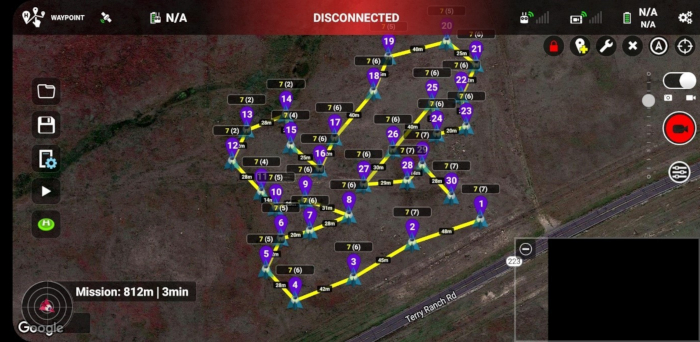
Figura 3: La missione di volo waypoint nell'applicazione di esecuzione della missione di Litchi in esecuzione su uno smartphone Android. Gli ID univoci dei waypoint sono mostrati in viola e rappresentano l'ordine relativo in cui le immagini sono state scattate nei vari punti dell'area di studio. I numeri in corrispondenza di ciascun waypoint, ad esempio 7(6), indicano i valori interi delle altezze dal suolo in cui sono state scattate le immagini (primo numero) e le altezze al di sopra del punto di partenza o del sito di lancio del drone (secondo numero). Notare le distanze tra i waypoint successivi che sono etichettati sulla mappa. La Figura 3 è specifica del Sito 1, anche se è simile nell'aspetto al Sito 2. Clicca qui per visualizzare una versione più grande di questa figura.
- Post-elaborazione delle immagini a livello del suolo.
NOTA: Le indicazioni sono disponibili a www.SamplePoint.org nella sezione tutorial; È allegato un file di .pdf supplementare.- Scarica le immagini su un computer con cavo USB o scheda SD.
- Assicurati che le immagini siano state scattate nelle posizioni corrette. Esistono vari software per inserire le immagini nel software GIS in base ai metadati all'interno delle immagini georeferenziate.
- Se le immagini sono state acquisite in più aree di studio, memorizzarle in cartelle separate per l'analisi delle immagini.
- Post-elaborazione delle immagini UAS
- Trasferisci le immagini salvate su una scheda microSD rimovibile dall'UAS al computer.
- Ripetere i passaggi 2.4.2 e 2.4.3.
3. Analisi delle immagini
NOTA: Tutti i passaggi possono essere trovati nella sezione "tutorial" su www.SamplePoint.org; È allegato un file 'tutorial.pdf' supplementare.
- In SamplePoint, fare clic su Opzioni | Creazione guidata database | Creare/popolare il database.
- Assegna un nome al database in base all'area di studio.
- Accedere alla cartella contenente i campioni dell'area di studio desiderati e selezionare quelli da classificare.
- Fare clic su Fine.
- Fare clic su Opzioni | Selezionare Database e selezionare il file *.xls generato da SamplePoint in base alla selezione dell'immagine (questo sarà nell'immagine).
- Verificare che il numero corretto di immagini siano state selezionate nel database quando richiesto da SamplePoint.
- Selezionare il numero desiderato di pixel da analizzare all'interno di ciascuna immagine. Questa operazione può essere eseguita in un modello a griglia o in modo casuale. Questo studio ha utilizzato una griglia 6 x 6 per selezionare un totale di 36 pixel, anche se è possibile classificare più o meno pixel per immagine a seconda della precisione di misurazione desiderata per la classificazione. Uno studio recente ha rilevato che 20-30 pixel per immagine sono adeguati per il campionamento di grandi aree31. L'opzione griglia assicura che i pixel si trovino nella stessa posizione se l'immagine viene rianalizzata, mentre l'opzione casuale genererà casualmente pixel ogni volta che un'immagine viene ricaricata.
- Crea un file Button personalizzato per la classificazione delle specie. Questo elenco può essere generato dall'elenco della vegetazione registrato sul campo prima dell'acquisizione dell'immagine, oppure può essere basato su altre informazioni pertinenti all'area di studio (ad esempio, elenco di miscele di semi sui siti bonificati o informazioni sulla descrizione ecologica del sito, ecc.). Assicurati che sia stato creato un pulsante per il terreno nudo o il suolo e altri potenziali oggetti non vegetali che potrebbero essere incontrati, come rifiuti o rocce. Si consiglia di creare un pulsante Sconosciuto per consentire all'analista di classificare le specie in un secondo momento. La casella di commento in SamplePoint può essere utilizzata per annotare i pixel che hanno utilizzato questa opzione. Inoltre, se la risoluzione dell'immagine non è sufficientemente alta per essere classificata a livello di specie, è utile creare pulsanti per gruppi funzionali (ad esempio, Erba, Forb, Arbusto).
- Inizia ad analizzare le immagini facendo clic sul pulsante di classificazione che descrive il pixel dell'immagine di destinazione del mirino rosso. Ripetere l'operazione fino a quando SamplePoint non richiede "Questi sono tutti i punti. Fai clic sull'immagine successiva. Ripetere l'operazione per tutte le immagini all'interno del database.
NOTA: La funzione Zoom può essere utilizzata per facilitare la classificazione. - Quando tutte le immagini nel database sono state completamente analizzate, SamplePoint visualizzerà il messaggio "Hai esaurito tutte le immagini". A questo punto, selezionare OK e quindi fare clic su Opzioni | Crea file di statistiche.
- Vai alla cartella contenente il database e apri il file *.csv appena creato per assicurarti che i dati di tutte le immagini siano memorizzati.
4. Analisi statistica
- Analisi del chi-quadrato per determinare le differenze tra i siti
- Poiché lo stesso numero di immagini (unità di campionamento primarie) e pixel (unità di campionamento secondarie) viene raccolto e analizzato in entrambi i siti, il confronto tra i due siti può essere considerato un prodotto di progettazione multinomiale.
- Utilizzando il file *.csv creato nel passaggio 3.11, calcolare la somma dei punti classificati per ogni categoria di classificazione.
- Eseguire l'analisi chi-quadrato sulle somme dei punti. Se il sito 1 e il sito 2 sono simili tra loro, su entrambi i siti18 sarà evidente un numero approssimativamente uguale di pixel classificati come ciascun tipo di copertina.
- Regressione per confrontare UAS con immagini a livello del suolo
- Utilizzando i file *.csv creati nel passaggio 3.11, copiare e incollare la percentuale media di copertura da ciascuna immagine e allineare i dati dell'immagine UAS con i dati dell'immagine a livello del suolo.
- Eseguire l'analisi di regressione in un programma di database.
Access restricted. Please log in or start a trial to view this content.
Risultati
L'acquisizione delle immagini UAS ha richiesto meno della metà del tempo della raccolta delle immagini a terra, mentre il tempo di analisi è stato leggermente inferiore con le immagini a terra (Tabella 1). Le immagini a terra avevano una risoluzione più elevata, che è probabilmente il motivo per cui sono state analizzate in meno tempo. Le differenze nei tempi di percorrenza tra i siti erano probabilmente dovute al fatto che i punti di partenza e di arrivo (sito di la...
Access restricted. Please log in or start a trial to view this content.
Discussione
L'importanza del monitoraggio delle risorse naturali è stata da tempo riconosciuta14. Con la crescente attenzione alle questioni ambientali globali, lo sviluppo di tecniche di monitoraggio affidabili ed efficienti in termini di tempo e costi è sempre più importante. Diversi studi precedenti hanno dimostrato che l'analisi delle immagini si confronta favorevolmente con le tradizionali tecniche di monitoraggio della vegetazione in termini di tempo, costi e fornend...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse. Il software utilizzato in questo studio era disponibile per gli autori sia come open-source che attraverso permessi istituzionali. Nessun autore è sponsorizzato da alcun software utilizzato in questo studio e riconosce che sono disponibili altri programmi software in grado di fare ricerche simili.
Riconoscimenti
Questa ricerca è stata finanziata in maggioranza dal Wyoming Reclamation and Restoration Center e da Jonah Energy, LLC. Ringraziamo Warren Resources ed Escelara Resources per aver finanziato l'unità Trimble Juno 5. Ringraziamo Jonah Energy, LLC per il continuo supporto al finanziamento del monitoraggio della vegetazione nel Wyoming. Ringraziamo il Wyoming Geographic Information Science Center per aver fornito l'attrezzatura UAS utilizzata in questo studio.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| ArcGIS | ESRI | GPS Software | |
| DJI Phantom 4 Pro | DJI | UAS | |
| G700SE | Ricoh | GPS-equipped camera | |
| GeoJot+Core | Geospatial Experts | GPS Software | Used to extract image metadata |
| Juno 5 | Trimble | Handheld GPS device | |
| Litchi Mission Hub | Litchi | Mission Hub Software | We chose Litchi for its terrain awareness and its ability to plan robust waypoint missions |
| Program R | R Project | Statistical analysis/programming software | |
| SamplePoint | N/A | Image analysis software |
Riferimenti
- Follett, R. F., Reed, D. A. Soil carbon sequestration in grazing lands: societal benefits and policy implications. Rangeland Ecology & Management. 63, 4-15 (2010).
- Ritten, J. P., Bastian, C. T., Rashford, B. S. Profitability of carbon sequestration in western rangelands of the United States. Rangeland Ecology & Management. 65, 340-350 (2012).
- Stahl, P. D., Curran, M. F. Collaborative efforts towards ecological habitat restoration of a threatened species, Greater Sage-grouse, in Wyoming, USA. Land Reclamation in Ecological Fragile Areas. , CRC Press. Boca Raton, FL. 251-254 (2017).
- Stohlgren, T. J., Bull, K. A., Otsuki, Y. Comparison of rangeland vegetation sampling techniques in the central grasslands. Journal of Range Management. 51, 164-172 (1998).
- Lovett, G. M., et al. Who needs environmental monitoring. Frontiers in Ecology and the Environment. 5, 253-260 (2007).
- Cagney, J., Cox, S. E., Booth, D. T. Comparison of point intercept and image analysis for monitoring rangeland transects. Rangeland Ecology & Management. 64, 309-315 (2011).
- Toevs, G. R., et al. Consistent indicators and methods and a scalable sample design to meet assessment, inventory, and monitoring needs across scales. Rangelands. 33, 14-20 (2011).
- Stiver, S. J., et al. Sage-grouse habitat assessment framework: multiscale habitat assessment tool. Bureau of Land Management and Western Association of Fish and Wildlife Agencies Technical Reference. , (2015).
- West, N. E. Accounting for rangeland resources over entire landscapes. Proceedings of the VI Rangeland Congress. , Aitkenvale, Queensland, Australia. (1999).
- Curran, M. F., Stahl, P. D. Database management for large scale reclamation projects in Wyoming: Developing better data acquisition, monitoring, and models for application to future projects. Journal of Environmental Solutions for Oil, Gas, and Mining. 1, 31-34 (2015).
- International Technology Team (ITT). Sampling vegetation attributes. Interagency Technical Report. , Denver, CO, USA. (1999).
- Daubenmire, R. F. A canopy-coverage method of vegetational analysis. Northwest Science. 33, 43-64 (1959).
- Heady, H. F., Gibbens, R. P., Powell, R. W. Comparison of charting, line intercept, and line point methods of sampling shrub types of vegetation. Journal of Range Management. 12, 180-188 (1959).
- Levy, E. B., Madden, E. A. The point method of pasture analysis. New Zealand Journal of Agriculture. 46, 267-269 (1933).
- Morrison, L. W. Observer error in vegetation surveys: a review. Journal of Plant Ecology. 9, 367-379 (2016).
- Kennedy, K. A., Addison, P. A. Some considerations for the use of visual estimates of plant cover in biomonitoring. Journal of Ecology. 75, 151-157 (1987).
- Bergstedt, J., Westerberg, L., Milberg, P. In the eye of the beholder: bias and stochastic variation in cover estimates. Plant Ecology. 204, 271-283 (2009).
- Curran, M. F., et al. Spatially balanced sampling and ground-level imagery for vegetation monitoring on reclaimed well pads. Restoration Ecology. 27, 974-980 (2019).
- Duniway, M. C., Karl, J. W., Shrader, S., Baquera, N., Herrick, J. E. Rangeland and pasture monitoring: an approach to interpretation of high-resolution imagery focused on observer calibration for repeatability. Environmental Monitoring and Assessment. 184, 3789-3804 (2011).
- Curran, M. F., et al. Combining spatially balanced sampling, route optimization, and remote sensing to assess biodiversity response to reclamation practices on semi-arid well pads. Biodiversity. , (2020).
- Stevens, D. L., Olsen, A. R. Spatially balanced sampling of natural resources. Journal of the American Statistical Association. 99, 262-278 (2004).
- Robertson, B. L., Brown, J. A., McDonald, T., Jaksons, P. BAS: Balanced acceptance sampling of natural resources. Biometrics. 69, 776-784 (2013).
- Brown, J. A., Robertson, B. L., McDonald, T. Spatially balanced sampling: application to environmental surveys. Procedia Environmental Sciences. 27, 6-9 (2015).
- Robertson, B. L., McDonald, T., Price, C. J., Brown, J. A. A modification of balanced acceptance sampling. Statistics & Probability Letters. 109, 107-112 (2017).
- Kermorvant, C., D'Amico, F., Bru, N., Caill-Milly, N., Robertson, B. Spatially balanced sampling designs for environmental surveys. Environmental Monitoring and Assessment. 191, 524(2019).
- Robertson, B. L., McDonald, T., Price, C. J., Brown, J. A. Halton iterative partitioning: spatially balanced sampling via partitioning. Environmental and Ecological Statistics. 25, 305-323 (2018).
- Hahsler, M., Hornik, K. TSP: Traveling Salesperson Problem (TSP). R package version 1.1-7. , Available from: https://CRAN.R-project.org/package=TSP (2019).
- Booth, D. T., Cox, S. E., Berryman, R. D. Point sampling imagery with 'SamplePoint'. Environmental Monitoring and Assessment. 123, 97-108 (2006).
- Bivand, R., Keitt, T., Rowlingson, B. rgdal: bindings for geospatial data abstraction library. R package version 1.2-7. , Available from: https://CRAN.R-project.org/package=rgdal (2017).
- McDonald, T. SDraw: spatially balanced sample draws for spatial objects. R package version 2.1.3. , Available from: https://CRAN.R-project.org/package=SDraw (2016).
- Ancin-Murguzur, F. J., Munoz, L., Monz, C., Fauchald, P., Hausner, V. Efficient sampling for ecosystem service supply assessment at a landscape scale. Ecosystems and People. 15, 33-41 (2019).
- Pilliod, D. S., Arkle, R. S. Performance of quantitative vegetation sampling methods across gradients of cover in Great Basin plant communities. Rangeland Ecology & Management. 66, 634-637 (2013).
- Anderson, K., Gaston, K. J. Lightweight unmanned aerial vehicles will revolutionize spatial ecology. Frontiers in Ecology and the Environment. 11, 138-146 (2013).
- Barnas, A. F., Darby, B. J., Vandeberg, G. S., Rockwell, R. F., Ellis-Felege, S. N. A comparison of drone imagery and ground-based methods for estimating the extent of habitat destruction by lesser snow geese (Anser caerulescens caerulescens) in La Perouse Bay. PLoS One. 14 (8), 0217049(2019).
- Chabot, D., Carignan, V., Bird, D. M. Measuring habitat quality for leaster bitterns in a created wetland with use of small unmanned aircraft. Wetlands. 34, 527-533 (2014).
- Cruzan, M. B., et al. Small unmanned vehicles (micro-UAVs, drones) in plant ecology. Applications in Plant Sciences. 4 (9), 1600041(2016).
- Booth, D. T., Cox, S. E. Image-based monitoring to measure ecological change in rangeland. Frontiers in Ecology and the Environment. 6, 185-190 (2008).
- Crimmins, M. A., Crimmins, T. M. Monitoring plant phenology using digital repeat photography. Environmental Management. 41, 949-958 (2008).
- Kermorvant, C., et al. Optimization of a survey using spatially balanced sampling: a single-year application of clam monitoring in the Arcachon Bay (SW France). Aquatic Living Resources. 30, 37-48 (2017).
- Brus, D. J. Balanced sampling: a versatile approach for statistical soil surveys. Geoderma. 253, 111-121 (2015).
- Foster, S. D., Hosack, G. R., Hill, N. A., Barnett, N. S., Lucieer, V. L. Choosing between strategies for designing surveys: autonomous underwater vehicles. Methods in Ecology and Evolution. 5, 287-297 (2014).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon