Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Shunt-Chirurgie, Rechtsherzkatheter und Gefäß Morphometry in einem Rattenmodell für Durchfluss-induzierte pulmonale arterielle Hypertonie
In diesem Artikel
Zusammenfassung
This protocol describes a surgical procedure to create a model for flow-induced pulmonary arterial hypertension (PAH) in rats and the procedures to analyze the principle hemodynamic and histological end-points in this model.
Zusammenfassung
In this protocol, PAH is induced by combining a 60 mg/kg monocrotalin (MCT) injection with increased pulmonary blood flow through an aorto-caval shunt (MCT+Flow). The shunt is created by inserting an 18-G needle from the abdominal aorta into the adjacent caval vein. Increased pulmonary flow has been demonstrated as an essential trigger for a severe form of PAH with distinct phases of disease progression, characterized by early medial hypertrophy followed by neointimal lesions and the progressive occlusion of the small pulmonary vessels. To measure the right heart and pulmonary hemodynamics in this model, right heart catheterization is performed by inserting a rigid cannula containing a flexible ball-tip catheter via the right jugular vein into the right ventricle. The catheter is then advanced into the main and the more distal pulmonary arteries. The histopathology of the pulmonary vasculature is assessed qualitatively, by scoring the pre- and intra-acinar vessels on the degree of muscularization and the presence of a neointima, and quantitatively, by measuring the wall thickness, the wall-lumen ratios, and the occlusion score.
Einleitung
Das Ziel dieses Verfahrens ist es, ein reproduzierbares Modell für schwere, strömungsinduzierten pulmonaler arterieller Hypertonie in Ratten zu erzeugen und ihr Prinzip hämodynamischen und histopathologischen Endpunkte zu messen.
Pulmonale arterielle Hypertonie (PAH) ist ein klinisches Syndrom, das eine progressive Zunahme des pulmonalen Gefässwiderstands führt zu Rechtsherzversagen und Tod umfasst. Innerhalb des übergeordneten Krankheitsspektrum der Lungenbluthochdruckerkrankungen (PH) ist PAH die schwerste Form und eine , die 1 ohne Heilung bleibt. Die zugrunde liegende Arteriopathie in PAH wird durch eine typische Form der Gefäßumbau gekennzeichnet, dass das Gefäßlumen verschliesst. Muskularisierung von normalen , nicht muskularisierte Gefäße und Hypertrophie des medialen Gefäßschicht als frühe Krankheitserscheinungen bei PAH angesehen werden, werden auch in anderen Formen der PH 2 und sind gedacht , gesehen 3 reversibel. Als PAH eindvances beginnt die Intima - Schicht umzubauen, schließlich charakteristische neointimalen Läsionen bilden 2. Neointima-Typ pulmonalen Gefäßumbau ist exklusiv für PAH und wird derzeit unumkehrbar 4 zu betrachten.
Als PAH eine seltene Krankheit ist, geht in seiner pathobiologischen Verständnis und Entwicklung von neuartigen Therapien haben sich stark auf Tiermodelle verlassen. Die monocrotalin (MCT) Modell bei Ratten ist ein einfaches Single - Hit - Modell , das war und ist immer noch, häufig verwendet. MCT ist ein Toxin , die eine Schädigung der Lungen Arteriolen und regionalen Entzündung 5 verursacht. 60 mg / kg MCT führt zu einer Erhöhung des mittleren Lungenarteriendruck (mPAP), pulmonaler vaskulärer Widerstand (PVR) und rechte ventrikuläre Hypertrophie (RVH) nach 3 - 4 Wochen 6. Die Histomorphologie wird durch isolierte mediale Hypertrophie ohne neointimalen Läsionen 5 gekennzeichnet. Der MCTso Rattenmodell stellt eine moderate Form von PH, und nicht die PAH, obwohl es allgemein als das letztere präsentiert wird.
Bei Kindern mit PAH in Verbindung mit angeborenem Links-Rechts - Shunt (PAH-CHD), erhöhte Lungenblutung als wesentliche Auslöser für die Entwicklung der neointimalen Läsionen 7, 8, 9 betrachtet wird. Bei Ratten erhöhte Lungenblutfluss kann durch die Schaffung eines Shunt zwischen der abdominalen Aorta und Vena cava, eine Technik erstmals 1990 beschrieben , 10 induziert werden. Alternativen erhöht zu schaffen Lungenfluss sind durch einseitige pneumonectomy oder durch subclavian zu Lungenarterie Anastomose 11. Conceptual Nachteile dieser Modelle bestehen aus Potentialausgleichs Wachstum der verbleibenden Lunge und adaptive Signalweg-Aktivierung durch die pneumonectomy induziert oder der iatrogenen Schädigung des Lungengefäßsystems durchzu Lungenarterie Anastomose, verwirrende sowohl die Auswirkungen der erhöhten Lungenblutung.
Wenn ein aorto-Kava-Shunt erzeugt und Lungenblutung erhöht wird als ein zweiter Treffer in MCT-behandelten Ratten induziert, treten charakteristische neointimalen Läsionen und eine schwere Form der PAH und Rechtsherzversagen assoziiert (RVF) entwickeln 3 Wochen nach der erhöhten 12 strömen. Die hämodynamische Progression von PAH in diesem Modell kann in vivo durch Echokardiographie und Rechtsherzkatheter zu beurteilen. Das vaskuläre Histomorphologie, Gefäßwanddicke, dem Grad der arteriolar Okklusion und Parameter für Rechtsherzversagen bilden die Säulen der ex vivo Charakterisierung von PAH.
Diese Methode beschreibt detaillierte Protokolle für die aorto-Kava-Shunt (AC-Shunt) Chirurgie, Rechtsherzkatheter und qualitative und quantitative Bewertung der vaskulären Histomorphologie.
Protokoll
Verfahren unter Verwendung tierischer Probanden wurden von der niederländischen Zentralkomitee für Tierversuche und der Animal Care Committee an der University Medical Center Groningen (NL) genehmigt. Beide Wistar und Lewis-Ratten mit Gewichten zwischen 180 und 300 g wurden verwendet.
1. Gehäuse und Akklimatisierung
- Nach der Ankunft in der zentralen Tieranlage, Hausratten in Gruppen von 5 pro Käfig. Während einer 7-Tage Eingewöhnungszeit daran gewöhnen, die Ratten für die menschliche Behandlung, aber üben keine experimentellen Verfahren.
2. Vorbereitung und Injektion von Sterile Monocrotalin
- 1 ml 60 mg / mL monocrotalin (MCT) -Lösung, 60 mg wiegen von monocrotalin in einem 2-ml-Röhrchen. Hinzufügen 700 & mgr; l 0,9% NaCl. Zugabe von 200 ul 1 M HCl. Wärmen Sie die Lösung in der Röhre unter fließendem warmen Leitungswasser und Wirbel es. Verwenden Sie 6 N NaOH, um den pH-Wert auf 7,0 zu bringen. Verwenden Sie sterile Technik zur Herstellung von MCT für die Injektion in Nagetieren.
- Injizieren von 1 ml steriles 60 mg / ml MCT Lösung pro kg subkutan in den Hals (0,3 ml von 60 mg / ml MCT für eine 300 g Ratte). HINWEIS: Wir bevorzugen nicht kleinere Mengen zu verwenden, aufgrund der größeren Wahrscheinlichkeit, dass die injizierten Dosis nicht geeignet sein wird.
3. Aorta-Kava-Shunt-Chirurgie
- Anästhesie.
- Füllen Sie die Induktionskammer mit 5% Isofluran / 100% O 2 (Fluss: 1 L / min) und legen Sie die Ratte in der Kammer. Überprüfen Sie für eine ausreichende Tiefe der Anästhesie durch einen hinteren Zehe Prise durchführen. Wiegen Sie die Ratte.
- Rasur und reinigen Sie den Bauch auf einer Fläche, die etwa 8 cm lang und 3 cm breit ist. Legen Sie die Ratte auf dem Rücken auf einer Heizmatte (37 ° C) durch eine sterile Matte bedeckt.
- Legen Sie die Schnauze in einer Beatmungsmaske / Kapuze mit 2 - 3% Isofluran / 100% O 2 (Fluss: 1 L / min). Schauen Sie sich die Tiefe der Anästhesie durch einen hinteren Zehe Prise durchführen. Bewerben Augensalbe Trockenheit zu verhindern, während der Narkose.
- Shunt SurGery.
- Scrub die Haut mit Chlorid-hexidine zur Desinfektion. Injizieren 0,01 mg / kg Buprenorphin subkutan für die postoperative Analgesie.
- Verwenden Sie sterile Instrumente für die Chirurgie. Einen Einschnitt mit einem # 10 Skalpellklinge in den Bauch auf der Mittellinie ab 1 cm unterhalb der Membran eine sich nach unten bis knapp oberhalb der Genitalien.
- Heben Sie den Darm mit einem Wattestäbchen auf, decken den Darm in einem sterilen, feuchten Gaze (0,9% NaCl), und legen Sie sie auf der linken Seite des Tieres.
- Verwenden Sie Wattestäbchen, um die Membranen zu trennen, die die Bauchaorta und die untere Hohlvene in die umliegenden Gewebe befestigen.
HINWEIS: sezieren nicht die Membranen zwischen der Aorta und die Hohlvene. - Mit Splitterpinzette, entfernen Sie die perivaskulären Aorten Fett knapp oberhalb der Bifurkation, nur auf der rechten Seite der Aorta und nur an der Stelle, wo die Nadel eingefügt wird.
- Verwenden Sie Wattestäbchen die Aorta und Vena Cava von 2 mm Supe zu trennenrior an der Stelle, wo die Nadel eingeführt werden, um Platz zu schaffen für eine Biemer Klemme.
- In diesem Bereich muss zunächst eine lose Ligatur (5-0 Naht) um die Aorta. Erstellen Spannung auf die Ligatur durch einen Kocher Klammer Platzierung auf, und legen Sie dann die Kocher besser als der Schnitt (1A). Legen Sie die Biemer klemmen nur überlegen die Ligatur (Figur e 1A).
- Mit einem Wattestäbchen, komprimieren die vena cava so distal wie möglich auf die Strömung (1A) zu behindern. Biegung eine Nadel (18 G in diesem Protokoll) in einen Winkel von 45 Grad, mit der Öffnung nach außen zeigen (1A).
- Bei einem Winkel von 90 Grad, legen Sie die Nadel in der Aorta, knapp oberhalb der Bifurkation, mit der Öffnung der Nadel auf der linken Seite (Abbildung 1A). Manipulieren die Spitze der Nadel nach links und legen Sie sie in die Hohlvene.
HINWEIS: Die Nadelspitze sollte jetzt sein visiBLE in der Hohlvene (1B). - Verwenden Sie einen zweiten Wattestäbchen das restliche Blut in die Aorta aus der Einstichstelle zu drücken Thrombose zu verhindern. Trocknen Sie den Bereich um den Shunt mit einer sterilen Gaze, um den Kleber ausreichend haften.
- Ziehen Sie die gesamte Nadel aus der Aorta und sofort einen Tropfen Gewebekleber auf die Einstichstelle in der Aorta Anwendung. Achten Sie darauf, nicht mit dem Wattestäbchen auf das Gewebe zu verkleben. Ausspannen Aorta.
- Überprüfen Sie den Shunt manuell durch Ziehen an und die Ligatur an der Aorta proximal der Shunt-Freigabe. Lockern sollte die Hohlvene distal der Shunt in leuchtend rote Farbe und schaffen Turbulenzen am Shunt Ort.
HINWEIS: Anziehen wird das Blut in die Hohlvene zurück zu dunkel rot. - Platzieren Sie den Darm wieder in das Tier. Schließen Sie die Muskelschicht und die Haut mit resorbierbaren 4-0 Nähten. Belüften das Tier mit 100% O 2 aus der Narkose zu erholen.
HINWEIS: Lassen Sie keine animal unbeaufsichtigt, bis es genügend Bewusstsein zu halten Brustlage wiedergewonnen hat.
- Sham-Chirurgie.
- Führen alle obigen Verfahren, mit Ausnahme der Einführung der Nadel in die Aorta.
- Post-chirurgische Versorgung.
- Legen Sie die Ratte in einem einzigen Käfig und in einem Inkubator bei 37 ° C bis zum nächsten Morgen.
- Etwa 6 Stunden nach der Operation, injizieren 0,01 mg / kg Buprenorphin subkutan für die postoperative Analgesie. Wiederholen Sie den nächsten Morgen, wenn die Ratte Anzeichen von Unwohlsein zeigt.
HINWEIS: Die ersten 3 Tage nach der Operation, Ratten neigen dazu, weniger zu essen und zu trinken (dies ist besonders wichtig, wenn Futter oder Trinkwasser mit Drogen gemischt). Die meisten Ratten zeigen normales Verhalten von 3 Tagen nach der Operation. Wenn nicht, genau überwachen. Gewichtsverlust von 15% in 1 Woche überschreitet wird als abnormal, und solche Ratten sollte durch die Extraktion des zirkulierenden Blutvolumen während der Narkose eingeschläfert werden.
4. Entwicklung von PAH
HINWEIS: In diesem Protokoll wird das Tier durch die Extraktion des zirkulierenden Blutvolumens, während sie unter Anästhesie eingeschläfert.
- Sacrifice 1 Tag nach der Operation (MF8) für die frühen zellulären und funktionellen Antworten zu einer erhöhten Lungenblutung (zB Gen Hochregulation oder frühen Transkriptionsfaktoren).
- Sacrifice 1 Woche nach der Operation (MF14) für eine im Frühstadium PAH vaskulären Phänotyp (mediale Hypertrophie ohne neointimalen Läsionen).
- Sacrifice von 2 Wochen nach der Operation (MF21) für eine im fortgeschrittenen Stadium PAH vaskulären Phänotyp (markiert mediale Hypertrophie und neointimale Bildung) mit leichter Höhen in RVP und mPAP.
- Sacrifice 3 Wochen nach der Operation (MF28) für eine im Endstadium PAH vaskuläre Phänotyp (markiert neointimalen Okklusion) und eine starke Erhöhung der RVP und mPAP. Klinische Zeichen einer Rechtsherzinsuffizienz sind in diesem Stadium üblich.
- Opfer nach dem 28. Tag (MF-RVFfür) PAH-assoziierten Rechtsherzinsuffizienz (RVF), klinisch als Dyspnoe definiert, schwere Lethargie und Gewichtsverlust (<10% in 1 Woche). Terminate Ratten, wenn eines dieser Zeichen vorhanden ist. Häufig Ratten diese Symptome zwischen den Tagen 28 und 35 und, wenn unbewacht gelassen entwickeln, sterben spontan während dieses Zeitintervalls.
5. Rechtsherzkatheter
- Anästhesie.
- Füllen Sie die Induktionskammer mit 5% Isofluran / 100% O 2 (Fluss: 1 L / min) und legen Sie die Ratte in der Box. Überprüfen Sie für eine ausreichende Tiefe der Anästhesie durch einen hinteren Zehe Prise durchführen. Wiegen Sie die Ratte.
- Rasur und reinigen Sie den Hals an der rechten Bauchseite der Ratte und für die Echokardiographie-Protokoll, dem Thorax und Oberbauch.
- Legen Sie die Ratte auf dem Rücken auf einer Heizmatte (37 ° C) und legen Sie die Schnauze in einer Beatmungsmaske / Kapuze mit 2 - 3% Isofluran / 100% O 2 (Fluss: 1 L / min). Die Schnauze sollte in Richtung der Forscher konfrontiert werden.
- Überprüfen der Narkosetiefe. Seien Sie vorsichtig mit Ratten mit schwerer PH. Wenn die Herzfrequenz abnimmt, verringern die Tiefe der Anästhesie. Bevorzugte, führen alle Messungen innerhalb von 20 min. Bewerben Augensalbe Trockenheit zu verhindern, während der Narkose.
- Echokardiographie-Protokoll.
- Führen Sie die Echokardiographie nach dem Protokoll von Brittain et al. in JoVE 13.
- Katheterisierung Protokoll.
HINWEIS: Um die 15-cm Silizium Katheter zu führen mit einer Kugel 2 mm von der Spitze Dieses Protokoll verwendet eine starre Kanüle mit einem vorgeformten Spitze 20 Grad gebogen. Eine 20-G - Nadel mit seiner Öffnung leicht gebogen nach innen benutzt wird , um die Kanüle in die rechte Halsvene einzufügen (siehe die Liste der Materialien). Ratten in jeder Phase der Progression der PAH und Steuerung kann in diesem Protokoll verwendet werden.- Desinfizieren Sie den Hals mit Chlorid-hexidine. Machen Sie einen 1,5-cm-Schnitt mit einem # 10 Skalpellklinge in der rechten Bauchseitedes Halses, vom rechten Kragen Knochen auf den Kieferknochen.
- Verbreiten Sie das Gewebe einer Schere. Mit einer Pinzette, ziehen Sie das Gewebe auseinander, bis die Halsvene erscheint. Präparieren der Membranen um die Halsvene Splitterpinzette verwendet wird.
- Setzen Sie die Spannung auf die Halsvene durch eine lose Ligatur platzieren (5-0 Naht) um das Gefäß. Erhöhen Sie die Spannung und Band der Ligatur auf die Beatmungsmaske (2A).
- Stromabwärts der Insertionsstelle legen eine lose Ligatur um das Gefäß zu ziehen , nachdem die Kanüle in situ ist , um Leckage und Druckverlust zu verhindern.
- Verwendung der Handgriffe einer Zange, verbiegen leicht die Spitze einer 20-G-Nadel mit der Öffnung an der Innenseite der Kanüle mit dem Katheter zu führen.
- Führen Sie die Spitze des 20-G-Nadel in die Vene und legen Sie schnell die Kanüle des Katheters im Inneren des Gefäßes enthält. Ziehen Sie die Nadel heraus, und schließen Sie dann die Ligaturdass in Schritt 5.3.4 vorbereitet.
- Führen Sie die Kanüle des Katheters in die Halsvene enthält. Die Spitze der Kanüle ist mit einer 20-Grad-Kurve (siehe Schritt 5.3.5). Manövrieren Sie die Kanüle unter dem Schlüsselbein und vorantreiben ein wenig in den rechten Vorhof (Abbildung 2C) einzugeben.
- Um den rechten Ventrikel eingeben, richten Sie die Spitze der Kanüle nach links, in Richtung des Herzens (2D). Auf dem Nacht Monitor sollte eine RV - Druckkurve erscheinen, passend 2D.
- Wenn der RV Druckkurve konstant ist, notieren Sie sich den systolischen und diastolischen Druck des rechten Ventrikels 1 (sRVP1 / dRVP1).
- Manipulieren der Spitze der Kanüle nach links und nach oben. Schieben Sie den Katheter innerhalb der Kanüle (Abbildung 2E).
- Schieben Sie den Katheter in die Hauptlungenarterie (PA). Kein Widerstand sollte spüren, wenn die Pulmonalklappe vorbei.
HINWEIS: Wenn der Katheter die Hauptlungenarterie gelangt, die diastolic Druck steigen. Auf dem Nacht Monitor sollte eine PA - Druckkurve erscheinen, passend 2E. - Wenn der PA-Druckkurve konstant ist, schreiben die Systole, Diastole nach unten, und die mittlere PA Druck 1 (sPAP1, dPAP1, mPAP1).
- weiter vorantreiben, den Katheter innerhalb der Kanüle, bis die Kugel an der Spitze des Katheters in einer Lungenarterie eingeklemmt wird. Beachten Sie die Druckkurve auf dem Nacht Monitor Abfall und entsprechen den Keil Druckkurve in 2F.
- Wenn der Keildruckkurve konstant ist, notieren Sie sich den systolischen, diastolischen und Keildruck bedeuten.
- Ziehen Sie den Katheter langsam zurück und anschließend messen und notieren Sie sich die Werte für sPAP2, dPAP2, mPAP2, sRVP2 und dRVP2, auf dem Nacht Monitor angezeigt.
- Wenn in der RV, leicht die Kanüle und Katheter zurückziehen zu messen die mittlere Druck im rechten Vorhof (RAP). Die Kurve sollte die RAP - Kurve in 2A entsprechen.
NEINTE: In diesem Protokoll werden die Ratten nach der Katheterisierung Protokoll durch die Extraktion des zirkulierenden Blutvolumens während der Narkose eingeschläfert.
6. Morphologie Beurteilung und Morphometry
HINWEIS: In diesem Protokoll wird das Tier durch die Extraktion des zirkulierenden Blutvolumens, während sie unter Anästhesie eingeschläfert. Ratten in jeder Phase der Progression der PAH und Steuerung kann in diesem Protokoll verwendet werden.
- Nach der Tötung nehmen die Lungen aus durch die Luftröhre etwa 5 mm über die bronchiale Bifurkation Schneiden und die Gefäße, die die Lunge zum Herzen zu verbinden. Setzen Sie die Lungen in kalter Kochsalzlösung. Präparieren Sie die linke Lunge. Schneiden Sie die linke Hauptbronchus an der Bifurkation.
- Füllen eines 50-ml-Spritze mit 4% Paraformaldehyd, ein Rohr mit einer Kanüle an der Spritze befestigen, und hängen die Spritze über einen Meter über dem Arbeitstisch. Setzen Sie die Kanüle in der linken Hauptbronchus zu passiv in die Lunge mit Paraformaldehyd zu füllen.Griff Paraformaldehyd mit Vorsicht zu genießen.
- Inkubieren Sie die linke Lunge in Paraformaldehyd für 48 Stunden.
- Dehydratisieren der linken Lunge von sie nacheinander in 70% Ethanol (1 h), 80% Ethanol (1 h), 90% Ethanol (1 h), 100% Ethanol (3 h), Xylol (2 h) Inkubieren und Paraffin ( 2 h).
- Einbetten der linken Lunge in Paraffin, mit dem Lungenhilus die Kassette zugewandt ist.
- Stain , die in Paraffin eingebettet, 4 um Lungenschnitten unter Verwendung eines Verhoeff oder Elastica-van Gieson - Färbung, als den Anweisungen des Herstellers 29. Stellen Sie sicher , dass die elastischen Schichten sind gut differenziert (wie in Abbildung 3). Scannen Sie die gefärbten Schnitten bei 40-facher Vergrößerung.
- Teilen Sie die Lunge in vier Quadranten. In jedem Quadranten finden 10 Schiffe mit einem äußeren Durchmesser von <50 & mgr; m (intra-acinar) und 10 Schiffe mit einem Außendurchmesser von> 50 & mgr; m (pre-acinar). Machen Sie ein Foto (2 x 40 Bilder pro Lunge). Zoom in zufällig bis zu 20-facher Vergrößerung und zu fotografieren jedes Schiffin diesem Blickfeld Selektionsbias zu minimieren.
- Ausschließen Schiffe, die eine längste / kürzeste Durchmesser-Verhältnis von> 2, eine unvollständige Kreisform, oder einen Zusammenbruch von mehr als einem Viertel der Gefäßwand haben.
Hinweis: Ein Beispiel für ein ausgeschlossen Schiff ist in Abbildung jedes Bild 3b Stellen auf der gleichen Vergrößerung (40X) und eine Skala , Bar. - Öffnen Sie ImageJ und das erste Bild. Zeichnen Sie eine gerade Linie auf der Maßstabsleiste im Bild der Skala einstellen über "Analyse" und "Set - Skala." Für "bekannte Strecke" , verwenden Sie den Wert auf der Skala bar Fotos hoch . Verwenden Mikrometer (& mgr; m) als die Längeneinheit. Stellen Sie die Skala auf globaler Ebene.
- Mit "freihändig Auswahlen" ziehen Sie eine Linie auf dem inneren Rand des luminalen Bereich (Abbildung 3), und verwenden "messen" (Crtl m) diesen Bereich zu messen. Dann ziehen Sie eine Linie um den äußeren elastic Lamina (Abbildung 3) , um den gesamten Gefäßbereich zu messen.
- Berechne den luminalen und Außendurchmesser (
 ) unter Verwendung von
) unter Verwendung von  .
. - Berechnen Wandstärke unter Verwendung von
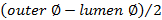 .
. - Berechnen Sie die Wand / Lumen-Verhältnis unter Verwendung von
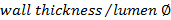 .
. - Berechnen Sie die Okklusion-Score
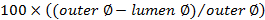 .
. - Ergebnis , das Schiff auf Muskularisierung (nein, teilweise oder total Muskularisierung) (3B).
HINWEIS: Gefäße mit einem Doppel Elastica für mehr als die Hälfte des Umfangs definiert sind als vollkommen muskularisierten. Schiffe, die mit einem doppelten Elastica weniger als die Hälfte des Umfangs definiert sind, wie teilweise muskularisierten. - Ergebnis, das Schiff auf der Anwesenheit eines neointima (ja oder nein) (3C).
HINWEIS: Die Schiffe ohne klar definierte interne elastische Lamina kombiniert mit (oft exzentrisch) Luminal Okklusion als neointimale Läsionen definiert.
Ergebnisse
Repräsentative Ergebnisse sind in Abbildung 4 dargestellt. Die vorgestellten Ergebnisse zeigen, Merkmale von MCT + FLOW in Lewis-Ratten in den folgenden Gruppen: Kontrolle (n = 3), MF8 (n = 5), MF14 (n = 5), MF28 (n = 5) und MF-RVF ( n = 10). Statistische Analysen wurden unter Verwendung der ANOVA Einweg mit Bonferroni-Korrektur durchgeführt.
60 mg / kg MCT und erhöhter Lungenblutfluss führen zu einem durc...
Diskussion
Dieses Verfahren beschreibt das chirurgische Verfahren eines aorto-Kava-Shunt bei Ratten mit MCT vorbehandelt strömungsinduzierten PAH und die Techniken zu schaffen, das Prinzip hämodynamischen und histopathologischen Endpunkte zu bewerten, die PAH und dieses Modell zu charakterisieren.
Kritische Schritte im Rahmen des Protokolls und Fehlerbehebung
Chirurgie und nach der Operation. Während der aorto-Kava-Shunt-Chirurgie, der wichtigste Schritt ist die Dissektion ...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This study was supported by the Netherlands Cardiovascular Research Initiative, the Dutch Heart Foundation, the Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development, and the Royal Netherlands Academy of Sciences (CVON nr. 2012-08, PHAEDRA, The Sebald fund, Stichting Hartekind).
Materialien
| Name | Company | Catalog Number | Comments |
| Shunt Surgery | |||
| Sterile surgical gloves | |||
| Duratears Eye ointment | Alcon | 10380 | |
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Histoacryllic tissue glue | B. Braun Medical | 1050052 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Safil 4-0 sutures violet resorbable | B. Braun Medical | ||
| 18 G needle | Luer | NN1838R BD | tip bent in 45 degrees orifice to the outside |
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Temgesic Buprenorphine | RB Pharmaceuticals | 5429 | subcutaneous injection |
| Sodium Chloride 0.9% | |||
| Ventilation mask Rat | |||
| Scalple blade | |||
| Biemer clamp 18 mm, 5 mm opening | AgnTho | 64-562 | |
| Heat mat | |||
| Kocher Clamp | |||
| Shaving machine | |||
| Microscope | Leica | ||
| Right Heart Catheterization | |||
| Sterile surgical gloves | |||
| Eye ointment | Duratears | ||
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Needle 20 G | Luer | Tip slightly bent to the inside | |
| Cannula 20 G | Luer | to introduce catheter, tip pre-formed in 20 degrees | |
| Silastic Catheter 15 cm long | 0.5 mm ball 2 mm from tip | ||
| Pressure transducer | Ailtech | ||
| Bedside monitor Cardiocap/5 | Datex-Ohmeda | ||
| Shaving machine | |||
| 10 mL Syringe | |||
| Sodium Chloride 0.9% | for flushing | ||
| Vascular Morphology | |||
| 50 mL Syringe | |||
| 4% Formaldehyde | |||
| 18 G cannula with tube | |||
| Verhoef staining kit | Sigma-Aldrich | HT254 | http://www.sigmaaldrich.com/catalog/product/sigma/ht254?lang=en®ion=US |
| Digital slide scanner | Hamamatsu | C9600 | |
| ImageJ | |||
| Elastic (Connective Tissue Stain) | Abcam | ab150667 | http://www.abcam.com/elastic-connective-tissue-stain-ab150667.html http://www.abcam.com/ps/products/150/ab150667/documents/ab150667-Elastic%20Stain%20Kit%20(website).pdf |
Referenzen
- Hoeper, M. M., Bogaard, H. J., Condliffe, R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol. 62, D42-D50 (2013).
- Stacher, E., Graham, B. B., Hunt, J. M., et al. Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med. 186 (3), 261-272 (2012).
- Levy, M., Maurey, C., Celermajer, D. S., et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease. J Am Coll Cardiol. 49 (7), 803-810 (2007).
- Sakao, S., Tatsumi, K., Voelkel, N. F. Reversible or irreversible remodeling in pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 43 (6), 629-634 (2010).
- Gomez-Arroyo, J. G., Farkas, L., Alhussaini, A. A., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Jones, J. E. Serial noninvasive assessment of progressive pulmonary hypertension in a rat model. Am J Physiol - Heart Circ Physiol. 283 (1), 364-371 (2002).
- Hoffman, J. I., Rudolph, A. M., Heymann, M. A. Pulmonary vascular disease with congenital heart lesions: Pathologic features and causes. Circulation. 64 (5), 873-877 (1981).
- van Albada, M. E., Berger, R. M. Pulmonary arterial hypertension in congenital cardiac disease--the need for refinement of the evian-venice classification. Cardiol Young. 18 (1), 10-17 (2008).
- Dickinson, M. G., Bartelds, B., Borgdorff, M. A., Berger, R. M. The role of disturbed blood flow in the development of pulmonary arterial hypertension: Lessons from preclinical animal models. Am J Physiol Lung Cell Mol Physiol. 305 (1), L1-L14 (2013).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovasc Res. 24 (5), 430-432 (1990).
- Okada, K., Tanaka, Y., Bernstein, M., Zhang, W., Patterson, G. A., Botney, M. D. Pulmonary hemodynamics modify the rat pulmonary artery response to injury. A neointimal model of pulmonary hypertension. Am J Pathol. 151 (4), 1019-1025 (1997).
- van Albada, M. E., Schoemaker, R. G., Kemna, M. S., Cromme-Dijkhuis, A. H., van Veghel, R., Berger, R. M. The role of increased pulmonary blood flow in pulmonary arterial hypertension. Eur Respir J. 26 (3), 487-493 (2005).
- Brittain, E. Echocardiographic assessment of the right heart in mice. JVis Exp. (e81), (2013).
- Dickinson, M. G., Bartelds, B., Molema, G., et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension. Am J Pathol. 179 (5), 2199-2209 (2011).
- Borgdorff, M. A., Bartelds, B., Dickinson, M. G., Steendijk, P., de Vroomen, M., Berger, R. M. Distinct loading conditions reveal various patterns of right ventricular adaptation. Am J Physiol Heart Circ Physiol. 305 (3), H354-H364 (2013).
- Ruiter, G., de Man, F. S., Schalij, I., et al. Reversibility of the monocrotaline pulmonary hypertension rat model. Eur Respir J. 42 (2), 553-556 (2013).
- van Albada, M. E., Bartelds, B., Wijnberg, H., et al. Gene expression profile in flow-associated pulmonary arterial hypertension with neointimal lesions. Am J Physiol Lung Cell Mol Physiol. 298 (4), L483-L491 (2010).
- Dickinson, M. G., Kowalski, P. S., Bartelds, B., et al. A critical role for egr-1 during vascular remodelling in pulmonary arterial hypertension. Cardiovasc Res. 103 (4), 573-584 (2014).
- van der Feen, D. E., Dickinson, M. G., Bartelds, M. G., et al. Egr-1 identifies neointimal remodeling and relates to progression in human pulmonary arterial hypertension. Jheart lung transplant. 35 (4), 481-490 (2016).
- Rungatscher, A. Chronic overcirculation-induced pulmonary arterial hypertension in aorto-caval shunt. Microvasc Res. 94, 73-79 (2014).
- O'Blenes, S. B., Fischer, S., McIntyre, B., Keshavjee, S., Rabinovitch, M. Hemodynamic unloading leads to regression of pulmonary vascular disease in rats. J Thorac Cardiovasc Surg. 121 (2), 279-289 (2001).
- Sakao, S., Taraseviciene-Stewart, L., Lee, J. D., Wood, K., Cool, C. D., Voelkel, N. F. Initial apoptosis is followed by increased proliferation of apoptosis-resistant endothelial cells. FASEB J. 19 (9), 1178-1180 (2005).
- Spiekerkoetter, E. FK506 activates BMPR2, rescues endothelial dysfunction, and reverses pulmonary hypertension. J Clin Invest. 123 (8), 3600-3613 (2013).
- Nickel, N. P., Spiekerkoetter, E., Gu, M., et al. Elafin reverses pulmonary hypertension via caveolin-1-dependent bone morphogenetic protein signaling. Am J Respir Crit Care Med. 191 (11), 1273-1286 (2015).
- Meloche, J., Potus, F., Vaillancourt, M., et al. Bromodomain-containing protein 4: The epigenetic origin of pulmonary arterial hypertension. Circ Res. 117 (6), 525-535 (2015).
- Happé, C. M. Pneumonectomy combined with SU5416 induces severe pulmonary hypertension in rats. Am J Physiol Lung Cell Mol Physiol. 310 (11), L1088-L1097 (2016).
- Ranchoux, B., Antigny, F., Rucker-Martin, C., et al. Endothelial-to-mesenchymal transition in pulmonary hypertension. Circulation. 131 (11), 1006-1018 (2015).
- de Raaf, M. A. SuHx rat model: Partly reversible pulmonary hypertension and progressive intima obstruction. Eur Respy J. 44 (1), 160-168 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten