È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
L'incapsulamento delle cellule dei mammiferi nei branelli di Alginate usando un vaso semplice mescolato
In questo articolo
Riepilogo
Questo video e il manoscritto descrivono un metodo basato sull'emulsione per incapsulare le cellule di mammiferi da 0,5% a 10% di branchi alginato, che possono essere prodotti in grandi lotti utilizzando un recipiente semplice mescolato. Le cellule incapsulate possono essere coltivate in vitro o trapiantate per applicazioni di terapia cellulare.
Abstract
L'incapsulamento cellulare in branchi alginato è stato utilizzato per la coltura cellulare immobilizzata in vitro e per l'immunoisolamento in vivo . L'incapsulamento delle isole pancreatiche è stato studiato in modo estensivo come mezzo per aumentare la sopravvivenza delle isole nei trapianti allogenici o xenogeneici. L'incapsulamento di Alginate è comunemente ottenuto mediante estrusione degli ugelli e gelazione esterna. Utilizzando questo metodo, le gocce di alginato contenenti cellule formate alla punta degli ugelli cadono in una soluzione contenente cationi bidimensionali che causano la gelazione ionotropica di alginato quando si diffondono nelle goccioline. Il requisito per la formazione di gocce alla punta dell'ugello limita la portata volumetrica e la concentrazione di alginato che può essere raggiunta. Questo video descrive un metodo di emulsionazione scalabile per incapsulare le cellule di mammiferi da 0,5% a 10% di alginato e dal 70% al 90% di sopravvivenza cellulare. Con questo metodo alternativo, le gocce di alginato contenenti le cellule e il carbonato di calcio vengono emulsionati in olio minerale,Minacciata da una diminuzione del pH che porta alla liberazione interna del calcio e alla gelazione ionotropica di alginato. Il metodo attuale consente la produzione di branchi alginati entro 20 minuti di emulsionazione. L'attrezzatura necessaria per la fase di incapsulamento è costituita da navi semplici agitate disponibili presso la maggior parte dei laboratori.
Introduzione
L'incapsulamento delle cellule di mammiferi è stato ampiamente studiato come mezzo per proteggere le cellule trapiantate dal rifiuto immunitario 1 o per fornire un supporto tridimensionale per la coltura cellulare immobilizzata 2 , 3 , 4 . L'incapsulamento delle isole pancreatiche in branchi alginato è stato usato per invertire il diabete in roditori allogenici di 5 , 6 o xenogeneic 7 , 8 , 9 , 10 , 11 , 12 . I trial preclinici e clinici del trapianto di isole pancreatiche incapsulati per il trattamento del diabete di tipo 1 sono in corso 13 , 14 , 15 . Per le applicazioni di trapianto o di grandi dimensioniE in vitro produzione di cellule immobilizzate, sono generalmente utilizzati generatori a base di ugelli a ugello. Tipicamente, una miscela di alginato e cellule viene pompata attraverso un ugello per formare gocce che cadono in una soluzione agitata contenente cationi bivalenti, con conseguente gelazione esterna delle goccioline. Il flusso del gas coassiale 16 , 17 , la vibrazione dell'ugello 18 , la repulsione elettrostatica 19 oi fili rotanti 20 facilitano la formazione di gocce alla punta dell'ugello.
Gli inconvenienti principali dei generatori convenzionali di perline sono la loro limitata produttività e la limitata gamma di viscosità delle soluzioni che porteranno ad un'adeguata formazione del tallone 21 . A elevate portate, il fluido che esce dall'ugello si rompe in goccioline più piccole del diametro dell'ugello, diminuendo il controllo della dimensione. Possono essere utilizzati generatori a branelli a più ugelli per aumentare il throughput, maLa distribuzione uniforme di flusso tra gli ugelli e l'impiego di soluzioni> 0,2 Pas è problematica 22 . Infine, tutti i dispositivi basati sugli ugelli dovrebbero dare un po 'di danno alle isole, poiché il diametro degli ugelli utilizzati è compreso tra 100 μm e 500 μm, mentre ~ 15% degli isolotti umani può essere maggiore di 200 μm 23 .
In questo video, descriviamo un metodo alternativo per incapsulare le cellule dei mammiferi formando goccioline in un singolo passaggio di emulsionazione anziché drop-by-drop. Poiché la produzione di branelli viene eseguita in un vaso semplice miscelato, il metodo è adatto per produzione di piccole dimensioni (~ 1 mL) su larga scala (gamma di 10 3 L) con bassi costi di attrezzatura 24 . Questo metodo consente la produzione di perline ad alta sfericità utilizzando una vasta gamma di viscosità alginica con brevi ( ad esempio 20 minuti) tempi di generazione del branco. Questo metodo è stato originariamente sviluppato da Poncelet et all. 25 , 26 e utilizzato per immobilizzare DNA 27 , proteine 28 tra cui insulina 29 e batteri 30 . Recentemente abbiamo adattato questi metodi all'incapsulazione di cellule di mammiferi usando le linee beta 31 del pancreas , 31 e il tessuto pancreatico primario 32 .
Il principio del metodo è quello di generare un'emulsione in acqua in olio costituita da gocce di alginato in olio minerale, seguita da una gelazione interna delle goccioline di alginato ( figura 1 ). In primo luogo l'incapsulante ( ad es. Le cellule) viene disperso in una soluzione alginata contenente un sale di calcio a grana fina con bassa solubilità al pH iniziale del processo. La miscela alginata viene quindi aggiunta ad una fase organica agitata per creare un'emulsione, di solito in presenza di unatensioattivo. Nel caso dell'incapsulamento cellulare di mammiferi, i componenti presenti nel siero possono agire come tensioattivi. Successivamente, il pH viene ridotto per solubilizzare il sale di calcio aggiungendo un acido solubile in olio che divide nella fase acquosa. L'acido acetico, con un coefficiente di ripartizione dell'olio / acqua minerale <0,005 33 , deve essere pre-disciolto in olio, quindi aggiunto all'emulsione dove viene mescolato in fase olio e rapidamente diviso nella fase acquosa 34 . La Figura 2 illustra le reazioni chimiche e la diffusione che si verificano durante l'acidificazione e la fase di gelazione interna. Infine, le cellule incapsulate vengono recuperate per inversione di fase, la separazione di fase accelerata mediante centrifugazione, ripetuti gradini di lavaggio e filtrazione. Questi passaggi possono quindi essere seguiti da un campionamento di branelli e cellule per analisi di controllo di qualità, cultura cellulare in vitro e / o trapianto delle cellule incapsulate.
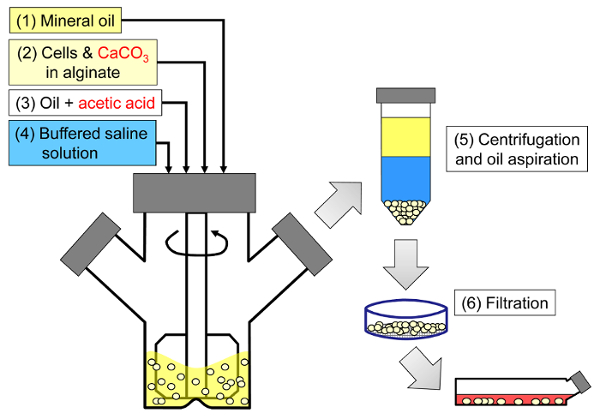
Figura 1: Schema del processo basato sulla emulsionazione per incapsulare le cellule dei mammiferi. Le perle vengono prima prodotte emulsionando una miscela di alginato, cella e CaCO 3 in olio minerale (passi 1 e 2 nello schema), innescando la gelazione interna aggiungendo acido acetico (fase 3). Le branche gelate vengono quindi separate dall'olio aggiungendo un tampone acquoso per innescare l'inversione di fase (fase 4), seguita da centrifugazione e aspirazione di olio (fase 5), quindi filtrazione (fase 6). Infine, le perle raccolte sul filtro vengono trasferite in terreno di coltura cellulare per coltura in vitro o per il trapianto. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Reazioni e fasi di diffusione che si verificano durante la gelazione interna. (1) L'acido acetico viene aggiunto alla fase organica ed è trasportato alle gocce di alginato per convezione. (2) L'acido acetico divide nella fase acquosa. (3) In presenza di acqua, l'acido si dissocia e diffonde per raggiungere i grani CaCO 3 raffigurati in blu scuro. (4) Gli ioni H + vengono scambiati con gli ioni Ca 2+ in CaCO 3 , rilasciando ioni Ca 2+ . (5) Gli ioni di calcio si diffondono fino a quando non incontrano un alginato non reagito, portando alla traversatura ionotropica delle catene alginiche. Clicca qui per visualizzare una versione più grande di questa figura.
Contrariamente agli incapsulatori convenzionali a base di ugelli convenzionali, è un'esperienza di grande distribuzione del beadCeduto da questo processo a causa del meccanismo di formazione di goccioline in emulsionazione mescolata. Per un sottoinsieme di applicazioni, questa distribuzione di dimensioni del tallone può essere problematica. Ad esempio, una frazione più grande delle cellule può essere esposta alla superficie del tallone in perle più piccole. Se i limiti di nutrienti ( ad es. Ossigeno) sono preoccupanti, queste limitazioni possono essere esacerbate in branelli più grandi. Un vantaggio del metodo di emulsionazione mescolato è che la dimensione del tallone medio può essere facilmente regolata cambiando il tasso di agitazione durante la fase di emulsionazione. La distribuzione di dimensioni larghe può essere sfruttata anche per studiare l'effetto della dimensione del bead sulle prestazioni delle cellule incapsulate.
L'incapsulamento delle cellule dei mammiferi mediante emulsionazione e gelazione interna è un'alternativa interessante per i laboratori che non sono dotati di un generatore di branelli. Inoltre, questo metodo consente agli utenti di ridurre il tempo di lavorazione o di generare perline a concentrato di alginato molto basso o molto altozioni.
Il protocollo descritto di seguito descrive come incapsulare le cellule in 10,5 ml di soluzione alginata al 5% preparata in 10 mM di tampone di acido 4- (2-idrossietil) -1-piperazinattanesolfonico (HEPES). L'alginato è costituito da una miscela 50:50 di alginato di LVM a livello di trapianto (acido ad alto contenuto di acido a bassa viscosità) e MVG (alta viscosità ad alta concentrazione di acido guluronico). Il carbonato di calcio a una concentrazione finale di 24 mM viene utilizzato come agente fisico di reticolazione. L'olio minerale leggero costituisce la fase organica, mentre l'acido acetico viene utilizzato per acidificare l'emulsione e attivare la gelazione interna. Tuttavia, il tipo e la composizione del alginato, così come il tampone di processo selezionato, dipendono dall'applicazione desiderata 32 . Per produrre perline con questo protocollo sono stati utilizzati diversi tipi di alginato (vedi tabella dei materiali).
Protocollo
1. Preparare la soluzione Alginate, la sospensione CaCO 3 e l'olio acidificato
- Preparare il buffer e il mezzo di processo.
- Preparare il tampone di processo tipico usato per generare branelli alginato ad alta concentrazione utilizzando 10 mM HEPES, 170 mM NaCl. Regolare il pH a 7,4.
- Preparare il mezzo di coltura tipico utilizzando il DMEM di Dulbecco contenente 10% di siero fetale fetale (FBS), 6mM glutammina, 100 U / mL penicillina e 100 mg / mL streptomicina.
- Preparare la soluzione di riserva alginata a 1,17 volte la concentrazione finale desiderata nelle perle.
- In primo luogo, pesare la quantità appropriata di polvere di alginato. Ad esempio, per ottenere una concentrazione finale del 5% alginato con 50:50 LVM e MVG alginato, pesare un totale di 1,17 g di alginato sodico combinando 0,583 g di polvere di alginato LVM e 0,583 g di polvere di alginato MVG.
- Inserire un tampone di processo di 20 mL in un autocLavare il vaso di vetro su una piastra di agitazione magnetica e agitare a ~ 200 giri / min. Aggiungere progressivamente la polvere alginato di sodio alla soluzione.
- Lasciare la soluzione mescolandola per una notte a bassa velocità. Se necessario, fissare il pallone alla piastra di mescolanza.
- Se la soluzione non è completamente disciolta, fissare la bottiglia su un miscelatore rotante e continuare a miscelare a 37 ° C per ulteriori 24 ore.
- Sterilizzare la soluzione alginata autoclavando la soluzione per 30 minuti in un recipiente inferiore a metà pieno. Lasciare che la temperatura scenda sotto i 60 ° C prima di recuperare la soluzione.
- Se necessario, rimuovere le particelle filtrando la soluzione alginata poco dopo l'autoclave prima di raggiungere la temperatura ambiente, mentre la viscosità rimane abbastanza bassa.
- Preparare la sospensione di carbonato di calcio a 21 volte la concentrazione finale desiderata per la gelazione interna.
- Pesare la polvere di CaCO 3 . Ad esempio, annuncioD 1 g CaCO da 3 a 20 mL di tampone di processo per ottenere 24 mM CaCO3 come concentrazione finale dell'agente gelificante.
- Autoclave la sospensione CaCO 3 per 30 min.
NOTA: la concentrazione di CaCO 3 cambierà nel tempo a causa del equilibrio del bicarbonato - CO 2 . Evitare di utilizzare lo stesso sacco CaCO 3 per più di 10 procedure di incapsulamento.
- Autoclave il vaso agitato utilizzato per il processo di emulsionazione. Prima dell'uso, rimuovere eventuali tracce di acqua condensata rimasta nel pallone.
- Immediatamente prima del processo di emulsionazione preparare l'olio acidificato. Sciogliere 44 μl di acido acetico per 11 ml di olio minerale posto in un tubo conico da 50 ml.
NOTA: Un errore comune è la dissoluzione incompleta dell'acido acetico. Evitare di pipettare piccole quantità di acido acetico e di assicurare che l'acido acetico sia completamente sciolto in olio mediante vortex ripetuta.
ATTENZIONE: l'acido acetico è un tossico D acido volatile. Maneggiare questo reagente sotto una cappa di fumo e mantenere l'acido acetico / soluzione olio in un contenitore chiuso fino alla fase di emulsionazione. Per ulteriori informazioni, fare riferimento alle informazioni sulla scheda di sicurezza di questo reagente. - Lasciare che tutte le soluzioni raggiungano la temperatura ambiente prima di procedere all'incapsulamento cellulare.
2. Generazione di branelli di Alginate per emulsione e gelato interno
- Posizionare 10 ml di olio minerale leggero nel pallone e iniziare ad agitare con una bassa velocità di rotazione ( ad es. 250 giri / min per il pallone da filo utilizzato in questo video).
- Se le cellule utilizzate per il processo sono da colture aderenti, applicare la tripsina per sospendere le cellule. Terminare la reazione aggiungendo un mezzo contenente FBS o inibitore della tripsina e raccogliendo un campione per l'enumerazione cellulare.
- Determinare la concentrazione e la vitalità delle cellule dopo la colorazione Trypan blu usando un emocitometro o un contatore di cellule automatiche, come descritto in precedenzaAss = "xref"> 32.
- Centrifugare le cellule per 7 minuti a 300 xg e lavare una volta nel mezzo desiderato per l'immobilizzazione cellulare. Assicurarsi che questo supporto contiene emulsionanti come FBS o albumina di siero bovina (BSA). Ad esempio, utilizzare DMEM contenente il 10% di FBS.
- Riposizionare il pellet di cellula nello stesso mezzo per ottenere 10,5 volte la concentrazione finale desiderata nelle perle.
- Aggiungere 1,1 mL di 10,5 volte la concentrazione di cellule concentrate a 9,9 mL di soluzione alginato. Aggiungere quindi 550 μL di sospensione CaCO 3 e mescolare mescolando con una spatola sterile per assicurare una distribuzione uniforme del CaCO 3 .
- Trasferire immediatamente 10,5 ml di miscela di alginato, cella e CaCO 3 nell'olio agitante usando una siringa.
NOTA: per soluzioni altamente viscose, aspirare e espellere la miscela molto lentamente per evitare le bolle d'aria. In alcuni casi, è preferibile interrompere l'agitazione aggiungendo la miscela al pallone per evitareAllungare l'entrainment sull'albero della girante. - Subito dopo l'aggiunta di alginato, cella e CaCO 3 all'olio, aumentare il tasso di agitazione.
NOTA: Per il 5% LVM: alginato MVG utilizzato qui, è stata applicata una velocità di rotazione di 1025 giri / min per generare branelli di diametro di circa 900 μm adatti alla coltura in vitro 35 . Le velocità di rotazione più elevate e le basse concentrazioni di alginato portano a un diametro medio inferiore del tallone, come descritto nelle pubblicazioni precedenti 25 , 32 . Le leggide modifiche nella geometria del girante e della vasca, nonché le proprietà alginate possono influire notevolmente sul diametro medio del tallone. Per ogni modifica della configurazione della nave o del lotto alginato, deve essere generata una curva standard relativa al diametro del tallone medio del momento della superficie della superficie rispetto alla velocità di rotazione 32 . - Avviare il timer e emulsionare l'alginato per 12 minuti.
- Aggiungere 10 ml di tOlio e acido acetico per acidificare l'emulsione, sciogliere il CaCO3 e quindi fisicamente incrociare l'alginato in branchi gelati. Lasciare 8 min per questa fase di acidificazione.
3. Recupero di branelli
- Ridurre la velocità di agitazione a 400 giri / min. Aggiungere 40 ml di tampone di processo mescolato con il 10% di media per aumentare il pH e provocare l'inversione di fase.
- Fermare l'agitazione 1 min dopo e trasferire la miscela a 50 ml di centrifuga. Risciacquare il pallone con un altro mezzo di 20 ml e aggiungerlo al tubo. Aspirare il più possibile la fase acquosa dalla fiala di spinner prima di aspirare la fase dell'olio per minimizzare il contatto del tallone con la fase dell'olio.
NOTA: Usare una pipetta di grandi dimensioni ( ad es. Pipetta da 25 ml) a questo punto e da questo punto in modo da evitare di danneggiare le perle. Per i volumi più piccoli, la sospensione del tallone può anche essere manipolata con punte di pipetta tagliate. Per ottenere tali punte, tagliare l'estremità della punta pipetta con forbici whIle che indossa la protezione dell'occhio. - Centrifugare i tubi per 3 minuti a 630 xg per accelerare la sedimentazione del fascio e la separazione di fase.
- Rimuovere l'olio e la soluzione acquosa in eccesso aspirando con una pipetta Pasteur.
- Lavare le perle almeno una volta con il mezzo. Filtrare la sospensione del tallone sui filtri a cellule in nylon da 40 μm e aspirare l'eccesso di liquido associato alle perle dal basso del filtro. Trasferire le perle in un volume noto di mezzo usando una spatola sterile.
NOTA: In questo passaggio possono essere utilizzati filtri di dimensioni più piccole o superiori, a seconda del diametro minimo del bead target. Tuttavia, la filtrazione di gravità è consigliata piuttosto che la filtrazione a pressione mediante filtri di dimensioni pori sub micron per evitare di danneggiare le perle. - Misurare il volume del branzino per volume di volume (volume dopo aver aggiunto le perle, meno il volume prima di aggiungere le perle) e caricare il mezzo per ottenere il brano desiderato: rapporto volume totale, che è tipicamente 1: 5 o 1 mL di branelli in4 ml di media. Da questo punto in poi, utilizzare sempre pipette di grandi dimensioni per evitare di danneggiare le perle.
- Trasferire le cellule incapsulate in T-palloni per esperimenti di coltura in vitro o trapiantati.
4. Controllo di qualità e applicazioni
NOTA: Per garantire la qualità delle cellule e del bead incapsulato, la distribuzione del formato del tallone e la sopravvivenza delle cellule dopo il processo dovrebbero essere quantificate. L'invertimento del gel per recuperare le cellule all'interno delle perle per ulteriori analisi viene comunemente eseguito.
- Per valutare la distribuzione del diametro del tallone, macchiare le perle con toluidina blu-O.
- Posare 0,5 ml di branchi in 4 mL di tampone di processo contenente il 10% di mezzo completo.
- Aggiungere 500 μl di una soluzione di blu toluidina 1 g / l preparata in tampone di processo.
- Incubare per 60 minuti in un tubo conico su un agitatore rotativo a 50 giri / min.
- Aggiungere 5 mL di tampone di processo contenente il mezzo completo del 10% e immedTrasferire le perle e la soluzione in un piatto di Petri e acquisire immagini su un microscopio a basso ingrandimento o utilizzando una fotocamera digitale a mano. Se necessario, posizionare il piatto di Petri in una scatola chiara prima di acquisire immagini con una fotocamera portatile per aumentare il contrasto e evitare le ombre.
- Esegui un'analisi delle immagini per quantificare la distribuzione del formato del tallone come descritto in precedenza 32 , ad esempio utilizzando l'immagine freeware 36 .
- Per valutare qualitativamente la sopravvivenza delle cellule, macchia le cellule usando homodimer ethidium per identificare le cellule morte e la calceina AM per identificare le cellule vive.
- Aggiungere 1 volume di perline a 4 volumi di tampone di processo contenenti il mezzo completo del 10%.
- Aggiungere la quantità appropriata di soluzioni calcein AM e etidum homodimer per ottenere rispettivamente concentrazioni di 4 μM e 2 μM. Genera controlli monocomponenti aggiungendo solo uno dei reagenti ad alcuni campioni di branelli.
- Incubare le perline sul ghiaccio per 20 min.
- Mettere la soluzione tra una diapositiva e la copertura con un distanziale come un O-ring per evitare la compressione delle perle.
- Procedi alla microscopia a fluorescenza. Utilizzare i singoli controlli di macchia per valutare la perdita di fluorescenza. Selezionare i filtri fluorescenti appropriati in base alle lunghezze d'onda di eccitazione / emissione associate con calceina AM (494/517 nm) e l'etodimide omodimero legato al DNA (528/617 nm).
- Per recuperare le cellule dalle perle per ulteriori analisi, degel l'alginato utilizzando citrato o un'altra soluzione chelante.
- Preparare una soluzione degenerante contenente 55 mM citrato, 10 mM HEPES e 95 mM NaCl a pH 7,4.
- Mescolare questa soluzione con il 10% di media e quindi aggiungere 1 ml di branchi alginato per 9 ml della miscela.
- Degel le perline sul ghiaccio con agitazione di 75 rpm per 20 minuti.
NOTA: le cellule possono ora essere utilizzate per l'analisi o rimosse dalla cellula degradata di alginatoIon per centrifugazione. Ad esempio, la vitalità cellulare dopo la degenerazione può essere quantificata dalla colorazione Trypan Blue. In alternativa, le cellule possono essere centrifugate e lavate, seguite da campioni e analisi di mRNA, DNA e / o proteine.
Risultati
Al termine dell'emulsionamento e del processo di gelazione interna, è necessario recuperare un volume di branzine simile al volume iniziale del alginato e della miscela cellulare. Le perline dovrebbero essere altamente sferiche con pochi difetti ( Figura 3 ). Le perle dovrebbero essere sufficientemente forti per resistere alla pipettazione tramite pipette a grande larghezza. Alle concentrazioni di alginato elevato, nelle perle possono essere osser...
Discussione
Varie fasi (illustrate nella Figura 2 ) durante la reazione di gelazione interna possono limitare la cinetica complessiva. Per i granuli di carbonato di calcio superiore a ~ 2,5 μm, è stato dimostrato che la velocità di dissoluzione del carbonato è limitata dai tassi 26 , 44 . La fase di acidificazione che porta al rilascio interno del calcio è stata anche dimostrata come la variabile di processo critica che pregiudica la sopravvivenza cell...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Jill Osborne per il suo lavoro a terra sul processo di emulsificazione e Lauren Wilkinson per il supporto tecnico. Ringraziamo il dottor Igor Laçik, il dottor Timothy J. Kieffer e il dott. James D. Johnson per il loro contributo e collaborazione. Ringraziamo il Diabète Québec, il JDRF, il ThéCell, il Centro di formazione scientifica delle scienze naturali (CQMF), il Consiglio di ricerca delle scienze naturali e di ingegneria (NSERC), il Centro per il trapianto delle isole umane e la rigenerazione delle cellule beta, la rete canadese delle cellule staminali, Fondazione Michael Smith per la ricerca sulla salute, Fondi per la ricerca sulla natura e le tecnologie e COST 865 per il sostegno finanziario.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
Riferimenti
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes--a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O'Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli's cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15 (2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E., Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. . Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels - a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M., Wijffels, R. H. . Immobilized Cells. , 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon