A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تجميع وتتبع التنمية المجتمعية الميكروبية داخل منصة ميكرويل صفيف
In This Article
Summary
ويعتمد تطوير المجتمعات الميكروبية على مجموعة من العوامل، بما في ذلك العمارة البيئية، وفرة الأعضاء، والصفات، والتفاعلات. يصف هذا البروتوكول بيئة الاصطناعية، ميكروفابريكاتد لتتبع في وقت واحد من الآلاف من المجتمعات الواردة في آبار فيمتوليتر، حيث يمكن تقريب العوامل الرئيسية مثل حجم المتخصصة والحبس.
Abstract
ويعتمد تطور المجتمعات الميكروبية على مجموعة من العوامل الحتمية والعوامل العشوائية المعقدة التي يمكن أن تغير بشكل كبير التوزيع المكاني وأنشطة أفراد المجتمع المحلي. قمنا بتطوير منصة مجموعة ميكرويل التي يمكن استخدامها لتجميع بسرعة وتتبع الآلاف من المجتمعات البكتيرية في موازاة ذلك. هذا البروتوكول يسلط الضوء على فائدة المنصة ويصف استخدامه لرصد بصريا لتطوير المجتمعات بسيطة، مكونة من عضوين ضمن مجموعة من المصفوفات داخل المنصة. يستخدم هذا المظاهرة اثنين من المسوخ من الزائفة الزنجارية ، وهي جزء من سلسلة من المسوخ المتقدمة لدراسة النوع السادس إفراز المرضية. إدراج الكروموسومات إما من مشيري أو الجينات غفب تسهيل التعبير التأسيسي من البروتينات الفلورية مع أطوال موجية الانبعاثات التي يمكن استخدامها لرصد وفرة عضو المجتمع والموقع داخل كل ميكرويل. يصف هذا البروتوكول ميثو مفصلد لتجميع مخاليط من البكتيريا في آبار الصفيف واستخدام التصوير الزمني مضان الفاصل الزمني وتحليل الصور الكمية لقياس النمو النسبي لكل فرد من السكان على مر الزمن. البذر والتجمع من منصة ميكرويل، وإجراءات التصوير اللازمة للتحليل الكمي للمجتمعات الميكروبية داخل مجموعة، والأساليب التي يمكن استخدامها للكشف عن التفاعلات بين منطقة الأنواع الميكروبية جميع نوقشت.
Introduction
تتشكل المجتمعات الميكروبية من قبل العوامل الحتمية، مثل بنية البيئة، والعمليات العشوائية، التي ترتبط مع موت الخلايا، والانقسام، وتركيز البروتين، وعدد من العضيات، والطفرات 1 . وفي البيئة الطبيعية، قد يكون من المستحيل تقريبا تحليل التأثير الفردي لهذه التأثيرات على تكوين المجتمع ونشاطه. إن تحديد أفراد المجتمع المحلي ومواصلة حل توزيعهم المكاني الزماني في البيئة الطبيعية أمر محفوف بالمخاطر بسبب وجود هياكل طبيعية ودفنها داخل بيئة كيميائية وبيولوجية. ومع ذلك، فقد أكدت الجهود المبذولة مؤخرا أهمية التنظيم المكاني على وظيفة المجتمع المحلي، وتشير إلى ضرورة مراعاة وفرة الأعضاء وتنظيمهم في الدراسات الجارية 2 و 3 و 4 .
هذامن الواضح أن البيئة الكيميائية المحلية ( أي توافر المغذيات والمستقلبات الثانوية)، والبنية المادية ( مثل بنية التربة، وجذور النباتات، وجسيمات المحيطات، أو الميكروفيلي المعوي)، ووجود أو غياب الأكسجين، وإدخال جميع الأنواع المسببة للأمراض تؤثر على تكوين، والهندسة المعمارية، ووظيفة المجتمعات الميكروبية 5 ، 6 ، 7 ، 8 ، 9 ، 10 ، 11 . ومع ذلك، فإن التقنيات التقليدية للثقافات التي تهمل الاستيلاء على هذه العوامل لا تزال سائدة. تكوين المجتمع (على سبيل المثال، وجود الأنواع التي تعتمد على مشترك)، والتعلق الجسدي، وتركيز جزيء الإشارات، والاتصال المباشر خلية الخلية كلها عوامل هامة لتشكيل المجتمع الميكروبي ويمكن أن تضيع في جظروف الثقافة التقليدية. هذه الخصائص يصعب تكرارها في ثقافة السائلة السائبة أو على لوحة أجار. ومع ذلك، فإن توافر تقنيات ميكروفلويديك، ميكروباترنينغ، و نانوفابريكاتيون التي تسمح بتكرار الميزات الفيزيائية والكيميائية الرئيسية للبيئات الطبيعية، مكنت العديد من الباحثين من بناء مجتمعات بكتيرية لدراسة تفاعلاتهم 12 و 13 و 14 وتطوير البيئات التركيبية التي تحاكي الظروف الطبيعية 4 ، 15 ، 16 ، 17 ، 18 ، 19 ، 20 .
يصف هذا البروتوكول طريقة لافتعال جهاز مجموعة ميكرويل ويوفر إجراءات تجريبية مفصلة التي يمكن استخدامها ل فونكتيوناليز ثوآبار في الصفيف، وتنمو البكتيريا، سواء كمستعمرات من نوع واحد أو في مجتمعات متعددة الأعضاء. ويوضح هذا العمل أيضا كيفية تعديل البكتيريا لإنتاج البروتينات الفلورسنت مراسل يمكن استخدامها لرصد النمو البكتيري داخل الآبار مع مرور الوقت. تم عرض مجموعة مماثلة سابقا وأظهرت أنه من الممكن تتبع نمو مستعمرات من نوع واحد من الزائفة الزنجارية ( P. الزنجارية) في ميكرويلز. من خلال تعديل حجم جيدا وكثافة البذر، وظروف انطلاق الآلاف من التجارب النمو يمكن أن تتنوع في موازاة لتحديد كيفية تأثير شروط التطعيم الأولية على قدرة البكتيريا في النمو 21 . يستخدم العمل الحالي نسخة معدلة قليلا من مجموعة ميكرويل التي تبني على العمل السابق من خلال تمكين المقارنة في وقت واحد من المصفوفات متعددة وباستخدام بروتوكول تجريبي أكثر قوة. المصفوفة المستخدمة في هذا العمل تحتوي على عدة سوباريز، أو صفيف إنسمبئر، تحتوي على آبار ذات أحجام مختلفة، تتراوح بين 15 - 100 ميكرون في القطر، والتي يتم ترتيبها في ثلاثة الملعب مختلفة ( أي 2X، 3X، و 4X قطر جيدا). يتم حفر الصفائف في السيليكون، ويتم تمكين نمو البكتيريا المصنفة في صفائف السيليكون عن طريق ختم الصفائف مع ساترة التي تم طلاءها مع هلام الاغاروز متوسطة الغرس. P. الطائر الزنجارية مصممة لدراسة نوع إفراز نظام تستخدم في هذه المظاهرة.
النتائج المعروضة هنا بناء نحو الهدف النهائي من تحليل المجتمعات مولتيمبر داخل صفائف ميكرويل، مما يتيح للباحثين لرصد وفرة وتنظيم البكتيريا في الموقع في حين السيطرة والتحقق من البيئة الكيميائية. وينبغي أن يوفر ذلك في نهاية المطاف نظرة ثاقبة عن "القواعد" التي تحكم تنمية المجتمع والخلافة.
Protocol
1. السيليكون ميكرويل-صفيف تلفيق
- طلاء باريلين
- إيداع بين 1-1.5 ميكرومتر من باريلين N على رقائق السيليكون باستخدام نظام طلاء باريلين المتاحة تجاريا وفقا لمواصفات الشركة المصنعة والتعليمات (إعدادات: نقطة المرذاذ نقطة = 160 درجة مئوية، نقطة مجموعة الفرن = 650 درجة مئوية).
ملاحظة: حوالي 6 غرام من باريلين N تحميلها في غرفة ينتج الطلاء 1-1،5 ميكرون سميكة.
- إيداع بين 1-1.5 ميكرومتر من باريلين N على رقائق السيليكون باستخدام نظام طلاء باريلين المتاحة تجاريا وفقا لمواصفات الشركة المصنعة والتعليمات (إعدادات: نقطة المرذاذ نقطة = 160 درجة مئوية، نقطة مجموعة الفرن = 650 درجة مئوية).
- الليثوغرافيا الضوئية
- سبين معطف رقائق باريلين N المغلفة مع المروج التصاق، هيكساميثيلديسيلازان 20٪ (همدس)، و 80٪ خلات البروبيلين غليكول مونوميثيل الأثير (بغما) (انظر جدول المواد ) في 3000 دورة في الدقيقة لمدة 45 ثانية. ملء 2 مل ماصة نقل مع المروج التصاق ويرش على الرقاقة بأكملها. السماح للرقاقة للجلوس لمدة 10 ثانية قبل الغزل الجاف.
- ملء 2 مل ماصة نقل مع إيجابية إلىن مقاومة للضوء (انظر جدول المواد ) والاستغناء عن مقاومة للضوء في وسط الرقاقة. تدور في 3000 دورة في الدقيقة لمدة 45 ثانية لانتاج طلاء مقاومة التي هي تقريبا 1.5 ميكرون سميكة.
- لينة خبز العينات على موقد في 115 درجة مئوية لمدة 1 دقيقة.
- استخدام يينر الاتصال و فوتوماسك مع نمط جيدا المطلوب لفضح العينة إلى الأشعة فوق البنفسجية. فضح رقاقة المغلفة تدور من خلال الضوئية منقوشة لمدة 6 ثوان، مما يعطي جرعة تقريبية من 60-80 مج / سم 2 تقاس في 365 نانومتر.
- تطوير نمط غمر العينة في المطور (<3٪ هيدروكسيد الأمونيوم رباعي الأمثيل في الماء؛ انظر جدول المواد ) لمدة 2 دقيقة. شطف مع دي المياه وجافة مع نظيفة، النيتروجين الجاف.
ملاحظة: مجالات مقاومة للضوء المعرضة للأشعة فوق البنفسجية يجب تطهيرها خلال التنمية.
- رد الفعل أيون الحفر
- استخدام حفر البلازما الأكسجين لإزالة باريلين يتعرضعلى طول الطريق إلى الركيزة السيليكون.
ملاحظة: وصفة يمكن تشكيلها لتغيير معدل حفر باريلين. لسمك باريلين بين 1 و 5 ميكرون، استخدم وصفة مع 60 متور، 20 درجة مئوية، 100 سسم O 2 ، 10 W رف، و 2000 W إيكب على أداة النقش الأيوني التفاعلية (ري). بعد الحفر وإزالة طبقة باريلين المكشوفة، يجب أن تبدو منطقة منقوشة ( أي السيليكون يتعرض) لامعة والفضة. - استخدام عميقة ري (دري؛ على سبيل المثال، بوش دري) عملية حفر إلى حفر في السيليكون.
ملاحظة: ومعدل حفر ومدة تحديد عمق البئر. دورة واحدة كاملة من عملية بوش (3 ثوان عملية الترسيب: 20 متور، 15 درجة مئوية، 140 سسم C 4 F 8 ، 10 W رف، و 1،750 W إيكب تليها عملية حفر 10 ثانية: 20 متور، 15 درجة مئوية ، 120 سسم سف 6 ، 8 W رف، و 1،750 W إيكب) يتوافق مع ما يقرب من 1 ميكرون من عمق حفر. وتتراوح الآبار المستخدمة في هذه المظاهرة من 3 - 3.5 ميكرون عميق. - الخامسوإزالة عمق حفر باستخدام بروفيلوميتري المادية.
- تحميل العينة إلى بروفيلوميتر المادية (انظر جدول المواد ).
- بدوره على فراغ العينة واضغط على زر تحميل اليدوي.
- ركز النظام على العينة عن طريق الضغط على زر "التركيز". ضع ميزة مناسبة للقياس على شاشة العرض.
- مسح العينة. مستوى الملف الشخصي وقياس عمق الميزة.
- تسجيل معدل حفر وتعديل مرات حفر لاحقة لتحقيق العمق المطلوب.
ملاحظة: وسوف تشمل القياسات عمق بئر السيليكون، سمك باريلين المودعة، وسمك مقاوم للضوء. التحقق من سمك كل طبقة في جميع أنحاء الإجراء هو ضروري لتحقيق عمق جيدا عمق.
- استخدام حفر البلازما الأكسجين لإزالة باريلين يتعرضعلى طول الطريق إلى الركيزة السيليكون.
2. ثقافة البكتيرية والبذر ( الشكل 1A )
- بدء المستعمرات على لوريا مرق (Lب) لوحات أجار من مخزون الجلسرين واستخدامها في غضون أسبوعين. اختيار مستعمرات سلالات المطلوب من لوحات أجار لب والبدء في الثقافات بين عشية وضحاها P. الزنجارية. احتضان الثقافات بين عشية وضحاها لحوالي 18 ساعة عند 37 درجة مئوية بينما يهز في 220 دورة في الدقيقة في وسط R2A.
ملاحظة: يجب اختيار المستعمرات في غضون أسبوعين من الطلاء لضمان الحفاظ على الطفرات وجينات مراسل الفلورسنت. وينبغي أن يتم كل عمل P. الزنجارية تحت ظروف بسل-2. - استخدام الكاتب الماس لقسم رقاقة السيليكون إلى رقائق الفردية التي تحتوي على مجموعات من أحجام مختلفة والمصفوفات الملعب جيدا. تأكد من أن كل شريحة تحتوي على مجموعة كاملة من أحجام البئر والملاعب للدراسة.
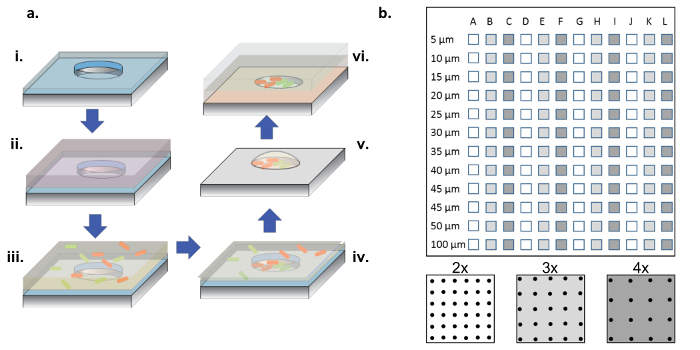
الشكل 1: التصنيع والبذر الخلية الإجراء. ( أ ) صفائف الميكرويل أإعادة محفورا في رقائق السيليكون المغلفة مع طبقة رقيقة من باريلين (ط). لترطيب الآبار و / أو فونكتيوناليز السطح، يتم إضافة محلول بروتين في قطرة على رأس المصفوفات (إي). تتم إزالة محلول البروتين، ويتم تجفيف الرقائق، ويضاف حل جديد يحتوي على البكتيريا المطلوبة (إي). تتم إزالة المحلول البكتيري بعد فترة الحضانة، ويسمح للرقائق أن تجف، وترك وراءها البكتيريا في الآبار وعلى السطح (إيف). تتم إزالة البكتيريا المرتبطة بالسطح مع رفع باريلين، وترك وراءها البكتيريا المصنفة بشكل نظيف في الميكرويلز ولا تزال قابلة للحياة بسبب 2٪ من الجلسرين، مما يساعد على إبقاء الآبار رطبة (v). ثم يتم وضع رقائق السيليكون صفيف الجانب أسفل على أغاروس الأغطية المغلفة الزجاج ساترة، الذي يغذي النمو البكتيري في ميكرويلز (السادس). ( ب ) تخطيط مصفوفات فرعية على جهاز سليكون واحد. وتحتوي كل صفيف فرعي على مجموعة من الآبار المتطابقة. قطر الميكرويلز في جميع الفرعية أمجموعة قطرها من 5-100 ميكرون ويتم تنظيمها في 2X، 3X، أو 4X الملعب قطرها جيدا، والتي يرمز إليها من الألوان البيضاء إلى الرمادي الداكن على التخطيطي لوحة السفلي. عندما تكون أعماق البئر ضحلة (أقل من 10 ميكرون)، نادرا ما تكون أقطار البئر 5 و 10 ميكرون مفيدة، بشكل عام بسبب نقص الخلايا التي تستعمر هذه الآبار الصغيرة جدا. في هذا العمل، تم تحليل فقط البيانات من الآبار مع 15-100 ميكرون أقطار. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
ملاحظة: كما هو مبين في الشكل 1B ، شريحة كاملة تحتوي على صفائف فرعية من الآبار، بأقطار تتراوح بين 5 إلى 100 ميكرون، مع ثلاثة الملاعب مختلفة ( أي 2X، 3X، و 4X قطر) تكرار 4 مرات.
- وضع قطرة 150 ميكرولتر من 500 ميكروغرام / مل البقري مصل الزلال (بسا) في برنامج تلفزيوني الحلعلى رأس المصفوفة لرطب ميكرويلز. احتضان حل بسا لمدة 1 ساعة على رقاقة في رت في غرفة رطبة.
- إنشاء غرفة عن طريق ملء الجزء السفلي من مربع غيض ماصة فارغة مع الفوسفات مخزنة المالحة (بس).
ملاحظة: مواد أخرى، مثل ليكتينس محددة، يمكن استخدامها بدلا من بسا إلى فونكتيوناليز سطح ميكرويلز.
- إنشاء غرفة عن طريق ملء الجزء السفلي من مربع غيض ماصة فارغة مع الفوسفات مخزنة المالحة (بس).
- في حين احتضان رقائق السيليكون مع حل بسا، الطرد المركزي الثقافات في 2500 دورة في الدقيقة (أي ما يعادل 950 زغ) لمدة 5 دقائق ثم ريسوسبيند لهم في 500 ميكرولتر من وسط R2A جديدة مع 2٪ الجلسرين.
- تحديد أود من الثقافة باستخدام مطياف الأشعة فوق البنفسجية فيس في 600 نانومتر. ضبطه إلى أود من 0.02 باستخدام 2٪ الجلسرين R2A المتوسطة.
ملاحظة: الجلسرين يساعد على منع الآبار من الجفاف خلال باريلين رفع قبالة.
- تحديد أود من الثقافة باستخدام مطياف الأشعة فوق البنفسجية فيس في 600 نانومتر. ضبطه إلى أود من 0.02 باستخدام 2٪ الجلسرين R2A المتوسطة.
- بعد الحضانة، وإزالة الحل بسا وشطف 3X مع برنامج تلفزيوني عن طريق إزالة واستبدال دروبل السائلر تغطي مجموعة ميكرويل السيليكون. جافة تحت النيتروجين.
- إضافة 150 ميكرولتر من 0.02 أود الثقافات لكل من صفيفات الجافة وضعت في غرفة رطبة. احتضان لمدة 1 ساعة في 4 درجات مئوية للسماح للبكتيريا على الانضمام إلى جدران جيدا.
ملاحظة: التبريد غير مطلوب للحضانة. ويمكن استخدام وقت الحضانة 4 درجات مئوية لمنع نمو البكتيريا قبل أن يبدأ التصوير بحيث يمكن للمرء أن تصور التنظيم المكاني للمجتمعات قبل النمو. ويمكن أيضا حضانة غرفة درجة الحرارة استخدامها. كلا البروتوكولين يؤدي إلى منحنيات نمو مماثلة.
3. المجهر انشاء المتابعة
- قبل بدء الحضانة البكتيرية على رقائق السيليكون، قم بتشغيل غرفة التحكم البيئي في الطور (انظر جدول المواد) وضبط الإعدادات على مربع التحكم بحيث الرطوبة (~ 100٪) ودرجة الحرارة (30-32 ° C، انظر الخطوة 3.2) يمكن أن تتوازن قبل إضافة العينات.
- مستوى صاحب العينة وخط في تيريور حول العينة مع بس -غارقة مناديل مختبر (انظر جدول المواد ) لزيادة الرطوبة في الغرفة إلى نقطة الندى. تعيين درجة حرارة الغرفة إلى 30 درجة مئوية، وغطاء الغرفة إلى 32 درجة مئوية للحد من التكثيف على الطائرة التصوير.
ملاحظة: حامل الشريحة يناسب في غرفة الخلية الحية مع طوقا التي هي حوالي 1 سم سميكة. يتم تسوية حامل العينة مع مساعدة من مستوى فقاعة التي يتم وضعها على رأس صاحب العينة. صاحب العينة يمكن إمالة قليلا وتبقى مختومة في طوقا إلى مستوى. - بينما الثقافات هي حضانة على رقائق السيليكون، وتحويل يدويا على مفتاح الطاقة لمصباح الزئبق لا يقل عن 30 دقيقة قبل التصوير. تشغيل يدويا على الكاميرا والمرحلة المجهر الآلي. افتح البرنامج المستخدم للسيطرة على المجهر والمعدات الطرفية والتأكد من أن المعدات معترف بها من قبل البرنامج.
ملاحظة: التكبير هو 10X مع نا = 0.3.
الطبقة = "jove_title"> 4. إعداد كوفرسليبس الزجاج المغلفة أغاروس
- الميكروويف أعدت سابقا حلول الاغاروز ( أي 2٪ الاغاروز في وسط R2A) حتى يتم التوصل إلى حالة سائلة، ما يقرب من 60 ثانية.
- الرطب الجزء الخلفي من 75 ملم × 22 ملم، # 1.5 ساترة الزجاج مع الإيثانول ووضعه طوليا، تتمحور، عبر شريحة زجاجية 2 × 3 "(50 × 75 ملم). وضع اثنين من الفواصل بدمس (سمك ~ 1 ملم) على طول الحواف الطويلة من ساترة وتحويل ساترة الزجاج بحيث ما يقرب من 1 ملم من ساترة هو المتدلية حافة الشريحة.
- صب 5 مل من محلول الاغاروز السائل على رأس ساترة الزجاج، فقط ما يكفي لتغطية تماما، ووضع الثانية 2 × 3 "الشريحة الزجاجية على رأس التجمع إلى" شطيرة "أجار السائل بين ساترة والشريحة.
ملاحظة: هذا يتحكم في عمق الاغاروز، مما يجعل سمك الكلي من ساترة وتصلب الاغاروز يساوي في سمك الفواصل بدمس. - السماح للشرائح الزجاج-- ساترة-- الاغاروز هلام-- شطيرة شريحة زجاجية لتعيين حتى الحل الاغاروز يبدأ في ترسيخ؛ ثم نقله إلى الثلاجة. بعد 15 دقيقة، وإزالة الاغاروز الصلبة الزائدة وقطع حول ساترة الزجاج. نقل هذا إلى طبق نظيفة ووضعه في الثلاجة حتى الاستخدام.
5. ختم الآبار مع كوفيرسليب المغلفة الاغار والتصوير
- بعد اكتمال فترة الحضانة البكتيريا، وإزالة ساترة الاغاروز المغلفة من الثلاجة وإعداد رقائق السيليكون، على النحو التالي.
- تراجع رقائق السيليكون في الماء عالى النقاء، واحدة في كل مرة، لمدة 10 ثانية لكل منهما. تعيينها على حوافهم على مسح مختبر أو الأنسجة حتى معظم السائل الزائد قد استنزفت من حواف رقائق.
- قطع قطعة من الشريط لتتناسب مع طول حافة كل رقاقة السيليكون. وضع الشريط على باريلين التي تغطي السيليكون واستخدامها لقشر بسرعة بعيدا طلاء باريلين.
- IMMEDعكس كل رقاقة مقشر ومكان كل رقاقة بحيث وجوه الجانب ميكرويل صفيف (ويجعل الاتصال مع) الجانب المغلفة الاغاروز من ساترة الاغاروز المغلفة. الحرص على عدم نقل أو التحول رقاقة بعد أن يمس الاغاروز لمنع نمو البكتيريا خارج الآبار.
- وضع مجموعة ميكرويل تجميعها / أغاروس ساترة في حامل الشريحة من غرفة التحكم البيئي المرحلة العليا على ميسكروسكوب.
- استخدام الضوء المحيط أو الضوء الموجه (على سبيل المثال، مصباح يدوي) لتحديد صفائف الفائدة. استخدام البرمجيات التجارية السيطرة على المرحلة الآلي لحفظ تلك المناصب (انظر جدول المواد). قم بإيقاف تشغيل الضوء المحيط أو الموجه بعد تخزين المواضع.
- في البرامج التجارية، وفتح لوحة "ند اقتناء".
ملاحظة: تتضمن هذه اللوحة قائمة لحفظ تلقائي لدليل معين، فضلا عن الحصول على صورة قابلة للبرمجة. لهذه التجارب، يتم استخدام القوائم "تايم" و "زي" و "λ". - لحفظ المواقع في البرنامج، انقر على "قائمة زي" ثم حدد مربع فارغ على الجانب الأيسر لكل موقف يحتاج إلى حفظه. أيضا، انقر على زر "تضمين Z".
- الحصول على الصور مع مرور الوقت في الموجات المطلوبة و 10 التكبير باستخدام مكعبات مرشح مضان المناسب (انظر جدول المواد).
- استخدم برنامج التحكم ومواقع الصفيف المحفوظة للانتقال إلى كل موقع محفوظ وللتركيز على الآبار. انقر على كل موقع زي في القائمة المحفوظة وضبط التركيز باستخدام البروتين الأخضر فلورزنس (غفب) مرشح. احفظ الموضع z الجديد بالنقر على السهم الذي يشير إلى z-لوكاتيون.
ملاحظة: هذه العملية يمكن أن تستغرق وقتا طويلا. النظر في اتخاذ الاحتياطات لزيادة الكسب واستخدام مرشح كثافة محايدة للحد من شدة الضوء لمنع فوتوبلاشينغ. - تحديد مسافة المحور z بين الطائرات البؤرية لكل طول موجة من خلال ملاحظة الفرق في موقف z- محور عندما تركز على سطح الصفيف. اختيار 2-3 مواقع من الصفيف مع السكان مختلطة الأحمر / الأخضر البكتيريا والتركيز باستخدام فلتر أحمر مضان البروتين (رفب).
- طرح المسافة بين الطائرات البؤرية باستخدام مرشحات مضان غفب و رفب وإضافة أن تعديل مستوى التنسيق تحت قائمة "λ".
ملاحظة: على سبيل المثال، إذا ظهرت المصفوفة مركزة في قناة غفب عند z-لوكاتيون قدرها 50 ميكرون، وتظهر نفس المصفوفة مركزة في قناة رفب عند 55 ميكرون، تضاف +5 بجوار التكوين البصري رفب في "λ " قائمة طعام.
- طرح المسافة بين الطائرات البؤرية باستخدام مرشحات مضان غفب و رفب وإضافة أن تعديل مستوى التنسيق تحت قائمة "λ".
- بدء اكتساب صورة الفاصل الزمني.
ملاحظة: بالنسبة للتجارب المعروضة هنا، تم الحصول على رفب و غفب الصور لكل موقف صفيف في فترات 30 دقيقة باستخدام الحصول على صورة متعددة الأبعاد من خلال البرامج التجارية التي تسيطرالكاميرا، مصراع، عجلة التصفية، ومرحلة الآلية.- تعيين "الفاصلة" إلى 30 دقيقة و "مدة التجربة" إلى 24 ساعة تحت القائمة "الوقت". انقر على "تشغيل الآن".
ملاحظة: مع "تايم"، "زي"، و "λ" مربعات فحص، تشغيل البرنامج سوف تتحرك المرحلة لصورة كل موقع ( أي مواقع شيز المحفوظة)، التقاط صورة في طول موجة واحدة، نقل z- موقف ( مثل لامدا أو التحكم في الطول الموجي)، أخذ الصورة الثانية، والانتقال إلى موقع صفيف المقبل (متعددة)، وحلقة هذا على فترات 30 دقيقة (الوقت الفاصل بين).
- تعيين "الفاصلة" إلى 30 دقيقة و "مدة التجربة" إلى 24 ساعة تحت القائمة "الوقت". انقر على "تشغيل الآن".
- استخدم برنامج التحكم ومواقع الصفيف المحفوظة للانتقال إلى كل موقع محفوظ وللتركيز على الآبار. انقر على كل موقع زي في القائمة المحفوظة وضبط التركيز باستخدام البروتين الأخضر فلورزنس (غفب) مرشح. احفظ الموضع z الجديد بالنقر على السهم الذي يشير إلى z-لوكاتيون.
- الحصول على الإضاءة السيطرة الصور.
ملاحظة: استخدام القوائم "ند اقتناء"، "الوقت" و "زي" لالتقاط صور من 4 مواقع، 25X لكل منهما.- خذ سلسلة من الصور 100 "مظلمة" عن طريق إيقاف جميع مصادر الضوء وأخذ"صورة" من الشريحة القياسية. هذه الصور سوف التقاط الضوضاء الكاميرا. استخدام أطول وقت التعرض المستخدمة خلال تيميلابس (الخطوة 5.3.3).
- اتخاذ سلسلة من 100 "حقل الإضاءة" الصور عن طريق تصوير شريحة القياسية ( أي رفب موحدة أو كثافة غفب) في عدد قليل من المواقع المختلفة لالتقاط الإضاءة غير المتكافئة في ظروف تجريبية معينة. اختيار وقت التعرض الذي يزيد من إشارة دون الوصول إلى التشبع.
6 - التحليل
- معالجة مداخن الصورة باستخدام برنامج تحليل الصور (على سبيل المثال، إيماجيج).
- تحويل الصور المكتسبة إلى تنسيق ملف تيف باستخدام البرامج التجارية. حمل الصور في برنامج تحليل الصور من خلال النقر على "ملف"> "استيراد"> "تسلسل صورة".
- إنشاء "صورة التصحيح" عن طريق المتوسط في جميع "الميدان المظلم" و "حقل الإضاءة" الصور. Subtract متوسط "داركفيلد" صورة من متوسط "إضاءة الحقل" صورة عن طريق اختيار "عملية"> "صورة حاسبة". حدد الصورتين، "Image1" و "Image2"، ثم "طرح" في الحقل "عملية". انقر فوق موافق."
- لتحديد المتوسط، قم بتحميل الصور التصحيحية (أو الصور المظلمة)، انقر فوق "إيماج"> "ستاكس"> "Z بروجيكت"> "متوسط العرض".
- أداء تسجيل صورة إذا لزم الأمر. ثم، إجراء الطرح الخلفية عن طريق النقر على "عملية"> "طرح الخلفية". أدخل نصف القطر (على سبيل المثال، 125) في حقل "نصف القطر" وحدد "بارابولويد انزلاق".
- إجراء تصحيح الإضاءة باستخدام "عملية"> "حاسبة زائد". اختيار المعلمات التالية: العملية، تقسيم؛ i1، صورة جيدا؛ i2، تصحيح الصورة؛ k1، تصحيح الصورة يعني؛ و k2، 0. انقر فوق "كريأكل نافذة جديدة. "
ملاحظة: هذه المجموعة من البيانات لم تتطلب التسجيل، ولكن في أعمال أخرى، تم استخدام إيماجيج المساعد ستاكريغ مع التحول "الترجمة". للحصول على الطرح الخلفية، واستخدام نفس انزلاق دائرة نصف قطرها بارابولويد لكل مجموعة صورة. على سبيل المثال، إذا كان أكبر الآبار تصويرها دائرة نصف قطرها بكسل من 100، واستخدام دائرة نصف قطرها أكبر من 100 (على سبيل المثال، 125) لكل مجموعة صورة.
- تحديد نمو كل سلالة في ميكرويلز.
- حدد مناطق الاهتمام (روي) حول كل ميكرويل في المصفوفات المطلوبة باستخدام إيماجيج "ميكرواراي" البرنامج المساعد.
- في القائمة "ماب"، انقر فوق "إعادة تعيين الشبكة". حدد الصفوف والأعمدة والقطر (استنادا إلى حجم البئر والعدد على الصفيف؛ انظر الشكل 1 ب ). حدد "دائرة" من قائمة "شكل عائد الاستثمار".
- اضغط مع الاستمرار على مفتاح "ألت" أثناء تحديد عائد الاستثمار أعلى اليسار مع الماوس لتحريك tوقال انه عائد الاستثمار. اضغط على المفتاح "شيفت" أثناء تحديد عائد الاستثمار السفلي الأيسر لتغيير حجم المصفوفة. اضغط على المفتاح "شيفت" أثناء تحديد عائد استثمار من الجانب الأيمن من المصفوفة، ولكن ليس عند الزوايا، لتغيير تباعد عائد الاستثمار.
- استخدم الأوامر أعلاه لتناسب صفيف عائد الاستثمار على الآبار في الصورة. انقر على "قياس رت".
ملاحظة: فإن البرنامج المساعد تصدير القياسات المطلوبة من كل عائد الاستثمار. استخدام ثلاثة أحجام روي، وخلق حلقات متحدة المركز حول الآبار لجمع المحلية إشارة الخلفية ( أي إشارة من الحلقة الوسطى تطرح من الحلقة الخارجية) وقياسات مضان ( أي إشارة من الحلقة الداخلية).
- جمع البيانات في برنامج جداول البيانات وحساب إشارة الخلفية. استيراده إلى برنامج البرمجة المخصصة لمزيد من التحليل.
- حدد مناطق الاهتمام (روي) حول كل ميكرويل في المصفوفات المطلوبة باستخدام إيماجيج "ميكرواراي" البرنامج المساعد.
- تنظيم البيانات وتحليلها
- استيراد البيانات وتنظيم البياناتالتي تم جمعها في إيماجيج في مصفوفة في الترتيب التالي لجميع الأوقات: العمود 1، عدد صفيف الفرعي. العمود 2، صف جيد؛ العمود 3، عمود جيدا؛ العمود 4، يعني كثافة. العمود 5، كثافة الخلفية؛ والعمود 6، يعني شدة - كثافة الخلفية.
- فصل نتائج الاستحواذ مشيري و غفب في المصفوفات المختلفة. تخزين النتائج من كل صفيف فرعي وكل لون في خلية مختلفة في صفيف خلية.
ملاحظة: هذه المنظمة يجعل من الأسهل للانتقال ذهابا وإيابا بين بيانات الصورة ونتائج القياس، وتنظيف البيانات وضمان أن القياسات تمثل بدقة البيانات.
- فصل نتائج الاستحواذ مشيري و غفب في المصفوفات المختلفة. تخزين النتائج من كل صفيف فرعي وكل لون في خلية مختلفة في صفيف خلية.
- ضبط ل أوتوفلورزنس من P. الزنجارية .
ملاحظة: في التجارب التي تنطوي على ثقافة مشتركة من غفب وسلالات مشيري، ينبغي تحليل رقاقة مشيري فقط للتأكد من العلاقة بين مشيري والأخضر تألق ذاتي.- مؤامرة إشارة مشيري مقابل غفب من جميع مشيري ΔretS &# 916؛ تسي / i1-6 الآبار في جميع نقاط الوقت لتحديد العلاقة بين إشارة مشيري والتألق الذاتي في قناة غفب. طرح إشارة تألق ذاتي من شارك في الثقافات.
- رسم المسارات وتناسب معادلة لوجستية معدلة لكل مسار لاستخراج المعلمات باستخدام المربعات الصغرى المناسب في أي برنامج جداول البيانات أو برامج البرمجة المخصصة.
- ابحث عن الارتباطات بين وبين غفب ومشي مسارات المسار.
- استيراد البيانات وتنظيم البياناتالتي تم جمعها في إيماجيج في مصفوفة في الترتيب التالي لجميع الأوقات: العمود 1، عدد صفيف الفرعي. العمود 2، صف جيد؛ العمود 3، عمود جيدا؛ العمود 4، يعني كثافة. العمود 5، كثافة الخلفية؛ والعمود 6، يعني شدة - كثافة الخلفية.
النتائج
تم تصميم منصة التجريبية المقدمة هنا لدراسات عالية الإنتاجية والدراسات عالية المحتوى من المجتمعات البكتيرية. تصميم يتيح الآلاف من المجتمعات المحلية، وتنمو في الآبار من مختلف الأحجام، ليتم تحليلها في وقت واحد. مع هذا التصميم مجموعة ميكرويل، والاعت?...
Discussion
قدمت هذه المادة جهاز صفيف ميكرويل والبروتوكولات التجريبية المصممة لتمكين الإنتاجية العالية والمحتوى عالي الخلية القائمة على التصوير التصوير القائم على تحليل التنمية المجتمعية البكتيرية. في حين أن تركيز المظاهرة هنا كان لدراسة آثار إفراز النوع السادس بوساطة الاتص...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
تم تصنيع صفائف ميكرويل وتتميز في مركز علوم المواد النانوية قسم المرافق المستخدم، مكتب علوم الطاقة الأساسية، وزارة الطاقة الأمريكية. وقدم الدعم المالي لهذا العمل من خلال صندوق البحوث والتنمية التابع لمدير مختبر أوك ريدج الوطني. ويود المؤلفون أيضا أن يشكروا مختبر J. مغوس (جامعة واشنطن، سياتل، وا) لتوريد سلالات P. أيروجينوسا المستخدمة في هذه الدراسات.
Materials
| Name | Company | Catalog Number | Comments |
| Parylene N | Specialty Coating Systems | CAS NO.:1633-22-3 | |
| Parylene coater | Specialty Coating Systems | Labcoter 2 Parylene Deposition Unit PDS2010 | |
| Silicon Wafer | WRS Materials | 100mm diameter, 500-550μm thickness, Prime, 10-20 resistivity, N/Phos<100>, | |
| adhesion promoter | Shin-Etsu Microsci | MicroPrime P20 adhesion promoter | |
| postive tone photoresist | Rohm and Haas Electronics Materials LLC (Owned by Dow) | Microposit S1818 Positive Photoresist (code 10018357) | |
| Quintel Contact Aligner | Neutronix Quintel Corp | NXQ 7500 Mask Aligner | |
| Reactive Ion Etching Tool | Oxford Instruments | Plasmalab System 100 Reactive Ion Etcher | |
| R2A Broth | TEKnova | R0005 | |
| Bovine Serum Albumin | Sigma | A9647 | |
| Multimode Plate Reader | Perkin Elmer | Enspire, 2300-0000 | |
| Fluorescent Microscope | Nikon | Eclipse Ti-U | |
| Automated Stage | Prior | ProScan III | |
| CCD camera | Nikon | DS-QiMc | |
| Stage-top environmental control chamber | In Vivo Scientific | STEV ECU-HOC | |
| Phosphate Buffered Saline | ThermoFisher Scientific | 14190144 | |
| UltraPure Agarose | ThermoFisher Scientific | 16500500 | |
| 25 x 75 mm No. 1.5 coverslip | Nexterion | High performance #1.5H coverslips | |
| Fluorescence Reference Slides | Ted Pella | 2273 | |
| Physical Stylus Profilometer | KLA Tencor | P-6 | |
| lab wipes | Kimberly Clark | Kimipe KIMTECH SCIENCE Brand, 34155 | |
| commercial software | Nikon | NIS Elements | |
| Zeiss 710 Confocal Microscope | Zeiss | ||
| filter cubes | Nikon | Nikon FITC (96311), Nikon Texas Red(96313) |
References
- Zhou, J., Deng, Y., et al. Stochasticity, succession, and environmental perturbations in a fluidic ecosystem. Proc Natl Acad Sci. 111, E836-E845 (2014).
- Valm, A. M., Welch, J. L. M., et al. Systems-level analysis of microbial community organization through combinatorial labeling and spectral imaging. Proc Natl Acad Sci USA. 108 (10), 4152-4157 (2011).
- Satoh, H., Miura, Y., Tsushima, I., Okabe, S. Layered structure of bacterial and archaeal communities and their in situ activities in anaerobic granules. Appl Environ Microbiol. 73 (22), 7300-7307 (2007).
- Kim, H. J., Boedicker, J. Q., Choi, J. W., Ismagilov, R. F. Defined spatial structure stabilizes a synthetic multispecies bacterial community. Proc Natl Acad Sci USA. 105 (47), 18188-18193 (2008).
- Nunan, N., Wu, K., Young, I. M., Crawford, J. W., Ritz, K. Spatial distribution of bacterial communities and their relationships with the micro-architecture of soil. FEMS Microbiol Ecol. 44, 203-215 (2003).
- Grundmann, G. L. Spatial scales of soil bacterial diversity - The size of a clone. FEMS Microbiol Ecol. 48, 119-127 (2004).
- Langenheder, S., Lindstrom, E. S., Tranvik, L. J. Structure and Function of Bacterial Communities Emerging from Different Sources under Identical Conditions. Appl Environ Microbiol. 72 (1), 212-220 (2006).
- Camp, J. G., Kanther, M., Semova, I., Rawls, J. F. Patterns and Scales in Gastrointestinal Microbial Ecology. Gastroenterology. 136 (6), 1989-2002 (2009).
- Renner, L. D., Weibel, D. B. Physicochemical regulation of biofilm formation. MRS Bull. 36 (5), 347-355 (2011).
- Wessel, A. K., Hmelo, L., Parsek, M. R., Whiteley, M. Going local: technologies for exploring bacterial microenvironments. Nat Rev Microbiol. 11 (5), 337-348 (2013).
- Stacy, A., McNally, L., Darch, S. E., Brown, S. P., Whiteley, M. The biogeography of polymicrobial infection. Nat Rev Microbiol. 14 (2), 93-105 (2015).
- Hansen, R. R., Shubert, K. R., Morrell-Falvey, J. L., Lokitz, B. S., Doktycz, M. J., Retterer, S. T. Microstructured block copolymer surfaces for control of microbe adhesion and aggregation. Biosensors. 4 (1), 63-75 (2014).
- Hansen, R. R., Hinestrosa, J. P., et al. Lectin-functionalized poly(glycidyl methacrylate)- block -poly(vinyldimethyl azlactone) surface scaffolds for high avidity microbial capture. Biomacromolecules. 14 (10), 3742-3748 (2013).
- Timm, C. M., Hansen, R. R., Doktycz, M. J., Retterer, S. T., Pelletier, D. A. Microstencils to generate defined, multi-species patterns of bacteria. Biomicrofluidics. 9 (6), (2015).
- Keymer, J. E., Galajda, P., Muldoon, C., Park, S., Austin, R. H. Bacterial metapopulations in nanofabricated landscapes. Proc Natl Acad Sci USA. 103 (46), 17290-17295 (2006).
- Zhang, Q., Lambert, G., et al. Acceleration of Emergence of Bacterial Antibiotic Resistance in Connected Microenvironments. Science. 333 (6050), 1764-1767 (2011).
- Friedlander, R. S., Vlamakis, H., Kim, P., Khan, M., Kolter, R., Aizenberg, J. Bacterial flagella explore microscale hummocks and hollows to increase adhesion. Proc Natl Acad Sci USA. 110 (14), 5624-5629 (2013).
- Zhou, J., Liu, W., et al. Stochastic Assembly Leads to Alternative Communities with Distinct Functions in a Bioreactor Microbial Community. MBio. 4 (2), 1-8 (2013).
- van Vliet, S., Hol, F. J., Weenink, T., Galajda, P., Keymer, J. E. The effects of chemical interactions and culture history on the colonization of structured habitats by competing bacterial populations. BMC Microbiol. 14 (1), 116 (2014).
- Niepa, T. H. R., Hou, L., et al. Microbial Nanoculture as an Artificial Microniche. Sci Rep. 6, 30578 (2016).
- Hansen, R. H., Timm, A. C., et al. Stochastic Assembly of Bacteria in Microwell Arrays Reveals the Importance of Confinement in Community Development. PLoS ONE. 11 (5), e0155080 (2016).
- Hood, R. D., Singh, P., et al. A Type VI Secretion System of Pseudomonas aeruginosa Targets a Toxin to Bacteria. Cell Host Microbe. 7 (1), 25-37 (2010).
- LeRoux, M., Ja De Leon, ., et al. Quantitative single-cell characterization of bacterial interactions reveals type VI secretion is a double-edged sword. Proc Natl Acad Sci. 109 (48), 19804-19809 (2012).
- Whitney, J. C., Beck, C. M., et al. Genetically distinct pathways guide effector export through the type VI secretion system. Mol Microbiol. 92 (3), 529-542 (2014).
- Warrick, J. W., Timm, A., Swick, A., Yin, J. Tools for Single-Cell Kinetic Analysis of Virus-Host Interactions. PLoS ONE. 11 (1), e0145081 (2016).
- Zwietering, M. H., Jongenburger, I., Rombouts, F. M., Van't Riet, K. Modeling of the Bacterial Growth Curve. Appl Environ Microbiol. 56 (6), 1875-1881 (1990).
- Halsted, M., Wilmoth, J. L., et al. Development of transparent microwell arrays for optical monitoring and dissection of microbial communities. J Vac Sci Technol B Nanotechnol Microelectron. 34 (6), 06KI03 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved