È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un saggio di taglio uniforme per piastrine umane e recettori superficiali delle cellule tramite viscometria conica
In questo articolo
Riepilogo
Descriviamo un metodo in-Solution per applicare un taglio uniforme ai recettori della superficie piastrinica utilizzando la viscometria a piastra conica. Questo metodo può anche essere utilizzato in modo più ampio per applicare il taglio ad altri tipi di cellule e frammenti di cellule e non è necessario indirizzare una coppia specifica del recettore ligare.
Abstract
Molte cellule/tessuti biologici percepiscono le proprietà meccaniche dei loro ambienti locali tramite meccanorecettori, proteine che possono rispondere alle forze come la pressione o le perturbazioni meccaniche. I meccanorecettori rilevano i loro stimoli e trasmettono segnali attraverso una grande varietà di meccanismi. Alcuni dei ruoli più comuni per i meccanorecettori sono nelle risposte neuronali, come il tatto e il dolore, o le cellule dei capelli che funzionano in equilibrio e udito. La meccanosensazione è anche importante per i tipi di cellule che sono regolarmente esposti a stress da taglio come le cellule endoteliali, che linea vasi sanguigni, o cellule del sangue che sperimentano il taglio in circolazione normale. I viscosimetri sono dispositivi che rilevano la viscosità dei fluidi. I viscosimetri rotazionali possono essere utilizzati anche per applicare una forza di taglio nota ai fluidi. La capacità di questi strumenti di introdurre un taglio uniforme ai fluidi è stata sfruttata per studiare molti fluidi biologici, tra cui sangue e plasma. La viscometria può anche essere utilizzata per applicare il taglio alle cellule in una soluzione e per testare gli effetti del taglio su specifiche coppie del recettore del Ligano. Qui, usiamo la viscometria cono-piastra per testare gli effetti dei livelli endogeni di stress da taglio sulle piastrine trattate con anticorpi contro il complesso recettore meccanosensoriale piastrinica GPIb-IX.
Introduzione
I meccanorecettori sono proteine che rispondono agli stimoli meccanici, come la pressione o la perturbazione meccanica/deformazione. Per alcuni meccanorecettori, il rilevamento di queste perturbazioni meccaniche è esplicito alla funzione dei tipi di cellule in cui sono espressi. Prendete, per esempio, i recettori elasticizzati nei neuroni barorecettori; questi canali ionici meccanosensibili regolano la pressione sanguigna rilevando il "tratto" vascolare1,2. Nell'orecchio interno, i canali ionici sulle cellule dei capelli rilevano deformazioni meccaniche causate da onde sonore3e i meccanorecettori a soglia bassa cutanea (ltmrs) facilitano la trasmissione delle informazioni tattili4. In altri casi, i meccanorecettori forniscono informazioni importanti alla cellula per la creazione di adesione o crescita. Le cellule possono percepire la rigidità del loro ambiente locale e possono contare su forze contrattili tramite il citoscheletro e le integrine actina per dettare la crescita o la diffusione di5,6.
Studiando le interazioni recettore-ligando in modelli cellulari o basati su tessuti, esistono saggi comuni che possono segnalare in modo rapido e accurato gli effetti dell'alterazione della temperatura, del pH, della concentrazione di ligando, della tonicità, del potenziale di membrana e di molti altri parametri che possono variare in vivo. Tuttavia, questi stessi saggi possono cadere in breve quando si tratta di rilevare il contributo della forza meccanica all'attivazione del recettore. Se le cellule stanno rilevando il loro microambiente, rilevando onde sonore o rispondendo a stiramento, una cosa che i suddetti meccanorecettori hanno in comune è che partecipano a interazioni in cui il ligando, recettore, o entrambi, sono ancorati a un superficie. I saggi sviluppati per testare gli effetti delle forze meccaniche sulle interazioni dei recettori spesso riflettono questo paradigma. Microfluidica e camere di flusso sono utilizzati per studiare gli effetti del flusso di taglio su cellule e recettori7,8. Questi tipi di esperimenti hanno il vantaggio di consentire la messa a punto dei tassi di taglio tramite velocità di flusso consolidate. Altre tecniche impiegano sonde molecolari fluorescenti per rilevare le forze applicate dalle cellule su superfici ricche di ligando, ottenendo una lettura accurata della grandezza e degli orientamenti delle forze coinvolte nell'interazione9,10.
Oltre alla meccanosensazione che si verifica quando uno o entrambi i partner sono ancorati ad una superficie, lo stress da taglio può influenzare le proteine e le cellule in soluzione. Questo è spesso osservato nelle cellule del sangue/proteine che sono costantemente in circolazione, e può manifestarsi tramite l'attivazione di meccanorecettori che sono normalmente ancorati in superficie11, o attraverso l'esposizione di sequenze bersaglio che sarebbero occlusi sotto condizioni statiche12. Tuttavia, relativamente meno tecniche di saggio gli effetti della forza di taglio sulle particelle in soluzione. Alcuni approcci in-Solution introducono il taglio attraverso le cellule Vortex in sospensione fluida con velocità e durate variabili, anche se questi approcci potrebbero non consentire una determinazione molto precisa della sollecitazione di taglio generata. I viscosimetri rotazionali misurano la viscosità applicando una forza di taglio specifica ai fluidi. Qui descriviamo un metodo applicato per determinare l'effetto di specifiche velocità di taglio laminare su cellule o frammenti di cellule in soluzione.
Una delle proteine più altamente espresse sulla superficie piastrinica è il complesso di glicoproteina (GP) IB-IX. GPIb-IX è il recettore primario per la proteina plasmatica von Willebrand Factor (VWF). Insieme, questa coppia recettore-ligante è stata a lungo riconosciuta come il fondamento della risposta piastrinica alla sollecitazione di taglio13. In caso di danno vascolare, il VWF si lega al collagene esposto nella matrice sub-endoteliale14, reclutando così le piastrine nel sito di lesione tramite l'interazione VWF-GPIb-IX. Il coinvolgimento del VWF nel suo sito di legame nella subunità GPIbα se GPIb-IX sotto stress di taglio fisiologico induce lo svolgimento di un dominio meccanosensoriale prossimale (MSD) a membrana, che a sua volta attiva GPIb-IX15. In uno studio recente, abbiamo dimostrato che gli anticorpi contro il GPIbα, come quelli generati in molti pazienti affetti da trombocitopenia immunitaria (ITP), sono anche in grado di indurre la segnalazione piastrinica tramite MSD che si sta svolgendo sotto sforzo di taglio11. Tuttavia, a differenza di VWF, che facilita l'attivazione di GPIb-IX indotta da taglio immobilizzando il complesso in normali condizioni di circolazione, gli anticorpi bivalenti sono in grado di Crosslink piastrine tramite GPIb-IX e dispiegano la MSD in circolazione. In questo modo, un meccanorecettore che viene normalmente attivato dall'immobilizzazione superficiale sotto il taglio può essere attivato in soluzione. Nella presente relazione, dimostreremo come è stato sfruttato un saggio di taglio uniforme basato su un viscosimetro per rilevare gli effetti di specifici livelli di stress da taglio sull'attivazione del recettore in soluzione.
Protocollo
Tutti i metodi che utilizzano le piastrine umane derivate dal donatore qui descritte sono stati approvati dal comitato di revisione istituzionale della Emory University/Children ' s Healthcare di Atlanta.
1. prelievo di sangue e isolamento piastrinico
- Attirare il sangue umano dal consenso dei donatori adulti sani attraverso la venipuntura il giorno dell'esperimento in 3,8% citrato trisodico. Un 4,5 mL di tubo di sangue è sufficiente a produrre abbastanza plasma ricco di piastrine (PRP) per 20-25 condizioni in donatori la cui conta piastrinica è vicina a 250 x 103 per μl.
Nota: evitare di trafilare il sangue tramite aghi a scartamento ridotto (inferiori a 21 G). - Preparare PRP tramite centrifugazione a 22 ° c e 140 x g per 12 min con un freno lungo. Questo si tradurrà in due strati distinti, con globuli rossi nella parte inferiore e la luce di colore PRP in alto.
- Isolare lo strato superiore, nuvoloso e giallo del PRP tramite un accurato pipettaggio attraverso una punta della pipetta tagliata ad un angolo di 45 ° e ottenere la conta piastrinica attraverso un conteggio ematico completo (CBC).
- Se necessario, lavare le piastrine in soluzione salina tamponata a tubi (150 mM NaCl, 20 mM PIPES) in presenza di prostaglandina E1 (PGE1) e risospendere nel buffer di Tyrode (134 mM NaCl, 0,34 mM na2HPO4, 2,9 mm KCl, 1 mM MgCl2,5mm glucosio, 12 mm NaHCO 3, 20 mm HEPES, pH 7,35) con glucosio 5 mm, altrimenti, procedere al passo 1,5. I seguenti passaggi descrivono il lavaggio in breve.
- Regolare il volume PRP a 10 mL con soluzione salina tamponata a tubo e aggiungere 0,6 μM PGE1.
- Centrifugare per 8 min a 1.900 x g, poi scartare surnatante e lasciare che il pellet piastrinico si sieda in 400 μl di soluzione di Tyrode e glucosio per 5 min.
- Risospendere delicatamente il pellet piastrinico e tenerlo indisturbato per 30 min.
- Regolare la conta piastrinica a ~ 250 x 103 piastrine per μl con plasma umano in pool (PPP) povero di piastrine e mantenere la sospensione a 22 ° c indisturbata o sotto rotazione delicata.
2. legatura e trattamento di taglio uniforme
Nota: tutte le fasi della sezione 2 che richiedono il pipettaggio devono essere eseguite lentamente, in modo da non introdurre alcun taglio.
- Aggiungete l'anticorpo o il ligando desiderati al PRP o alle piastrine lavate e mescolate delicatamente con il pipettaggio su e giù o mescolandosi con una punta della pipetta. Lasciarlo indisturbato a temperatura ambiente per 5-10 min. aggiungere un volume equivalente di PPP o buffer di Tyrode a un controllo negativo.
- Accendere il viscosimetro della piastra conica, impostare la temperatura della piastra a 22 ° c e lasciare che il piatto raggiunga questa temperatura.
- Pipettare il PRP trattato o le piastrine lavate sul viscosimetro a piastra conica a temperatura controllata direttamente al centro della piastra. Assicurarsi che tutto il campione sia depositato tra il cono e la piastra nel punto di contatto e non all'esterno del cerchio del cono.
- Taglio ad una velocità e durata appropriate.
- Calcolare il taglio come indicato dal manuale del viscosimetro, o come mostrato in precedenza15,16.
- Determinare la velocità di taglio da viscosità e sollecitazione di taglio desiderata tramite la legge di Newton di viscosità;
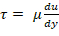 ; la viscosità plasmatica è 1,5-1,6 centipoise (cP)17. Ad esempio, un intervallo di taglio normale per la circolazione umana è 5-30 dyn/cm2 e il taglio deve essere applicato sulla scala temporale a singola cifra.
; la viscosità plasmatica è 1,5-1,6 centipoise (cP)17. Ad esempio, un intervallo di taglio normale per la circolazione umana è 5-30 dyn/cm2 e il taglio deve essere applicato sulla scala temporale a singola cifra.
- Sollevare il cono dalla leggermente piastra (~ 2 mm) in modo che il campione rimanga a contatto sia con la piastra e cono, e utilizzare un gel-caricamento o altra punta di pipetta lunga per raccogliere 5-10 μl dal centro del volume del campione.
- Incubare i campioni tagliati con i marcatori desiderati per 20 minuti a temperatura ambiente. Per i marcatori di fosfatidilserina, β-galattosio, e P-selectin esposizione uso Lattaderin C2 dominio (LactC2) a 0,08 μM18, Erythrina cristagalli lectina (ECL) a 6,25 μg/ml, e anti-p-selectin anticorpo (20 μg/ml), rispettivamente.
- Fissare i campioni in 2% paraformaldeide per 20 minuti a RT prima della diluizione o della conservazione a freddo, e procedere al passo 3,1 o conservare i campioni a 4 ° c per non più di 12 h.
3. rilevamento di marcatori di superficie e reticolazione tramite citometria a flusso
- Analizzare il campione tramite citometria a flusso, raccogliendo almeno 20.000 eventi per ogni condizione.
- Quantitare la potenza del segnale dei marcatori fluorescenti utilizzando il valore di altezza per l'intensità di ogni fluoroforo, o l'intensità di fluorescenza media geometrica (MFI).
- Se si mira a rilevare il reticolazione piastrinica dopo il trattamento di taglio, analizzare il campione su un citometro a flusso capace di imaging e quantificare il reticolato per parametri di area e proporzioni.
- Tracciare un istogramma di area e/o proporzioni.
- Utilizzare un controllo negativo con albumina sierica bovina (BSA) o veicolo per disegnare un cancello escludendo gli eventi più completamente circolari (questo cancello è di solito disegnato ad un rapporto di aspetto ~ 0,819,20) e quantitare la percentuale di eventi all'interno di questo cancello. Gli eventi con proporzioni più basse hanno maggiori probabilità di essere reticolati.
Risultati
La Figura 1 illustra come il modello di trigger dell'attivazione di GPIb-IX, inizialmente introdotto per spiegare l'attivazione del recettore dipendente dal taglio quando ancorato alla parete del vaso, può anche supportare l'attivazione di piastrine incrociate da un ligando multivalente. La Figura 2 Mostra letture dell'attivazione piastrinica umana trattate da due anticorpi che si rivolgono al dominio N-terminale di GPIB-IX (6B4 e 11A8) e un anticorpo di contro...
Discussione
Il protocollo descritto in questo manoscritto consente una valutazione rapida e versatile dell'effetto della cesoia laminare sui recettori della superficie piastrinica e cellulare. I risultati rappresentativi specifici presentati qui sottolineano come gli effetti dei ligandi multimerica o bivalenti possono essere influenzati dal flusso di taglio. Oltre a questa applicazione, un saggio di taglio uniforme ha ampie applicazioni nell'osservare gli effetti di taglio-dipendente. In assenza di una coppia di recettori ligando co...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
I lavori pertinenti a questo studio sono stati sostenuti in parte dagli istituti nazionali di sanità (NIH) National Heart, Lung e Blood Institute, che concede HL082808, HL123984 (R.L.) e F31HL134241 (M.E.Q.). Finanziamento fornito anche da NIH National Institute of General Medical Sciences Grant T32GM008367 (M.E.Q.); e i fondi di sovvenzione pilota da Children ' s Healthcare di Atlanta e Emory University Pediatric Flow citometria nucleo. Gli autori vorrebbero ringraziare il dottor Hans Deckmyn per aver condiviso l'anticorpo 6B4, e il nucleo di citometria a flusso del centro di ricerca pediatrica Emory Children ' s per il supporto tecnico.
Materiali
| Name | Company | Catalog Number | Comments |
| APC anti-human CD62P (P-Selectin) | BioLegend | 304910 | |
| Brookfield Cap 2000+ Viscometer | Brookfield | - | |
| FITC-conjugated Erythrina cristagalli lectin (ECL) | Vector Labs | FL-1141 | |
| Pooled Normal Human Plasma | Precision Biologic | CCN-10 | |
| Vacutainer Light Blue Blood Collection Tube (Sodium Citrate) | BD | 369714 | |
| Vacutainer Blood Collection Set, 21G x ¾" Needle | BD | 367287 |
Riferimenti
- Sullivan, M. J., et al. Non-voltage-gated Ca2+ influx through mechanosensitive ion channels in aortic baroreceptor neurons. Circulation Research. 80 (6), 861-867 (1997).
- Lansman, J. B., Hallam, T. J., Rink, T. J. Single stretch-activated ion channels in vascular endothelial cells as mechanotransducers. Nature. 325 (6107), 811-813 (1987).
- Fettiplace, R. Hair Cell Transduction, Tuning, and Synaptic Transmission in the Mammalian Cochlea. Comprehensive Physiology. 7 (4), 1197-1227 (2017).
- Zimmerman, A., Bai, L., Ginty, D. D. The gentle touch receptors of mammalian skin. Science. 346 (6212), 950-954 (2014).
- Nelson, C. M., et al. Emergent patterns of growth controlled by multicellular form and mechanics. Proceedings of the National Academy of Sciences USA. 102 (33), 11594-11599 (2005).
- Yu, C. H., Law, J. B., Suryana, M., Low, H. Y., Sheetz, M. P. Early integrin binding to Arg-Gly-Asp peptide activates actin polymerization and contractile movement that stimulates outward translocation. Proceedings of the National Academy of Sciences USA. 108 (51), 20585-20590 (2011).
- Wen, L., et al. A shear-dependent NO-cGMP-cGKI cascade in platelets acts as an auto-regulatory brake of thrombosis. Nature Communications. 9 (1), 4301 (2018).
- Marki, A., Gutierrez, E., Mikulski, Z., Groisman, A., Ley, K. Microfluidics-based side view flow chamber reveals tether-to-sling transition in rolling neutrophils. Scientific Reports. 6, 28870 (2016).
- Brockman, J. M., et al. Mapping the 3D orientation of piconewton integrin traction forces. Nature Methods. 15 (2), 115-118 (2018).
- Wang, X., et al. Constructing modular and universal single molecule tension sensor using protein G to study mechano-sensitive receptors. Scientific Reports. 6, 21584 (2016).
- Quach, M. E., et al. Fc-independent immune thrombocytopenia via mechanomolecular signaling in platelets. Blood. 131 (7), 787-796 (2018).
- Cao, W., Krishnaswamy, S., Camire, R. M., Lenting, P. J., Zheng, X. L. Factor VIII accelerates proteolytic cleavage of von Willebrand factor by ADAMTS13. Proceedings of the National Academy of Sciences USA. 105 (21), 7416-7421 (2008).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Pareti, F. I., Niiya, K., McPherson, J. M., Ruggeri, Z. M. Isolation and characterization of two domains of human von Willebrand factor that interact with fibrillar collagen types I and III. Journal of Biological Chemistry. 262 (28), 13835-13841 (1987).
- Deng, W., et al. Platelet clearance via shear-induced unfolding of a membrane mechanoreceptor. Nature Communications. 7, 12863 (2016).
- Ikeda, Y., et al. The role of von Willebrand factor and fibrinogen in platelet aggregation under varying shear stress. Journal of Clinical Investigation. 87 (4), 1234-1240 (1991).
- Westerhof, N., Stergiopulos, N., Noble, M. I. . Snapshots of hemodynamics: an aid for clinical research and graduate education. , (2010).
- Liang, X., et al. Specific inhibition of ectodomain shedding of glycoprotein Ibalpha by targeting its juxtamembrane shedding cleavage site. Journal of Thrombosis and Haemostasis. 11 (12), 2155-2162 (2013).
- Samsel, L., et al. Imaging flow cytometry for morphologic and phenotypic characterization of rare circulating endothelial cells. Cytometry Part B: Clinical Cytometry. 84 (6), 379-389 (2013).
- Basiji, D. A., Ortyn, W. E., Liang, L., Venkatachalam, V., Morrissey, P. Cellular image analysis and imaging by flow cytometry. Clinics in Laboratory Medicine. 27 (3), 653-670 (2007).
- Quach, M. E., Chen, W., Li, R. Mechanisms of platelet clearance and translation to improve platelet storage. Blood. 131 (14), 1512-1521 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon