È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Utilizzo di dispositivi di assistenza ventricolare percutanea nell'infarto miocardico acuto complicato da shock cardiogeno
In questo articolo
Riepilogo
I dispositivi di assistenza ventricolare percutanea sono sempre più utilizzati nei pazienti con infarto miocardico acuto e shock cardiogeno. Qui, discutiamo il meccanismo d'azione e gli effetti emodinamici di tali dispositivi. Esaminiamo anche algoritmi e best practice per l'impianto, la gestione e lo svezzamento di questi dispositivi complessi.
Abstract
Lo shock cardiogeno è definito come ipotensione persistente, accompagnata da evidenza di ipoperfusione dell'organo terminale. I dispositivi di assistenza ventricolare percutanea (PVAD) sono utilizzati per il trattamento dello shock cardiogeno nel tentativo di migliorare l'emodinamica. Impella è attualmente il PVAD più comune e pompa attivamente il sangue dal ventricolo sinistro nell'aorta. I PVAD scaricano il ventricolo sinistro, aumentano la gittata cardiaca e migliorano la perfusione coronarica. I PVAD sono tipicamente collocati nel laboratorio di cateterizzazione cardiaca sotto guida fluoroscopica attraverso l'arteria femorale quando possibile. In caso di grave arteriopatia periferica, i PVAD possono essere impiantati attraverso un accesso alternativo. In questo articolo, riassumiamo il meccanismo d'azione del PVAD e i dati a supporto del loro uso nel trattamento dello shock cardiogeno.
Introduzione
Lo shock cardiogeno (CS) è definito come ipotensione persistente (pressione arteriosa sistolica <90 mmHg per >30 minuti, o necessità di vasopressori o inotropi), ipoperfusione dell'organo terminale (produzione di urina <30 mL/h, estremità fredde o lattato > 2 mmol/L), congestione polmonare (pressione del cuneo capillare polmonare (PCWP) ≥ 15 mmHg) e diminuzione delle prestazioni cardiache (indice cardiaco <2,2) 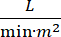 1, 2 a causa di un disturbo cardiaco primario. L'infarto miocardico acuto (AMI) è la causa più comune di CS3. La CS si verifica nel 5-10% delle AMI e storicamente è stata associata a una significativa mortalità3,4. I dispositivi di supporto circolatorio meccanico (MCS) come la pompa a palloncino intra-aortica (IABP), i dispositivi di assistenza ventricolare percutanea (PVAD), l'ossigenazione extracorporea a membrana (ECMO) e i dispositivi percutanei da atriali aortici sinistri sono frequentemente utilizzati nei pazienti con CS5. L'uso di routine di IABP non ha dimostrato alcun miglioramento negli esiti clinici o nella sopravvivenza in AMI-CS1. Dati gli scarsi risultati associati all'AMI-CS, le difficoltà nel condurre studi in AMI-CS e i risultati negativi dell'uso di IABP in AMI-CS, i medici guardano sempre più ad altre forme di MCS.
1, 2 a causa di un disturbo cardiaco primario. L'infarto miocardico acuto (AMI) è la causa più comune di CS3. La CS si verifica nel 5-10% delle AMI e storicamente è stata associata a una significativa mortalità3,4. I dispositivi di supporto circolatorio meccanico (MCS) come la pompa a palloncino intra-aortica (IABP), i dispositivi di assistenza ventricolare percutanea (PVAD), l'ossigenazione extracorporea a membrana (ECMO) e i dispositivi percutanei da atriali aortici sinistri sono frequentemente utilizzati nei pazienti con CS5. L'uso di routine di IABP non ha dimostrato alcun miglioramento negli esiti clinici o nella sopravvivenza in AMI-CS1. Dati gli scarsi risultati associati all'AMI-CS, le difficoltà nel condurre studi in AMI-CS e i risultati negativi dell'uso di IABP in AMI-CS, i medici guardano sempre più ad altre forme di MCS.
I PVAD sono sempre più utilizzati nei pazienti con AMI-CS6. In questo articolo, concentreremo la nostra discussione principalmente sull'Impella CP, che è il PVAD più comune attualmente utilizzato6. Questo dispositivo utilizza una pompa a vite archimede a flusso assiale che spinge attivamente e continuamente il sangue dal ventricolo sinistro (LV) nell'aorta ascendente (Figura 1). Il dispositivo viene posizionato più frequentemente nel laboratorio di cateterizzazione cardiaca sotto guida fluoroscopica attraverso l'arteria femorale. In alternativa, può essere impiantato attraverso un accesso ascellare o transcavale quando necessario7,8.
Protocollo
Questo protocollo è lo standard di cura nella nostra istituzione.
1. Inserimento del PVAD (ad esempio, Impella CP)
- Ottenere l'accesso femorale comune sopra la metà inferiore della testa del femore sotto guida fluoroscopica ed ecografica utilizzando un ago dimicro-puntura 9,10. Posizionare la guaina di micropuntura e ottenere un angiogramma dell'arteria femorale per confermare la posizione arteriotomia appropriata11.
- Inserire una guaina da 6 Fr nell'arteria femorale.
- Se c'è preoccupazione per la malattia ilio-femorale, inserire un catetere pigtail nella parte inferiore dell'aorta addominale ed eseguire un angiogramma del sistema iliofemorale per garantire che non vi sia alcuna significativa malattia delle arterie periferiche (PAD) che possa precludere l'inserimento di PVAD. Se c'è una malattia moderata o calcificazione delle arterie iliache, prendere in considerazione l'utilizzo di una guaina francese più lunga di 25 cm 14 in modo che la punta della guaina si trovi in un segmento relativamente sano dell'aorta addominale.
- Dilatare in serie il sito arteriotomia su un filo rigido da 0,035 "utilizzando dilatatori da 8, 10 e 12 Fr in sequenza. Quindi, inserire la guaina da 14 Fr peel away sotto guida fluoroscopica, assicurando che la punta avanzi senza resistenza.
- Somministrare il bolo di eparina (~ 100 U / kg di peso corporeo) per un obiettivo ACT da 250 a 300 s. L'anticoagulazione alternativa include bivalirudina e argatroban.
- Utilizzare un catetere pigtail per attraversare il LV utilizzando un filo con punta J da .035 ". Rimuovere il filo J e controllare un LVEDP.
- Modellare la punta del filo di lunghezza di scambio da 0,018" incluso nel kit e inserirlo nel LV in modo che formi una curva stabile all'apice LV.
- Assicurarsi che ACT sia a obiettivo (da 250 a 300 s) prima dell'inserimento12,13.
- Rimuovere il catetere pigtail e inserire la pompa caricando il filo sul lumen rosso di caricamento preassemblato (ad esempio, EasyGuide) fino a quando non esce vicino all'etichetta.
- Rimuovere il lume rosso di caricamento tirando delicatamente l'etichetta mentre si tiene il catetere.
- Far avanzare il dispositivo con piccoli incrementi sotto guida fluoroscopica nel LV sul filo da 0,018".
- Posizionare la pompa nel BT con il suo ingresso 4 cm sotto la valvola aortica e assicurarsi che sia libero dalle corde mitraliche. Essere troppo vicini all'apice può causare PVC e attivare "allarmi di aspirazione". Rimuovere il filo .018 "e, una volta rimosso, avviare la pompa. Rimuovere l'allentamento in eccesso in modo che la pompa si appoggi contro la minore curvatura dell'aorta.
- Monitorare la console per assicurarsi che la corrente del motore sia pulsatile e che venga visualizzata la forma d'onda aortica. Se viene visualizzata una forma d'onda ventricolare, potrebbe essere necessario tirare indietro la pompa.
- Se il dispositivo deve essere lasciato in situ, rimuovere la guaina a scomparsa e inserire la guaina di riposizionamento precaricata sul dispositivo.
- Controllare nuovamente la posizione del dispositivo sulla fluoroscopia e le forme d'onda sulla console.
- Palpare (o senso con Doppler) gli impulsi arteriosi degli arti inferiori distali tra cui dorsalis pedis e tibiale posteriore prima e dopo l'inserimento del dispositivo. Documentarlo in modo appropriato nella cartella clinica del paziente.
- Se non è possibile ottenere impulsi o dopplers, prendere in considerazione l'idea di eseguire un angiogramma degli arti inferiori utilizzando la porta di reintroduzione del filo situata sul lato del dispositivo o utilizzando un altro accesso per garantire un flusso non ostruttivo all'arto inferiore.
- Se il flusso è ostruito, posizionare una guaina di riperfusione prima di trasferire il paziente alla CCU. Nei pazienti con PAD che sono ad alto rischio di flusso ostruttivo, considerare fortemente l'inserimento della guaina di riperfusione prima del posizionamento della guaina da 14 Fr (cioè dopo il passaggio 1.4 sopra elencato).
- Monitorare i pazienti trattati con un PVAD nell'unità di terapia intensiva (CCU) da personale addestrato al suo utilizzo.
2. Assistenza post-procedurale
- Applicare una medicazione sterile.
- Posizionare il dispositivo con un angolo di 45° quando si entra nella pelle (una garza sotto la guaina di riposizionamento può essere utile per mantenere questo angolo). In caso contrario, può trasudare l'arteriotomia, portando alla formazione di un ematoma. È anche utile posizionare le suture con pressione in avanti per evitare la migrazione del dispositivo e prevenire il sanguinamento.
NOTA: il fissaggio dell'arto inferiore con un immobilizzatore del ginocchio può anche limitare la migrazione del dispositivo come promemoria per il paziente a non piegare / spostare l'arto interessato. Questo non dovrebbe essere fissato troppo strettamente in modo da non compromettere la circolazione. - Continuare a eseguire controlli del polso di routine (palpabili o Doppler).
3. Posizionamento
- Utilizzare l'ecocardiogramma transtoracico al posto letto per confermare la posizione appropriata del dispositivo prima del trasferimento o immediatamente all'arrivo in terapia intensiva cardiaca, a seconda della disponibilità di un'ecografia del punto di cura.
- Utilizzare una vista parasternale ad asse lungo per valutare la posizione del dispositivo. Una vista subxifoide può anche essere utilizzata se la vista parasternale a lungo asse non è ottenibile. Una misurazione dalla valvola aortica all'ingresso del dispositivo dovrebbe idealmente essere di 3-4 cm per il corretto posizionamento del dispositivo.
- Utilizzare ecocardiogrammi per annotare la posizione del dispositivo in relazione alla valvola mitrale.
- Quando un dispositivo deve essere riposizionato, abbassare il dispositivo a P2, svitare il meccanismo di bloccaggio sul coperchio sterile per far avanzare o ritrarre il dispositivo. Si può coppia come avanzamento o retrazione se la coda di maiale o l'ingresso è troppo vicino alla valvola mitrale.
- Blocca il dispositivo nella nuova posizione e documenta la nuova posizione.
- Successivamente, aumentare il dispositivo al livello di supporto desiderato.
- Dopo aver aumentato il livello di supporto, rivalutare la posizione del dispositivo in quanto il dispositivo può saltare in avanti quando la velocità aumenta.
NOTA: se il dispositivo è stato tirato indietro attraverso la valvola aortica, il riposizionamento è meglio fatto nel laboratorio di cath sotto guida fluoroscopica.
4. Svezzamento
- Considerare lo svezzamento quando i vasopressori / inotropi sono a basse dosi o completamente svezzati. L'emodinamica deve essere continuamente monitorata per mantenere un CPO > 0,6 W. Monitorare attentamente l'emodinamica ventricolare destra (RV) con l'obiettivo di mantenere la pressione atriale destra (RAP) <12 mmHg e l'indice di pulsatilità dell'arteria polmonare (PAPI) >1,014. Considera anche di ottenere pH, saturazioni venose miste e lattato ogni 2-6 ore per monitorare il lavoro cardiaco e la perfusione degli organi finali.
- Diminuire la potenza di 1-2 livelli in 2 ore, notando CPO, PAPI, RAP, MAP e produzione di urina. Se il CPO scende <0,6 W, il RAP inizia ad aumentare, la produzione di urina scende > 20 ml / h o MAP <60 mmHg, aumentare la potenza al livello precedente.
5. Rimozione12
- Utilizzare dispositivi di chiusura vascolare per chiudere il sito di accesso all'arteriotomia con la distribuzione completa del dispositivo eseguita quando viene rimossa la guaina di grandi dimensioni14. Il tamponamento temporaneo con palloncino endovascolare o "tecnica di chiusura del campo secco" è un modo efficace e sicuro per garantire l'emostasi del sito di accesso al grande foro15.
- Comporre fino a P1 e tirare indietro il dispositivo nell'aorta seguito da passare a P0 e scollegare il dispositivo dalla console mentre il catetere viene estratto dal corpo.
- Si noti che il dispositivo non deve essere lasciato attraverso la valvola aortica a P0 a causa del rischio di rigurgito aortico.
- Se si considera l'emostasi manuale, attendere fino a ACT <150 e tenere premuti 3 minuti di pressione per dimensione francese.
Risultati
La Tabella 1 mostra la sicurezza e l'efficacia dell'impianto di PVAD35,36, 37,38,39,40.
Ottimizzazione dei risultati PVAD
I PVAD sono un intervento che richiede una notevole esperienza e competenza per ottimizzare i risultati. È necessario prendere in considera...
Discussione
Ridurre al minimo i rischi e le complicanze del PVAD (Tabella 2)
I benefici emodinamici della PVAD possono essere significativamente neutralizzati se si verificano complicazioni da accesso di grandi dimensioni, come sanguinamento maggiore e ischemia acuta degli arti28,29. È quindi essenziale ridurre al minimo il rischio e le complicazioni del dispositivo.
Al fine di ridurre le complicanze del sito di accesso e ridu...
Divulgazioni
Dr. Aditya Bharadwaj è consulente, supervisore e membro del Speakers Bureau per Abiomed.
Il Dr. Mir Basir è consulente per Abbott Vascular, Abiomed, Cardiovascular System, Chiesi, Procyrion e Zoll.
Riconoscimenti
Nessuno
Materiali
| Name | Company | Catalog Number | Comments |
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
Riferimenti
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d'intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O'Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O'neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon