JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포외 소포의 정량화 및 크기 측정을 위한 나노 입자 추적 분석
요약
우리는 마우스 perigonadal 지방 조직 및 인간 혈장에서 분리된 세포외 소포의 크기 분포 및 총 입자 농도를 추정하기 위하여 새로운 나노 입자 추적 분석 계기를 사용하는 방법을 보여줍니다.
초록
세포 외 소포 (EV)의 생리학적 및 병리학적 역할은 점점 더 인식되고 있으며, EV 분야는 빠르게 진화하는 연구 영역으로 만듭니다. EV 격리를 위한 다양한 방법이 있으며, 각각 은하류 수율과 EV순도에 영향을 미치는 고유한 장점과 단점이 있습니다. 따라서 선택한 방법에 의해 지정된 소스로부터 분리된 EV 준비의 특성화는 다운스트림 결과를 해석하고 실험실 전체의 결과를 비교하는 데 중요합니다. 질병 상태에 의해 또는 외부 조건에 응하여 변경될 수 있는 전기 의 크기와 양을 결정하기 위한 각종 방법이 존재합니다. 나노 입자 추적 분석 (NTA)은 개별 EV의 높은 처리량 분석에 사용되는 저명한 기술 중 하나입니다. 여기서, 우리는 현장에서 주요 발전을 나타내는 NTA에 대한 획기적인 기술을 사용하여 마우스 페리고나달 지방 조직 및 인간 플라즈마로부터 분리 된 전기 의 정량화 및 크기 측정을위한 상세한 프로토콜을 제시합니다. 결과는 이 방법이 전송 전자 현미경검사법에 의해 확인된 바와 같이 다른 방법을 사용하여 다른 소스로부터 분리된 전기에 대한 재현 가능하고 유효한 총 입자 농도 및 크기 분포 데이터를 제공할 수 있음을 보여준다. NTA에 대한이 악기의 적응은 EV 연구에서 엄격과 재현성을 높이기 위해 NTA 방법의 표준화의 필요성을 해결합니다.
서문
세포외 소포(Ev)는 거의 모든 세포 유형 1에 의해 분비되는 작은 (0.03-2 μm) 막 결합소포이다. 그들은 종종 방출 및 크기2의그들의 기계장치에 따라 "엑소좀", "microvesicles" 또는 "apoptotic 바디"로 불립니다. 처음에는 전기자동차가 항상성을 유지하기 위해 세포에서 폐기물을 제거하는 수단이라고생각되었지만,우리는 이제 DNA, RNA(mRNA, microRNA), 지질 및 단백질4,5를 포함한 분자 물질의 전송을 통해 세포간 통신에 참여할 수 있다는 것을 알고 있으며, 정상 생리학뿐만 아니라 정상적인 생리학의 중요한 조절제라는 것을알고 있습니다. 5,6,7,8.
다른곳에서 설명 된 다른 9,10,11,12에설명 된 전기 를 분리하고 정량화하는 많은 다른 방법이 있습니다. EV의 소스뿐만 아니라 사용되는 격리 프로토콜은 EV 수율과 순도에 큰 영향을 미칠 수 있습니다. 엑소좀 격리를 위한 "금본위제" 접근법으로 오랫동안 고려되었던 차동 원심분리조차도, 이후 얻어진 EV 인구에 영향을 미치는 실질적인 변동성의 대상이 될 수 있으며, 다운스트림분석(13). 따라서, EV 절연 및 정량화를 위한 다양한 방법론을 통해문헌(14)에보고된 실험결과를 비교, 재현 및 해석하기가 어렵다. 또한, EV 방출은 세포 조건 또는 다양한 외부 요인에 의해 조절될 수 있다. 그것은 EV 세포 스트레스에 대 한 세포를 보호 하 여 세포 항상성을 유지 에 역할을 제안 되었습니다15,여러 연구는 세포 스트레스 EV 분 비를 자극 하는 것으로 나타났습니다. 예를 들어, 증가된 EV 방출은 저산소증, 폐막성 망막 응력, 산화 스트레스, 기계적 스트레스, 담배 연기 추출물 및 미립자 대기 오염16,17,18, 19,20,21,22에세포 노출 후 보고되었다. EV 릴리스는 또한 생체 내에서 수정 된 것으로 나타났습니다. 16시간 동안 고지방 식단또는 금식을 실시한 마우스는 더 많은 지방외 식EV(23)를방출한다. 특정 치료 또는 조건이 EV 릴리스를 변경하는지 여부를 조사하려면 EV 수를 정확하게 결정해야 합니다. EV 크기 분포의 평가는 또한 EV의 주요 세포 전원점(예를 들어, 플라즈마 멤브레인 대 플라즈마 멤브레인의 신진을 가진 후기 내분/다중 혈관 체의 융합)를 나타낼 수있다. 따라서, 연구중인 EV 준비의 총 농도 및 크기 분포를 정확하게 측정하는 견고한 방법이 필요하다.
용액에서 EV의 시각화 및 특성화를 위한 신속하고 매우 민감한 방법은 나노입자 추적 분석(NTA)입니다. 이 방법의 원리에 대한 상세한 설명및 EV 크기 및 농도의 평가를 위한 대체 방법과 비교한 것은 이전에25,26,27,28에기술되었다. 간단히 말해서 NTA 측정 중에 전기 는 레이저 빔으로 조사 될 때 산란 된 빛에 의해 시각화됩니다. 흩어진 빛은 입자 움직임을 기록하는 카메라에 현미경에 의해 집중됩니다. NTA 소프트웨어는 각 입자의 임의열 모션을 추적, 브라우니아 모션으로 알려진, 스토크스 - 아인슈타인 방정식을 사용하여 각 입자의 크기를 계산하는 데 사용되는 확산 계수를 결정합니다. NTA는 2011년25년생물학적 샘플에서 전기자동차의 측정에 처음 적용되었다. 최근까지, 다른 NTA 기술의 상당한 한계를 극복하기 위해 새로운 하드웨어 및 소프트웨어 솔루션의 조합을 사용하는 ViewSizer 3000 (이하 입자 추적 기기라고함)의 도입까지 상용 NTA 악기29를 제공하는 두 개의 주류 회사가 있었다.
입자 추적 기기는 브라우니아 운동을 분석하여 액체 샘플의 나노 입자를 특성화하고 중력 침전을 분석하여 더 큰 미크론 크기의 입자를 특성화합니다. 3개의 레이저 광원(450nm, 520nm, 635nm)을 포함하는 이 계측기의 독특한 광학 시스템은 연구원이 다양한 입자 크기(예: 엑소좀, 마이크로베스캔들)를 동시에 분석할 수 있도록 합니다. 계측기 설정의 회로도가 도 1에표시됩니다.
여기서는 새로운 NTA 계측기를 사용하여 격리된 마우스 및 인간 전기의 입자 크기 분포 및 농도 측정을 수행하는 방법을 시연합니다.
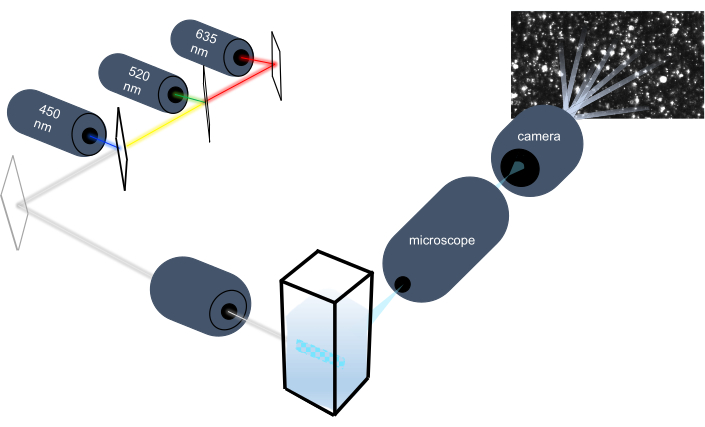
그림 1: 입자 추적 기기 광학 시스템. NTA 계측기는 450nm, 520nm, 635nm의 세 레이저를 사용하여 입자를 조명합니다. 개별 입자에서 흩어져 있는 빛의 비디오 녹화는 큐벳에서 90° 방향의 디지털 비디오 카메라에 의해 감지되고 추적됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
이러한 샘플의 모든 작업은 기관 동물 관리 및 사용 위원회 및 기관 검토 위원회 지침에 따라 수행되었습니다. NTA 메서드에 대한 회로도 개요는 도 2에묘사됩니다.
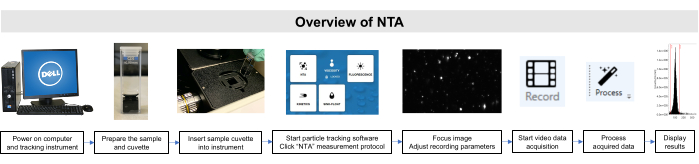
그림 2: 입자 추적 기기를 사용하는 NTA 메서드개요입니다. 샘플은 준비되고 기기에 삽입됩니다. NTA 소프트웨어가 열리고, 기록 매개 변수가 조정되고, 샘플에 초점을 맞췄다. 그런 다음 데이터가 기록, 처리 및 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 세포 외 소포 격리
참고: 마우스 페리고나달 지방 조직 EV는 이전에 설명된23과같이 격리되었다. 플라즈마 전기는 다음 프로토콜을 사용하여 인간 플라즈마의 1 mL로부터 격리되었다:
- 플라즈마와 원심분리기를 3,000 x g에서 15분 동안 수집하여 셀룰러 이물질을 제거합니다. 상체를 새 튜브로 옮기습니다.
참고: 추가 파편이 탐지 가능한 상태로 유지되면 상체원분리기를 12,000 x g로 10분 추가로 원심분리하고 상체부를 새 튜브로 옮긴다. - 플라즈마 의 250 μL 당 외성 절연 시약의 67 μL을 추가합니다. 튜브를 반전하거나 가볍게 하여 잘 섞습니다.
- 30 분 동안 얼음 수직에 배양.
- 4°C에서 10분 동안 3,000 x g에서 엑소솜 절연 시약/플라즈마 혼합물을 원심분리합니다.
참고: 원심분리는 실온 또는 4°C에서 유사한 결과를 수행할 수 있지만 4°C가 바람직하다. 원심분리 후, 전기는 튜브 의 바닥에 베이지 색 또는 흰색 펠릿으로 나타날 수 있습니다. - 신중하게 상체를 흡인. 잔류 외식 절연 용액을 스핀 다운하고 펠릿의 침전 된 전기 를 방해하지 않도록 주의하여 포부로 유체의 모든 흔적을 제거하십시오.
- 버퍼 B의 200 μL에서 펠릿을 다시 일시 중지합니다(제조업체에서 제공). 분광계, 불소계, 브래드포드 분석법 또는 기타 바람직한 방법을 사용하여 샘플의 단백질 농도(단계 2.8의 경우)를 측정하고 기록합니다.
2. 격리된 EV의 정화
- 다시 일시 중단된 EV에 버퍼 A 200 μL(제조업체에서 제공)을 추가합니다.
- 정화 열(제공)을 꺼내 나사 캡을 풀고 바닥 닫기를 스냅합니다. 컬럼을 수집 튜브에 넣습니다.
참고: 2.7-2.9 단계의 하단 닫기 저장. - 저장소 버퍼를 제거하기 위해 30 s용 1,000 x g의 원심분리기.
- 흐름을 버리고 컬럼을 다시 수집 튜브에 배치합니다.
- 컬럼을 세척하려면 캡을 제거하고 수지 위에 500 μL의 버퍼 B를 적용하고 30s의 경우 1,000 x g에서 원심분리기를 적용합니다. 흐름을 폐기합니다. 2.7-2.9 단계에 대한 캡을 저장합니다.
- 2.4-2.5 단계를 한 번 더 반복하여 열을 세척합니다.
- 열의 아래쪽 을 아래쪽 닫기(2.2단계에서)로 연결합니다. 수지 위에 버퍼 B 100 μL을 적용하여 시료 적재를 준비합니다.
- 전체 함량을 1.6단계(또는 총 단백질 4mg에 해당하는 부피)에서 수지에 추가합니다. 나사 캡을 열 상단에 놓습니다.
- 실온에서 회전 셰이커에 5분 이상 섞어주세요.
3. 샘플 용출
- 나사 캡을 풀고 바닥 폐쇄를 제거하고 즉시 2mL 마이크로 센실리후지 튜브로 옮긴다.
참고: 샘플은 바닥 닫기가 제거되는 즉시 elute가 시작됩니다. 2mL 마이크로원심분리기 튜브가 용출되어 샘플 손실을 최소화할 수 있는지 확인하십시오. - 정제 된 전기 를 얻기 위해 30 s에 대한 1,000 x g에서 원심 분리기. 열을 삭제합니다.
4. 나노 입자 추적 분석을위한 샘플 준비
- 마이크로 화이버 천과 같은 보풀이없는 재료를 사용하여 작업 공간을 커버하고 섬유가 큐벳에 들어가지 않도록하십시오.
- 장갑을 끼고, 커벳을 마그네틱 큐벳 지그 위에 놓고, 커벳에 스티어 바를 놓습니다. 항상 지문과 얼룩이 큐벳표면에 나타나는 것을 방지하기 위해 장갑으로 큐벳을 처리하십시오.
- 후크 도구를 사용하여 도 3에묘사된 대로 삽입을 큐벳에 넣습니다. 나중에 삽입의 방향을 주의하는 것이 중요합니다(5.4단계).

그림 3: 석영 큐벳 내의 적절한 삽입 방향. 인서트가 큐벳 의 전면에서 볼 수 있어야 합니다. 카메라를 향한 기기에 삽입해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 파이펫을 사용하여, 천천히 삽입의 구멍을 통해 큐벳에 실온에서 희석 또는 희석 된 샘플의 400-500 μL을 추가합니다. 부드럽게 위아래로 파이펫을 섞어 주세요. 기포를 도입하지 마십시오.
- 먼저 희석제의 입자 농도를 측정하기 위해 선택한 희석제(blank)로 로드된 큐벳을 준비합니다. 샘플의 배경 농도를 수정할 수 있도록 샘플을 측정하기 전에 수행해야 합니다.
참고: 좋은 빈칸(이 경우 인산염 완충식식염수[PBS])은 농도<9 x 10 6(희석제에 따라 다름)을 가지며, 라이브 뷰(그림4)에서화면당 1~10개의 입자를 표시합니다. 실제 시료 입자 농도는 배경 농도의 3배 이상인 것이 좋습니다. - 선택적으로, 샘플 프라임을 기록하기 전에 측정하기 전에 희석 또는 희석 시료의 400-500 μL을 가진 큐벳을 기록한다. 이렇게 하려면 희석된 시료의 400-500 μL을 큐벳에 적재하고 용액을 폐기한 다음 측정을 위해 400-500 μL을 더 추가합니다. 이것은 큐벳 내에서 잔류물을 씻어 하는 데 도움이 될 수 있습니다.
- 먼저 희석제의 입자 농도를 측정하기 위해 선택한 희석제(blank)로 로드된 큐벳을 준비합니다. 샘플의 배경 농도를 수정할 수 있도록 샘플을 측정하기 전에 수행해야 합니다.

그림 4: 빈의 적절한 농도 범위 내에서 희석제의 대표 라이브 스트림 보기. 여과(0.02 μm 또는 3kDa, 선호) PBS에서 EV 준비액을 희석시켰다. 좋은 공백은 라이브 뷰에서 화면당 ~1-10 개의 입자를 표시하여 범위 105-106내에서 농도를 산출합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 큐벳을 캡하고 거품을 확인합니다. 필요한 경우 거품을 탭합니다. 보풀이 없는 천을 사용하여 큐벳의 바깥쪽 얼굴을 닦으세요.
5. 입자 추적 기기의 시작 절차
- 컴퓨터 워크스테이션과 계측기를 켜고 첫 번째 샘플을 실행하기 몇 분 전에 기다렸다가 소프트웨어 아이콘을 클릭하여 프로그램을 시작합니다. 메시지가 표시되면 화면에서 NTA를 클릭하여 나노입자 추적 분석을 수행합니다. 기록 탭에서 시작하여 다양한 소프트웨어탭(기록, 프로세스, 플롯)을클릭하여 프로토콜 전체에서 전환할 수 있습니다. 샘플을 먼저 기록(희석 또는 EV 준비)한 다음 녹음을 처리하고 마지막으로 결과를 플롯합니다.
- 샘플에 대한 필요한 모든 정보를 작성하려면 화면의 지침을 따르십시오. 필요한 모든 필드가 완료되고 정확한지, 즉 샘플 이름, 설명, 샘플 준비, 희석 계수 [1000], 대상 온도(22°C로 설정) 및 희석제: 드롭다운 메뉴에서 희석제를 선택하고 PBS를 EV용 희석제로 사용합니다. 드롭다운 메뉴에서 PBS를 선택하면 명분이 9%로 자동으로 채워집니다. 이 정보는 액체의 동적 점도를 결정하는 데 필요합니다.
참고: 프로브가 이미 원하는 온도를 표시하더라도 큐벳 내부에 온도가 평형화되기까지 최대 3분이 걸릴 수 있습니다(즉, 녹색 점이 안정됨). 샘플 온도 차이가 입자의 브라우니아 운동을 크게 변화시킬 수 있으므로 목표 온도가 설정되지 않으면 샘플 판독이 상당히 달라질 수 있습니다. - 기기 뚜껑을 열고 큐벳이 배치될 보호 캡 덮개를 제거합니다.
주의: 입자 추적 기기는 클래스 1 레이저 제품(21 CFR Ch)으로 인증되었습니다. 나는 1040 부분), 위험 할 수있는 레이저를 포함하고 화상 및 / 또는 시력에 영구적 인 손상을 일으킬 수 있습니다. 사고 나 부상을 방지하기 위해, 측면에서 볼트를 풀어 악기 커버를 제거하지 마십시오. 작동 중에 레이저 빔이 완전히 밀폐되어 사용자에게 위협이 되지 않습니다. 또한, 시료 홀더의 캡을 제거할 때 레이저가 작동하지 않도록 기기의 샘플 홀더에 자기 안전 연동이 내장되어 있습니다. - 큐벳(4.3단계에서) 악기 안에 올바른 방향으로 놓습니다(그림 5참조). 큐벳 위에 캡을 교체하고 기기 뚜껑을 닫습니다. 항상 샘플 홀더 위에 캡을 배치하여 계측기를 작동시하십시오. 안전 연동 기능을 사용하지 않도록 설정하거나 우회하지 마십시오.

그림 5: 입자 추적 기기 내에서 큐벳의 적절한 방향. 커벳의 얼굴(인서트가 보이는 "노치"가 있음)은 카메라를 향해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 스트리밍위의 화살표를 클릭하여 카메라를 켭니다.
- 쉐브론 화살표를 클릭하여 레코드 설정을 확장합니다. 게인 및 레이저 전원을 응용 프로그램에 적합한 값으로 설정합니다. 작은 (100 nm) EV의 NTA에 사용되는 매개 변수에 대한 표 1 (및 보충 도 1)을참조하십시오.
참고: 쉐브론 화살표를 클릭하여 액세스하는 이러한 고급 설정은 암호로 보호될 수 있습니다. 희석제(공백)에 대해 기록 및 처리에 대해 후속 샘플에 사용되는 설정과 동일한 설정을 사용합니다. - 파티클에 제대로 초점을 맞출 때까지 초점을 조정합니다. 집중은 상대적으로 작은 입자(그림 6)에수행해야합니다. 작은 EV 정량화 (엑소좀과 일치) 다음과 같은 기록 설정을 권장합니다 : 프레임 속도 : 30 fps, 노출 : 15 ms, Stir time : 5 s, 대기 시간 : 3, 레이저 파워 - 블루 : 210 mW, 녹색 : 12 mW, 빨간색 : 8 mW, 비디오 당 프레임 : 300 프레임 및 게인 : 300 dB.
참고: 사용자는 줌을 1x로 늘리거나 게인을 늘려 초점 에 도움이 될 수 있습니다. 비디오를 녹화하기 전에 이러한 매개 변수를 권장 값으로 다시 설정해야 합니다.
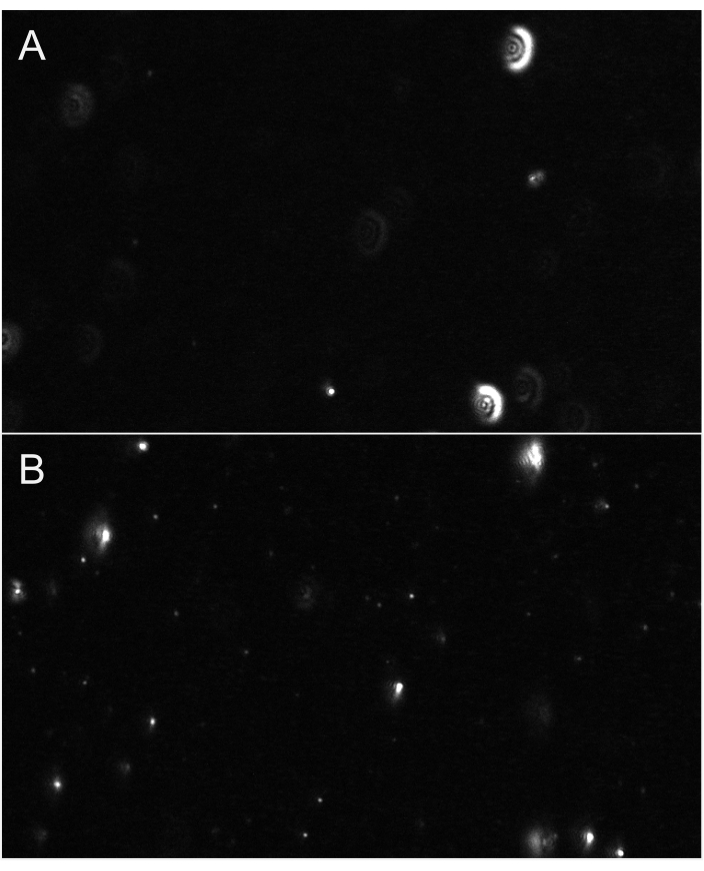
그림 6: 파티클 포커스를 나타내는 대표적인 라이브 스트림 뷰. (A)초점이 아닌 파티클의 실시간 스트림 뷰. 파티클은 빛과 같은 후광을 가지고 있거나 흐릿해 보입니다. 초점을 조정합니다. (B)적절한 초점에서 입자의 예를 들어 라이브 스트림 뷰. 가장 작은 파티클이 초점에 있습니다. 녹화를 시작합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 샘플이 제대로 희석되었는지 확인하기 위해 시각적 품질 검사를 수행합니다. 샘플이 너무 농축되면 계측기에서 큐벳을 제거하고 샘플을 순차적으로 희석시합니다. 6단계로 진행하기 전에 샘플이 제대로 희석될 때까지 반복합니다.
참고 : 샘플을 과도하게 희석하지 마십시오! 항상 희석을 순차적으로 만듭니다. 이상적인 공백은 그림 4에표시된 것처럼 화면에 몇 개의 파티클(1-4)만 표시됩니다. EV 샘플과 관련하여 제대로 희석된 시료에는 약 20-100개의 파티클이 화면에 표시되며 배경에는 글로우 와 같은 이미지나 흐린 이미지가 없습니다(그림 7을 예로 참조). 이는 mL당 5 x 106 ~ 2 x 108 입자 범위(희석 계수에 대해 조정되지 않음)의 범위에서 최적의 입자 농도를 초래해야 합니다.
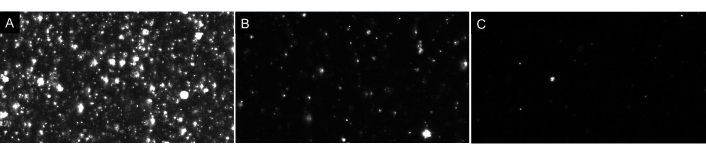
그림 7: 상이한 입자 희석을 묘사하는 대표적인 라이브 스트림 뷰. (A)너무 집중된 샘플의 예라이브 스트림 뷰. 너무 집중된 샘플을 기록하면 부정확한 결과가 생성됩니다. (B)제대로 희석된 시료의 예가 실시간 스트림 뷰입니다. 화면에 60-100 개의 입자가 표시되고 기록 결과 5 x 106- 2 x 108 입자 / mL의 원시 농도가 생성됩니다. (C)너무 희석된 샘플의 예라이브 스트림 뷰. 샘플이 희석되면 충분한 파티클이 추적되지 않아 샘플 크기를 낮추므로 결과가 통계적으로 유효하지 않습니다. 이 경우 녹화된 동영상 수를 늘리는 것이 좋습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 비디오 데이터 수집
- (선택 사항) 확대/축소 설정을 0.5x로 설정하여 대역폭을 절약하고 프레임 손실방지를 방지합니다.
- 녹화를 클릭하여 동영상 녹화를 시작합니다(권장 녹음 매개 변수의 표 1 참조).
참고: 기본적으로 계측기는 샘플을 5초 동안 저어서 3초를 기다린 다음 이 과정을 반복하기 전에 10초 동안 기록합니다. 50개의 동영상의 일반적인 측정 시간은 ~15분, 처리하는 데 는 13분입니다. - 비디오를 녹화하는 동안 악기를 만지지 마십시오. 실험실 벤치의 표면이 진동하지 않는지 확인합니다.
참고: 기기는 진동 방지 플랫폼 또는 테이블에 설정되어 나노입자 이동의 판정을 방해하는 인근 장비의 진동 장애를 줄이는 것이 좋습니다. 입자 추적 기기와 동일한 벤치에서 원심분리기, 소용돌이 믹서 또는 기타 잠재적 진동 발생 장치를 작동하지 마십시오. 진동은 일반적으로 둥근 입자의 신장으로 화면에 쉽게 볼 수 있습니다. 격렬한 진동에 노출되면 계측기는 광학 요소의 재조정이 필요할 수 있습니다. 계측기는 고객이 서비스하거나 보정하도록 설계되지 않았습니다. 유지 보수, 서비스 및 교정을 위해 제조업체에 문의하십시오. - 크고 불규칙한 흰색 방울처럼 보이는 매우 큰 파티클이 있는 녹화된 비디오에 유의하십시오. 7.3 단계에서 이러한 비디오를 처리하지 않도록 제거합니다.
7. 수집된 데이터 처리
- 동영상이 녹화되었음을 알리는 메시지가 표시되면 확인을 클릭하여 녹화를 완료합니다. 그런 다음 프로세스 탭을 선택합니다.
참고: 프로토콜은 여기에서 중지할 수 있습니다. 획득된 데이터의 처리는 파티클 추적 기기의 소프트웨어를 열고 녹화된 비디오가 저장되는 디렉토리를 지정한 후 프로세스 탭으로 직접 이동하여 나중에 다시 시작할 수 있습니다. - EV를 분석할 때 자동 감지 재정의 를 비활성화하고 피처 직경을 30으로설정하려면 확인란을 선택합니다. 프로세스를클릭합니다. (처리 설정 및 추가 그림 2의 처리 표시를 위한 표 2를 참조하십시오.) 사용자가 실시간으로 처리를 볼 수 있도록 라이브 배포 그래프가 표시됩니다.
- 엑소좀의 경우 검출 임계값을 기본 Poly분산 샘플로설정된 프로세스합니다. 입자 크기가 매우 큰 솔루션에 대해서만 0.99의 표준 임계값 대신 0.8로 설정된 검출 임계값 수동으로 데이터를 처리합니다.
- 동영상이 눈에 띄게 매우 큰 파티클이 표시된 경우(단계 6.4 참조), 녹화된 비디오의 디렉토리로 이동하여 문제가 있는 비디오를 제거합니다. 비디오 파일 목록을 편집한 후 다른 사용자가 보관하는 로그에서 녹화된 비디오 수를 변경합니다.
- 처리가 완료되면 확인을 클릭합니다. 그런 다음 플롯 탭을 선택합니다. EV의 경우 주 차트를 로그빈실리카로 표시합니다.
참고: 여기서 플롯 탭에서 사용자는 x 축(입자 직경, nm)의 범위를 정의하는 것과 같은 그래프의 다른 피쳐를 사용자 지정하여 생성된 그림에 대한 통합 영역을 설정할 수 있습니다.
8. 결과를 표시하고 해석
- PDF 보고서를 만들려면 보고서 단추를 클릭합니다. 이제 측정이 완료되고 결과를 볼 수 있습니다.
참고: 후속 샘플의 배경 농도를 수정할 수 있도록 공백을 먼저 기록하고 처리해야 합니다. 이 단계를 잊어버린 경우 샘플 및 샘플 입자 농도가 수동으로 수정된 후 빈 칸을 기록할 수 있습니다. - 희석계수에 대해 조정되고 희석제의 입자 농도를 빼서 보정한 농도뿐만 아니라 평균, 중앙값 및 모드 크기를 표시하는 PDF 보고서를 검사합니다. 분포 폭(표준 편차)도 표시됩니다.
참고: 단일 값이 적절하고 대표적인 응용 프로그램은 거의 없습니다. 따라서 전체 크기 분포를 설명하고 분석된 모든 샘플에 대한 분포의 폭을 보고하는 것이 좋습니다(예: 표 3에 도시된 바와 같이). - 결과를 보고할 때 명시해야 하는 데이터를 생성하는 데 사용되는 다음 계측기 설정을 기록합니다. 각 레이저 [mW], 노출 [ms], 게인 [dB], 프레임 속도 [fps], 비디오 당 프레임, 녹화 된 비디오 수, 처리 설정 (예 : LogBinSilica), 통합 범위 [최소 nm, 최대 nm] (최소 50 nm로 분 설정하는 것이 좋습니다) 및 입자의 수 (최소 ~ 150 입자당 분석하는 것이 좋습니다) 및 추적 입자의 수 (최소 당 ~ 150 입자 당 분석하는 것이 바람직하다; 총 35 입자 크기 분포의 아티클 스파이크를 방지하고 통계적으로 유의한 데이터를 생성하는 것이 좋습니다.
9. 큐벳 청소
- 샘플 사이에 수동으로 큐벳을 청소하십시오. 첫째, 큐벳을 비웁니까.
참고: 샘플은 큐벳에서 복구하고 저장하거나 폐기할 수 있습니다. - 큐벳이 비어 있으면 이온화(DI) 물로 10-15회 헹구면 큐벳을 청소하십시오. 그런 다음 에탄올(70-100%)으로 3회 헹구는 것입니다. 이렇게 할 때, 완전히 용매와 큐벳을 채우기 위해해야합니다.
- 보풀이 없는 마이크로화이버 천으로 큐벳의 바깥쪽을 건조시다. 표면에 얼룩을 피하십시오. 압축 공기 먼지를 사용하여 큐벳 내부를 건조하거나 건조하십시오.
참고: 대부분의 종이 제품에는 큐벳 표면을 긁거나 손상시킬 수 있는 작은 목재 섬유가 포함되어 있기 때문에 렌즈 클리닝 용지 또는 보풀이 없는 마이크로화이버 천만 큐벳의 광표면을 닦아야 합니다. - 유리 반짝임 바이알 두 개를 준비합니다: 하나는 70-100% 에탄올로 채워지고 다른 하나는 DI 물로 채워져 있습니다. 인서트를 헹구고 에탄올(다음 DI water)에 삽입/저어바를 적절한 신클렌션 바이알에 넣고 유리병을 격렬하게 흔들어 줍니다. 보풀이 없는 천이나 압축 공기 먼지를 사용하여 인서트를 말리고 바를 저어줍니다.
참고: 큐벳과 인서트도 초음파 처리 수조를 사용하여 청소할 수 있습니다. 이렇게하려면 먼저 초음파 장치가 충분한 물 (최소 5cm 깊이)을 포함하도록하십시오. 그런 다음 큐벳을 넣고 유리 비커 (50 mL 이상) 내부에 삽입하고 비커를 수조와 동일한 수준으로 알코올로 채우고 비커를 물에 넣고 전원을 켭니다. 한 번에 최대 5분 동안 초음파 처리하여 더 긴 시간이 필요한 경우 각 5분 버스트 사이에 >5분 간 휴식을 취합니다. - 완료되면 즉시 모든 세척 및 건조 된 구성 요소를 보관하십시오.
결과
이 데모 전에, 계측기의 교정은 폴리스티렌 비드 표준의 크기 분포를 측정하여 획득 된 데이터의 유효성을 보장하기 위해 먼저 테스트되었습니다. 기본 기록 매개 변수및 이 프로토콜에 권장되는 처리 설정을 사용하여 100nm 및 400 nm 구슬의 크기 분포를 테스트했습니다(그림8).
100 nm 폴리스티렌 비드 표준의 경우 4.205 x 107 입자 /mL의 농도를 측정하...
토론
여기서, 우리는 다양한 입자 크기의 크기 분포를 동시에 측정하고 다분산 샘플에서 총 EV 농도를 측정하는 NTA의 NTA 프로토콜을 시연한다. 이 연구에서는 마우스 페리고나달 지방 조직과 인간 혈장이 EV의 공급원으로 사용되었습니다. 그러나, 혈청, 소변, 타액, 모유, 양수 및 세포 배양 과 같은 다른 조직 또는 생물학적 유체로부터 분리된 전기자동차도 NTA에 사용될 수 있다. 폴리스티렌 비드 표준의...
공개
모든 저자는 이해 상충이 없다고 선언했다.
감사의 말
이 작품은 국립 보건원 (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608)에 의해 지원되었습니다. 우리는 제프리 바디콤, 호리바 인스트루먼트 박사, 악기 를 보정하는 그의 도움을 위해 통합 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | - | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | - | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | - | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | - | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | - | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | - | Nanoparticle tracking instrument |
참고문헌
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution - a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유