È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Semplice monitoraggio continuo del glucosio in topi che si muovono liberamente
In questo articolo
Riepilogo
Qui, descriviamo un metodo semplice per impiantare un monitor glicemico continuo commerciale progettato per i pazienti sui topi e forniamo gli script per analizzare i risultati.
Abstract
I topi sono un organismo modello comune utilizzato per studiare malattie metaboliche come il diabete mellito. I livelli di glucosio sono tipicamente misurati dal sanguinamento della coda, che richiede la manipolazione dei topi, provoca stress e non fornisce dati sui topi che si comportano liberamente durante il ciclo oscuro. La misurazione continua del glucosio nei topi richiede l'inserimento di una sonda nell'arco aortico del topo, nonché un sistema di telemetria specializzato. Questo metodo impegnativo e costoso non è stato adottato dalla maggior parte dei laboratori. Qui, presentiamo un semplice protocollo che prevede l'utilizzo di monitor glicemici continui disponibili in commercio utilizzati da milioni di pazienti per misurare continuamente il glucosio nei topi come parte della ricerca di base. La sonda sensibile al glucosio viene inserita nello spazio sottocutaneo nella parte posteriore del topo attraverso una piccola incisione sulla pelle e viene tenuta in posizione saldamente usando un paio di punti di sutura. Il dispositivo viene suturato sulla pelle del topo per garantire che rimanga in posizione. Il dispositivo può misurare i livelli di glucosio per un massimo di 2 settimane e invia i dati a un ricevitore vicino senza alcuna necessità di maneggiare i topi. Vengono forniti script per l'analisi dei dati di base dei livelli di glucosio registrati. Questo metodo, dalla chirurgia all'analisi computazionale, è economico e potenzialmente molto utile nella ricerca metabolica.
Introduzione
Il diabete mellito (DM) è una malattia devastante caratterizzata da alti livelli di glucosio nel sangue. Il DM di tipo 1 può essere il risultato di un attacco autoimmune sulle cellule beta produttrici di insulina nel pancreas. Il DM di tipo 2 e il DM gestazionale, d'altra parte, sono caratterizzati da un fallimento delle cellule beta nel secernere insulina sufficiente in risposta a un aumento dei livelli di glucosio1. Il topo è un organismo modello comune utilizzato per studiare il DM poiché ha una fisiologia simile e i suoi normali livelli di glucosio sono vicini a quelli degli esseri umani. Inoltre, ceppi murini specifici possono sviluppare DM a causa di mutazioni nelle vie di segnalazione chiave o in seguito all'esposizione a diete specifiche, che consente la modellazione della malattia 2,3,4.
La glicemia viene comunemente misurata nei topi utilizzando glucometri progettati per i pazienti estraendo una piccola goccia di sangue (1-2 μL) dalla punta della coda del topo. Questo metodo provoca stress e richiede la manipolazione del topo, che influisce sui livelli di glucosio e vieta la misurazione dei livelli di glucosio nel sangue nei topi che si comportano liberamente o quando il ricercatore non è vicino a5. Il sanguinamento dei topi può causare stress ai topi vicini, in particolare ai topi della stessa gabbia la cui glicemia non è stata ancora misurata, influenzando così i risultati. I topi rispondono in modo diverso a seconda del conduttore e la persona che misura il glucosio può influenzare i livelli di glucosio dei topi. Queste insidie richiedono un'attenta progettazione sperimentale e sono alla base di alcune incongruenze tra gli esperimenti.
È possibile misurare il glucosio in topi che si muovono liberamente senza sanguinamento impiantando sensori di glucosio nell'arco aortico dei topi utilizzando la telemetria all'avanguardia6. Le misurazioni risultanti sono molto buone e possono essere sostenute per un lungo periodo, ma è difficile impiantare questi sensori e il sistema di telemetria è costoso, portando a un'adozione moderata di questa metodologia e nessuna adozione in laboratori non specializzati. Negli ultimi anni sono stati sviluppati sensori sottocutanei o altri sensori di glucosio adattati alle dimensioni dei topi e alla loro fisiologia, ma anche questi richiedono esperti altamente qualificati e in alcuni casi sono costosi 6,7,8,9,10.
I monitor glicemici continui commerciali (CGM) originariamente sviluppati per monitorare i livelli di glucosio dei pazienti con DM offrono un'altra opzione per misurare il glucosio nei topi che si muovono liberamente, con costi inferiori e requisiti di competenza tecnica rispetto alle sonde impiantate. Tali sonde sono state utilizzate nella ricerca di base da alcuni laboratori 5,11,12,13,14,15 compresi i nostri colleghi che hanno usato questo protocollo 16. Questi dispositivi includono in genere un sensore, un dispositivo di montaggio, un ricevitore e un'applicazione software. Il sensore ha una cannula che guida il glucosensore enzimatico, nastro adesivo, una fonte di energia, memoria a breve termine e un modulo di comunicazione wireless che memorizza e invia i dati al ricevitore. Il ricevitore può mostrare i livelli di glucosio attuali e invia i dati a un server; Questo ricevitore può essere un cellulare. L'applicazione software fornisce dati per il paziente e il team di assistenza medica sulla glicemia del paziente. Nei pazienti, il sensore viene collegato facilmente utilizzando il dispositivo di montaggio. La cannula viene inserita per via sottocutanea premendo il dispositivo di montaggio contro la pelle e il sensore rimane in posizione con l'aiuto del nastro adesivo.
Questo è un protocollo dettagliato per adattare un dispositivo CGM commerciale per misurare i livelli di glucosio nei topi. Questo protocollo descrive come inserire chirurgicamente il sensore di glucosio e collegarlo al mouse. Vengono forniti script per l'analisi e la visualizzazione dei dati di base. Vengono fornite le potenziali insidie, la risoluzione dei problemi e gli esempi di risultati standard. Il protocollo seguente è specifico per un determinato CGM, ma può essere facilmente adattato ad altri tipi di CGM commerciali non appena diventano disponibili.
Protocollo
Gli esperimenti sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) dell'Università Ebraica.
NOTA: Tutti gli strumenti devono essere sterilizzati e la manipolazione della cannula deve essere eseguita utilizzando una tecnica sterile. Il protocollo seguente è ottimizzato per un CGM specifico. Il protocollo può essere adattato ad altri CGM.
1. Somministrazione analgesica prima della procedura
- Somministrare destrosio al 5% e soluzione salina allo 0,45% con meloxicam a 5 mg/kg di peso corporeo per via sottocutanea.
2. Somministrazione dell'anestesia
- Posizionare il mouse nella camera di induzione, chiudendo ermeticamente il coperchio. Impostare l'induzione dell'anestesia nella camera di induzione al 3% di isoflurano ad una portata di 500 ml/min.
- Una volta che il mouse non risponde, rimuovere il mouse dalla camera e adattare il cono del naso al mouse. Confermare il livello di anestesia con un pizzico interdigitale. Impostare la concentrazione su 1%-1,5% di isoflurano e la portata su 100 ml/min in un topo del peso di 30 g.
- Applicare unguento oftalmico agli occhi per prevenire la secchezza durante l'anestesia.
3. Preparazione del sensore
- Montare il sensore sul dispositivo di montaggio del sensore per esporre il nastro del sensore e il lato della cannula (Figura 1A). Prestare attenzione poiché l'ago viene inserito nella cannula ed esposto.
- Suturare due suture a punta di conicità 5-0 sul nastro su entrambi i lati della cannula (Figura 1A).
4. Depilazione e disinfezione
- Rasare un'area di circa 4 cm x 4 cm sulla linea mediana del dorso del mouse.
- Somministrare una crema depilatoria sulla zona rasata per garantire la completa depilazione.
- Pulire la pelle e disinfettarla con una soluzione antisettica contenente il 2% di clorexidina gluconato e il 70% di alcool isopropilico.
5. Preparazione della pelle dorsale
- Fare un'incisione di 2 mm al centro dell'area rasata sopra la colonna vertebrale usando forbici affilate (Figura 1B).
- Brevemente, inserire una piccola pinza con un bordo smussato sotto la pelle per formare una piccola tasca sottocutanea in modo che la cannula possa essere inserita facilmente nella tasca sottocutanea (Figura 1B).
- Passare una sutura dal punto 3.2 attraverso la pelle su ciascun lato dell'incisione (Figura 1C).
6. Inserimento del sensore
- Rimuovere completamente il sensore dal dispositivo di montaggio del sensore (la cannula è vuota dall'ago) e tenere il sensore con una pinza per evitare che il nastro circostante si attacchi a se stesso.
- Inserire con cautela la cannula nella tasca sottocutanea.
- Tirare le suture su ciascun lato, stringerle e legarle per fissare saldamente il sensore in posizione, evitando così che la cannula scivoli fuori dalla tasca sottocutanea una volta che il nastro adesivo si allenta nel tempo.
7. Attacco e sutura del sensore
- Fissare saldamente il sensore alla parte posteriore legando le suture interne e utilizzando il nastro adesivo che circonda il sensore.
- Effettuare otto punti di sutura discontinui attorno al sensore, attaccando il bordo del nastro adesivo del sensore alla pelle (Figura 1D).
8. Attivazione del lettore
- Una volta inserito il sensore, attivare il lettore accendendo il lettore, premendo Avvia nuovo sensore e facendo scorrere il sensore seguendo le istruzioni del produttore.
- La prima lettura può essere eseguita solo pochi minuti dopo l'installazione del CGM. Nel caso di questo CGM, la prima lettura può essere presa dopo 60 minuti.
9. Risultati di lettura
- Posizionare il lettore vicino al mouse (non è necessario toccarlo). Tutti i dati memorizzati nel sensore vengono trasmessi al lettore.
NOTA: diversi dispositivi CGM possono differire nel periodo di capacità di salvataggio dei dati storici. Nel caso di questo CGM, è possibile memorizzare un massimo di 8 ore tra due letture.
10. Rimozione del sensore
- Anestetizzare il mouse (vedere paragrafo 2).
- Tagliare le suture che collegano il sensore alla parte posteriore del mouse usando forbici affilate.
- Rimuovere e tagliare le suture all'incisione rimuovendo delicatamente il sensore.
- Se necessario, utilizzare una singola sutura per chiudere l'incisione nella parte posteriore del mouse.
11. Analisi dei dati
- Download dei dati: scaricare i dati secondo le istruzioni fornite dal produttore CGM.
NOTA: Ogni CGM ha un formato diverso, che può o non può essere facilmente accessibile all'utente. Questa è una considerazione importante nella scelta del CGM. - Per l'analisi con il software fornito, formattare i dati secondo le istruzioni nel file readme su Github (https://github.com/mika-littor/CGM-in-Mice-Analysis.git).
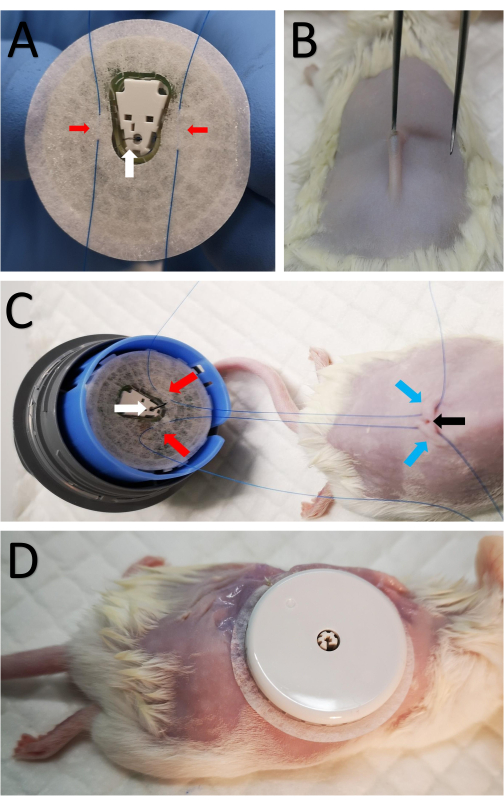
Figura 1: Fissaggio del sensore al mouse . (A) Due punti di sutura contrassegnati da frecce rosse passano attraverso il nastro del sensore su entrambi i lati della cannula sul lato inferiore del sensore CGM, contrassegnati da una freccia bianca. (B) Una piccola incisione di 2 mm viene praticata al centro dell'area rasata lungo la colonna vertebrale usando forbici affilate. Piccole pinze con un bordo smussato vengono brevemente inserite sotto la pelle per formare una piccola tasca sottocutanea in modo che la cannula possa essere inserita per via sottocutanea. (C) Le stesse suture da A vengono passate per via sottocutanea su ciascun lato dell'incisione. Le frecce rosse indicano le suture collegate al sensore come in A, le frecce blu indicano la posizione in cui le suture sono passate attraverso la pelle nella parte posteriore del mouse e la freccia nera mostra l'incisione. (D) Dopo aver inserito la cannula, le suture interne vengono serrate e legate vicino all'incisione per fissare il CGM. Il sensore viene quindi suturato sulla pelle. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Esito chirurgico
Vengono mostrati i risultati di otto topi HSD:ICR (di 8 settimane) alimentati con una dieta ricca di grassi ad alto contenuto di saccarosio (HFHS) per 18 settimane e cinque topi HSD:ICR magri (di 12 settimane). Il dispositivo che abbiamo utilizzato memorizza i dati per un massimo di 8 ore. L'accesso alla struttura locale per animali è stato limitato alle 07:00-19:00, vietando così la raccolta dei dati durante le ore del pomeriggio, quando i topi sono attivi. I topi sono stati, quind...
Discussione
Questo protocollo offre un metodo semplice ed economico per monitorare i livelli di glucosio nei topi che non richiede microchirurgia impegnativa e non comporta sanguinamento o manipolazione dei topi. Il metodo è facile da implementare in ogni struttura e non causa mortalità, dolore o eccessivo disagio ai topi. Il passaggio più critico nel protocollo è l'inserimento della cannula del sensore di glucosio sotto la pelle del topo. L'aggiunta di alcuni punti di sutura consente alla cannula di rimanere in posizione per un...
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Ringraziamo Dvir Mintz DVM e il personale veterinario e zootecnico della struttura per animali, nonché i membri del nostro gruppo, per le fruttuose discussioni. Questo studio è stato supportato da una sovvenzione della Israel Science Foundation 1541/21 assegnata a D.B.Z. D.B.Z. è una facoltà STEM di Zuckerman.
Materiali
| Name | Company | Catalog Number | Comments |
| 2% Chlorhexidine Gluconate and 70% Isopropyl Alcohol | 3M | ID 7000136290 | |
| 5% Dextrose and 0.45% Sodium Chloride Injection, USP | Braun | L6120 | |
| Castroviejo needle holder | FST | 12061-02 | |
| Extra Fine Bonn scissors | FST | 14084-08 | |
| FreeStyle Libre 1 reader | Abbott | ART27543 | |
| FreeStyle Libre sensor | Abbott | ART36687 | |
| FreeStyle Libre sensor applicator | Abbott | ART36787 | |
| Gauze pads | Sion medical | PC912017 | |
| Graefe Forceps | FST | 11052-10 | |
| Hair Removal Cream | Veet | 3116523 | |
| High-fat high-sucrose diet | Envigo Teklad diets | TD.08811 | |
| Isoflurane, USP Terrell | Piramal | 26675-46-7 | |
| Meloxicam 5 mg/mL | Chanelle Pharma | 08749/5024 | |
| MiniARCO Clipper kit | Moser | CL8787-KIT | |
| PROLENE Polypropylene Suture 5-0 | Ethicon | 8725H | |
| Puralube Opthalmic Ointment | Perrigo | 574402511 | |
| Q-tips | B.H.W | 271676 | |
| SomnoSuite Low-Flow Anesthesia System | Kent Scientific | SOMNO |
Riferimenti
- Polonsky, K. S. The past 200 years in diabetes. New England Journal of Medicine. 367 (14), 1332-1340 (2012).
- Rees, D. A., Alcolado, J. C. Animal models of diabetes mellitus. Diabetic Medicine. 22 (4), 359-370 (2005).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the non-obese diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Heydemann, A. An overview of murine high fat diet as a model for Type 2 diabetes mellitus. Journal of Diabetes Research. 2016, 2902351 (2016).
- Kennard, M. R., et al. The use of mice in diabetes research: The impact of experimental protocols. Diabetic Medicine. 38 (12), 14705 (2021).
- Klueh, U., et al. Continuous glucose monitoring in normal mice and mice with prediabetes and diabetes. Diabetes Technology and Therapeutics. 8 (3), 402-412 (2006).
- Wuyts, C., Simoens, C., Pinto, S., Philippaert, K., Vennekens, R. Continuous glucose monitoring during pregnancy in healthy mice. Scientific Reports. 11, 4450 (2021).
- Korstanje, R., et al. Continuous glucose monitoring in female NOD mice reveals daily rhythms and a negative correlation with body temperature. Endocrinology. 158 (9), 2707-2712 (2017).
- Han, B. G., et al. Markers of glycemic control in the mouse: Comparisons of 6-h-and overnight-fasted blood glucoses to Hb A1c. American Journal of Physiology - Endocrinology and Metabolism. 295 (4), 981-986 (2008).
- Xie, X., et al. Reduction of measurement noise in a continuous glucose monitor by coating the sensor with a zwitterionic polymer. Nature Biomedical Engineering. 2 (12), 894-906 (2018).
- Van Der Meulen, T., et al. Urocortin3 mediates somatostatin-dependent negative feedback control of insulin secretion. Nature Medicine. 21 (7), 769-776 (2015).
- Peterson, Q. P., et al. A method for the generation of human stem cell-derived alpha cells. Nature Communications. 11, 2241 (2020).
- Klueh, U., Liu, Z., Feldman, B., Kreutzer, D. Interstitial fluid physiology as it relates to glucose monitoring technologies: Importance of Interleukin-1 and Interleukin-1 receptor antagonist in short-term glucose sensor function in vivo. Journal of Diabetes Science and Technology. 4 (5), 1073 (2010).
- Klueh, U., Antar, O., Qiao, Y., Kreutzer, D. L. Role of interleukin-1/interleukin-1 receptor antagonist family of cytokines in long-term continuous glucose monitoring in vivo. Journal of Diabetes Science and Technology. 7 (6), 1538 (2013).
- Klueh, U., Kaur, M., Qiao, Y., Kreutzer, D. L. Critical role of tissue mast cells in controlling long-term glucose sensor function in vivo. Biomaterials. 31 (16), 4540-4551 (2010).
- Kogot-Levin, A., et al. Mapping the metabolic reprogramming induced by sodium-glucose cotransporter 2 inhibition. JCI Insight. , 164296 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon