A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
كروماتوغرافيا الغاز - الأيض المستهدف القائم على قياس الطيف الكتلي لعينات المرجان الصلب
In This Article
Summary
هنا ، نقدم استخراج وإعداد المستقلبات القطبية وشبه القطبية من holobiont المرجانية ، وكذلك الأنسجة المضيفة المرجانية المنفصلة وكسور خلايا Symbiodiniaceae ، لتحليل مطياف الكتلة اللوني الغازي.
Abstract
أثبتت الأساليب القائمة على قياس الطيف الكتلي اللوني للغاز (GC-MS) أنها قوية لتوضيح الأساس الأيضي لتكافل cnidarian-dinoflagellate وكيف يستجيب المرجان للإجهاد (أي أثناء التبييض الناجم عن درجة الحرارة). تم تطبيق التنميط المستقلب في الحالة المستقرة للهولوبيونت المرجاني ، والذي يضم المضيف cnidarian والميكروبات المرتبطة به (Symbiodiniaceae وغيرها من الطلائعيات والبكتيريا والعتائق والفطريات والفيروسات) بنجاح في ظل الظروف المحيطة والإجهاد لتوصيف الحالة الأيضية الشاملة للمرجان.
ومع ذلك ، للإجابة على الأسئلة المحيطة بالتفاعلات التكافلية ، من الضروري تحليل ملامح الأيض للمضيف المرجاني وتعايشاته الطحلبية بشكل مستقل ، والتي لا يمكن تحقيقها إلا عن طريق الفصل المادي وعزل الأنسجة ، يليها استخراج وتحليل مستقل. في حين أن تطبيق الأيض جديد نسبيا في مجال المرجان ، فقد أدت الجهود المستمرة لمجموعات البحث إلى تطوير طرق قوية لتحليل المستقلبات في الشعاب المرجانية ، بما في ذلك فصل الأنسجة المضيفة المرجانية والطحالب المتعايشة.
تقدم هذه الورقة دليلا تفصيليا لفصل holobiont واستخراج المستقلبات لتحليل GC-MS ، بما في ذلك خطوات التحسين الرئيسية للنظر فيها. نوضح كيف ، بمجرد تحليلها بشكل مستقل ، فإن ملف الأيض المشترك للجزأين (المرجان و Symbiodiniaceae) يشبه ملف تعريف الكل (holobiont) ، ولكن من خلال فصل الأنسجة ، يمكننا أيضا الحصول على معلومات أساسية حول التمثيل الغذائي والتفاعلات بين الشريكين التي لا يمكن الحصول عليها من الكل وحده.
Introduction
تمثل المستقلبات المنتجات النهائية للعمليات الخلوية ، ويمكن أن توفر الأيضات - دراسة مجموعة المستقلبات التي ينتجها كائن حي أو نظام بيئي معين - مقياسا مباشرا لعمل الكائن الحي1. وهذا أمر بالغ الأهمية بشكل خاص لاستكشاف النظم الإيكولوجية والتفاعلات التكافلية وأدوات الاستعادة ، حيث أن الهدف من معظم استراتيجيات الإدارة هو الحفاظ على (أو استعادة) وظائف خدمة النظام الإيكولوجي المحددة2. الشعاب المرجانية هي أحد النظم الإيكولوجية المائية التي توضح القيمة المحتملة لعملية التمثيل الغذائي لتوضيح التفاعلات التكافلية وربط الاستجابات الفسيولوجية المرجانية بالتأثيرات على مستوى المجتمع ومستوى النظام الإيكولوجي3. يحظى تطبيق قياس الطيف الكتلي لكروماتوغرافيا الغاز عالي الإنتاجية (GC-MS) بتقدير خاص نظرا لقدرته على التحليل السريع لمجموعة واسعة من فئات الأيض في وقت واحد بانتقائية وحساسية عالية ، وتوفير تحديد سريع للمركب عند توفر المكتبات الطيفية ، وتوفير مستوى عال من التكرار والدقة ، بتكلفة منخفضة نسبيا لكل عينة.
الشعاب المرجانية هي holobionts تتكون من المرجان ، و endosymbionts dinoflagellate الضوئي (العائلة: Symbiodiniaceae4) ، وميكروبيوم معقد 5,6. بشكل عام ، يتم الحفاظ على لياقة holobiont في المقام الأول من خلال تبادل الجزيئات والعناصر الصغيرة لدعم الأداء الأيضي لكل عضو7،8،9،10. أثبتت الأساليب الأيضية أنها قوية بشكل خاص لتوضيح الأساس الأيضي لخصوصية التكافل 9,11 ، واستجابة التبييض للإجهاد الحراري7،8،12،13 ، واستجابات المرض 14 ، واستجابات التعرض للتلوث 15 ، والتأقلم الضوئي 16 ، والإشارات الكيميائية 17 في الشعاب المرجانية ، وكذلك المساعدة في اكتشاف العلامات الحيوية 18، 19. بالإضافة إلى ذلك ، يمكن أن توفر الأيضات تأكيدا قيما للاستنتاجات المستنتجة من التقنيات القائمة على الحمض النووي والحمض النووي الريبي9،20. لذلك ، هناك إمكانات كبيرة لاستخدام الأيض لتقييم صحة الشعاب المرجانية وتطوير أدوات للحفاظ على الشعاب المرجانية3 ، مثل من خلال الكشف عن المؤشرات الحيوية الأيضية للإجهاد18,19 ولدراسة إمكانات استراتيجيات الإدارة النشطة مثل الإعانات الغذائية21.
يمكن أن يؤدي فصل الخلايا المضيفة والخلايا المتعايشة وتحليل ملفات تعريف الأيض الخاصة بها بشكل مستقل ، بدلا من تجميعها معا مثل holobiont ، إلى مزيد من المعلومات حول تفاعلات الشريك ، والحالات الفسيولوجية والأيضية المستقلة ، والآليات الجزيئية المحتملة للتكيف11،12،22،23،24. بدون فصل المرجان و Symbiodiniaceae ، يكاد يكون من المستحيل توضيح مساهمة واستقلاب المرجان و / أو Symbiodiniaceae بشكل مستقل ، باستثناء إعادة بناء الجينوم المعقدة والنمذجة الأيضية25 ، ولكن هذا لم يتم تطبيقه بعد على تكافل المرجان ثنائي السوط. علاوة على ذلك ، فإن محاولة استخراج معلومات حول التمثيل الغذائي الفردي للمضيف أو الطحالب المتعايشة من ملف الأيض الخاص بالهولوبيونت يمكن أن يؤدي إلى سوء التفسير.
على سبيل المثال ، حتى وقت قريب ، كان يعتقد أن وجود الأحماض الدهنية المتعددة غير المشبعة C18: 3n-6 و C18: 4n-3 و C16 في مستخلصات من أنسجة المرجان و holobiont مشتق من الطحالب المتكافلة ، حيث كان من المفترض أن الشعاب المرجانية لا تمتلك ωx desaturases الأساسية لإنتاج أحماض أوميغا 3 الدهنية (ω3) ؛ ومع ذلك ، تشير الأدلة الجينومية الحديثة إلى أن العديد من cnidarians لديهم القدرة على إنتاج ω3 PUFA de novo والمزيد من التخليق الحيوي ω3 PUFA26 طويل السلسلة. يمكن استخدام الجمع بين GC-MS مع وضع العلامات النظيرية المستقرة (على سبيل المثال ، 13 C-bicarbonate ، NaH13CO 3) لتتبع مصير الكربون الثابت ضوئيا من خلال شبكات التمثيل الغذائي holobiont المرجانية في ظل ظروف التحكم واستجابة للضغوط الخارجية27,28. ومع ذلك ، فإن الخطوة الحاسمة في تتبع مصير 13 C هي فصل الأنسجة المرجانية عن خلايا الطحالب - عندها فقط يمكن تعيين وجود مركب يحمل علامة 13C في جزء مضيف المرجان بشكل لا لبس فيه كمستقلب مشتق من Symbiodiniaceae يتم نقله إلى المرجان أو منتج مصب لمركب مسمى منقولة. أثبتت هذه التقنية قوتها من خلال تحدي الافتراض السائد منذ فترة طويلة بأن الجلسرين هو الشكل الأساسي الذي يتم فيه نقل التمثيل الضوئي من المتعايش إلى المضيف29 ، بالإضافة إلى توضيح كيفية تغير التدفق الغذائي بين الشركاء أثناء التبييض27,28 واستجابة لأنواع Symbiodiniaceae غير المتوافقة11.
في حين أن قرار فصل الأنسجة مدفوع في المقام الأول بسؤال البحث ، فإن التطبيق العملي والموثوقية والتأثيرات الأيضية المحتملة لهذا النهج مهمة في الاعتبار. هنا ، نقدم طرقا مفصلة ومثبتة لاستخراج المستقلبات من holobiont ، بالإضافة إلى الكسور المضيفة والمتعايشة المنفصلة. نقارن ملامح الأيض للمضيف والمتعايش بشكل مستقل وكيف تقارن هذه الملفات الشخصية بملف تعريف مستقلب holobiont.
Protocol
ملاحظة: تم وصف التصميم التجريبي وجمع العينات وتخزينها بالتفصيل في مكان آخر2،30،31. يجب الحصول على الموافقة على تصريح جمع الشعاب المرجانية البرية قبل الجمع والتجريب. تم جمع العينات هنا من مستعمرات Montipora mollis (اللون الأخضر) المستوردة من مزارع باتافيا المرجانية (جيرالدتون ، واشنطن) ، والتي تم جمعها في الأصل من الشعاب المرجانية قبالة جزر أبروهلوس (غرب أستراليا ؛ 28 ° 52'43.3 "S 114 ° 00'17.0" E) على عمق 1 متر بموجب ترخيص الاستزراع المائي AQ1643. قبل أخذ العينات ، تم الاحتفاظ بالمستعمرات في حوض مائي سعة 800 لتر عند 35 PSU ، تحت الضوء الأزرق والأبيض عند 150 ميكرولتر فوتونات · م − 2 · ثانية − 1 ، وعند 25 درجة مئوية ± 0.5 درجة مئوية لمدة 3 أشهر. تم تجميد شظايا المرجان (~ 5 سم2 ، N = 6) في النيتروجين السائل وتخزينها عند -80 درجة مئوية حتى المعالجة.
1. إعداد حلول ومعدات الاستخراج
- على الأقل 1 يوم قبل إزالة الأنسجة المرجانية، وإعداد حلول استخراج والمعدات.
- قم بتبريد الماء عالي النقاء مسبقا في أواني زجاجية نظيفة وخالية من المنظفات عند 4 درجات مئوية.
- امزج الميثانول بدرجة LC بنسبة 100٪ مع تركيز نهائي 10 ميكروغرام · مل − 1 من المعيار (المعايير) الداخلية المناسبة (على سبيل المثال ، 13C6 السوربيتول).
- قم بإنشاء محلول استخراج الميثانول بنسبة 50٪ باستخدام نصف ميثانول بدرجة LC بنسبة 100٪ ونصف ماء فائق النقاء. قم بتخزين كل من محاليل الميثانول في درجة حرارة -20 درجة مئوية.
ملاحظة: للمساعدة في منع تدهور الأيضات ، يوصى بإجراء خطوات معالجة العينات على دفعات من خمس شظايا مرجانية في وقت واحد ، مع فراغ بيولوجي إضافي (الماء فقط) (إجمالي العينات N = 6). بمجرد فصل كل عينة مرجانية إلى جزأين (النسيج المضيف المرجاني ، من الآن فصاعدا "المضيف" ، وخلايا الطحالب الدقيقة ، من الآن فصاعدا "Symbiont") ، سيكون العدد الإجمالي للعينات في دفعة معالجة واحدة 12.
2. تبريد استقلاب المرجان
ملاحظة: تم وصف التصميم التجريبي وجمع العينات وتخزينها بالتفصيل في مكان آخر2،30،31. ومع ذلك ، تجدر الإشارة إلى أن الوقت المستغرق لإخماد التمثيل الغذائي (أي الوقت بين جمع عينات المرجان وحفظها) أمر بالغ الأهمية لالتقاط الاستجابة الأصلية30. الحفاظ على العينة في أسرع وقت ممكن بعد جمعها لمنع التغيرات في تكوين الأيض بسبب تدهور العينة أو الاستجابات الفسيولوجية غير المستهدفة32.
- ضع شظية المرجان في كيس معقم لجمع العينات ، واستنزاف أي مياه بحر زائدة قدر الإمكان. اغمر العينة في النيتروجين السائل لمدة لا تقل عن 30 ثانية. انقل العينات في أسرع وقت ممكن إلى مجمد -80 درجة مئوية للتخزين.
ملاحظة: يمكن تجميد العينات عند -80 درجة مئوية في حاويات مسدودة بالضوء حتى المعالجة ، وتجنب دورات التجميد والذوبان.
3. إزالة الأنسجة المرجانية من الهيكل العظمي
ملاحظة: يجب حفظ العينات على الثلج (4 درجات مئوية) في جميع الأوقات للتأكد من أنها في وقت واحد في شكل سائل مع منع التمثيل الغذائي المستمر.
- ضع كيسا نظيفا ومعقما لجمع العينات على الثلج بحيث يكون الكيس مستقرا ومفتوحا فوق الجليد في بئر ضحلة ولكن لا يتم غمره في الجليد. أضف 10 مل من الماء البارد (4 درجات مئوية) عالي النقاء إلى الكيس.
ملاحظة: سيساعد ذلك على تجنب ذوبان الجليد المتكرر لجزء المرجان بسبب الهواء البارد المضغوط والجليد المحيط. - اختر جزءا من المرجان بملاقط معقمة ، واشطفه بماء بارد (4 درجات مئوية) عالي النقاء باستخدام ماصة باستور معقمة حتى لا تبقى بقايا مياه البحر. اغمر جزء المرجان المغسول في الكيس الذي يحتوي على 10 مل من الماء عالي النقاء.
ملاحظة: هذا الشطف أمر بالغ الأهمية لإزالة أي أملاح متبقية من شأنها أن تتداخل مع تحليل المصب. تجنب ملامسة اليد للماء أو شظية المرجان من خلال الكيس للحفاظ على العينة عند 4 درجات مئوية. - قم بلصق طرف ماصة معقم سعة 1 مل على نهاية مسدس هوائي بشريط كهربائي ، مع قطع ~ 5 مم من نهاية الطرف (الشكل 1 أ).
- صوب مسدس الهواء على الجزء المرجاني بحيث يكون الكيس نصف مغلق وتدفق الهواء على وسط منخفض لإزالة الأنسجة برفق عن طريق تشجيع حركة دائرية للمياه فوق جزء المرجان.
- بعد ~ 3 دقائق ، أو عندما يبدو أن جميع الأنسجة قد تمت إزالتها من الهيكل العظمي ، قم بإيقاف تشغيل الهواء وإزالة البخاخة. أغلق الكيس تماما.
- اضغط على جميع الأنسجة المرجانية التي تمت إزالتها في الزاوية السفلية من الكيس. اقطع الزاوية المقابلة واسكب محتويات الكيس برفق في أنبوب سعة 15 مل على الثلج.
4. التجانس الاختياري
ملاحظة: بعض الأنواع المرجانية أكثر لزوجة من غيرها ، مما يعني أن تنظيف الهواء بالفرشاة سيزيل الأنسجة في كتل بدلا من الملاط. إذا كانت كتل الأنسجة مرئية في التجانس المصقول بالهواء ، فيمكن إضافة خطوة تجانس عند 4 درجات مئوية لجميع العينات.
- نظف الخالط الميكانيكي لسن المنشار مرتين باستخدام 4 درجات مئوية 70٪ ميثانول وأخيرا بماء فائق النقاء 4 درجات مئوية.
- تجانس عينة المرجان في أنبوب 15 مل لمدة ~ 1 دقيقة حتى يتم تجانس العينة بالكامل وعدم ظهور كتل.
- نظف الخالط كما في الخطوة 4.1 بين كل عينة. حافظ على اتساق وقت التجانس عبر العينات.
5. جمع العينات للتطبيع
- اجمع حصة 1000 ميكرولتر من الأنسجة المتجانسة لتعداد خلايا Symbiodiniaceae ، وتحليل محتوى بروتين الأنسجة المضيفة المرجانية ، وتقدير الكلوروفيل. يحفظ في درجة حرارة -20 درجة مئوية حتى يصبح جاهزا للتحليل (القسم 10).
6. اختياري أنسجة مضيف المرجان - فصل الخلايا Symbiodiniaceae
- أجهزة الطرد المركزي تجانس المرجان عند 2500 × جم لمدة 5 دقائق عند 4 درجات مئوية باستخدام جهاز طرد مركزي مبرد.
ملاحظة: هذه السرعة مثالية لفصل خلايا Symbiodiniaceae الأثقل ، مع الحفاظ على جدرانها الخلوية سليمة ، عن الأنسجة المضيفة ، المعلقة في المادة الطافية. - قم بإزالة المادة الطافية التي تحتوي على المادة المضيفة ، وضعها في أنبوب جديد سعة 15 مل.
ملاحظة: تشكل الدهون من الأنسجة المضيفة عادة طبقة وردية / بيضاء ضيقة فوق الخلايا المتعايشة. يمكن جمع هذه الطبقة مع المادة الطافية المضيفة القابلة للذوبان عن طريق السحب (الشكل 1 ب). - دوامة بقوة المضيف لمدة 1 دقيقة بالضبط. احتفظ بعينة حبيبات الطحالب وعينة طاف المضيف على الجليد.
- أضف 2 مل من الماء عالي النقاء عند 4 درجات مئوية إلى حبيبات الطحالب. دوامة بقوة لمدة 2 دقيقة بالضبط لإعادة تعليق بيليه.
ملاحظة: إذا لم يتم جمع شظايا فردية من 1 سم من مستعمرة المرجان للتنميط الجيني ل Symbiodiniaceae ، فيمكن جمع حصة 200 ميكرولتر من معلق خلية Symbiodiniaceae هنا ، وحفظها في محلول عازلة الحمض النووي المفضل ، وتخزينها كما هو موضح في Thurber et al.30 للتنميط الجيني Symbiodiniaceae (على سبيل المثال ، وفقا ل González-Pech et al.12). - كرر الخطوات 6.1-6.4 مرة أخرى.
ملاحظة: يعتمد الفصل الموثوق بين المضيف والمتعايش على الكتلة الحيوية المرجانية والأنواع ، حيث يمكن أن تكون بعض الأنواع أكثر لزوجة من غيرها. يوصى بثلاث خطوات غسيل على الأقل ، ولكن يمكن زيادة ذلك اعتمادا على نجاح الفصل. كرر خطوات الغسيل 4.7-4.9 حتى لا يمكن رؤية خلايا Symbiodiniaceae في الجزء السفلي من الجزء المضيف وحتى يصبح جزء Symbiodiniaceae خاليا بشكل واضح من المواد المضيفة (على سبيل المثال ، لا توجد طبقة بيضاء في الأعلى) (الشكل 1). - قم بإزالة المادة الطافية التي تحتوي على المادة المضيفة ، وضعها في أنبوب جديد سعة 15 مل.
- احتفظ بالحبيبات المتعايشة في أنبوب سعة 15 مل.
7. تجفيف العينة
- قم بتجميد إما تجانس holobiont أو كل من المضيف المنفصل وكسور Symbiodiniaceae ، عند -80 درجة مئوية لمدة ~ 120 دقيقة. قم بتجفيف العينات بالتجميد طوال الليل باستخدام فراغ 0.01 ملي بار عند -85 درجة مئوية.
ملاحظة: لتجنب فقدان العينة أثناء التجفيد ، يوصى باستخدام غطاء مقطوع من أنبوب معقم آخر ، أو بارافيلم معقم ، مع ثقب ~ 2 مم مثقوب بعناية باستخدام إبرة معقمة 25 جرام. - عندما تجف ، باستخدام ميزان المختبر ، تزن واحدا مما يلي: 1) 25 ملغ من holobiont ؛ 2) 15 ملغ من الكسر المتعايش ؛ أو 3) 30 ملغ من الأنسجة المضيفة من كل عينة إلى أنابيب طرد مركزي منفصلة خالية من الملدنات سعة 2 ملدنات.
ملاحظة: خطوة حاسمة: يعد تحسين الكتلة الحيوية للاستخراج أمرا ضروريا لضمان عدم تحميل GC-MS بشكل زائد مع ضمان إشارة كافية. المواد المرجانية المجففة ثابتة للغاية. لتجنب فقدان العينة، استخدم الأجهزة المضادة للكهرباء الساكنة للتخلص من الشحنات الكهروستاتيكية من العينات وأوعية الوزن. بديل بسيط وفعال من حيث التكلفة هو وضع ورقة مجفف الغسيل تحت أنبوب العينة. يمكن قطع الحبيبات المتعايشة المجففة إلى الوزن المطلوب باستخدام شفرة معقمة.
8. استخراج المستقلب داخل الخلايا
- استخراج المستقلب داخل الخلايا من holobiont المجففة بالتجميد:
- أضف 400 ميكرولتر من الميثانول البارد بنسبة 100٪ (-20 درجة مئوية) مع المعيار / المعايير الداخلية (IS; 13C6 السوربيتول و / أو 13C5-15 N فالين ، عند 10ميكرومتر) لكل أنبوب.
- أضف عددا صغيرا من 710-1180 ميكرومتر من الخرز الزجاجي المغسول بالحمض (~ 10 مجم) لكل عينة. ضعه في مطحنة الخرز عند 50 هرتز لمدة 3 دقائق في مطحنة حبة مبردة مسبقا (-20 درجة مئوية).
- أضف 600 ميكرولتر إضافية من الميثانول البارد بنسبة 100٪ (-20 درجة مئوية) مع ISs (13 C6 سوربيتول و / أو 13C 5-15 N فالين ، عند 10ميكرومتر) لكل أنبوب.
- دوامة لخلط لمدة 1 دقيقة. ضعيها على شاجة المشواء على حرارة 4 درجات مئوية لمدة 30 دقيقة.
- استخراج المستقلب داخل الخلايا من خلايا Symbiodiniaceae المجففة بالتجميد:
- أضف 200 ميكرولتر من الميثانول البارد 100٪ (-20 درجة مئوية) مع ISs (13 C6 السوربيتول و / أو 13C 5-15 N فالين ، عند 10ميكرومتر) إلى مادة Symbiodiniaceae المجففة.
- أضف عددا صغيرا من 710-1180 ميكرومتر من الخرز الزجاجي المغسول بالحمض (~ 10 مجم). ضعه في مطحنة الخرز عند 50 هرتز لمدة 3 دقائق في مطحنة حبة مبردة مسبقا (-20 درجة مئوية).
- أضف 800 ميكرولتر أخرى من الميثانول البارد بنسبة 100٪ (-20 درجة مئوية) مع ISs ، والدوامة لمدة 30 ثانية.
- استخراج المستقلب داخل الخلايا من الأنسجة المضيفة المجففة بالتجميد المنفصلة:
- أضف 1 مل من الميثانول البارد 100٪ (-20 درجة مئوية) المحتوي على ISs (13 C6 سوربيتول و / أو 13C 5-15 N فالين ، عند 10ميكرومتر) إلى المادة المضيفة المجففة.
- دوامة لخلط لمدة 20 ثانية. ضعه في حامل أنبوب عائم في حوض صوتنة مضبوط على درجة حرارة 4 درجات مئوية لمدة 30 دقيقة.
9. تنقية استخراج الأيض
- أجهزة الطرد المركزي العينات (holobiont / host / symbiont) عند 3000 × جم لمدة 30 دقيقة عند 4 درجات مئوية.
- انقل كل المادة الطافية إلى أنبوب طرد مركزي صغير جديد سعة 2 مل ، مع الحرص على عدم إزعاج حبيبات حطام الخلية.
ملاحظة: هذه هي المستخلصات شبه القطبية. يمكن الاحتفاظ بها على الجليد مؤقتا ولكن يتم تخزينها على المدى الطويل عند -80 درجة مئوية في الظلام. - أضف إلى بقايا الخلايا المتبقية 1000 ميكرولتر من الميثانول البارد بنسبة 50٪ (-20 درجة مئوية). دوامة بقوة لمدة 1 دقيقة لإنعاش.
- أجهزة الطرد المركزي العينات عند 3000 × جم لمدة 30 دقيقة عند 4 درجات مئوية.
- جمع وتجميع المادة الطافية (المستخلصات القطبية) مع المستخلصات شبه القطبية من نفس العينة.
ملاحظة: يمكن تخزين بقايا الخلايا عند -80 درجة مئوية واستخدامها لتطبيع محتوى البروتين (القسم 11). - أجهزة الطرد المركزي المستخلصات المجمعة عند 16100 جم لمدة 15 دقيقة لإزالة جميع الرواسب ، ونقل المادة الطافية إلى أنبوب طرد مركزي دقيق جديد خال من الملدنات (2 مل).
ملاحظة: يمكن تخزين مستخلصات العينة في درجة حرارة -80 درجة مئوية في الظلام. - عندما تكون جاهزا للتحليل ، قم بإدخال 50 ميكرولتر من كل مستخلص في ملحق زجاجي. ركز لمدة 30 دقيقة عند 30 درجة مئوية باستخدام مكثف مفرغ من الهواء. كرر أربع مرات أخرى (ل 250 ميكرولتر من إجمالي المستخلص المجفف).
ملاحظة: يمكن تخزين العينات المجففة في درجة حرارة الغرفة تحت ظروف التجفيف حتى التحليل.
10. اشتقاق الأيض
ملاحظة: يتم استخدام عملية اشتقاق عبر الإنترنت من خطوتين للميثوكسيميتيون وثلاثي ميثيل سيليل للمستقلبات القطبية.
- أضف 25 ميكرولتر من ميثوكسيامين هيدروكلوريد (30 مجم / مل في البيريدين) إلى كل عينة.
- حرك عند 37 درجة مئوية على شاكر مداري مضبوط عند 750 دورة في الدقيقة لمدة 2 ساعة.
- أضف 25 ميكرولتر من N، O-bis (ثلاثي ميثيل سيليل) ثلاثي فلورو أسيتاميد + ثلاثي ميثيل كلورو سيلان إلى كل عينة.
- حرك مرة أخرى عند 37 درجة مئوية و 750 دورة في الدقيقة لمدة 1 ساعة.
- اسمح للعينات بالتوازن في درجة حرارة الغرفة لمدة ساعة واحدة قبل حقن 1 ميكرولتر بنسبة تقسيم 1:10 على GC.
11. تحليل كروماتوغرافيا الغاز - قياس الطيف الكتلي
ملاحظة: يجب ضبط مطياف الكتلة وفقا لتوصيات الشركة المصنعة باستخدام tris- (perfluorobutyl) - أمين (CF43).
- استخدم الهيليوم عالي النقاء كغاز حامل بمعدل تدفق عمود ثابت يبلغ 1 مل / دقيقة.
- استخدم عمود DB-5 بطول 30 مترا بسمك فيلم 1 ميكرومتر وقطر داخلي 0.25 مم.
- برنامج فرن GC
- اضبط درجة حرارة المدخل على 280 درجة مئوية.
- ابدأ عند الحقن بدرجة حرارة فرن 100 درجة مئوية ، واستمر لمدة 4 دقائق.
- قم بزيادة درجة الحرارة بمقدار 10 درجة مئوية / دقيقة إلى 320 درجة مئوية ، ثم استمر لمدة 11 دقيقة.
- معلمات مطياف الكتلة
- اضبط خط نقل MS على 280 درجة مئوية ، واضبط مصدر الأيونات على 200 درجة مئوية.
- استخدم الأرجون كغاز خلية التصادم لتوليد أيون ناتج مراقبة التفاعل المتعدد (MRM).
- تحقيق الكشف عن المستقلب بالنسبة إلى مكتبة MRM مجزأة زمنيا تحتوي على أهداف MRM.
12. تعداد خلايا Symbiodiniaceae ، وتحليل محتوى بروتين الأنسجة المضيفة المرجانية ، وتقدير الكلوروفيل
- عدد خلايا التكافل:
- خذ حصة من تجانس الأنسجة المرجانية.
- أجهزة الطرد المركزي العينات في 2000 × غرام لحبيبات الطحالب.
- قم بإزالة المادة الطافية ~ 200 ميكرولتر من حبيبات الطحالب ، وضعها في أنبوب طرد مركزي دقيق جديد.
ملاحظة: ستكون هذه هي عينة البروتين التي سيتم استخدامها لتطبيع البيانات ؛ قم بتخزينه في درجة حرارة -20 درجة مئوية قبل التحليل ، إذا لزم الأمر. - أعد تعليق حبيبات الطحالب في 1 مل من مياه البحر المفلترة عن طريق سحب الإصبع برفق لأعلى ولأسفل. إذا لزم الأمر ، قم بتخفيف تعليق الطحالب لتسهيل عد الخلايا.
- قم بإجراء تعداد الخلايا باستخدام مقياس الدم تحت المجهر الضوئي عن طريق إضافة 10 ميكرولتر إلى إحدى الغرف. أكمل 8-10 تهم لكل عينة.
ملاحظة: يمكن أيضا تطبيق طرق بديلة لحساب خلايا الطحالب حيثما كانت متاحة (على سبيل المثال ، قياس التدفق الخلوي ، الفحص المجهري متحد البؤر عالي الإنتاجية). - احسب تركيز الخلايا المتعايشة (mL−1) ، مع مراعاة أي عوامل تخفيف مستخدمة.
- فحص لمحتوى البروتين
- حدد كمية محتوى بروتين العينة (على سبيل المثال ، عبر مقايسة برادفورد اللونية ، كما وصفها في البداية برادفورد وآخرون 33 ، أو مقايسة لوري34،35 ، التي تم وصف البروتوكول الخاص بها ل cnidarians في مكان آخر 36).
- الكلوروفيل استخراج
- استخدم بيليه خلية من ~ 200،000 خلية ، مجمدة أو طازجة.
- انقل كل حبيبات طحالب إلى 2 مل من ثنائي ميثيل فورماميد (DMF) في قنينة تلألؤ زجاجية ، واحتضانها في الظلام عند 4 درجات مئوية لمدة 48 ساعة.
ملاحظة: DMF سام ومسرطن ، لذلك يجب إكمال تحضير العينة تحت غطاء دخان مظلم قدر الإمكان وعلى الجليد. إذا كان هناك <200000 خلية ، فاستخدم DMF أقل. - أجهزة الطرد المركزي لمدة 3 دقائق في 16000 × غرام.
- انقل 200 مل إلى لوحة بئر UV-96 للقياسات الضوئية. قم بتشغيل كل عينة في ثلاث نسخ مع DMF كفراغ.
- قم بقياس الامتصاص عند الأطوال الموجية (E) 663.8 nm و 646 nm و 750 nm. اطرح الامتصاص عند 750 nm من الامتصاص عند كلا الطولين الموجيين الآخرين.
ملاحظة: القياس عند 750 نانومتر يصحح أي تشتت أو تعكر في العينة. - احسب تركيز الكلوروفيل أ (ميكروغرام / مل) باستخدام المعادلة (1):
Chl تركيز (ميكروغرام / مل) = (12.00 × E 663.8) - (3.11 × E646.8) (1)
13. القياس الكمي للكتلة الحيوية للخلية بعد استخراج المستقلب للتطبيع
ملاحظة: هناك خياران للقياس الكمي للكتلة الحيوية للخلية الموصوفة أدناه: القياس الكمي للبروتين المرتبط بالكتلة الحيوية باستخدام طريقة برادفورد اللونية المعدلة وقياس الوزن الجاف لحطام الخلية. كلتا الطريقتين مناسبة للاستخدام ، حيث يوفر كلاهما تقديرا دقيقا للكتلة الحيوية للخلية.
- محتوى البروتين من حطام الخلية
- أعد تعليق بقايا الخلايا المجمدة ب 1 مل من 0.2 M NaOH ، واحتضان العينات عند 98 درجة مئوية لمدة 20 دقيقة.
- تبريد العينات على الجليد لمدة ~ 10 دقيقة ، وأجهزة الطرد المركزي في 3000 × غرام لمدة 5 دقائق في درجة حرارة محيطة.
- حدد كمية محتوى بروتين العينة (على سبيل المثال ، عبر مقايسة برادفورد اللونية ، كما وصفها في البداية برادفورد وآخرون 33 وعدلها سمارت وآخرون 37).
- قياس الوزن الجاف لحطام الخلية
- إعادة تعليق حطام الخلية من استخراج المستقلب داخل الخلايا في الماء المقطر المزدوج (~ 10 مل).
- قم بتصفية المحلول تحت فراغ باستخدام مرشح غشاء مسبق الوزن (0.22 ميكرومتر مسام ، 47 مم).
- اغسل الأنابيب التي تحتوي على الكتلة الحيوية مرتين بماء فائق النقاء لضمان النقل الكامل للكتلة الحيوية إلى مرشح الغشاء.
- قم بإزالة مرشح الغشاء الذي يحتوي على الكتلة الحيوية وجففه باستخدام فرن ميكروويف (طاقة منخفضة ؛ ~ 250 واط لمدة 20 دقيقة).
- قم بتخزين ورق الترشيح في مجفف طوال الليل. سجل الوزن الجاف لورق الترشيح واحسب الوزن الجاف للكتلة الحيوية عن طريق طرح وزن مرشح الغشاء الجاف (باستخدام مرشح غشاء جاف نظيف مجفف جنبا إلى جنب مع مرشح العينة) من الوزن الكلي.
14. تحليل البيانات
- تحليل أهداف الأيض باستخدام قواعد بيانات الأيض حيث يتكون كل هدف من MRM كمي ومؤهل.
- افحص بصريا أهداف الأيض المكتشفة وقم بدمجها يدويا كما هو مطلوب.
- استخدم منطقة ذروة الأيض لحساب الوفرة النسبية لكل عينة لكل مجموعة. يتم تصحيح القيم فارغة وتطبيعها لأخذ عينة من منطقة الذروة القياسية الداخلية ، ثم لأخذ عينات من محتوى بروتين حطام الخلية وفقا ل Smart et al.37.
- تجاهل المستقلبات ذات الانحراف المعياري النسبي أكبر من 35٪ في جميع مجموعات العلاج (N = 23 مستقلبا).
- تحويل البيانات (على سبيل المثال ، الجذر التكعيبي) ، ومتوسط مركزها ؛ تأكيد التوزيع الطبيعي وتجانس التباين.
- إجراء تحليل البيانات (ANOVA وبناء خريطة الحرارة ؛ على سبيل المثال ، باستخدام https://www.metaboanalyst.ca)38. قم بتجميع العينات لفحص التباين داخل العلاج باستخدام الحزم "cluster" و "factoextra" و "klustR". احسب إحصائية الفجوة (طريقة لتحديد العدد الأمثل للمجموعات39) باستخدام وظيفة "clusGap" في R والمؤامرات باستخدام حزمة R "tidyverse". إجراء PERMANOVAs لفحص الأهمية في الفصل بين ملامح الأيض العلاج (على سبيل المثال ، في التمهيدي).
النتائج
وجميع البيانات التي أنتجت خلال هذا العمل متاحة في المعلومات التكميلية.
فصل المضيف المتكافل
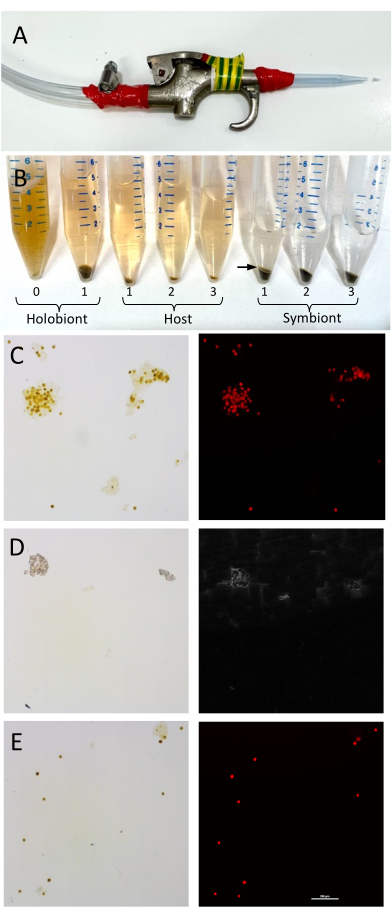
الشكل 1: إعداد فصل أنسجة مضيف المرجان وخلايا Symbiodiniaceae والتحقق من صح...
Discussion
يمكن تحقيق فصل المضيف والمتعايش بسهولة وسرعة عن طريق الطرد المركزي البسيط ، وتظهر النتائج هنا أن فصل الكسور يمكن أن يوفر معلومات قيمة تشير إلى مساهمات محددة لأعضاء holobiont ، والتي يمكن أن تسهم في التحليل الوظيفي لصحة المرجان. في الشعاب المرجانية البالغة ، يتم إجراء تخليق الدهون بشكل أس?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم JLM من قبل زمالة أبحاث مستشار UTS.
Materials
| Name | Company | Catalog Number | Comments |
| 100% LC-grade methanol | Merck | 439193 | LC grade essential |
| 2 mL microcentrifuge tubes, PP | Eppendorf | 30121880 | Polypropylene provides high resistance to chemicals, mechanical stress and temperature extremes |
| 2030 Shimadzu gas chromatograph | Shimadzu | GC-2030 | |
| 710-1180 µm acid-washed glass beads | Merck | G1152 | This size is optimal for breaking the Symbiodiniaceae cells |
| AOC-6000 Plus Multifunctional autosampler | Shimadzu | AOC6000 | |
| Bradford reagent | Merck | B6916 | Any protein colourimetric reagent is acceptable |
| Compressed air gun | Ozito | 6270636 | Similar design acceptable. Having a fitting to fit a 1 mL tip over is critical. |
| DB-5 column with 0.25 mm internal diameter column and 1 µm film thickness | Agilent | 122-5013 | |
| DMF | Merck | RTC000098 | |
| D-Sorbitol-6-13C and/or 13C5–15N Valine | Merck | 605514/ 600148 | Either or both internal standards can be added to the methanol. |
| Flat bottom 96-well plate | Merck | CLS3614 | |
| Glass scintillation vials | Merck | V7130 | 20 mL, with non-plastic seal |
| Immunoglogin G | Merck | 56834 | if not availbe, Bovine Serum Albumin is acceptable |
| Primer | v4 | ||
| R | v4.1.2 | ||
| Shimadzu LabSolutions Insight software | v3.6 | ||
| Sodium Hydroxide | Merck | S5881 | Pellets to make 1 M solution |
| tidyverse | v1.3.1 | R package | |
| TissueLyser LT | Qiagen | 85600 | Or similar |
| TQ8050NX triple quadrupole mass spectrometer | Shimadzu | GCMS-TQ8050 NX | |
| UV-96 well plate | Greiner | M3812 | |
| Whirl-Pak sample bag | Merck | WPB01018WA | Sample collection bag; Size: big enough to house a ~5 cm coral fragment, but not too big that the water is too spread |
References
- Bundy, J. G., Davey, M. P., Viant, M. R. Environmental metabolomics: A critical review and future perspectives. Metabolomics. 5 (1), 3-21 (2008).
- Matthews, J. L., Beale, D. J., Hillyer, K. E., Warden, A. C., Jones, O. A. H., et al. The metabolic significance of symbiont community composition in the coral-algal symbiosis. Applied Environmental Metabolomics. , 211-229 (2022).
- Lawson, C. A., van Oppen, M. J. H., Aranda Lastra, M., et al. Informing coral reef conservation through metabolomic approaches. Coral Reef Conservation and Restoration in the Omics Age. Coral Reefs of the World. , 179-202 (2022).
- LaJeunesse, T. C., et al. Systematic revision of Symbiodiniaceae highlights the antiquity and diversity of coral endosymbionts. Current Biology. 28 (16), 2570-2580 (2018).
- Rohwer, F., Seguritan, V., Azam, F., Knowlton, N. Diversity and distribution of coral-associated bacteria. Marine Ecology Progress Series. 243, 1-10 (2002).
- Maire, J., et al. Intracellular bacteria are common and taxonomically diverse in cultured and in hospite algal endosymbionts of coral reefs. The ISME Journal. 15 (7), 2028-2042 (2021).
- Hillyer, K. E., et al. Metabolite profiling of symbiont and host during thermal stress and bleaching in the coral Acropora aspera. Coral Reefs. 36, 105-118 (2016).
- Hillyer, K. E., Tumanov, S., Villas-Bôas, S., Davy, S. K. Metabolite profiling of symbiont and host during thermal stress and bleaching in a model cnidarian-dinoflagellate symbiosis. Journal of Experimental Biology. 219 (4), 516-527 (2016).
- Matthews, J. L., et al. Optimal nutrient exchange and immune responses operate in partner specificity in the cnidarian-dinoflagellate symbiosis. Proceedings of the National Academy of Sciences of the United States of America. 114 (50), 13194-13199 (2017).
- Rosset, S. L., et al. The molecular language of the cnidarian-dinoflagellate symbiosis. Trends in Microbiology. 29 (4), 320-333 (2020).
- Matthews, J. L., et al. Partner switching and metabolic flux in a model cnidarian-dinoflagellate symbiosis. Royal Society. 285 (1892), 20182336 (2018).
- González-Pech, R. A., et al. Physiological factors facilitating the persistence of Pocillopora aliciae and Plesiastrea versipora in temperate reefs of south-eastern Australia under ocean warming. Coral Reefs. 41, 1239-1253 (2022).
- Williams, A., et al. Metabolomic shifts associated with heat stress in coral holobionts. Science Advances. 7 (1), (2021).
- Deutsch, J. M., et al. Metabolomics of healthy and stony coral tissue loss disease affected Montastraea cavernosa corals. Frontiers in Marine Science. 8, 1421 (2021).
- Stien, D., et al. A unique approach to monitor stress in coral exposed to emerging pollutants. Scientific Reports. 10 (1), 9601 (2020).
- Lohr, K. E., et al. Resolving coral photoacclimation dynamics through coupled photophysiological and metabolomic profiling. Journal of Experimental Biology. 222 (8), (2019).
- Jorissen, H., et al. Coral larval settlement preferences linked to crustose coralline algae with distinct chemical and microbial signatures. Scientific Reports. 11 (1), 14610 (2021).
- Roach, T. N., Dilworth, J., Jones, A. D., Quinn, R. A., Drury, C. Metabolomic signatures of coral bleaching history. Nature Ecology & Evolution. 5 (4), 495-503 (2021).
- Parkinson, J. E., et al. Molecular tools for coral reef restoration: Beyond biomarker discovery. Conservation Letters. 13 (1), 12687 (2020).
- Jiang, J., et al. How Symbiodiniaceae meets the challenges of life during coral bleaching. Coral Reefs. 40, 1339-1353 (2021).
- Guerra, F. D., Attia, M. F., Whitehead, D. C., Alexis, F. Nanotechnology for environmental remediation: materials and applications. Molecules. 23 (7), 1760 (2018).
- Matthews, J. L., et al. Metabolite pools of the reef building coral Montipora capitata are unaffected by Symbiodiniaceae community composition. Coral Reefs. 39, 1727-1737 (2020).
- Papina, M., Meziane, T., van Woesik, R. Symbiotic zooxanthellae provide the host-coral Montipora digitata with polyunsaturated fatty acids. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 135 (3), 533-537 (2003).
- Kellogg, R., Patton, J. Lipid droplets, medium of energy exchange in the symbiotic anemone Condylactis gigantea: A model coral polyp. Marine Biology. 75, 137-149 (1983).
- Ankrah, N. Y., Chouaia, B., Douglas, A. E. The cost of metabolic interactions in symbioses between insects and bacteria with reduced genomes. mBio. 9 (5), e01433 (2018).
- Kabeya, N., et al. Genes for de novo biosynthesis of omega-3 polyunsaturated fatty acids are widespread in animals. Science Advances. 4 (5), (2018).
- Hillyer, K. E., Dias, D., Lutz, A., Roessner, U., Davy, S. K. 13C metabolomics reveals widespread change in carbon fate during coral bleaching. Metabolomics. 14 (1), 12 (2018).
- Hillyer, K. E., Dias, D. A., Lutz, A., Roessner, U., Davy, S. K. Mapping carbon fate during bleaching in a model cnidarian symbiosis: the application of 13C metabolomics. New Phytologist. 214 (4), 1551-1562 (2017).
- Burriesci, M. S., Raab, T. K., Pringle, J. R. Evidence that glucose is the major transferred metabolite in dinoflagellate-cnidarian symbiosis. Journal of Experimental Biology. 215 (19), 3467-3477 (2012).
- Thurber, R. V., et al. Unified methods in collecting, preserving, and archiving coral bleaching and restoration specimens to increase sample utility and interdisciplinary collaboration. PeerJ. 10, 14176 (2022).
- Grottoli, A. G., et al. Increasing comparability among coral bleaching experiments. Ecological Applications. 31 (4), 02262 (2020).
- Mushtaq, M. Y., Choi, Y. H., Verpoorte, R., Wilson, E. G. Extraction for metabolomics: access to the metabolome. Phytochemical Analysis. 25 (4), 291-306 (2014).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1), 248-254 (1976).
- Peterson, G. L., et al. A simplification of the protein assay method of Lowry et al. which is more generally applicable. Analytical Biochemistry. 83 (2), 346-356 (1977).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Zamer, W. E., Shick, J. M., Tapley, D. W. Protein measurement and energetic considerations: Comparisons of biochemical and stoichiometric methods using bovine serum albumin and protein isolated from sea anemones. Limnology and Oceanography. 34 (1), 256-263 (1989).
- Smart, K. F., Aggio, R. B., Van Houtte, J. R., Villas-Boas, S. G. Analytical platform for metabolome analysis of microbial cells using methyl chloroformate derivatization followed by gas chromatography-mass spectrometry. Nature Protocols. 5 (10), 1709-1729 (2010).
- Pang, Z., et al. Using MetaboAnalyst 5.0 for LC-HRMS spectra processing, multi-omics integration and covariate adjustment of global metabolomics data. Nature Protocols. 17 (8), 1735-1761 (2022).
- Tibshirani, R., Walther, G., Hastie, T. Estimating the number of clusters in a data set via the gap statistic. Journal of the Royal Statistical Society: Series B (Statistical Methodology). 63 (2), 411-423 (2001).
- Chen, W. -. N., et al. Diel rhythmicity of lipid-body formation in a coral-Symbiodinium endosymbiosis). Coral Reefs. 31 (2), 521-534 (2012).
- Imbs, A. Fatty acids and other lipids of corals: composition, distribution, and biosynthesis. Russian Journal of Marine Biology. 39 (3), 153-168 (2013).
- Rosset, S., et al. Lipidome analysis of Symbiodiniaceae reveals possible mechanisms of heat stress tolerance in reef coral symbionts. Coral Reefs. 38 (6), 1241-1253 (2019).
- Carreón-Palau, L., Parrish, C. C., Del Angel-Rodriguez, J. A., Perez-Espana, H. Seasonal shifts in fatty acids and sterols in sponges, corals, and bivalves, in a southern Gulf of Mexico coral reef under river influence. Coral Reefs. 40 (2), 571-593 (2021).
- Imbs, A. B., Dang, L. T. Seasonal dynamics of fatty acid biomarkers in the soft coral Sinularia flexibilis, a common species of Indo-Pacific coral reefs. Biochemical Systematics and Ecology. 96, 104246 (2021).
- Oku, H., Yamashiro, H., Onaga, K., Sakai, K., Iwasaki, H. Seasonal changes in the content and composition of lipids in the coral Goniastrea aspera. Coral Reefs. 22 (1), 83-85 (2003).
- Weis, V. M. Cell biology of coral symbiosis: foundational study can inform solutions to the coral reef crisis. Integrative and Comparative Biology. 59 (4), 845-855 (2019).
- Oakley, C., Davy, S., van Oppen, M., Lough, J. Cell biology of coral bleaching. Coral Bleaching. , 189-211 (2018).
- Lu, W., et al. Metabolite measurement: Pitfalls to avoid and practices to follow. Annual Review of Biochemistry. 86, 277-304 (2017).
- Lawson, C. A., et al. Heat stress decreases the diversity, abundance and functional potential of coral gas emissions. Global Change Biology. 27 (4), 879-891 (2021).
- Olander, A., et al. Comparative volatilomics of coral endosymbionts from one-and comprehensive two-dimensional gas chromatography approaches. Marine Biology. 168 (5), 76 (2021).
- Wuerz, M., et al. Symbiosis induces unique volatile profiles in the model cnidarian Aiptasia. Journal of Experimental Biology. 225 (19), (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved