Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Antimikrobiyallerin İn vitro Biyofilm Mimarisi Üzerindeki Etkilerinin COMSTAT Yazılımı Kullanılarak Ölçülmesi
Bu Makalede
Özet
Pseudomonas aeruginosa biyofilm mimarisinde antimikrobiyal kaynaklı değişiklikler, kistik fibroz ve kronik akciğer enfeksiyonu olan hastalardan kültürlenen klinik izolatlar arasında farklılık gösterir. Konfokal mikroskobu takiben, anti-enfektif ajanların etkinliğini değerlendirmek için bireysel izolatlar için biyofilm mimarisindeki (örneğin, yüzey alanı, kalınlık, biyokütle) varyasyonları ölçmek için COMSTAT yazılımı kullanılabilir.
Özet
Biyofilmler, koruma ve yapısal bütünlük için kendi ürettiği hücre dışı polimerik madde matrisine dayanan mikroorganizma kümeleridir. Nozokomiyal patojen Pseudomonas aeruginosa'nın , kistik fibrozisli (KF) hastalarda kronik akciğer enfeksiyonuna neden olan bir biyofilm büyüme modunu benimsediği bilinmektedir. Bilgisayar programı, COMSTAT, üç boyutlu konfokal görüntülerden veri çıkararak P. aeruginosa biyofilm mimarisindeki antimikrobiyal kaynaklı değişiklikleri ölçmek için yararlı bir araçtır. Bununla birlikte, yazılımın standartlaştırılmış çalışması daha az yaygın olarak ele alınır, bu da biyofilm davranışının en iyi şekilde raporlanması ve merkezler arası karşılaştırma için önemlidir. Bu nedenle, bu protokolün amacı, COMSTAT aracılığıyla değişen antimikrobiyal koşullar altında in vitro biyofilm yapılarının miktarını belirlemek için basit ve tekrarlanabilir bir çerçeve sağlamaktır. Teknik, biyofilm kopyaları şeklinde büyütülen ve tobramisin ve anti-Psl monoklonal antikoru Psl0096'ya maruz bırakılan bir CF P. aeruginosa izolatı kullanılarak modellenmiştir. Adım adım yaklaşım, kullanıcı belirsizliğini azaltmayı ve önemli görüntü işleme adımlarını gözden kaçırma olasılığını en aza indirmeyi amaçlar. Spesifik olarak, protokol, görüntü segmentasyonu ve uygun nicel analiz fonksiyonlarının seçimi de dahil olmak üzere, COMSTAT'ın manuel çalışmasıyla ilişkili öznel varyasyonların ortadan kaldırılmasını vurgular. Bu yöntem, kullanıcıların COMSTAT'ı çalıştırmadan önce konfokal görüntüleri işlemek için ek zaman harcamasını gerektirse de, otomatik çıktılarda yanlış temsil edilen biyofilm heterojenisitesini en aza indirmeye yardımcı olur.
Giriş
Biyofilmler, kendi kendine üretilen hücre dışı polimerik maddelerden (EPS) oluşan bir matrise yönlendirilmiş mikroorganizma kümeleridir. EPS matrisi çok karmaşıktır, esas olarak bakteri hücreleri, su, proteinler, polisakkaritler, lipitler ve nükleik asitlerden1 oluşur ve bunların tümü biyofilmleri serbest yaşayan planktonik hücrelerden belirgin şekilde farklı kılar. Biyofilm EPS birbirine ve çeşitli yüzeylere yapışır. EPS matrisi, hücreler arası sinyalleşme ve savunma2 için kullanılan metabolitlerin, genetik materyalin ve bileşiklerin hücreden hücreye değişimine aracılık eden özelliklere sahiptir. Bu özellikler toplu olarak biyofilmlerin yapısal bütünlüğü ve dış stres faktörlerine karşı koruma sağlayarak bağışıklıktan kaçınmaya ve antimikrobiyal dirence katkıda bulunur3.
Pseudomonas aeruginosa, antimikrobiyallere yanıt olarak kaçış amaçlı bir biyofilm büyüme stratejisi benimsediği bilinen, iyi bilinen bir nozokomiyal patojendir. Bunun en iyi örneği, resesif genetik bozukluk olan kistik fibroz (KF) olan hastalarda görülür. Biyofilmler, antimikrobiyal dirençli P. aeruginosa4'ün gelişiminde çok önemli bir rol oynar ve KF'li hastalarda kronik akciğer enfeksiyonunun oluşmasına izin vererek akciğer fonksiyonlarında hızlı düşüşe ve erken mortaliteyeneden olur 5. Bu nedenle, CF 6,7 olan hastalardan elde edilen P. aeruginosa izolatlarına karşı antibiyotiklerin ve yeni anti-enfektif ajanların etkinliğini test etmek için in vitro biyofilm çalışmaları yapılmaktadır. Biyofilm oluşumunu takiben, antimikrobiyaller yapıya dışarıdan uygulanır ve biyofilm segmentlerinin yüksek çözünürlüklü, üç boyutlu rekonstrüksiyonlarını oluşturmak için konfokal lazer tarama mikroskobu (CLSM) kullanılır. Daha sonra, biyofilm mimarisindeki değişiklikleri ölçmek için ImageJ'ye bir eklenti olarak bilgisayar yazılımıCOMSTAT'ı kullanmak yaygın bir uygulamadır 8,9,10,11.
COMSTAT, biyofilm yapısını ölçmek için yararlı olsa da, görüntü analizinin tekrarlanabilirliği ve standardizasyonu daha az yaygın olarak ele alınmaktadır. Örneğin, COMSTAT çalıştırılmadan önce gerçekleştirilen görüntü işleme prosedürü nesneldir, ancak görüntü eşikleri12,13 ayarlanırken bir öznellik öğesi içerir. Benzer şekilde, COMSTAT programı, operatörün görüntü segmentasyonu için temel koşullardan gelişmiş koşullara ve parametrelere ve ayrıca on nicel analiz fonksiyonuna (örneğin, kalınlık dağılımı, yüzey alanı, biyokütle, boyutsuz pürüzlülük katsayısı) seçim yapmasına olanak tanır. Değişen operatör uzmanlık seviyeleriyle birleşen çok sayıda kullanıcı seçeneği, biyofilm davranışının yanlış yönlendirilmiş raporlanmasına neden olabilir.
Bu nedenle, bu protokolün amacı, COMSTAT kullanılarak in vitro biyofilm yapılarının kantitatif karşılaştırması için nispeten basit bir yöntem sunmaktır. Burada, bir CF P. aeruginosa izolatından alınan biyofilm segmentlerinin üç boyutlu görüntüleri, tekrarlanabilir in vitro biyofilm deneyleri gerçekleştirmek için kullanılan yerleşik bir teknik olan odacıklı kapak camı modeli14 kullanılarak CLSM aracılığıyla yakalanır. COMSTAT'ı ImageJ'e bir eklenti olarak kullanan bu yöntem, araştırmacıların değişen koşullar altında antimikrobiyallerin varlığında biyofilm mimarisindeki değişiklikleri nicel olarak tanımlamasına olanak tanır. Genel olarak, bu yöntem, COMSTAT'ın manuel olarak çalıştırılmasıyla ilişkili öznel varyasyonları ortadan kaldırmayı ve böylece protokollerin merkezler arasında standardizasyonunu kolaylaştırmayı amaçlamaktadır.
Protokol
1. Bakteriyel izolat toplama
- SickKids'te (Toronto) inhale tobramisin ile eradikasyon tedavisi gören KF'li pediatrik hastalardan oluşan bir kohorttan P. aeruginosa izolatları elde edin. İzolatları kullanımdan önce en az üç kez -80 ° C'de gliserol sitrat ve alt kültürde dondurun.
2. İn vitro biyofilm oluşumu
NOT: Modifikasyonlarla in vitro biyofilm oluşumu için odacıklı bir kapak camı yöntemi1 kullanın. Bu modelin genel iş akışı Şekil 1'de gösterilmiştir.
- P. aeruginosa'yı triptik soya agar ve% 5 koyun kanı ile hazırlanan kan agar üzerinde 37 ° C'de gece boyunca izole edin (bkz. Malzeme Tablosu).
- Kanlı agardan 1-2 bakteri kolonisini 4 mL lizojeni et suyuna (LB) aşılayın. 225 rpm'ye ayarlanmış bir çalkalayıcıda 37 °C'de gece boyunca büyütün.
- 4 mL taze LB içinde 40 μL kültür ekleyerek 1:100 oranında bir gece boyunca inokülum seyreltmesi hazırlayın. 600 nm'de (OD600) (erken günlük faz) yaklaşık 0,1'lik bir optik yoğunluk elde etmek için 225 rpm'ye ayarlanmış bir çalkalayıcıda 37 ° C'de 3-4 saat büyütün.
- 220 μL aşılamayı 8 odacıklı bir kapak camı slaytının her bir oyuğuna aktarın. 37 ° C'de 24 saat boyunca rahatsız edilmeden inkübe edin.
- Biyofilmlerin tabanda ayrılmasını önlemek için ortamı her bir kuyucuktan yavaşça çıkarın.
NOT: Sürgüyü 45°'lik bir açıyla öne doğru eğin ve pipet ucuyla tabana dokunmadan ortamı her odacıklı kuyunun alt köşelerinden aspire edin. - 100 μL 56 μg/mL floresan etiketli monoklonal antikor (mAb) hazırlayın ve yavaşça ekleyin. Bakteriyel antijen epitopuna antikor bağlanmasına izin vermek için oda sıcaklığında (RT) 1 saat inkübe edin.
NOT: Kullanmadan önce, 56 μg/mL'lik bir nihai konsantrasyon elde etmek için floresan etiketli (kırmızı) mAb, Psl0096'yı LB cinsinden seyreltin. Psl0096, ilk hücre bağlanması ve yapısal bütünlükte yer alan P . aeruginosa biyofilmlerinin önemli bir EPS matris bileşeni olan sınıf I Psl epitopuna bağlanan bir anti-Psl mAb'dir (Cam003'ün optimize edilmiş afinite türevi)15. - 100 μL 1000 μg / mL antibiyotik çözeltisi hazırlayın ve yavaşça ekleyin ( Malzeme Tablosuna bakınız) belirtilen odacıklı kuyucukların yan tarafına. 37 ° C'de 24 saat boyunca rahatsız edilmeden inkübe edin.
NOT: Kullanmadan önce, 1000 μg / mL'lik bir nihai konsantrasyon elde etmek için LB'de 50 mg / mL tobramisin antibiyotik stoğunu seyreltin.
3. Biyofilm floresan boyama
- Canlı hücre boyama floresan boyanın 0.01 mM'lik bir çözeltisini hazırlayın. Ortamı odacıklı oyuklardan yavaşça çıkarın ve her bir oyuğa 200 μL boya karışımı ekleyin. Karanlıkta RT'de 45 dakika inkübe edin.
NOT: Kullanmadan önce, 2 mL LB'ye 4 μL 5 mM stok ekleyerek canlı hücre boyama (yeşil) floresan boyayı hazırlayın. - Ortamı her kuyucuktan yavaşça çıkarın ve 2x'i 200 μL taze LB ile yıkayın.
- Her kuyucuğa 200 μL taze LB ekleyin ve konfokal mikroskopi ile incelemeye devam edin.
4. Konfokal mikroskopi ile görüntü elde etme
NOT: Görüntü işleme ve COMSTAT analiz prosedürü Şekil 2'de sunulmuştur. Biyofilm boyamanın aynı gününde kuyuların görüntülerini elde edin. Görselleştirmedeki gecikme 1 saati aşarsa, odacıklı kapak camını daha fazla işleme kadar karanlıkta soğutun.
- Uygun lazer uyarma dalga boylarına ve elde etmek için filtre setlerine sahip bir konfokal mikroskop sistemi ( Malzeme Tablosuna bakınız) kullanarak kuyuların görüntülerini elde edin.
NOT: Burada, sırasıyla 561 ve 491 nm uyarma dalga boylarını kullanarak floresan etiketli (kırmızı) mAb ve canlı hücre (yeşil) boyasını uyarın. - 20-25x suya daldırmalı lens ile 0,3 μm'lik artışlarla katmanlı z yığını görüntüleri (alt tabakadan her bir biyofilm segmentinin tepesine kadar) yakalayın. Kuyu başına en az 6 görüntü yığını alın.
NOT: Burada, görüntüleri 25x suya daldırma lensli yüksek çözünürlüklü bir kamera kullanarak görselleştirin ve görüntü analiz yazılımı kullanılarak işlenin (bkz. Malzeme Tablosu). Tek bir deneydeki tüm alımlar için yazılım kurulumunu ve dijital görüntüleme parametrelerini (yani parlaklık ve hassasiyet) sabit tutun. - COMSTAT analizi için görüntüleri OME-TIFF olarak kaydedin.
NOT: OME-TIFF'lerin her kanal için ayrı ayrı kaydedildiğinden emin olun (yani kırmızı ve yeşil). Bu adım, kullanılan görüntü analiz yazılımına bağlı olarak değişir. - Bakteri izolatı başına toplam 3 biyolojik kopyadan (yani 3 bağımsız deney) görüntü yakalamak için 2.1–4.3 adımlarını tekrarlayın.
5. COMSTAT analizi
NOT: ImageJ'ye bir eklenti (Comstat16,17) olarak yeniden yazılmış, ücretsiz olarak kullanılabilen bilgisayar programı COMSTAT 2'yi kullanarak görüntüleri nicel olarak analiz edin. İndirilen paketteki biyofilmlerin görüntü yığınlarını analiz etmek için genel talimatları okuyun. Bu katkı, antimikrobiyallerin biyofilm oluşumu üzerindeki etkilerini ölçmek için önerilen seçilmiş ImageJ işleme adımları ve COMSTAT özellikleri ile özetlenmiş bir protokol sağlar.
- Comstat2 paketini http://www.comstat.dk/'dan indirin. Yüklü klasörün içinde ImageJ'yi bulun ve çalıştırın.
- Masaüstünde bir kaynak klasör oluşturun ve klasöre tek bir OME-TIFF ekleyin.
- Kaynak klasörden OME-TIFF'i açın ve biyokütle içermeyen boş katmanları silin. Bu katmanlar, z-yığınının ilk veya son birkaç katmanı olacaktır.
NOT: Mikroskop tanımlı z-yığını sınırları bazen kullanıcılar tarafından fazla tahmin edilir. Bu boş katmanları silmek, COMSTAT analizi için daha rafine bir z-yığını sınırı oluşturur. - Dosya | İthalat | Görüntü Sırası. Kaynak klasörü bulun, açmadan vurgulayın ve Seç'e tıklayın. Bir 'Sıra Seçenekleri' penceresi görünecektir. Tamam'ı seçin.
NOT: ImageJ'de ek görüntüleri içe aktarmak için önce önceki OME-TIFF'i kaynak klasörden kaldırın, ardından yeni OME-TIFF'i klasöre ekleyin ve 5.3 ve 5.4 adımlarını tekrarlayın. - Görüntü | öğesini seçerek biyofilmin yönünü çevirin Dönüştür | Alt tabakayı ilk (en üst) yığın olarak konumlandırmak için Z'yi çevirin.
NOT: COMSTAT algoritmaları, biyofilmleri z yönünde yukarıdan (yığın 1) aşağıya doğru okur. Kullanılan konfokal mikroskop sistemine bağlı olarak, OME-TIFF çıkışı ters çevrilebilir. Bu nedenle, çıktı verilerinin kusurlu hale gelmesini önlemek için alt tabakayı görüntü yığını 1 olarak konumlandırarak dilimlerin sırasını tersine çevirmek önemlidir. - Görüntü | Özellikleri. Bir 'Kaynak' penceresi görünecektir.
- 'Uzunluk Birimi'ni 'mikron' olarak belirtin.
- Aşağıdaki denklemi kullanarak 'Piksel genişliği' ve 'Piksel yüksekliği'ni matematiksel olarak belirleyin:
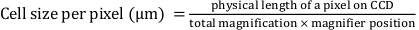 (1)
(1)
Burada, 'Piksel genişliği' ve 'Piksel yüksekliği' 0,427 olarak tanımlanır, burada şarj bağlantılı cihazdaki (CCD) bir pikselin fiziksel uzunluğu 16 μm'dir; toplam büyütme 25x'tir; ve büyüteç konumu 1.5x'tir.
NOT: Piksel başına hücre boyutunu hesaplamak için kullanılan denklem, mikroskop kamera üreticisine bağlı olarak değişebilir. Alternatif olarak, 'Piksel genişliği' ve 'Piksel yüksekliği' uzamsal kalibrasyon ile tanımlanabilir (https://imagej.net/Spatial_Calibration bakın). - 'Voksel derinliğini' 0,3 olarak tanımlayın (yani, her z-yığını katmanı arasındaki artımlı boşluk). 'Kaynak' penceresinde Tamam'ı seçin.
- Görüntü | öğesini seçerek görüntü eşiğini ayarlayın Ayarla | Eşik. Bir 'Eşik' penceresi görünecektir.
NOT: Görüntüdeki nesneler gri tonlamalı bir arka planla kırmızı görünecektir. Alternatif olarak, 'Kırmızı'yı 'S&B' olarak değiştirmek için 'Eşik' penceresindeki açılır menüyü kullanarak eşik siyah beyaz olarak ayarlanabilir.- Görüntü penceresinde, kaydırıcıyı en sağa ayarlayın (yani, biyofilmin en üst katmanı). Arka plan gürültüsünü gidermek için, maksimum ve minimum eşik değerlerini manuel olarak ayarlamak için görüntünün histogramını görüntüleyen 'Eşik' penceresini kullanın. İlk olarak, alt kaydırıcıyı mümkün olduğunca sağa ayarlayarak maksimum eşik değerini ayarlayın. İkinci olarak, görüntüyü iki ayrı faza ayıran minimum eşik değerini ayarlamak için üst kaydırıcıyı kullanın: kırmızı biyokütle ve gri tonlamalı arka plan (Şekil 3).
NOT: Burada açıklanan in vitro biyofilm oluşumu ve floresan mikroskopi prosedürü, ideal durumda OME-TIFF'ler oluşturur ve görüntülerin basit bir histogram eşik yöntemi aracılığıyla iki ayrı faza bölünmesine izin verir. Bununla birlikte, bazı durumlarda, farklı fazlar arasındaki histogram ayrımı o kadar net değildir. Bunun nedeni, yoğun arka plan gürültüsünün varlığı, değişen arka plan yoğunlukları veya biyokütle ile arka plan arasındaki düşük yoğunluklu kontrast olabilir. Bu gibi durumlarda, kullanıcılar gelişmiş bir segmentasyon prosedürübenimsemelidir 18,19.- Alternatif olarak, 'Eşik' penceresinde 'Varsayılan' olarak ayarlanan sol açılır menüyü kullanarak tek tek görüntüler için eşikleri algoritmik olarak ayarlayın. Bu özellik, aralarından seçim yapabileceğiniz 17 farklı algoritmik eşik seçeneği sunar (https://imagej.net/Auto_Threshold bakın). En uygun seçeneği seçin, ardından eşiği ayarlamak için 'Otomatik'i seçin.
- Eşik değerleri ayarlandığında, arka plan gürültüsünün baştan sona yeterince giderildiğinden emin olmak için her katmanda gezinmek için görüntü penceresindeki kaydırıcıyı kullanın.
- Önce alt eşik değerini düzeltmek için 'Eşik' penceresinde Ayarla'yı seçin. Bir 'Eşik Düzeylerini Ayarla' penceresi görünecektir. Tamam'ı seçin. Yeniden Ayarla'yı seçin ve maksimum eşik değerini sabitlemek için bu adımı tekrarlayın.
NOT: Her 'Ayarla' seçildiğinde, alt kaydırıcı otomatik olarak ayarlanabilir. Bu gibi durumlarda, kaydırıcıyı manuel olarak yeniden ayarlayın (veya algoritmik eşiklerden birini kullanıyorsanız 'Otomatik'i seçin) ve 5.6.2–5.6.3 adımlarını tekrarlayın. Ana fikir, kaydırıcılar otomatik olarak yeniden ayarlandığında, hem üst hem de alt eşiklerin sabitlendiğinden emin olmak için 'Ayarla'nın daha sonra iki kez daha seçilmesi gerektiğidir. - Uygula'yı seçin ve 'Yığını İkiliye Dönüştür' penceresi görünecektir. Tamam'ı seçin ve ardından 'Eşik' penceresinden çıkın.
- Eklentiler | Biyo-Formatlar | Biyo-Format İhracatçısı|. Yeni bir dosya adı girin ve kaynak klasöre OME-TIFF olarak kaydedin. Bir 'Biyo-Format Dışa Aktarıcı - Birden Çok Dosya' penceresi görünecektir. Tamam'ı seçin. Bir 'Biyo-Format Dışa Aktarıcı Seçenekleri' penceresi görünecektir. Tamam'ı seçin.
NOT: COMSTAT analizine geçmeden önce kaynak klasöre yalnızca yeni ayarlanan siyah beyaz OME-TIFF'lerin kaydedildiğinden emin olun. Tüm orijinal OME-TIFF'leri klasörden kaldırın.
- Görüntü penceresinde, kaydırıcıyı en sağa ayarlayın (yani, biyofilmin en üst katmanı). Arka plan gürültüsünü gidermek için, maksimum ve minimum eşik değerlerini manuel olarak ayarlamak için görüntünün histogramını görüntüleyen 'Eşik' penceresini kullanın. İlk olarak, alt kaydırıcıyı mümkün olduğunca sağa ayarlayarak maksimum eşik değerini ayarlayın. İkinci olarak, görüntüyü iki ayrı faza ayıran minimum eşik değerini ayarlamak için üst kaydırıcıyı kullanın: kırmızı biyokütle ve gri tonlamalı arka plan (Şekil 3).
- Eklentiler | Comstat2 |. Bir 'Hakkında' penceresi görünecektir. Tamam'ı seçin. Üç pencere görünecektir.
- 'Gözlemlenen Dizinler' penceresinde (sağ üstte), Ekle'yi seçin. Kaynak klasörü bulun, açmadan vurgulayın ve Seç'i seçin. COMSTAT aracılığıyla analiz edilecek OME-TIFF'leri listeleyen bir 'Dizinlerdeki Görüntüler' penceresi (sol üstte) görünecektir.
- 'Comstat 2.1' penceresinde (sağ altta), yazılımın daha önce ayrı OME-TIFF'ler için ayarlanmış eşik değerlerini kullandığından emin olmak için 'Otomatik eşikleme (Otsu yöntemi)' seçimini kaldırın. Ayrıca, biyofilm yapısının boşluklarında bulunan serbest yüzen hücrelerin veya biyokütlenin çok ince kısımlarının analize dahil edildiğinden emin olmak için Bağlı Hacim Filtresig (CVF) seçimini kaldırın.
NOT: Burada, CVF'nin seçimini kaldırın çünkü COMSTAT analizi çok erken biyofilmler (24 saatlik başlangıç büyümesi) ve antimikrobiyal tedaviden sonra kalan planktonik hücreler/koloniler üzerinde gerçekleştirilir. Olgun biyofilmler için, yalnızca biyofilm yapısına bağlı biyokütlenin miktarının ölçülmesini sağlamak için CVF'yi seçin. - 'Comstat 2.1' penceresinde (sağ altta), kantitatif analiz için istediğiniz özellikleri seçin. Burada Biyo Kütle, Kalınlık Dağılımı ve Yüzey Alanı'nı seçin. Programı çalıştırmak için Git'i seçin. 'Günlük' penceresinde (sol altta), çıktı verileri 'Seçilen işlevler/görüntüler ile tamamlandı!' görünene kadar işlenirken gösterilir. COMSTAT ölçümlerini kaydedin. Bu ölçümler ayrıca otomatik olarak kaynak klasörüne TXT dosyaları olarak kaydedilir.
Sonuçlar
KF'li enfekte bir hastadan kültürlenen bir P. aeruginosa izolatı, in vitro biyofilm mimarisindeki antimikrobiyal kaynaklı değişiklikleri doğru bir şekilde ölçmede bu yaklaşımın güçlü yönlerini göstermek için kullanılır. Bu modelin genel iş akışı Şekil 1'de temsil edilmektedir. ImageJ'deki görüntü işleme ve COMSTAT analiz prosedürü Şekil 2'de gösterilmiştir. ImageJ'de görüntü segmentasyonu için bir CLSM z-s...
Tartışmalar
İn vitro biyofilm yapılarının üç boyutlu görüntülerini kantitatif olarak karşılaştırmak için önceden belirlenmiş bir yöntem yoktur ve bu bağlamda açıklanan prosedürlerin, operatörler arası değişkenlik nedeniyle standartlaştırılması genellikle zordur20. Bu nedenle, bu protokol, değişen antimikrobiyal koşullar altında in vitro biyofilm mimarisindeki değişiklikleri ölçmek isteyen COMSTAT uygulamaları için basit ve tekrarlanabilir bir çerçeve ...
Açıklamalar
Hiç kimse
Teşekkürler
Yazarlar, bu araştırma için fon sağladığı için Kistik Fibrozis Vakfı'na teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anti-Psl mAb, Psl0096 | Medimmune | ||
| Blood Agar (TSA with 5 % Sheep Blood) Medium | Fisher Scientific | R01200 | |
| Eight-well Chambered Coverglass w/ non-removable wells | Thermo Fisher Scientific | 155411 | |
| Invitrogen SYTO 9 Green Fluorescent Nucleic Acid Stain | Thermo Fisher Scientific | S34854 | |
| LB BROTH (LENNOX), Liquid Autoclave Sterilized | BioShop Canada | LBL666 | |
| Tobramycin, 900 µg/mg | Alfa Aesar by Thermo Fisher Scientific | J66040 | It is recommended to perform a minimal inhibitory concentration (MIC) test for every batch made to ensure quality control of antimicrobial potency |
| Quorum Volocity 6.3 | Quorum Technologies | Image analysis software |
Referanslar
- Flemming, H. C., Wingender, J. The biofilm matrix. Nature Reviews Microbiology. 8, 623-633 (2010).
- Flemming, H. C., et al. Biofilms: an emergent form of bacterial life. Nature Reviews Microbiology. 14, 563-575 (2016).
- Rybtke, M., Hultqvist, L. D., Givskov, M., Tolker-Nielsen, T. Pseudomonas aeruginosa biofilm infections: community structure, antimicrobial tolerance and immune response. Journal of Molecular Biology. 427, 3628-3645 (2015).
- Wendel, A. F., Ressina, S., Kolbe-Busch, S., Pfeffer, K., MacKenzie, C. R. Species diversity of environmental GIM-1-producing bacteria collected during a long-term outbreak. Applied and Environmental Microbiology. 82, 3605-3610 (2016).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Powell, L. C., et al. Targeted disruption of the extracellular polymeric network of Pseudomonas aeruginosa biofilms by alginate oligosaccharides. NPJ Biofilms and Microbiomes. 4, 1-10 (2018).
- Ciofu, O., Tolker-Nielsen, T., Jensen, P. &. #. 2. 1. 6. ;., Wang, H., Høiby, N. Antimicrobial resistance, respiratory tract infections and role of biofilms in lung infections in cystic fibrosis patients. Advanced Drug Delivery Reviews. 85, 7-23 (2015).
- Landry, R. M., An, D., Hupp, J. T., Singh, P. K., Parsek, M. R. Mucin-Pseudomonas aeruginosa interactions promote biofilm formation and antibiotic resistance. Molecular Microbiology. 59, 142-151 (2006).
- Beaudoin, T., et al. Staphylococcus aureus interaction with Pseudomonas aeruginosa biofilm enhances tobramycin resistance. NPJ Biofilms and Microbiomes. 3, 1-9 (2017).
- Rojo-Molinero, E., et al. Sequential treatment of biofilms with aztreonam and tobramycin is a novel strategy for combating Pseudomonas aeruginosa chronic respiratory infections. Antimicrobial Agents and Chemotherapy. 60, 2912-2922 (2016).
- Hentzer, M., et al. Alginate overproduction affects Pseudomonas aeruginosa biofilm structure and function. Journal of Bacteriology. 183, 5395-5401 (2001).
- Tolker-Nielsen, T., Sternberg, C. Growing and analyzing biofilms in flow chambers. Current Protocols in Microbiology. 21, 1-17 (2011).
- Luo, T. L., et al. A Sensitive thresholding method for confocal laser scanning microscope image stacks of microbial biofilms. Scientific Reports. 8, 1-14 (2018).
- Beaudoin, T., Kennedy, S., Yau, Y., Waters, V. Visualizing the effects of sputum on biofilm development using a chambered coverglass model. Journal of Visualized Experiments. (118), e54819 (2016).
- DiGiandomenico, A., et al. Identification of broadly protective human antibodies to Pseudomonas aeruginosa exopolysaccharide Psl by phenotypic screening. Journal of Experimental Medicine. 209, 1273-1287 (2012).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146, 2395-2407 (2000).
- Vorregaard, M. Comstat2 - a modern 3D image analysis environment for biofilms, in Informatics and Mathematical Modelling. Technical University of Denmark. , (2008).
- Hashemi, M. A., Khaddour, G., François, B., Massart, T. J., Salager, S. A tomographic imagery segmentation methodology for three-phase geomaterials based on simultaneous region growing. Acta Geotechnica. 9, 831-846 (2014).
- Rogowska, J. Overview and fundamentals of medical image segmentation. Handbook of Medical Image Processing and Analysis. , 73-90 (2009).
- Webb, D., et al. Assessing technician effects when extracting quantities from microscope images. Journal of Microbiological Methods. 53, 97-106 (2003).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43, 313-351 (2017).
- Xavier, J. B., et al. Objective threshold selection procedure (OTS) for segmentation of scanning laser confocal microscope images. Journal of Microbiological Methods. 47, 169-180 (2001).
- Arena, E. T., et al. Quantitating the cell: turning images into numbers with ImageJ. Wiley Interdisciplinary Reviews: Developmental Biology. 6, 260 (2017).
- Daims, H., Wagner, M. Quantification of uncultured microorganisms by fluorescence microscopy and digital image analysis. Applied Microbiology and Biotechnology. 75, 237-248 (2007).
- Yerly, J., Hu, Y., Jones, S. M., Martinuzzi, R. J. A two-step procedure for automatic and accurate segmentation of volumetric CLSM biofilm images. Journal of Microbiological Methods. 70, 424-433 (2007).
- Lee, B., et al. Heterogeneity of biofilms formed by nonmucoid Pseudomonas aeruginosa isolates from patients with cystic fibrosis. Journal of Clinical Microbiology. 43, 5247-5255 (2005).
- Stapper, A. P., et al. Alginate production affects Pseudomonas aeruginosa biofilm development and architecture, but is not essential for biofilm formation. Journal of Medical Microbiology. 53, 679-690 (2004).
- Reichhardt, C., Parsek, M. Confocal laser scanning microscopy for analysis of Pseudomonas aeruginosa biofilm architecture and matrix localization. Frontiers in Microbiology. 10, 677 (2019).
- Yang, X., Beyenal, H., Harkin, G., Lewandowski, Z. Quantifying biofilm structure using image analysis. Journal of Microbiological Methods. 39, 109-119 (2000).
- Yang, X., Beyenal, H., Harkin, G., Lewandowski, Z. Evaluation of biofilm image thresholding methods. Water Research. 35, 1149-1158 (2001).
- Ross, S. S., et al. Quantification of confocal images of biofilms grown on irregular surfaces. Journal of Microbiological Methods. 100, 111-120 (2014).
- Ma, L., et al. Assembly and development of the Pseudomonas aeruginosa biofilm matrix. PLoS Pathogens. 5, (2009).
- Mah, T. F., et al. A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance. Nature. 426, 306-310 (2003).
- Srinandan, C. S., Jadav, V., Cecilia, D., Nerurkar, A. S. Nutrients determine the spatial architecture of Paracoccus sp. biofilm. Biofouling. 26, 449-459 (2010).
- Ramos, I., Dietrich, L. E., Price-Whelan, A., Newman, D. K. Phenazines affect biofilm formation by Pseudomonas aeruginosa in similar ways at various scales. Research in Microbiology. 161, 187-191 (2010).
- Ma, L., Jackson, K. D., Landry, R. M., Parsek, M. R., Wozniak, D. J. Analysis of Pseudomonas aeruginosa conditional psl variants reveals roles for the psl polysaccharide in adhesion and maintaining biofilm structure postattachment. Journal of Bacteriology. 188, 8213-8221 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır