Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Histon Asetiltransferaz 1 Asetilasyonunu Ölçmek için Bir Asetil-Tıklama Kimyası Testi
Bu Makalede
Özet
Spesifik inhibitörleri taramak için hızlı ve doğru kimyasal tahliller, ilaç geliştirme cephaneliğinde önemli bir araçtır. Burada, HAT1 asetilasyon aktivitesinin inhibisyonunu ölçmek için ölçeklenebilir bir asetil-tıklama kimyası testi sunuyoruz.
Özet
Histon asetiltransferaz 1 olarak da bilinen HAT1, nükleozom montajından önce ortaya çıkan H4'ü stabilize ederek ve asetilleyerek kromatin sentezinde çok önemli bir rol oynar. Çeşitli sistemlerde tümör büyümesi için gereklidir, bu da onu kanser tedavisi için potansiyel bir hedef haline getirir. HAT1 enzimatik aktivitesini inhibe edebilen bileşiklerin tanımlanmasını kolaylaştırmak için, hızlı tarama için bir asetil-tıklama testi tasarladık. Bu basit tahlilde, aktive edilmiş insan hücrelerinden saflaştırılan rekombinant HAT1 / Rbap46 kullanıyoruz. Yöntem, bir tıklama kimyası yaklaşımında asetil-CoA analoğu 4-pentinoil-CoA'yı (4P) kullanır. Bu, bir alkin sapının, HAT1'e bağlı bir asilasyon reaksiyonu yoluyla biyotinillenmiş bir H4 N-terminal peptidine enzimatik transferini içerir. Yakalanan peptit daha sonra nötravidin plakaları üzerinde hareketsiz hale getirilir, ardından biyotin-azid ile tıklama kimyası işlevselleştirilmesi yapılır. Daha sonra, amplex kırmızısını oksitlemek için streptavidin-peroksidaz alımı kullanılır ve bu da kantitatif bir floresan çıktısı ile sonuçlanır. Asilasyon reaksiyonu sırasında kimyasal inhibitörler ekleyerek, floresan sinyalinin azalmasına dayalı olarak enzimatik inhibisyonu ölçebiliriz. Daha da önemlisi, bu reaksiyon ölçeklenebilir ve HAT1 enzimatik aktivitesi için potansiyel inhibitörlerin yüksek verimli taranmasına izin verir.
Giriş
Çok sayıda ökaryotik asetiltransferaz arasında HAT1,izole edilecek ilk histon asetiltransferazdı 1,2,3. Daha sonraki araştırmalar, kromatin replikasyonunda, özellikle S-fazı4 sırasında yeni nükleozomların sentezinde önemli rolünü sağlam bir şekilde ortaya koymuştur. Araştırma çabalarımız, HAT1'in meme hücrelerindeepidermal büyüme faktörü (EGF) tedavisi ile yüksek oranda uyarıldığının kabul edilmesine yol açmıştır 5. Ayrıca, HAT1'in hızlı hücre proliferasyonu ve tümör oluşumu için gerekli olduğu ortaya çıkmıştır in vivo 6,7,8,9. Veriler, HAT1'in hücre bölünmesi için anabolik ve epigenetik süreçleri koordine etmede kritik olduğunu ve tümör büyümesini yönlendirdiğini göstermektedir.
HAT1, histon H4'ün amino terminal kuyruğunu, histonu bağlayan ve amino terminalini HAT1'e sunan şaperon proteini Rbap46 ile kompleks halinde lizin 5 ve 12 üzerinde di-asetillenir. Histon tetramerleri veya disomları10, HAT1/Rbap46 ve diğer histon şaperonları11 ile birlikte daha sonra çekirdeğe aktarılır. Histonlar daha sonra replikasyon çatalında veya gen aktivasyonunu veya baskılanmasını desteklemek için diğer bölgelerde biriktirilmek üzere serbest bırakılır. HAT1 di-asetilasyon işaretinin histon H4 üzerindeki işlevi tam olarak anlaşılmamıştır. H4 kromatine yerleştirildikten sonrahiston deasetilaz 12,13,14,15'in etkisiyle 15-30 dakikalık bir süre içinde muhtemelen hızlı bir şekilde çıkarılır. Bu nedenle, HAT1 di-asetilasyon işareti kromatin içinde yayılmaz ve kromatin modifiye edici enzimlerin yeni ortaya çıkan kromatine alınmasında bir rol olduğu öne sürülmesine rağmen, gerçek bir epigenetik role hizmet etmeyebilir12. Ayrıca, HAT1 kromatini doğrudan asetillemez; Aktivitesi çözünür histonlarla sınırlıdır.
Küçük moleküllü histon asetiltransferaz inhibitörlerinin geliştirilmesi, spesifik olmayan ve düşük verimli deneyler tarafından engellenmiştir ve bu da genellikle biyolojik olarak reaktif bileşiklerinüretilmesine neden olmuştur 16,17. Asetiltransferaz aktivitelerini ölçmek için altın standart tahlil, verimi sınırlayan ve radyasyon gerektiren 3H-asetil-coA kullanımını gerektirir. Bununla birlikte, son zamanlarda, CBP / p30018 ve KAT6A / B 19,20'yi hedefleyen spesifik ve oldukça güçlü küçük moleküllü asetiltransferaz inhibitörleri tanımlanmış ve 3H-asetil-CoA kullanımı ile doğrulanmıştır. İleriye dönük olarak, daha iyi verim elde etmek ve laboratuvar tehlikelerinden kaçınmak için geliştirilmiş tahliller tasarlanmaktadır.
Asetilasyon izleme21'deki son gelişmeler, enzimatik reaksiyon izlemeyi sağlamak için tıklama kimyasını kullanmıştır. Basit sentetik yollarla erişilebilen veya enzim reaksiyonlarına dahil edilebilen satın alınabilen çeşitli tıklama özellikli öncüler vardır. Bu reaksiyonlar tipik olarak rekombinant sistemlerde gerçekleştirilir, ancak hücre bazlı tahliller de mümkündür22. Tıklama özellikli kofaktörlerin ve substratların avantajı, taramanın, genellikle tarama bileşikleri tarafından bozulan ve ek işleme adımları gerektiren birleştirilmiş okuma sistemlerine ihtiyaç duymadan enzim aktivitesini doğrudan ölçebilmesidir. Bu, inhibitör tedavilerine yalnızca enzimatik adım sırasında izin verirken, tüm aşağı akış işlevselleştirme ve tespit adımları, bileşikleri uzaklaştırmak için kapsamlı yıkamadan sonra gerçekleştirilir, böylece tahlil girişiminin meydana gelme potansiyelini sınırlar. Bu avantajlar, tıklama özellikli testlerin tasarımını, genellikle serbest koenzim A'nın saptanmasına dayanan birleştirilmiş tahlillere tercih edilir hale getirir.
Önemli bir husus, tıklama özellikli kofaktörlerin enzim aktif bölgesine kabul edilmesidir. Mevcut tıklamanın etkin olduğu ortak faktörler, yerel ortak faktör için optimize edilmiş etkin siteyle tam olarak uyumlu olmayabilir. Yapısal bilgi ve modelleme, değiştirilmiş substratları dahil etmek için aktif bölgeyi genişletmek için amino asit ikamelerini tasarlamak için kullanılabilir23. Bu, gelişmiş enzim kinetiği ve daha düşük substrat ve enzim seviyeleri ile taramayı mümkün kılabilir. Bu yaklaşımın dezavantajı, değiştirilmiş katalitik ceplerin, doğal enzimle güçlü bir şekilde etkileşime giren inhibitörleri tanımlayamamasıdır. Sonuç olarak, potansiyel enzim inhibitörlerini tanımlamak ve doğrulamak için yaklaşımların bir kombinasyonu gereklidir.
Burada, tıklama ko-faktörü 4-pentinoil-CoA24 kullanarak HAT1 enzim aktivitesini saflaştırmak ve test etmek için geliştirilmiş bir yöntemi açıklıyoruz. Bu test (Şekil 1), enzim aktivitesini arttırdığı gösterilen gerekli ortak proteini Rbap46 ile kompleks halinde doğal enzim dizisini kullanır. Enzimin insan hücrelerinden saflaştırılması, tam enzim aktivitesi için önemli olan uyarıcı translasyon sonrası modifikasyonları koruyabilen selülde enzim aktivasyonuna izin verir. Yüksek verimli kimyasal ekranlar için rekombinant enzim deneylerinin tasarımı ve optimizasyonu, HAT1 küçük molekül inhibitörlerini tanımlamak ve karakterize etmek için başarıyla kullanılmıştır.
Protokol
1. Yöntem 1: Rekombinant HAT1/Rbap46 kompleksinin üretilmesi ve saflaştırılması
- HEK293f hücrelerinin çözülmesi, kurtarılması ve genişletilmesi
- 100 mL'lik bir şişede 1-10 milyon HEK293f memeli hücresini26 30 mL serbest stil 293 ekspresyon ortamına çözün. 60 rpm'de dönerken 37 °C'de% 8 CO2 içinde inkübe edin.
- Ertesi gün, hücre canlılığını sayın ve kontrol edin, ardından dönüş hızını 120 rpm'ye ayarlayın. 1 L'lik bir şişede 300 mL kültüre genişletin, tohumlama yoğunluğunu 500.000 hücre/mL'de tutun ve yoğunluk 3 x 106 hücre/mL'yi aşmadan hücreleri bölün.
- HEK293f transfeksiyon
- 1 L'lik bir şişede 300 mL kültürde 5 x10 5 hücre / mL tohumlayın ve 24 saat boyunca kültürleyin. Ertesi gün, 7,5 x 105 ila 1,2 x 106 hücre/mL arasında olduklarından emin olmak için hücreleri sayın.
- 30 mL PBS'de 300 μg pHEK-FLAG-HAT1 ve 300 μg pHEK-Rbap46 plazmit DNA'larının bir karışımını hazırlayın. DNA/PBS'ye 1.2 mL polietilenimin (PEI) ekleyin ve karıştırın. DNA/PBS/PEI karışımını 300 mL kültüre ekleyin ve 37 °C'de 120 rpm'de 48 saat inkübe edin.
- Hasat hücreleri
- 1,7 x 106 ila 2,5 x 106 hücre/mL arasında olduklarından emin olmak için hücreleri sayın. Bu hücre yoğunluğunda, HAT1'i aktive etmek ve hücreleri 30 dakika, 37 °C, 120 rpm inkübe etmek için 12.5 μM'lik bir son konsantrasyona forskolin ekleyin.
- Hücreleri 5 dakika boyunca 300 x g'da pelet haline getirin, bir kez 30 mL PBS ile yıkayın ve sıvıN2'de dondurun. Protein saflaştırılana kadar -80 °C'de saklayın veya doğrudan saflaştırmaya devam edin.
- HAT1/Rbap46 kompleks BAYRAK boncuk saflaştırma
- Hücreleri parçalayın ve protein özü hazırlayın.
- 50 mL RSB-500'e (20 mM Tris-HCl pH 7.5, 500 mM NaCl, 25 mM MgCl2) bir tablet proteaz inhibitör kokteyli (PIC) ekleyerek lizis tamponu hazırlayın.
- 300 mL kültürden elde edilen hücre peletini buz üzerinde çözdürün ve %0.1 Triton X-100 ile 40 mL buz gibi soğuk lizis tamponu ile parçalayın. Buz üzerinde sonikate, daha sonra 4 ° C'de 10 dakika boyunca 10.000 x g'de döndürün. Tüm süpernatanı, şimdi protein özü olan buz üzerinde 50 mL'lik bir tüpte toplayın.
- BAYRAK boncukları hazırlayın.
- 5 mL 0,1 M Glisin pH 3,5,% 0,01 Triton X-100 içeren her tüpe 400 μL M2-FLAG agaroz boncuk bulamacı ekleyerek FLAG boncuklarını dört adet 15 mL'lik konik tüpe bölün. Her tüpü elle 5 saniye kuvvetlice çalkalayın.
- 4 ° C'de 1000 x g'de 30 saniye boyunca nabız santrifüjü, süpernatanı aspire edin, 5 mL RSB-500 +% 0.1 Triton X-100 (Tx-100; proteaz inhibitörü yok) ile iki kez yıkayın ve buz üzerinde inkübe edin.
- FLAG immünopresipitasyon gerçekleştirin.
- Yıkanmış boncuklar içeren her 15 mL konik tüpe 10 mL protein özü ekleyin. Tüpleri 4 ° C'de ters dönüşle en az 90 dakika veya gece boyunca inkübe edin.
- Bağlı boncukları 5x 10 mL RSB-500 +% 0.1 Tx-100 içinde yıkayın. Her yıkama için, boncukları yeniden süspanse etmek için tüpü 2x-5x ters çevirin, ardından 4 °C'de 1 dakika boyunca 1000 x g'da pelet yapın. Son olarak, RSB-100 (20 mM Tris-HCl pH 7.5, 100 mM NaCl, 25 mM MgCl2) +% 0.1 Tx-100'de 1 kez yıkayın.
- FLAG peptit elüsyonu: 0.5 mg / mL FLAG peptidi içeren 1.5 mL Elüsyon Tamponu (EB) içinde HAT1 kompleksini elute edin. 4 °C'de en az 1 saat veya gece boyunca inkübe edin. Ayrıştırılmış boncukları 4 °C'de 30 saniye boyunca 1000 x g'da darbeli santrifüjleyin ve saflaştırılmış HAT1/Rbap46 kompleksini içeren süpernatanı toplayın.
- Proteini konsantre edin ve FLAG peptidini çıkarın.
- 20 mL, 10.000 Dalton'luk bir kesme filtre tüpüne elüat ekleyin. EB ile hacmi 15 mL'ye getirin. 4 ° C'de 15 dakika boyunca 2500 x g'da döndürün, her seferinde ek 15 mL EB ile iki kez tekrarlayın.
- Filtre tüpünden son elüatı geri kazanın ve protein konsantrasyonunu A260 ile kontrol edin. 6 mL EB'de (300 mL başlangıç kültürü başına) 1 mg toplam protein konsantrasyonu bekleyin. SDS-PAGE, Coomassie ve immünoblotlama ile protein saflığını kontrol edin ve alikotları -80 ° C'de saklayın.
- Hücreleri parçalayın ve protein özü hazırlayın.
2. Yöntem 2: HAT1 asetil tıklama standart eğrisi
- Standart eğrinin hazırlanması
- Pozitif bir kontrol H4 N-terminal peptidini şu sırayla sentezleyin: SCRG [Pra] GGKGLG [Pra] GGAKRHRKVLRGG [Lys (Biotin)], burada [Pra] Propargilglisin anlamına gelir.
- Pra peptidini DMSO'da 0.1 mg / mL'ye yeniden süspanse edin. Standart bir eğri oluşturmak için Pra peptidini biyotinile histon H4 peptidi (1-23-GGK-biotin) ile karıştırın (Şekil 2; Tablo 1'de bulunan hacimler). Standart eğriler, plaka bağlamadan önce taze olarak yapılabilir veya önceden yapılmışsa, 20 μL 8 M üre ile karıştırılabilir ve adım 3.3'e kadar -20 ° C'de saklanabilir.
3. Yöntem 3: HAT1 asetil-tıklama testi
- Asetilasyon reaksiyonlarının test inhibitörleri ile birleştirilmesi
- Aşağıdaki bileşenlerden 0.2 mL PCR tüplerinde veya 96 oyuklu PCR plakalarında iki kopya halinde asetilasyon reaksiyonlarını birleştirin: DMSO'da 0.1 mg / mL'ye (34.8 μM) yeniden süspanse edilmiş biyotinile histon H4 peptidi (1-23-GGK-biotin), EB içinde önceden seyreltilmiş HAT1 enzimi, 20x tampon (1M Tris pH 8.5,% 0.1 NP40), 2 mM DTT, suda 1 mg / mL'ye (1 mM) çözülmüş 4-pentinoil-CoA. 20 μL'lik bir reaksiyon, 10 μL enzim, 1 μL H4 peptit, 1 μL 20x tampon, önceden karıştırılmış 1 μL DTT içerir ve buz üzerinde 96 oyuklu bir PCR plakasının kuyucuklarına gönderilir.
- Kuyucuk başına 1 μL DMSO (negatif kontrol) veya 1-10 μM'de çözünmüş test bileşiği veya H4K12CoA25 (veya uygun pozitif kontrol inhibitörü) ekleyin. Nazikçe pipetleyerek karıştırın ve enzim: inhibitör komplekslerinin oluşmasını sağlamak için buz üzerinde 10 dakika inkübe edin.
- Asetilasyon reaksiyonunun devamı
- 2 μL 4-pentinoil-CoA'yı 4 μL su ile birleştirin, ardından kuyucuklara ekleyin. Pipetleme ile nazikçe karıştırın, içeriği toplamak için RT'de 300 s boyunca 300 x g'da santrifüjleyin ve 37 °C'de 1 saat boyunca kapaklı tüplerde veya yeniden kapatılabilir folyolu plakalarda inkübe edin.
- İçeriği doğrudan reaksiyon ürünleri için işleyin veya 20 μL 8 M üre ile söndürün ve işlenene kadar -20 °C'de saklayın.
- Neutravidin plakasına peptit bağlanması
- Kuyucuk başına 80 μL PBST (PBS +% 0.1 Tween-20) içeren sığır serum albümini (BSA) önceden bloke edilmiş siyah Nötravidin kaplı 96 oyuklu plakalara üreli veya üresiz reaksiyon içerikleri ekleyin.
- Standart eğri peptitleri, 80 μL PBST içeren kendi kuyucuklarına iki kopya halinde ekleyin. Peptitleri oda sıcaklığında (RT) 1 saat boyunca hafif yörüngesel çalkalama ile bağlayın.
- Yıkama: Bağlama işlemi tamamlandıktan sonra, sıvıyı kuyulardan aspire edin ve kuyuları bir plaka yıkayıcı kullanarak 200 μL PBST 3x 15 strok (180 μL strok hacmi) ile yıkayın.
- Kimya reaksiyonunu tıklayın
- Tıklama reaksiyonu için reaktifleri şu şekilde hazırlayın: suda 100 mM Tris(3-hidroksipropiltriazolimetil)amin (THPTA) ligandı ve suda 20 mMCuS4 . THPTA, Cu (II) katalizli hidrolizi önler veO2 / Cu / askorbattan üretilen radikalleri ve peroksitleri söndürür.
- THPTA/Cu karışımını suda 300 mM sodyum askorbata ve DMSO'da 2.5 mM biotin azide ekleyin. Tek tıklamayla reaksiyon 140 μL PBS, 10 μL THPTA, 10 μLCuS4, 10 μL sodyum askorbat, 20 μL biyotin-azid içerir. Tıklama reaktiflerini her zaman taze olarak karıştırın, ardından her bir oyuğa 190 μL dağıtın, plakayı kapatın ve 37 ° C'de 1 saat inkübe edin.
- Yıkama: Sıvıyı kuyulardan aspire edin ve plakayı 3x PBST ile yıkayın (180 μL strok hacmi, her yıkama için 15 strok).
- Streptavidin-yaban turpu peroksidaz bağlanması: Streptavidin (0.224 mg / mL) streptavidin-HRP'yi (0.224 mg / mL) 1:10 oranında seyreltin, ardından PBST'de 1:1000 oranında seyreltin. Steptavidin-HRP: streptavidin karışımı (oyuk başına 100 μL) ekleyin ve hafif yörünge çalkalama ile 1 saat boyunca RT'de inkübe edin.
- Önceki adımlarda olduğu gibi PBST ile 3 kez yıkayın.
- Amplex kırmızı oksidasyon
- Amplex kırmızı tespit reaktiflerini aşağıdaki gibi birleştirin: 4.45 mL NaHPO4 tamponu (1x = 50 mM nihai konsantrasyon), 50 μL amplex kırmızı (DMSO'da seyreltilmiş 20 mM), 500 μL seyreltilmişH2O2.
- H2O2'yi 1x NaHPO 4 tamponunda %30 stoktan %3'e seyreltin, ardından 977 μL 1x NaHPO4 tamponuna 22.7 μL %3H2O2ekleyin (bu, amplex reaksiyonu için kullanılan H2O2'dir). Oyuk başına 100 μL amplex kırmızı reaksiyon karışımı ekleyin, RT'de 30 dakika boyunca ışıktan korunarak inkübe edin, ardından standart bir floresan plaka okuyucu kullanarak floresan uyarımını/emisyonunu 571/585 nm tespit edin.
- Enzim inhibisyonunun hesaplanması: İnhibisyon yüzdesini hesaplayın (Şekil 3) aşağıdaki formüle göre:
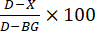 burada D sadece DMSO ile muamele edilen kontrol reaksiyonlarının floresan değeridir, X test bileşikleri ile muamele edilen reaksiyonların değeridir ve BG arka plan kuyularının değeridir (H4 peptit kontrolü, enzim eklenmemiş).
burada D sadece DMSO ile muamele edilen kontrol reaksiyonlarının floresan değeridir, X test bileşikleri ile muamele edilen reaksiyonların değeridir ve BG arka plan kuyularının değeridir (H4 peptit kontrolü, enzim eklenmemiş). - Doz eğrisi: Bileşik seri olarak seyreltilmişken, tekrar tahliller için HAT1 enzim aktivitesini inhibe ettiği tespit edilen test bileşiklerini seçin. Bileşik dilüsyonları ampirik olarak belirleyin. Örneğin, 2 mM stok konsantrasyonu ile başlayın, ardından sekiz seyreltme için seri olarak 1:3 oranında seyreltin. Daha sonra 1:20 oranında seyrelterek 100 μM üst doz veren enzim tahlillerine seyreltin.
- Eğrinin çizilmesi: Veri analiz yazılımında (GraphPad Prism) doz-yanıt inhibisyon eğrilerine (adım 3.10'daki yüzde inhibisyon değerlerini kullanarak) uyması için en küçük kareler regresyonunu kullanın ve her bileşik için IC50 değerleri türetin (Şekil 4).
- Asetil-CoA ile asetilasyon reaksiyonu:
- Enzim aktivitesini 4-pentinoil-CoA yerine doğal kofaktör asetil-CoA ile doğrulamak için bunu kullanın. HAT1 asetilasyon testlerini 3.1-3.2 adımlarında açıklandığı gibi 4-pentinoil-CoA yerine asetil-CoA ile gerçekleştirin.
- Reaksiyon ürünlerini nitroselüloz membranlara (1-2 μL) yerleştirin, kurumasını bekleyin, ardından anti-H4-lizin-12-asetil veya anti-H4-lizin-5-asetil antikorları ile nokta-lekeleyin. İmmünoblot sinyalini dansitometri ile ölçün.
Sonuçlar
Uygun tahlil performansını sağlamak için her plakaya çift (16 kuyucuk) standart eğriler dahil edilmelidir. Standart eğri verileri, Pra içeren peptitin çözeltideki doğal H4 peptidine oranına göre %100 ila %0 aralığında tablo şeklinde ayarlanmalıdır (Tablo 1). Amplex kırmızı sinyal, %100 pra/%0 doğal H4 peptit kuyularında en yüksek ve %0 pra/%100 doğal H4 peptit kuyularında en düşük olacaktır. Floresan tespit edildikten ve kuyuların ortalaması alındıktan sonra, ortaya ç?...
Tartışmalar
Son on yılda, tıklama kimyası öne çıktı20 ve etkileşen kimyasal yapıların hassas tasarımını mümkün kıldı. Bu bağlamda, çeşitli biyoortogonal kovalent bağlantılar21 doğal ortamlarında kompleksler oluşturmak için umut verici seçenekler olarak ortaya çıkmıştır. Tıklama kimyası, genellikle "tıklama reaksiyonları" olarak bilinen hızlı ve seçici reaksiyonlar sergileyen fonksiyonel grup çiftlerini kullanır. Bu reaksiyonlar, çevre dostu, yu...
Açıklamalar
HAT1 asetil tıklama testini (PCT / US20 / 29395) açıklayan patentler aldık. J.J.G., Sharma Therapeutics, LLC ve Guidepoint ile danışmanlık anlaşmaları ve Hummingbird Biosciences'tan araştırma desteği (kurumuna) bildirdi.
Teşekkürler
George Zheng'e H4K12CoA'yı sağladığı için teşekkür ederiz. Yararlı tartışmalar ve geri bildirimler için Gruber Lab üyelerine teşekkür ederiz. NIH/NCI (1K08CA245024), CPRIT (RR200090) ve V Vakfı'nın (V2022-022) desteğine teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4P CoA | Cayman Chemical | 10547 | Click chemistry co-factor |
| Amplex Red | Fisher Sci | A12222 | Fluorescence substrate |
| Biotin-PEG-Azide | Alfa Aesar | J64996MC | Click chemistry |
| Copper Sulfate | Sigma-aldrich | 7758-98-7 | Click chemistry |
| DMSO | Fisher Scientific | 67-68-5 | diluent |
| DTT | Acros Organics | 03-12-3483 | reducting agent |
| Forskolin | VWR | 102987-310 | Protein expression |
| Freestyle 293 Expression Medium | Thermo Fisher | 12338018 | Media |
| Freestyle 293-F cells | Thermo Fisher | R790-07 | Protein expression |
| H4-peptide/1-23-GGK-biotin | Anaspec | AS65097 | peptide substrate |
| HEPES | Sigma-aldrich | 7365-45-9 | EB buffer |
| Hydrogen peroxide 30% solution | Sigma-aldrich | Z00183-99-0 | initiator |
| M2 FLAG antibody slurry | Millipore-Sigma | A2220 | Protein purification |
| Macrosep 10K Filter (Pall Lab) | VWR | 89131-980 | Protein purification |
| Neutravidin Plate | Thermo Sci | 15127 | BSA-pre-blocked |
| NP40 (IGEPAL) | MP Biomedical | 198596 | 20x buffer |
| pHEK-293 plasmid | Takara Bio | 3390 | Protein expression |
| Phosphate Buffered Saline 10x | Alfa Aesar | Z00082-33-6 | wash buffer |
| Pra peptide | Genscript | Custom synthesis | biotinylated |
| Sodium Ascorbate | Sigma-aldrich | 134-03-2 | Click chemistry |
| Sodium chloride | Sigma-aldrich | 7647-14-5 | EB buffer |
| Sodium phosphate | VWR International | 7558-80-7 | buffer |
| Streptavidin | EMD Millipore | 189730 | competitor |
| Streptavidin-HRP | Cell Signaling | 3999S | enzyme |
| THPTA ligand | Fisher Sci | 1010-500 | Click chemistry |
| Tris base | Sigma-aldrich | 77-86-1 | 20x buffer |
| Triton-X 100 | VWR International | 9002-93-1 | EB buffer |
| Tween-20 | Sigma-aldrich | 9005-64-5 | Wash buffer |
| Urea | Sigma-Aldrich | 57-13-6 | quencher |
Referanslar
- Kleff, S., et al. Identification of a gene encoding a yeast histone H4 acetyltransferase. J Biol Chem. 270 (42), 24674-24677 (1995).
- Parthun, M. R., Widom, J., Gottschling, D. E. The major cytoplasmic histone acetyltransferase in yeast: links to chromatin replication and histone metabolism. Cell. 87 (1), 85-94 (1996).
- Verreault, A., et al. Nucleosomal DNA regulates the core-histone-binding subunit of the human Hat1 acetyltransferase. Curr Biol. 8 (2), 96-108 (1998).
- Parthun, M. R. Histone acetyltransferase 1: more than just an enzyme. Biochim Biophys Acta. 1819 (3-4), 256-263 (2013).
- Gruber, J. J., et al. HAT1 coordinates histone production and acetylation via H4 promoter binding. Mol Cell. 75 (4), 711-724 e5 (2019).
- Fan, P., et al. Overexpressed histone acetyltransferase 1 regulates cancer immunity by increasing programmed death-ligand 1 expression in pancreatic cancer. J Exp Clin Cancer Res. 38 (1), 47 (2019).
- Xia, P., et al. MicroRNA-377 exerts a potent suppressive role in osteosarcoma through the involvement of the histone acetyltransferase 1-mediated Wnt axis. J Cell Physiol. 234 (12), 22787-22798 (2019).
- Yang, G., et al. Histone acetyltransferase 1 is a succinyltransferase for histones and non-histones and promotes tumorigenesis. EMBO Rep. 22 (2), e50967 (2021).
- Xue, L., et al. RNAi screening identifies HAT1 as a potential drug target in esophageal squamous cell carcinoma. Int J Clin Exp Pathol. 7 (7), 3898-3907 (2014).
- Zhang, W., et al. Structural plasticity of histones H3-H4 facilitates their allosteric exchange between RbAp48 and ASF1. Nat Struct Mol Biol. 20 (1), 29-35 (2013).
- Campos, E. I., et al. The program for processing newly synthesized histones H3.1 and H4. Nat Struct Mol Biol. 17 (11), 1343-1351 (2010).
- Agudelo Garcia, P. A., et al. Identification of multiple roles for histone acetyltransferase 1 in replication-coupled chromatin assembly. Nucleic Acids Res. 45 (16), 9319-9335 (2017).
- Nagarajan, P., et al. Histone acetyl transferase 1 is essential for mammalian development, genome stability, and the processing of newly synthesized histones H3 and H4. PLoS Genet. 9 (6), e1003518 (2013).
- Annunziato, A. T. Assembling chromatin: the long and winding road. Biochim Biophys Acta. 1819 (3-4), 196-210 (2013).
- Annunziato, A. T., Seale, R. L. Histone deacetylation is required for the maturation of newly replicated chromatin. J Biol Chem. 258 (20), 12675-12684 (1983).
- Dahlin, J. L., et al. Assay interference and off-target liabilities of reported histone acetyltransferase inhibitors. Nat Commun. 8 (1), 1527 (2017).
- Baell, J. B., Miao, W. Histone acetyltransferase inhibitors: where art thou. Future Med Chem. 8 (13), 1525-1528 (2016).
- Lasko, L. M., et al. Discovery of a selective catalytic p300/CBP inhibitor that targets lineage-specific tumours. Nature. 550 (7674), 128-132 (2017).
- Baell, J. B., et al. Inhibitors of histone acetyltransferases KAT6A/B induce senescence and arrest tumour growth. Nature. 560 (7717), 253-257 (2018).
- Falk, H., et al. An efficient high-throughput screening method for MYST family acetyltransferases, a new class of epigenetic drug targets. J Biomol Screen. 16 (10), 1196-1205 (2011).
- He, M., et al. Chemical biology approaches for investigating the functions of lysine acetyltransferases. Angew Chem Int Ed Engl. 57 (5), 1162-1184 (2018).
- Lipchik, A. M., et al. A peptide-based biosensor assay to detect intracellular Syk kinase activation and inhibition. Biochemistry. 51 (38), 7515-7524 (2012).
- Song, J., et al. Chemoproteomic profiling of protein substrates of a major lysine acetyltransferase in the native cellular context. ACS Chem Biol. 17 (5), 1092-1102 (2022).
- Gaddameedi, J. D., et al. Acetyl-click screening platform identifies small-molecule inhibitors of histone acetyltransferase 1 (HAT1). J Med Chem. 66 (8), 5774-5801 (2023).
- Ngo, L., Brown, T., Zheng, Y. G. Bisubstrate inhibitors to target histone acetyltransferase 1 (HAT1). Chem Biol Drug Des. 93 (5), 865-873 (2019).
- Parker, C. G., Pratt, M. R. Click chemistry in proteomic investigations. Cell. 180 (4), 605-632 (2020).
- Islam, K. The bump-and-hole tactic: Expanding the scope of chemical genetics. Cell Chem Biol. 25 (10), 1171-1184 (2018).
- Radziwon, K., Weeks, A. M. Protein engineering for selective proteomics. Curr Opin Chem Biol. 60, 10-19 (2021).
- Rich, R. L., Myszka, D. G. Survey of the year 2007 commercial optical biosensor literature. J Mol Recognit. 21 (6), 355-400 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır