A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أو-تفاعل Slp1 البوليمرات واحد رقائق من
In This Article
Summary
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
Abstract
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
Introduction
نظرا لتزايد استخدام الذهب لعدة تطبيقات مثل الالكترونيات والمواد الحفازة، أجهزة الاستشعار، أو الأدوات الطبية، نما الطلب على هذا المعدن النفيس أكثر من مرة خلال السنوات القليلة الماضية "6-9. يتم الافراج عن الذهب، فضلا عن العديد من المعادن الثمينة والثقيلة الأخرى في البيئة من خلال النفايات الصناعية السائلة في تركيزات المخففة، من خلال أنشطة التعدين، والتخلص من النفايات 7،8،10، على الرغم من أن معظم التلوث البيئي بالمعادن الثقيلة أو الثمينة هو عملية مستمرة الناجمة أساسا عن الأنشطة التكنولوجية. وهذا يؤدي إلى تدخل كبير من النظم الإيكولوجية الطبيعية، ويمكن أن تهدد صحة الإنسان 9. معرفة هذه النتائج السلبية يشجع على البحث عن تقنيات جديدة لإزالة المعادن من النظم الإيكولوجية والتحسينات الملوثة في إعادة تدوير المعادن من مياه الصرف الصناعي. أساليب الفيزيائية والكيميائية راسخة مثل هطول الأمطار أو التبادل الأيوني ليست فعالة جدا، وخصوصا في عاليةلاي المخفف حلول 7،8،11. Biosorption، إما مع المعيشة أو الكتلة الحيوية الميتة، هو بديلا جذابا لمعالجة مياه الصرف الصحي 10،12. استخدام مثل هذه المواد البيولوجية يمكن أن تقلل من استهلاك المواد الكيميائية السامة. وقد وصفت العديد من الكائنات الحية الدقيقة لتتراكم أو شل المعادن. على سبيل المثال، خلايا Lysinibacillus كروي (L. كروي) JG-A12 أظهرت قدرات عالية ملزمة للمعادن الثمينة، على سبيل المثال، PD (II)، وحزب العمال (II)، والاتحاد الافريقي (III)، والمعادن السامة الأخرى مثل الرصاص (II) أو U (VI) 4،13، خلايا العصوية الضارية لالكروم (VI) 14، خلايا خميرة الخباز لحزب العمال (II) والمشتريات (II) 15، وشلوريلا المبتذلة ل Au (III) وU (VI) 16 17. الربط المعادن السابقة مثل الاتحاد الافريقي (III)، PD (II)، وحزب العمال (II) كما تم الإبلاغ عن منتزعة الكبريت desulfuricans 18 وL. كروي JG-B53 19،20. ومع ذلك، لا آلالميكروبات ل ربط كميات عالية من المعادن وتطبيقها كمادة sorptive محدودة 12،21. وعلاوة على ذلك، معدنية سعة ملزم يعتمد على معايير مختلفة، مثل تكوين الخلية، وتستخدم المكون الحيوي، أو البيئية والظروف التجريبية (درجة الحموضة، والقوة الأيونية، ودرجة الحرارة وما إلى ذلك). دراسة معزولة شظايا جدار الخلية 22،23، مثل الدهون غشاء، ببتيدوغليكان، البروتينات، أو غيرها من المكونات، ويساعد على فهم المعدن عمليات الخلايا الكاملة المعقدة التي شيدت 8،21 ملزمة.
مكونات الخلية التي تركز على هذه الدراسة هي بروتينات S-طبقة. البروتينات S-طبقة هي جزء من المغلف الخلية الخارجي من العديد من أنواع البكتيريا والعتيقة، والتي تشكل حوالي 15-20٪ من مجموع كتلة البروتين من هذه الكائنات. واجهة الأولى للبيئة، فإن هذه المركبات الخلية يؤثر بقوة على خصائص الامتصاص البكتيرية 3. البروتينات S-طبقة مع الأوزان الجزيئية تتراوح بين أربعينلتنتج مئات من كيلو دالتون داخل الخلية، ولكن يتم تجميعها خارج حيث أنها قادرة على تشكيل طبقات على الأغشية الدهنية أو البوليمر مكونات جدار الخلية. مرة واحدة معزولة، ما يقرب من جميع S-طبقة بروتينات لها خاصية ذاتية للعفويا التجمع الذاتي في التعليق، في واجهات، أو على الأسطح المستوية أو تشكيل أنبوب يشبه الهياكل 3. سمك أحادي الطبقة البروتين يعتمد على البكتيريا وضمن مجموعة من 5-25 نانومتر 24. بشكل عام، يمكن الهياكل بروتين S-طبقة تشكلت لديهم المائل (P1 أو P2)، مربع (P4)، أو سداسية (P3 أو P6) التماثل مع ثوابت شعرية من 2،5 حتي 35 نانومتر 3،24. يبدو أن تشكيل شعرية ليكون في كثير من الحالات تعتمد على الكاتيونات ثنائي التكافؤ وبشكل رئيسي على الكالسيوم 2+ 25،26، راف، J. آخرون. S-طبقة nanocomposites استنادا للتطبيقات الصناعية في القائمة على البروتين المهندسة النانو. (محرران Tijana Z. غروف وAitziber L. Cortajarena) (الوثاب، 2016 (المقدمة)). ومع ذلك، فإن سلسلة التفاعل الكامل للطي مونومر، التفاعل مونومر-مونومر، تشكيل شعرية، ودور المعادن المختلفة، وخاصة من الكاتيونات ثنائي التكافؤ مثل الكالسيوم والمغنيسيوم 2+ 2+، لا تزال غير مفهومة تماما.
سلالة إيجابية الجرام L. تم عزل كروي JG-B53 (التي أعيدت تسميتها من عصيات كروي بعد تصنيف النشوء والتطور الجديد) 27 من كومة من النفايات تعدين اليورانيوم "Haberland" (Johanngeorgenstadt، ساكسونيا، ألمانيا) 4،28،29. في ظيفية البروتين S-طبقة (Slp1) يمتلك شعرية مربع، الوزن الجزيئي من 116 كيلو دالتون 30، وسمك ≈ 10 نانومتر في العيش البكتيريا الخلايا 31. في دراسات سابقة، وقد تحقق تشكيل في المختبر من طبقة البروتين المغلقة ومستقرة مع سمك حوالي 10 نانومتر في أقل من 10 دقيقة 19. سلالة ذات الصلة L. كروي JG-A12، أيضا عزل من "Haberland" كومة، يمتلك قدرات معدنية عالية ملزمة وأظهرت معزول بروتين S-طبقته على معدلات الامتصاص الجيدة الكيميائية عالية والاستقرار الميكانيكية والمعادن الثمينة مثل الاتحاد الافريقي (III)، وحزب العمال (II)، وبالشلل الرعاش (II) 4،32،33. هذا الربط من المعادن الثمينة هو أكثر أو أقل محددة لبعض المعادن ويعتمد على توفر مجموعة وظيفية على سطح البروتين الخارجي والداخلي من البوليمر والمسام، والقوة الأيونية، وقيمة الرقم الهيدروجيني. المجموعات الوظيفية ذات الصلة للتفاعل المعدن من البروتينات COOH-، NH 2 - OH-، PO 4 -، SO 4 - وستتناول ما. من حيث المبدأ، والقدرات المعادن ملزم فتح مجموعة واسعة من التطبيقات، راف، J. آخرون. S-طبقة nanocomposites استنادا للتطبيقات الصناعية في القائمة على البروتين المهندسة النانو. (محرران Tijana Z. غروف وAitziber L. Cortajarena) (الوثاب، 2016 (مقدم)). على سبيل المثال، كمكونات biosorptive لإزالة أو الانتعاشمن المعادن السامة أو قيمة المنحل، قوالب لتخليق أو ترسب محددة من الجسيمات النانوية منظم بانتظام المعدنية (NPS) لالحفز، وغيرها من المواد الهندسة الحيوية مثل طبقات الحيوية الحسية 3،5،18،33. ترتيب بانتظام صفائف NP مثل الاتحاد الافريقي (0) يمكن استخدام -NPs لتطبيقات رئيسية تتراوح بين الإلكترونيات الجزيئية وأجهزة الاستشعار، أجهزة التخزين كثافة عالية جدا، والمحفزات لCO للأكسدة 34-37. تطوير مثل هذه التطبيقات والتصميم الذكي لهذه المواد تستدعي فهما أعمق لآليات ملزمة المعادن الأساسية.
ومن الشروط الأساسية لتطوير مثل هذه المواد الحيوي القائم هو تنفيذ موثوق من طبقة واجهة بين جزيء حيوي وسطح الفني 38،39. على سبيل المثال، polyelectrolytes تجميعها مع طبقة من قبل طبقة (LBL) تقنية 40،41 استخدمت بوصفها طبقة واجهة لالتبلور من البروتينات S-طبقة 39 . هذه واجهة تقدم طريقة سهلة نسبيا لأداء طلاء البروتين بطريقة متكررة والكمية. عن طريق إجراء تجارب مختلفة مع وبدون تعديل مع المروجين لاصق، فمن الممكن لجعل البيانات المتعلقة حركية طلاء والاستقرار طبقة، وتفاعل المعادن مع الجزيئات الحيوية 19،42، راف، J. آخرون. S-طبقة nanocomposites استنادا للتطبيقات الصناعية في القائمة على البروتين المهندسة النانو. (محرران Tijana Z. غروف وAitziber L. Cortajarena) (الوثاب، 2016 (مقدم)). ومع ذلك، ليست مفهومة تماما الآلية المعقدة لامتصاص البروتين والتفاعل بروتين السطح. وبخاصة تكنولوجيا المعلومات على التشكل، والتوجه نمط، وكثافة الطلاء ما زال مفقودا.
وقد اجتذب الكوارتز الكريستال توازن دقيق مع مراقبة تبديد (QCM-D) تقنية الاهتمام في السنوات الأخيرة كأداة لدراسة امتصاص البروتين، حركية طلاء، والتفاعل المواليةسيرورات على مقياس النانومتر 19،43-45. هذا الأسلوب يسمح للكشف تفصيلي لامتصاص الكتلة في الوقت الحقيقي، ويمكن استخدامها كمؤشر لعملية الذاتي تجميع البروتين واقتران الجزيئات وظيفية على الشبكات البروتين 19،20،42،46-48. وبالإضافة إلى ذلك، والقياسات QCM-D تفتح إمكانية دراسة عمليات التفاعل معدنية مع طبقة البروتينية في ظل الظروف البيولوجية الطبيعية. في دراسة حديثة، والتفاعل من البروتين S-طبقة بالمعادن المختارة مثل الاتحاد الأوروبي (III)، والاتحاد الافريقي (III)، PD (II)، وحزب العمال (II) وقد درس مع QCM-D 19،20. طبقة البروتين كثف يمكن أن تكون بمثابة نموذج مبسط لجدار الخلية البكتيريا إيجابية الجرام. دراسة هذا المكون واحد يمكن أن تسهم في فهم أعمق للتفاعل المعدن. ومع ذلك، فقط التجارب QCM-D لا تسمح بيانات بخصوص الهياكل السطح والتأثيرات من المعادن إلى البروتين. تقنيات أخرى ضرورية للحصول على هذه المعلومات. أحد نقاط البيعsibility عن التصوير الحيوي النانو والحصول على معلومات عن الخصائص الهيكلية هي القوة المجهر الذري (AFM).
وكان الهدف من الدراسة التي قدمت للتحقيق في الامتصاص من الذهب (الاتحاد الافريقي (III) والاتحاد الافريقي (0) -NPs) للبروتينات S-طبقة، ولا سيما Slp1 من L. كروي JG-B53. وقد أجريت تجارب على البروتينات مع وقف التنفيذ على نطاق ودفعة في مجموعة ودرجة الحموضة 2،0-5،0 باستخدام ICP-MS ومع يجمد S-طبقات باستخدام QCM-D. بالإضافة إلى ذلك، تم التحقيق تأثير محلول الملح المعدنية على استقرار شعرية مع دراسات AFM اللاحقة. الجمع بين هذه التقنيات يساهم في التوصل إلى فهم أفضل للفي المختبر عمليات التفاعل المعدن كأداة لتعلم المزيد حول الأحداث على الخلايا البكتيرية كاملة بشأن الصلات المعادن محددة ملزمة. هذه المعرفة أمر بالغ الأهمية لتطوير مواد التصفية المطبقة لاستخلاص المعادن من أجل حماية البيئة والحفاظ على إعادة ليس فقطمصادر 49، ولكن أيضا لتطوير صفائف تلك المصادر المعدنية أمر غاية في التطبيقات التقنية المختلفة.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. الكائنات الدقيقة وزراعة الأحكام
ملاحظة: تم إجراء كافة التجارب تحت ظروف معقمة L. تم الحصول كروي JG-B53 من ثقافة الحفاظ البرد 29،30.
- نقل البرد الحفاظ على ثقافة (1.5 مل) تحت مقاعد البدلاء النظيفة إلى 300 مل العقيمة مرق مغذي (NB) وسائل الاعلام (3 ز / L استخراج اللحوم، 5 ز / L ببتون، 10 غرام / لتر كلوريد الصوديوم). بعد ذلك يحرك الحل لا يقل عن 6 ساعة عند 30 ° C للحصول على ما قبل الثقافة للزراعة.
- زراعة البكتيريا في الظروف الهوائية في NB وسائل الإعلام في الرقم الهيدروجيني = 7.0، 30 ° C في 70 L تحجيم مفاعل حيوي البخار في المكان. لذلك، وملء المفاعل ≈ 57 لتر ماء منزوع الأيونات. إضافة وحل سائل الإعلام NB الصلبة مباشرة في مفاعل حيوي (تركيزات انظر أعلاه).
- بالإضافة إلى إضافة عامل مضاد الرغوة (30 ميكرولتر / L NB-وسائل الاعلام) إلى وسائل الإعلام لقمع تشكيل رغوة خلال زراعة، ثم الأوتوكلاف (122 درجة مئوية، ودرجة الحرارة عقد من الزمن 30 دقيقة) وسائل الإعلامداخل منشأة المفاعل.
- تهدئة الإعلامية وتنفيذ كامل تشبع الأكسجين. ضبط درجة الحموضة إلى 7.0 (باستخدام 1 MH 2 SO 4 و 2 M هيدروكسيد الصوديوم) وبدء التلقيح الآلي ل300 مل قبل الثقافة. بدء تسجيل بيانات المعلمات زراعة عند نقطة التلقيح. تسجيل المعلمات على الانترنت على سبيل المثال، مستوى الأكسجين الذائب (DO 2)، وحمض وقاعدة بالإضافة إلى ذلك، وقيم درجة الحموضة داخل زراعة.
- مراقبة نمو البكتيريا عبر الإنترنت من خلال القياسات التعكر غير الغازية.
- أداء عينات إضافية بعد كل ساعة من زراعة وتحديد مزيد من المعلمة مثل الوزن الحيوي الجافة (BDW) وحاليا الضوئية الكثافة (OD). لذلك، وجمع 20 مل زراعة مرق في كل نقطة أخذ العينات تحت ظروف معقمة.
- تحديد متواجد حاليا OD بواسطة القياسات الضوئية للامتزاز في 600 نانومتر. استخدام معقم مرشح NB-المتوسطة كقيمة فارغة. الخلفإيه الوصول الامتزاز> 0.4 تمييع تعليق الخلية التالية الخطي للقانون لامبرت-البيرة.
- لتحديد BDW الطرد المركزي 1-5 مل من تعليق البكتيرية (اعتمادا على كثافة الخلية) في 5000 x ج لمدة 5 دقائق على RT. تجفيف بيليه الخلية التي تم الحصول عليها في 105 درجة مئوية في تسخين الفرن حتى الاستقرار الشامل وقياس كتلة بيليه.
- التقاط صور مجهرية مع المرحلة البصرية المجهر البحوث التباين في 400 و 1000 التكبير أضعاف (الطوري المكثف 2 و 3 على التوالي) للتحقق من نمو البكتيريا وكوسيلة لمراقبة التلوث المتبادل.
- بعد الوصول إلى مرحلة النمو الأسي الكشف عنها بواسطة الانترنت تفعل 2 وتعكر على الانترنت، حصاد الكتلة الحيوية من خلال التدفق من خلال الطرد المركزي في 15000 x ج، 4 ° C، ويغسل الكتلة الحيوية مرتين مع العازلة القياسي (50 ملي تريس، 10 ملي MgCl 2، 3 ملم نان 3، ودرجة الحموضة = 7.5).
ملاحظة: يمكن تخزين بيليه الكتلة الحيوية التي تم الحصول عليها في -18 & #176؛ C حتى مزيد من الاستخدام لعزل.
2. S-طبقة عزل البروتين وتنقية
ملاحظة: تنقية البوليمرات Slp1 وفقا لطريقة تكييفها كما هو موضح سابقا 2،19،30،32،50،51.
- تجانس الكتلة الحيوية الخام غسلها وديفروستيد تم الحصول عليها من زراعة في المخزن القياسي (1: 1 (ث / ت)) لإزالة الآفة باستخدام المفرق (المستوى 3، 10 دقيقة) تحت حمام الثلج التبريد عند 4 درجات مئوية.
- الطرد المركزي تعليق (8000 x ج، 4 درجة مئوية لمدة 20 دقيقة)، ويغسل بيليه الحصول عليها مرتين مع العازلة القياسي (1: 1 (ث / ت)). بعد غسل والطرد المركزي (8000 x ج، 4 درجة مئوية لمدة 20 دقيقة)، resuspend الكرية في المخزن القياسي (1: 1 (ث / ت))، إضافة الدناز الثاني وريبونوكلياز (0.4 وحدة / ز الكتلة الحيوية) إلى تعليق وتتفكك الخلايا في 1000 شريط مع الخالط الضغط العالي. بعد ذلك الطرد المركزي تعليق في 27500 x ج، 4 درجة مئوية لمدة 1 ساعة.
ملاحظة: تعليق خلية مراقبة مع ميل البحوثcroscope. اكتمال تمزق عندما يكون أقل من 2-3 خلايا سليمة واضحة في هذا المجال نظرا لالمجهر في التكبير 400 أضعاف. - يغسل بيليه مرتين مع العازلة القياسي (1: 1 (ث / ت)) وإجراء الطرد المركزي مرة أخرى. بعد ذلك resuspend الكرية في المخزن القياسي (2: 1 (ث / ت)) مختلطة مع 1٪ تريتون X-100 واحتضان لمدة 20 دقيقة تحت المتتالية تهز (100 دورة في الدقيقة) لإذابة الدهون الودائع.
- الطرد المركزي الحل (27500 x ج، 4 درجة مئوية لمدة 1 ساعة)، ويغسل الحصول بيليه ثلاث مرات مع العازلة القياسي (1: 1 (ث / ت)).
- احتضان بيليه الحصول عليها بعد الطرد المركزي الإضافية (27500 x ج، 4 درجة مئوية لمدة 1 ساعة) لمدة 6 ساعة في المخزن القياسي (1: 1 (ث / ت)) مختلطة مع 0.2 جم / L الليزوزيم، ليتحلل الروابط في ببتيدوغليكان 50. بالإضافة إلى ذلك إضافة الدناز الثاني وريبونوكلياز (كل 0.4 وحدة / ز الكتلة الحيوية) إلى تعليق.
- بعد الطرد المركزي (45500 x ج، 4 ° C، 1 ساعة)، resuspend والمرحلة بروتين البيض العليا مع انخفاض حجم رانه الطرد المركزي طاف (<30 مل) التي تحتوي على وحدات بروتين.
- إذابة تعليق البيضاء عن طريق خلط 1: 1 مع 6 M غوانيدين هيدروكلوريد (6 M GuHCl، 50 ملي تريس، ودرجة الحموضة = 7.2). الحل يصبح مشرق.
- أداء الترشيح العقيمة (0.2 ميكرون) من حل معاملة GuHCl تليها إضافي الطرد المركزي عالية السرعة (45500 x ج، 4 درجة مئوية لمدة 1 ساعة).
- طاف لنقل أنابيب غشاء غسيل الكلى (MWCO 50،000 دالتون) ومدال ضد عازلة التبلور (1.5 ملي تريس، 10 ملي CaCl 2، ودرجة الحموضة = 8.0) لمدة 48 ساعة.
- نقل بيضاء اعادة بلورة حل البروتين البوليمر في الأنابيب وأجهزة الطرد المركزي في 45500 x ج، 4 درجة مئوية لمدة 1 ساعة. resuspend الكرية في انخفاض حجم عالى النقاء المياه (<30 مل).
- بعد ذلك، نقل تعليق في أنابيب غشاء غسيل الكلى وإجراء غسيل الكلى ضد الماء عالى النقاء لمدة 24 ساعة لإزالة محتوى العازلة.
ملاحظة: عدة تغييرات عازلة أو الماء عالى النقاء دخلال شهر غسيل الكلى لا غنى عنها. - يجفد وSlp1 تنقيته في مجفف التجميد.
3. توصيف والكمي لSlp1 للتجارب
ملاحظة: تم كميا تركيز Slp1 لالامتصاص وطلاء التجارب التي كتبها UV-VIS الطيفي.
- ماصة 2 ميكرولتر من عينة Slp1 المنحل مباشرة على أقل رمى قياس مضواء. تحديد تركيز البروتين في امتصاص أقصى عند طول موجي 280 نانومتر ل، سمة للبروتينات. استخدام معامل انقراض 0.61 لتحديد تركيز Slp1. استخدام Slp1 حل مجانية لقياس مرجعية.
- تمييع البروتين مع العازلة (للتجارب الامتصاص في دفعة واسطة استخدام كلوريد الصوديوم 0.9٪، ودرجة الحموضة = 6.0 وللتجارب QCM-D تستخدم عازلة التبلور، ودرجة الحموضة = 8.0) إلى التركيز المطلوب لإجراء التجارب (1 جم / لتر و 0.2 غرام / L على التوالي).
- تحليل Slp1 الجودة والوزن الجزيئي من قبل bioanal القياسيةytical طريقة الصوديوم دوديسيل كبريتات بولي أكريلاميد الكهربائي (SDS-PAGE) التي وصفها Laemmli، UK 52.
- أداء SDS-PAGE قبل استخدام Slp1 ضمن التجارب وعلى سبيل المثال، بعد الاتحاد الافريقي (0) -NP حضانة باستخدام 10٪ والمواد الهلامية الفصل بولي أكريلاميد.
- مقابل عينات SDS مزيج ≈10 ميكرولتر من زراعة أو البروتين العينة مع عينة العازلة (1.97 ز تريس، 5 ملغ برموفينول الأزرق، 5.8 مل الجلسرين، 1 غرام SDS، 2.5 مل β المركابتويثانول، وملء مع الماء عالى النقاء إلى 50 مل) في نسبة 1: 1 (ت / ت) وماصة الخليط بعد 4 دقائق الحضانة عند 95 درجة مئوية في جيوب هلام.
- تشغيل SDS-PAGE 30 دقيقة عند جهد 60 V حتى العينات تمرير هلام جمع وتغيير الجهد إلى 120 فولت مرة واحدة اجتياز جل الانفصال.
- إزالة المواد الهلامية من نظام هلام، وشطف مع الماء عالى النقاء ومكان لمدة 1 ساعة إلى حل التثبيت (حمض الحمضية 10٪ والايثانول المطلق 50٪). بعد ذلك، وشطف المواد الهلامية مع الماء عالى النقاء.
- المواد الهلامية وصمة عارباستخدام الغروية غير محددة تكييفها Coomassie الرائعة طريقة الأزرق 53،54. بعد destaining 72،73، التقاط صور SDS-PAGE من قبل نظام توثيق جل وفقا لبروتوكول الشركة الصانعة.
4. التجارب الامتصاص في دفعة واسطة والكمي المعادن
- لدفعة التجارب الامتصاص الاستعداد الاتحاد الافريقي (III) حل سهم من HAuCl 4 ∙ 3 H 2 O، ويخفف من الملح والمعادن ومزجها مع الحل Slp1 / كلوريد الصوديوم إلى تركيز المعادن الأولي من 1 ملم والتركيز Slp1 النهائي من 1 غرام / L . إجراء تجارب في ثلاثة توائم مع سيطرة سلبية إضافية دون Slp1. استخدام إجمالي حجم 5 مل للتجارب الامتصاص.
- يهز تعليق مستمر في RT على قيم مختلفة درجة الحموضة تعديلها قبل بين 2،0-5،0 لمدة 24 ساعة (ضبط درجة الحموضة مع انخفاض حمض الهيدروكلوريك المركز ومحلول هيدروكسيد الصوديوم).
- بعد الامتصاص، الطرد المركزي العينات في 15000 x ج، 4 درجة مئوية لمدة 20 دقيقة) لseparأكل Slp1 من طاف.
- نقل طاف في أنابيب الترشيح الفائق (MWCO 50،000 دا) وأجهزة الطرد المركزي هذه في 15000 x ج، 4 درجة مئوية لمدة 20 دقيقة لإزالة أحادية البروتين المذاب.
- تحديد تركيز المعادن في الترشيح الناجم عن ICP-MS 19،20 واستخدام النتائج لظهر حساب الممتص منها المعادن من قبل الكتلة الجافة Slp1. مبادئ القياس، وصفت الفرص للأسلوب ومكونات تستخدم ICP-MS في الأدب 55.
- إعداد العينات والمراجع لقياس ICP-MS باستخدام 1٪ HNO 3 مثل المصفوفة والروديوم كمعيار داخلي (1 ملغ / مل).
5. توليف الاتحاد الافريقي-NP وتحديد حجم الجسيمات
ملاحظة: سترات استقرت الاتحاد الافريقي (0) تم تصنيعه -NP وفقا لطريقة تكييفها وصفها من قبل Mühlpfordt، H. وآخرون. (1982) للحصول على جسيمات كروية يبلغ قطرها 10-15 نانومتر 56،57 .
- إعداد استقرت 25 ملي HAuCl 4 ∙ 3 H 2 O الأسهم لتشكيل NP.
- تمييع 250 ميكرولتر من هذا الحل الأسهم في 19.75 مل عالى النقاء المياه واحتضان هذه في 61 درجة مئوية لمدة 15 دقيقة تحت الهز على التوالي.
- إعداد 5 مل من محلول المخزون الثاني (12 ملم حمض التانيك، 7 ملي سيترات الصوديوم ثنائي الهيدرات، 0.05 ملي K 2 3 CO)، واحتضان الحل 2 الثاني بشكل منفصل في 61 درجة مئوية لمدة 15 دقيقة.
- إضافة إطار ثابت تحريك المحلول 2 إلى حل واحد. يحرك خليط التفاعل لمدة 10 دقيقة على الأقل في 61 ° C. تبرد بعد ذلك إلى أسفل الحل واستخدامه لNP الطلاء على Slp1 شعرية ضمن التجارب QCM-D.
ملاحظة: الناتج الاتحاد الافريقي (0) تميزت -NP مع UV-VIS الطيفي في الامتصاصية كحد أقصى من 520 نانومتر، التي تستخدم عادة للكشف عن تشكيل الاتحاد الافريقي (0) -NPs 58. ويمكن تخزين الحل في 4 درجات مئوية. - تحليل حجم المشكلةالاتحاد الافريقي (0) -NP بواسطة الفوتون ارتباط التحليل الطيفي (PCS) والذي يعرف أيضا باسم تشتت الضوء الحيوي.
- لتحديد حجم NP، ونقل 1.5 مل من توليفها الاتحاد الافريقي (0) -NP الحل في cuvettes في ظل ظروف خالية من الغبار في مربع تدفق الصفحي وتحليلها مع حجم وزيتا المحتملة بحجم الجسيمات. ويرد وصف تفصيلي لPCS وإعداد العينات في Schurtenberger، P. وآخرون. (1993) 59 وجاين، R. وآخرون. (2015) 60.
6. التجارب QCM-D - Slp1 طلاء على السطوح والاتحاد الافريقي-NP الامتزاز على Slp1 شعرية
تم إجراء قياسات مع QCM-D مجهزة مع ما يصل إلى أربع وحدات تدفق: مذكرة. أجريت جميع التجارب QCM-D مع معدل تدفق ثابت من 125 ميكرولتر / دقيقة عند 25 درجة مئوية. وقد أجريت Slp1 الطلاء والمعادن / NP الحضانة على شافي 2 كهرضغطية أجهزة الاستشعار AT-قطع الكوارتز (Ø 14 ملم) مع تردد الأساسي لل≈ 5 ميغاهرتز. الشطف الخطوات وإضافةيتم وضع علامة ition من الحل في أرقام النتائج جزء تمثيلي. يمكن وصف التجارب QCM-D باعتباره خطوة بخطوة طريقة التي تبدأ مع تنظيف وتعديل السطح من أجهزة الاستشعار المستخدمة تليها Slp1 التبلور في وقت لاحق على معادن والتفاعل NP.
- تنظيف الإجراءات:
- تجهيز خلايا السائل مع الدمى الاستشعار. مضخة لا يقل عن 20 مل (كل لكل وحدة) من القلوية وكيل التطهير السائل (2٪ المطهر في الماء عالى النقاء (ت / ت)) من خلال نظام QCM-D وأنبوب. ضخ بعد ذلك حجم خمسة أضعاف (كل لكل وحدة) من الماء عالى النقاء من خلال نظام (معدل تدفق تصل إلى 300 ميكرولتر / دقيقة). أداء التنظيف وفقا لبروتوكول الشركة المصنعة.
- تنظيف أجهزة الاستشعار شافي 2 خارج وحدات التدفق عن طريق الحضانة (20 دقيقة على الأقل) في 2٪ SDS الحل وشطف أجهزة الاستشعار بعد ذلك عدة مرات مع الماء عالى النقاء 61،62.
- تجفيف بلورات مع شركات تصفيتهاressed الهواء ووضعها في غرفة التنظيف الأوزون لمدة 20 دقيقة 63،64.
- كرر الإجراء التنظيف مرتين لإزالة كافة محتويات العضوية.
- لإزالة المعادن المربوطة من سطح جهاز الاستشعار شطف أجهزة الاستشعار مع 1 M HNO 3. بعد ذلك، نفذ كل الخطوات الشطف بالماء عالى النقاء.
- استشعار تعديل السطحية التي Polyelectrolytes:
ملاحظة: يمكن أن يتم تعديل سطح إما داخل (تتدفق من خلال الداخلي) أو خارج وحدة التدفق (تقنية LBL). ضمن هذه التجارب تم استخدام الطريقة التالية لتعديل السطوح.- تعديل أجهزة الاستشعار مع 3 غرام / لتر من طبقات متبادلة من البولي ايثلين PE إمين (PEI، MW 25000) والبوليسترين سلفونات (PSS، MW 70000) عن طريق تراجع الطلاء باستخدام تقنية LBL 40،41 الموصوفة سابقا لنظام خاص المستخدمة في المقالة التي كتبها سور، M. وآخرون. (2014) 19.
- وضع أجهزة الاستشعار داخل PE-الحل المناسب في ث عميقلوحات الذراع واحتضان هذه لمدة 10 دقيقة في RT.
- خذ أجهزة الاستشعار من PE-حل وشطف أجهزة الاستشعار بين كل طلاء خطوة تراجع بشكل مكثف مع الماء عالى النقاء.
ملاحظة: يتكون تعديل السطح الجديد لا يقل عن ثلاثة PE طبقة تنتهي مع موجبة الشحنة PEI. - بعد هذا التعديل الخارجي وضع أجهزة الاستشعار داخل وحدة التدفق وتتوازن أجهزة الاستشعار من قبل الشطف بالماء عالى النقاء قبل بدء التجارب.
- Slp1 أحادي الطبقة التبلور:
- حل Slp1 في 4 M اليوريا لتحويل البوليمرات في مونومرات.
- الطرد المركزي البروتينات monomerized في 15000 x ج، 4 درجة مئوية لمدة 1 ساعة لإزالة تكتلات أكبر من البروتين.
- مزيج طاف Slp1 solubilized وطرد مع العازلة التبلور إلى تركيز البروتين النهائي من 0.2 جم / L.
ملاحظة: الكالسيوم اعتمادا التبلور من Slp1 (تجميع الذات) يبدأ من خلال إضافة تفصيلrystallization العازلة. لذلك، ضخ حل مختلطة مع معدل تدفق 125 ميكرولتر / دقيقة لأجهزة الاستشعار (وضعت داخل وحدات تدفق) على الفور. ويتم التبلور بعد القيم المستقرة للتحولات التردد وتبديد تم الكشف عنه خلال التجارب QCM-D. - بعد نجاح التبلور البروتين على رأس أجهزة الاستشعار تعديل PE داخل وحدات تدفق شطف أجهزة الاستشعار المغلفة مع العازلة التبلور أو عالى النقاء waterintensively مع معدل تدفق 125 ميكرولتر / دقيقة حتى القيم المستقرة للتحولات التردد وتبديد تم الكشف عنها.
ملاحظة: يتم تصور تعديل سطح شافي 2 مع PE للتجارب الامتصاص في وقت لاحق على Slp1 أحادي الطبقة وAFM دراسات في الشكل 1.

الشكل 1. تخطيطي تصميم PE تعديل السطحية وSlp1 أحادي الطبقةالطلاء؛ تم تعديل هذا الرقم من سور، M. وآخرون. (2015) 19 بإذن من سبرينغر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- المعادن والمعادن NP التفاعل:
ملاحظة: الامتصاص مع الاتحاد الافريقي محلول الملح المعدنية (HAuCl 4 ∙ 3 H 2 O) أجريت في تركيزات 1 ملم أو 5 ملم في الرقم الهيدروجيني = 6.0 في 0.9٪ كلوريد الصوديوم الحلول. وقد تم أو-NP الامتزاز مع مخفف أو-المصادر في 1.6 ملي العازلة ثلاثي الصوديوم سترات في الرقم الهيدروجيني ≈ 5.0.- بعد نجاح Slp1 الطلاء في وحدات تدفق، وشطف طبقة Slp1 التي تم الحصول عليها بشكل مكثف مع 0.9٪ كلوريد الصوديوم الحل حتى تم الكشف عن القيم المستقرة للتحولات التردد وتبديد.
- ضخ حل استعداد المعادن (1 ملم) وحل NP إلى وحدات تدفق بمعدل تدفق 125 ميكرولتر / دقيقة وتتبع امتصاص الكتلة إلى المدعوهطبقة P1. ويمكن الكشف عن الامتزاز الشامل مباشرة عن طريق تتبع التحولات تردد اشارة الى المعادلة ساوربري (المعادلة 1).
- بعد الانتهاء من التفاعل المعادن وNP المعادن، وشطف مع طبقة معدنية / NP عازلة خالية لإزالة ضعيفة أو المعادن النانوية المرفقة المربوطة أو ضعيفة.
ملاحظة: يتم عرض مثال على الإعداد التجريبي في الشكل 2.

الشكل 2. التصميم التخطيطي من الإعداد QCM-D باستخدام وحدة تدفق قطر للطحين 401 * 66. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- تسجيل البيانات والتقييم:
- تسجيل التغيرات في التردد في هرتز (Δf ن) وتبديد (ΔD ن) ضمن التجارب QCM-D باستخدام QCM-D برامج معينة.
- استخدام لتقييم حساسية جماعية كثف (Δm) وساوربري المعادلة / نموذج (المعادلة 1) 65 66 صالحة للأفلام رقيقة وصلبة إلى جانب دون احتكاك على سطح مستشعر تطبيقها على ال ن يغلب. على المدى C (سوربري ثابت) لاستخدامها 5 ميغاهيرتز AT قطع استشعار الكوارتز هو 17.7 نانوغرام ∙ هرتز -1 ∙ سم -2 68. لجامدة، موزعة بالتساوي، وطبقات رقيقة بما فيه الكفاية كثف استخدام المعادلة 1 كما تقريب جيد.
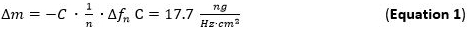
- أداء نماذج إضافية وفقا للنموذج كلفن فويت صالحة لجزيئات اللزجة 68-71 مع برنامج تصنيع محددة، ومقارنة النتائج مع هذا النموذج سوربري.
- لحساب من سمك طبقة واستخدام الامتزاز الشاملكما الهامة المعلمة النمذجة كثافة طبقة طبقة كثف من 1.35 غرام ∙ سم -3 المقابلة لقيم المذكورة سابقا للبروتينات S-طبقة 72-75. استخدام نفس القيمة لحساب تفاعل المعدن مع الطبقة البروتينية.
7. AFM القياسات
- إجراء دراسات وقادرة تماما على AFM المجهر الضوئي المقلوب.
- تسجيل صور AFM في السائل باستخدام المخزن المؤقت التبلور أو الماء عالى النقاء مباشرة على أجهزة استشعار المغلفة QCM-D.
- شطف أجهزة الاستشعار مع الماء عالى النقاء بعد عدة تجارب QCM-D ووضعها داخل الخلية السوائل AFM. ولذلك، استخدم خلية السوائل مغلقة مع الحجم الإجمالي حوالي 1.5 مل. الحفاظ على درجة حرارة ثابت خلية السائل عند 30 درجة مئوية.
- استخدام ناتئ مع تردد صدى ≈ 25 كيلو هرتز في الماء وتصلب <0.1 N / م. ضبط سرعة المسح الضوئي بين 2.5 و 10 ميكرون / ثانية. التقط الصور في وضع الاتصال ديناميكي في حين هو متحمس ناتئ من قبل بيزو في تردد صدى لها. تحديد مسافة ناتئ إلى السطح من التذبذب التخميد 76.
ملاحظة: يتم عرض الصور الارتفاع مع ض النطاق بينما قيم Z تمثل تضاريس الدقيق للسطح. يتم عرض السعة (الزائفة 3D) الصور دون ض النطاق لقيم Z السعة تعتمد على المعلمات المسح الضوئي وتحمل معلومات محدودة. وقد تم تحليل الصور باستخدام ثلاثة برامج التقييم مختلفة في 77.
Access restricted. Please log in or start a trial to view this content.
النتائج
زراعة الكائنات الدقيقة وSlp1 توصيف
البيانات المسجلة للنمو البكتيري يشير إلى نهاية مرحلة النمو الأسي في حوالي 5 ساعة. وقد أظهرت التحقيقات السابقة التي Slp1 يمكن عزله عن هذه النقطة من ال...
Access restricted. Please log in or start a trial to view this content.
Discussion
في هذا العمل دراسة الربط من الاتحاد الافريقي للبروتينات S-طبقة تم التحقيق باستخدام مزيج من الأساليب التحليلية المختلفة. على وجه الخصوص، الربط من الاتحاد الافريقي غير جذابة للغاية ليس فقط لاسترداد الاتحاد الافريقي من المياه التعدين أو حلول عملية، ولكن أيضا لبناء ا...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وقد تم تمويل هذا العمل جزئيا من قبل المشروع IGF "S-المنخل" (490 ZBG / 1) بتمويل من BMWi وBMBF المشروع "Aptasens" (BMBF / DLR 01RB0805A). شكر خاص لتوبياس J. غونتر لمساعدته القيمة خلال الدراسات AFM وإريك جونستون V. لقراءة المخطوطة كما يتحدث اللغة الإنجليزية. وعلاوة على ذلك، فإن مؤلف هذه الورقة أود أن أشكر ألين ريتر وسابرينا Gurlit (من معهد البيئة الموارد من أجل المساعدة في القياسات ICP-MS)، مانجا فوغل، نانسي أنجر، كارين E. Viacava والتكنولوجيا الحيوية مجموعة للمعهد هيلمهولتز فرايبرغ للتكنولوجيا الموارد.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000 - 6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein = 90 %, = 40,000 units/mg protein (Sigma) |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50 - 100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50,000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
References
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. Atimtay, T. A., Sikdar, S. K. , Springer. 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B. Environmental Microbe-Metal Interactions. Lovely, D. R. , ASM Press. Washington. 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , Forschungszentrum Rossendorf. Dresden. (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , Technische Universität Dresden. (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, Rice University . Houston. 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. Gold : science and applications. , CRC Press - Taylor&Francis Group. (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, Dr Dietrich Steinkopff Verlag. (1992).
- Günther, T. J. S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , Technische Universität Dresden. (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. Methods for general and molecular bacteriology. , American Society for Microbiology. 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C. [6] Quantitation of protein. Methods in Enzymology. Deutscher, M. P. 182, Academic Press. 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. ICP Mass Spectrometry - The 30-Min to ICP-MS. , PerkinElmer. USA. (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. Colloidal Gold - Principles, Methods and Applications. , Academic Press. (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E. Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. Buffle, J., van Leeuwen, H. P. 2, Lewis Publishers. 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705(2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , Technische Universität Dresden. (2003).
- Jennings, T., Strouse, G. Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , Springer. 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved