Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Au-Wechselwirkung von SLP1 Polymere und Monolayer aus
In diesem Artikel
Zusammenfassung
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
Zusammenfassung
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
Einleitung
Aufgrund der zunehmenden Verwendung von Gold für verschiedene Anwendungen wie Elektronik, Katalysatoren, Biosensoren oder medizinische Instrumente hat sich die Nachfrage des Edelmetalls in den letzten Jahren 6-9 gewachsen. Gold sowie viele andere wertvolle und Schwermetalle in die Umwelt über industrielle Abwässer in verdünnten Konzentrationen durch Bergbauaktivitäten freigesetzt, und Entsorgungs 7,8,10, obwohl die meisten Umweltkontamination durch schwere oder Edelmetalle ist ein fortlaufender Prozess vor allem durch technologische Aktivitäten verursacht. Dies führt zu einer erheblichen Störung der natürlichen Ökosysteme und könnte möglicherweise die menschliche Gesundheit gefährden 9. Die Kenntnis dieser negativen Ergebnisse fördert die Suche nach neuen Techniken, um Metalle aus kontaminierten Ökosystemen und Verbesserungen beim Recycling von Metallen aus industriellen Abwässern zu entfernen. Etablierte physikalisch-chemische Methoden wie Fällung oder Ionenaustausch sind nicht so effektiv, vor allem in der Hochly verdünnten Lösungen 7,8,11. Biosorption entweder mit lebenden oder toten Biomasse, ist eine attraktive Alternative für die Abwasserbehandlung 10,12. Die Verwendung solcher biologischer Materialien kann der Verbrauch von toxischen Chemikalien zu verringern. Viele Mikroorganismen beschrieben worden zu sammeln oder zu immobilisieren Metallen. Zum Beispiel Zellen der Lysinibacillus sphaericus (L. sphaericus) JG-A12 haben hohe Bindungskapazitäten für Edelmetalle, dargestellt beispielsweise Pd (II), Pt (II), Au (III) und anderen toxischen Metallen wie Pb (II) oder U (VI) 4,13, Zellen des Bacillus megaterium für Cr (VI) 14, Zellen von Saccharomyces cerevisiae für Pt (II) und Pd (II) 15 und Chlorella vulgäre zur Au (III) und U (VI) 16 , 17. Die Bindung von Metallen wie Au vorherigen (III), Pd (II) und Pt (II) wurde auch für Desulfovibrio desulfuricans 18 gemeldet und L. sphaericus JG-B53 19,20. Dennoch sind nicht all Mikroben binden große Mengen von Metallen und deren Anwendung als Sorptionsmaterial begrenzt 12,21. Weiterhin Metallbindungskapazität hängt von verschiedenen Parametern, beispielsweise Zell-Zusammensetzung, die verwendet Biokomponente oder Umwelt- und experimentellen Bedingungen (pH, Ionenstärke, Temperatur etc.). Das Studium der isolierten Zellwandfragmente 22,23, wie Membranlipiden, Peptidoglycan, Proteinen oder anderen Komponenten kann dabei die Metallbindungsverfahren komplexer aufgebaut ganzen Zellen 8,21 zu verstehen.
Die Zellbestandteile in dieser Studie konzentrierte sich auf sind S-Layer-Proteine. S-Layer-Proteine sind Teile der äußeren Zellhülle von vielen Bakterien und Archaebakterien, und sie machen etwa 15 bis 20% der Gesamtproteinmasse dieser Organismen. Wie die erste Schnittstelle für die Umwelt, diese Zell Verbindungen beeinflussen die Bakterien Sorptionseigenschaften 3. S-Schicht-Proteine mit Molekulargewichten im Bereich von vierzigHunderte von kDa sind innerhalb der Zelle produziert, aber außerhalb montiert, wo sie in der Lage, Schichten auf den Lipidmembranen oder polymere Zellwandbestandteile bilden. Nach der Isolierung fast alle S-Layer-Proteine die intrinsische Eigenschaft, sich spontan durch Selbstorganisation in Suspension, an Grenzflächen oder auf Oberflächen bilden ebene oder röhrenförmige Gebilde 3. Die Dicke der Proteinmonoschicht hängt von den Bakterien und ist in einem Bereich von 5 bis 25 nm 24. Im Allgemeinen können die gebildeten S-Layer-Protein-Strukturen eine schräge (P1 oder P2), quadratisch (p4) oder hexagonal (p3 oder P6) symmetrisch Gitterkonstanten von 2,5 bis 35 nm 3,24 haben. Die Gitterbildung scheint in vielen Fällen abhängig von zweiwertigen Kationen und hauptsächlich Ca 2+ 25,26, Raff, J. et al. S-Layer-basierte Nanokomposite für industrielle Anwendungen in Proteinbasis Engineered Nanostrukturen. (Hrsg Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (eingereicht)). Dennoch ist die vollständige Reaktionskaskade des Monomers Faltung Monomer-Monomer-Wechselwirkung, die Bildung eines Gitters, und die Rolle, die aus unterschiedlichen Metallen, insbesondere zweiwertigen Kationen, wie Ca 2+ und Mg 2+, noch nicht vollständig verstanden.
Die Gram-positive Stamm L. sphaericus JG-B53 27 (von Bacillus sphaericus, nachdem neue phylogenetische Einordnung umbenannt) wurde aus dem Uranbergbau Halde "Haberland" (Johanngeorgenstadt, Sachsen, Deutschland) 4,28,29 isoliert. Seine Funktions S-Layer-Protein (SLP1) einen quadratischen Gitter, ein Molekulargewicht von 116 kDa 30 und eine Dicke von ≈ 10 nm an lebenden Bakterienzellen 31. In früheren Studien wurde die in vitro Bildung einer geschlossenen und stabilen Proteinschicht mit einer Dicke von etwa 10 nm in weniger als 10 min 19 erreicht. Die verwandten Stammes L. sphaericus JG- angezeigtA12, auch ein Isolat aus dem "Haberland" Haufen, besitzt eine hohe Metallbindungskapazitäten und seiner isolierten S-Schicht-Protein hat eine hohe chemische und mechanische Stabilität und gute Sorptionsraten für Edelmetalle wie Au (III) gezeigt, Pt (II), und Pd (II) 4,32,33. Diese Bindung von Edelmetallen ist mehr oder weniger spezifisch für bestimmte Metalle und hängt von der Verfügbarkeit der funktionellen Gruppen auf der äußeren und inneren Proteinoberfläche des Polymers und die in ihren Poren, der Ionenstärke und dem pH-Wert. Relevante funktionelle Gruppen für die Metall-Wechselwirkung durch die Proteine sind COOH-, NH 2 -, OH-, PO 4 -, SO 4 - und SO. Grundsätzlich Metallbindungskapazitäten eröffnen ein breites Spektrum von Anwendungen, Raff, J. et al. S-Layer-basierte Nanokomposite für industrielle Anwendungen in Proteinbasis Engineered Nanostrukturen. (Hrsg Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (eingereicht)). zB als biosorptive Komponenten zur Entfernung oder Wiederherstellungvon gelösten toxischen oder wertvolle Metalle, Vorlagen für die Synthese oder definierte Abscheidung von regelmäßig strukturierten metallischen Nanopartikeln (NPs) für die Katalyse und andere Bio-engineered Materialien wie Bio-sensorischen Schichten 3,5,18,33. Regelmäßig angeordnet NP Arrays wie Au (0) -NPs könnte für große Anwendungen, die von der molekularen Elektronik und Biosensoren, Ultrahochdichte-Speichergeräte, und Katalysatoren für die CO-Oxidation 34-37 verwendet werden. Die Entwicklung solcher Anwendungen und intelligente Design dieser Materialien erfordert ein tieferes Verständnis der zugrundeliegenden Metallbindungsmechanismen.
Eine Voraussetzung für die Entwicklung solcher Materialien auf biologischer Basis ist die zuverlässige Ausführung eines Schnittstellenschicht zwischen dem Biomolekül und der technische Oberfläche 38,39. Zum Beispiel Polyelektrolyte mit der Schicht-für-Schicht (LBL) Technik 40,41 zusammengebaut wurden als Zwischenschicht zur Rekristallisation von S-Layer-Proteine 39 verwendet wurden . Eine solche Schnittstelle bietet eine relativ einfache Möglichkeit, die Proteinbeschichtung auf eine reproduzierbare und quantitative Weise auszuführen. Durch Durchführung verschiedener Experimente mit und ohne Modifikation mit Klebevermittler, ist es möglich, Aussagen über die Beschichtungs Kinetik, Schichtstabilität und die Interaktion von Metallen mit Biomolekülen 19,42, Raff, J. et al machen. S-Layer-basierte Nanokomposite für industrielle Anwendungen in Proteinbasis Engineered Nanostrukturen. (Hrsg Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (eingereicht)). Jedoch ist die komplexen Mechanismen der Proteinadsorption und Protein-Oberflächen-Wechselwirkung nicht vollständig verstanden. Vor allem Informationen über Konformation, Muster Orientierung und Beschichtungsdichten fehlt noch.
Quarzmikrowaage mit Verlustüberwachung (QCM-D) Technik hat sich die Aufmerksamkeit in den letzten Jahren als ein Werkzeug für die Untersuchung der Proteinadsorption, Beschichtungs Kinetik und Interaktion pro zogenProzesse auf der Nanometerskala 19,43-45. Diese Technik ermöglicht die detaillierte Erfassung der Masse Adsorption in Echtzeit und kann als Indikator für das Protein selbst Montage und die Kopplung der funktionellen Moleküle auf Proteingitter 19,20,42,46-48 verwendet werden. Darüber hinaus öffnen QCM-D-Messungen die Möglichkeit, Metallwechselwirkungsprozesse mit der proteinhaltigen Schicht unter natürlichen biologischen Bedingungen zu studieren. In einer neueren Studie der Wechselwirkung des S-Layer-Protein mit ausgewählten Metallen wie Eu (III), Au (III), Pd (II) und Pt (II) wurde mit der QCM-D 19,20 sucht. Die adsorbierte Proteinschicht kann als vereinfachtes Modell eines Zellwand von gram-positiven Bakterien dienen. Die Untersuchung dieses einzelne Komponente kann zu einem tieferen Verständnis der Metall-Wechselwirkung beitragen. Allerdings wissen nur QCM-D-Experimente nicht Aussagen in Bezug auf Oberflächenstrukturen und Einflüsse von Metallen, um Protein zu ermöglichen. Andere Techniken sind notwendig, um diese Informationen zu erhalten. Eine postung für Abbildungs bio-Nanostrukturen und Gewinnung von Informationen über Struktureigenschaften ist die Rasterkraftmikroskopie (AFM).
Das Ziel der vorliegenden Studie war es, die Sorption von Gold (Au (III) und Au (0) -NPs) bis S-Layer-Proteine zu untersuchen, insbesondere SLP1 von L. sphaericus JG-B53. 5.0 Verwendung von ICP-MS und immobilisiert S-Schichten unter Verwendung von QCM-D - Experimente wurden mit suspendierten Proteine auf Ansatzgröße in einem pH-Bereich von 2,0 durchgeführt. Zusätzlich wurde der Einfluß der Metallsalzlösung auf dem Gitter Stabilität mit anschließender AFM-Studien untersucht. Die Kombination dieser Techniken trägt zu einem besseren Verständnis der in-vitro-Metall-Interaktionsprozesse als Werkzeug für das Lernen mehr über Bindungsereignisse auf ganze Bakterienzellen in Bezug auf bestimmte Metall Affinitäten. Diese Erkenntnis ist nicht nur wichtig für die Entwicklung von anwendbaren Filtermaterialien zur Rückgewinnung von Metallen für den Umweltschutz und zur Erhaltung der WiederQuellen 49, sondern auch für die Entwicklung von hoch geordneten Arrays von metallischen Nanopartikeln für verschiedene technische Anwendungen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Mikroorganismus und Anzuchtbedingungen
Anmerkung:. Alle Experimente wurden unter sterilen Bedingungen durchgeführt L. sphaericus JG-B53 wurde von einem kryokonserviert Kultur 29,30 erhalten.
- Transfer kryokonserviert Kultur (1,5 ml) unter der Sterilbank auf 300 ml sterile Nährbrühe (NB) Medien (3 g / l Fleischextrakt, 5 g / l Pepton, 10 g / l NaCl). Danach rühren Sie die Lösung für mindestens 6 h bei 30 ° C, um die Vorkultur für den Anbau zu erhalten.
- Kultivieren der Bakterien unter aeroben Bedingungen in NB Medien bei pH 7,0, 30 ° C in einem 70 L skaliert Dampf-in-place-Bioreaktor. Deshalb füllen den Reaktor mit ≈ 57 L VE-Wasser. Hinzufügen und lösen feste NB Medien direkt im Bioreaktor (Konzentrationen siehe oben).
- Zusätzlich fügen Antischaummittel (30 & mgr; l / L NB-Medium) an die Medien, um während der Kultivierung die Schaumbildung zu unterdrücken, dann Autoklaven (122 ° C, Temperaturhaltezeit 30 min) die Medienim Inneren des Reaktoranlage.
- Kühlen Sie sich die Medien und führen komplette Sauerstoffsättigung. Den pH-Wert auf 7,0 (mit 1 MH 2 SO 4 und 2 M NaOH) und starten Sie die automatische Impfung des 300 ml Vorkultur. Starten Sie die Datenaufzeichnung der Kultivierungsparameter an der Impfstelle. Melden Sie sich Online-Parameter zB gelöstem Sauerstoff (DO 2), Säure- und Basenadditions und pH-Werte im Anbau.
- Überwachung des Bakterienwachstums Online durch die nicht-invasive Trübungsmessungen.
- Führen Sie zusätzliche Probenahme nach jeder Stunde des Anbaus und der Bestimmung weiterer Parameter wie Bio Trockengewicht (BDW) und Offline-optische Dichte (OD). Daher sammeln 20 ml Kultivierungsbrühe an jedem Probenpunkt unter sterilen Bedingungen.
- Bestimmen Sie offline OD durch photometrische Messung der Absorption bei 600 nm. Verwenden Sie sterile filtrierte NB-Medium als Leerwert. Achterner erreichte Adsorption> 0,4 verdünnten Zellsuspension nach der Linearität des Lambert-Beer'schen Gesetz.
- Zur Bestimmung BDW Zentrifuge 1 bis 5 ml Bakteriensuspension (abhängig von der Zelldichte) bei 5000 × g für 5 min bei RT. Trocknen des erhaltenen Zellpellets bei 105 ° C in einem Heizofen bis Massenstabilität und messen die Pelletmasse.
- Nehmen mikroskopische Bilder mit optischen Phasenkontrastforschungsmikroskop in 400 und 1000 facher Vergrößerung (Phasenkontrast Kondensator 2 und 3) zur Überprüfung des bakteriellen Wachstums und als Kreuzkontaminationskontrolle.
- Nach dem Erreichen der nach online erfasst exponentiellen Wachstumsphase DO 2 und Online-Trübung, Ernte der Biomasse von Flow-Through-Zentrifugation bei 15.000 × g, 4 ° C und zweimal waschen der Biomasse mit Standard-Puffer (50 mM Tris, 10 mM MgCl 2, 3 mM NaN 3, pH = 7,5).
Hinweis: Die gewonnene Biomasse Pellet bei -18 & # gespeichert werden176; C bis zur weiteren Verwendung zur Isolierung.
2. S-Layer-Protein Isolierung und Reinigung
Hinweis: Reinigen SLP1 Polymere gemäß einem angepassten Verfahren wie zuvor 2,19,30,32,50,51 beschrieben.
- Homogenisieren gewaschen und aufgetauten rohen Biomasse aus dem Anbau in Standardpuffer erhalten (1: 1 (w / v)), um Geißeln mit Hilfe eines Dispergators (Ebene 3, 10 min) unter Eisbadkühlung bei 4 ° C zu entfernen.
- Zentrifugieren Sie die Suspension (8.000 × g, 4 ° C für 20 min) und zweimal waschen das erhaltene Pellet mit Standard-Puffer (1: 1 (w / v)). Nach Waschen und Zentrifugation (8000 x g, 4 ° C für 20 min), das Pellet in Standardpuffer (1: 1 (w / v)), fügen DNase II und RNase (0,4 Einheiten / g Biomasse) zu der Suspension und zerfallen die Zellen bei 1000 bar mit einem Hochdruckhomogenisator. Danach zentrifugieren der Suspension bei 27.500 x g, 4 ° C für 1 Stunde.
Hinweis: Steuerzellsuspension mit den Forschungs mikop. Bruch ist abgeschlossen, wenn weniger als 2-3 intakte Zellen in das Gesichtsfeld des Mikroskops in 400-facher Vergrößerung sichtbar sind. - Zweimal Waschen des Pellets mit Standard-Puffer (1: 1 (w / v)) und führen Sie die Zentrifugation erneut. Anschließend das Pellet in Standardpuffer (2: 1 (w / v)) mit 1% Triton X-100 gemischt und inkubiert für 20 Minuten unter aufeinander Schütteln (100 UpM), um Lipidablagerungen solubilisieren.
- Zentrifuge die Lösung (27.500 × g, 4 ° C für 1 h), und die erhaltenen Pellets dreimal Waschen mit Standardpuffer (1: 1 (w / v)).
- Inkubieren nach zusätzlicher Zentrifugation (27.500 × g, 4 ° C für 1 h) 6 h lang in Standardpuffer erhaltene Pellet (1: 1 (w / v)) mit 0,2 g / l Lysozym, gemischt werden, um Bindungen in Peptidoglycan 50 hydrolysieren. Zusätzlich zu der Suspension hinzu DNase II und RNase (jeweils 0,4 Einheiten / g Biomasse).
- Nach Zentrifugation (45.500 × g, 4 ° C, 1 h), resuspendieren obere weiße Proteinphase mit einem geringen Volumen von ter Zentrifugationsüberstand (<30 ml), die Protein-Untereinheiten.
- Solubilisierung des weißen Suspension durch Mischen von 1: 1 mit 6 M Guanidinhydrochlorid (6 M GuHCl, 50 mM TRIS, pH = 7,2). Die Lösung wird hell.
- Zuführen Sterilfiltration (0,2 um) des GuHCl behandelte Lösung gefolgt von einer zusätzlichen Hochgeschwindigkeits-Zentrifugation (45.500 × g, 4 ° C für 1 h).
- Den Überstand in einen Dialysemembranrohre (MWCO 50.000 Dalton) dialysiert gegen Rekristallisation Puffer (1,5 mM Tris, 10 mM CaCl 2, pH = 8,0) für 48 Stunden.
- Übertragen Sie die weißen rekristallisierte Proteinpolymerlösung in Rohren und Zentrifuge bei 45.500 × g, 4 ° C für 1 Stunde. Das Pellet in einem geringen Volumen von ultrareinem Wasser (<30 ml).
- Anschließend übertragen Sie die Suspension in Dialysemembran Röhren und führen Sie eine Dialyse gegen Reinstwasser für 24 Stunden, um Pufferinhalt zu entfernen.
Hinweis: Mehrere Pufferwechsel oder Reinstwasser dährend der Dialyse sind unverzichtbar. - Lyophilisieren die gereinigt SLP1 in einem Gefriertrockner.
3. Charakterisierung und Quantifizierung von SLP1 für Experimente
Anmerkung: SLP1 Konzentration zur Sorption und Beschichtungsexperimente wurden durch UV-VIS-Spektrophotometrie quantifiziert.
- Pipette 2 ul SLP1 Probe direkt auf die untere Mess Sockel des Photometers. Bestimmen Proteinkonzentration bei Adsorptionsbedingungen Maximum bei einer Wellenlänge von 280 nm, die charakteristisch für Proteine. Verwenden Sie die Extinktionskoeffizienten von 0,61 bis SLP1 Konzentration zu bestimmen. Verwenden SLP1 kostenlose Lösung für Referenzmessungen.
- Verdünnen des Proteins mit dem Puffer (für Sorptionsexperimenten im Batch-Modus zu verwenden 0,9% NaCl, pH = 6,0 und für die QCM-D Experimenten Umkristallisation Puffer, pH = 8,0) bis zur gewünschten Konzentration für die Experimente (1 g / L und 0,2 g / L beziehungsweise).
- Analysieren SLP1 Qualität und Molekulargewicht durch die Standard bioanalytical Verfahren Natriumdodecylsulfat-Polyacrylamid-Elektrophorese (SDS-PAGE) nach Laemmli, UK 52 beschrieben.
- Führen SDS-PAGE, bevor Sie SLP1 in Experimenten und zB nach Au (0) -NP Inkubation mit 10% Polyacrylamid Trenn Gele.
- Für SDS-Proben-Mix ≈10 ul der Anbau oder Proteinprobe mit Probenpuffer (1,97 g TRIS, 5 mg Bromphenolblau, 5,8 ml Glycerin, 1 g SDS, 2,5 ml β-Mercaptoethanol, füllen mit hochreinem Wasser bis 50 ml) in ein Verhältnis von 1: 1 (v / v) und Pipetten der Mischung nach 4 min Inkubation bei 95 ° C in die Geltaschen.
- Run SDS-PAGE 30 Minuten bei einer Spannung von 60 V, bis die Proben übergeben Sie die Sammlung Gel und Änderungsspannung bis 120 V, wenn das Bestehen der Trennung Gel.
- Entfernen Sie die Gele aus dem Gel-System gründlich mit hochreinem Wasser und Platz für 1 h in Fixierungslösung (10% Essigsäure, 50% absolutem Ethanol). Danach spülen Sie die Gele mit hochreinem Wasser.
- Stain Geledurch die Verwendung eines geeignet unspezifische kolloidale Coomassie-Brilliantblau-Methode 53,54. Nach Entfärben 72,73 nehmen SDS-PAGE-Bilder von der Gel-Dokumentations-System nach Herstellerprotokoll.
4. Sorptionsexperimenten im Batch-Modus und Metall Quantifizierung
- Für Batch Sorptionsexperimenten vorzubereiten Au (III) Stammlösung von HAuCl 4 ∙ 3 H 2 O verdünnt man das Metallsalz und mischen Sie es mit dem SLP1 / NaCl-Lösung auf einen anfänglichen Metallkonzentration von 1 mM und letzte SLP1 Konzentration von 1 g / l . Führen Sie Experimente in Dreiergruppen mit einem zusätzlichen Negativkontrolle ohne SLP1. Verwenden Sie ein Gesamtvolumen von 5 ml für Sorptionsexperimenten.
- Schütteln Sie die Suspension kontinuierlich bei RT an verschiedenen voreingestellten pH-Werten zwischen 2,0 bis 5,0 während 24 Stunden (pH-Einstellung mit niedriger konzentrierte HCl und NaOH-Lösung).
- Nach der Sorption Zentrifugation der Proben bei 15000 x g, 4 ° C für 20 min), um Separaß SLP1 vom Überstand.
- Den Überstand in die Ultrafiltrationsröhrchen (MWCO 50.000 Da) und Zentrifuge diese bei 15.000 × g, 4 ° C für 20 min, um gelösten Proteins Monomere zu entfernen.
- Bestimmen Sie die Metallkonzentration in dem erhaltenen Filtrat durch ICP-MS 19,20 und die Ergebnisse für die Rückrechnung des sorbierten Metall vom SLP1 Trockenmasse. Messprinzipien wurden Möglichkeiten des Verfahrens und der Komponenten des verwendeten ICP-MS in der Literatur 55 beschrieben.
- Vorbereitung der Proben und Referenzen für ICP-MS-Messungen unter Verwendung von 1% HNO 3 als Matrix und Rhodium als interner Standard (1 mg / ml).
5. Synthese von Au-NP und Bestimmung von Partikelgröße
Anmerkung: Citrat stabilisiert Au (0) -NP wurden gemäß einem zuvor durch Mühlpfordt, H. et al angepasst Verfahren synthetisiert. (1982), um kugelförmige Teilchen mit einem Durchmesser unter Erhalt von 10 bis 15 nm 56,57 .
- Bereiten Sie eine stabilisierte 25 mM HAuCl 4 ∙ 3 H 2 O Lager für den NP-Bildung.
- Verdünnen Sie 250 ul dieser Stammlösung in 19,75 ml hochreinem Wasser und Inkubation diese auf 61 ° C für 15 Minuten unter Schütteln aufeinander.
- Vorbereitung 5 ml einer zweiten Stammlösung (12 mM Gerbsäure, 7 mM Natriumcitrat-Dihydrat, 0,05 mM K 2 CO 3) und inkubiere die 2. Lösung getrennt bei 61 ° C für 15 min.
- Fügen Sie unter konstantem Rühren der 2. Stammlösung zu einer Lösung. Rühre das Reaktionsgemisch für mindestens 10 Minuten bei 61 ° C. Danach abkühlen lassen die Lösung und es für NP-Beschichtung auf SLP1 Gitter innerhalb QCM-D-Experimente.
Hinweis: Die resultierende Au (0) -NP wurden mit UV-VIS-Spektroskopie bei dem Absorptionsmaximum von 520 nm, typischerweise zum Nachweis von Au gebildet (0) -NPs 58 verwendet wird. Die Lösung kann bei 4 ° C gelagert werden. - Analysieren Sie die Größe des gebildetenAu (0) -NP durch Photonenkorrelationsspektroskopie (PCS), die auch als dynamische Lichtstreuung, ist bekannt.
- Zur Bestimmung der NP Größe, über 1,5 ml synthetisiert Au (0) -NP Lösung in Küvetten unter staubfreien Bedingungen in einer Laminar-Flow-Box und analysieren sie mit einer Größe und Zetapotential-Partikelmessgerät. Eine detaillierte Beschreibung des PCS und Probenvorbereitung ist in Schurtenberger, P. et al. (1993) 59 und Jain, R. et al. (2015) 60.
6. QCM-D-Experimente - SLP1 Beschichtung auf Oberflächen und Au-NP Adsorption auf SLP1 Lattice
Hinweis: Die Messungen wurden mit einem QCM-D mit bis zu vier Flow-Module ausgestattet ist. Alle QCM-D Versuche wurden mit einer konstanten Fließgeschwindigkeit von 125 ul / min bei 25 ° C durchgeführt. Slp1 Beschichtung und Metall / NP Inkubation wurden auf SiO 2 piezo AT-geschnittenen Quarz-Sensoren (Ø 14 mm) mit einer Grundfrequenz von ≈ 5 MHz durchgeführt. Spülschritte und fügenition der Lösung sind in den Figuren der repräsentative Ergebnisse Teil markiert. Die QCM-D Experimenten könnte als ein Schritt für Schritt Weise beginnend mit Reinigen und Oberflächenmodifikation der verwendeten Sensoren, gefolgt von SLP1 Rekristallisation und später auf dem Metall und Metalloxid NP Wechselwirkung beschrieben.
- Reinigungsverfahren:
- Statten Sie die Flüssigkeitszellen mit Sensor-Attrappen. Pumpe mindestens 20 ml (jeweils pro Modul) eines alkalischen flüssigen Reinigungsmittel (2% Reinigungsmittel in ultrareinem Wasser (v / v)) über die QCM-D und Schlauchsystem. Danach pumpen das fünffache Volumen (jeweils pro Modul) von ultrareinem Wasser durch das System (Durchflussmenge bis zu 300 & mgr; l / min). Führen Sie die Reinigung nach dem Protokoll des Herstellers.
- Reinigen Sie die SiO 2 Sensoren außerhalb der Flow-Module durch Inkubation (mindestens 20 min) in 2% SDS-Lösung und mehrmals gründlich die Sensoren danach mit Reinstwasser 61,62.
- Trocknen Sie die Kristalle gefiltert compressed Luft und legen Sie sie in einem Ozonreinigungskammer für 20 min 63,64.
- Wiederholen Sie den Reinigungsvorgang zweimal, um alle organischen Inhaltsstoffe zu entfernen.
- Um von der Sensoroberfläche zu entfernen gebundenen Metallen spülen Sie die Sensoren mit 1 M HNO 3. Danach führen alle Spülschritte mit hochreinem Wasser.
- Sensor Oberflächenmodifikation durch Polyelektrolyte:
Hinweis: Die Oberflächenmodifizierung kann entweder im Inneren (durchströmen Verfahren) oder außerhalb des Strömungsmoduls (LbL-Technik). In diesen Experimenten, die auf folgende Weise, um die Oberflächen zu modifizieren, verwendet.- Ändern Sie die Sensoren mit 3 g / l aus alternierenden Schichten von PE Polyethylenimin (PEI, MW 25.000) und Polystyrolsulfonat (PSS, MW 70.000) über Tauchbeschichtung mit LbL-Technik 40,41 vorher für den speziellen verbreitete System in dem Artikel von beschrieben Suhr, M. et al. (2014) 19.
- Legen Sie die Sensoren im Inneren des entsprechenden PE-Lösung in tiefen well Platten und inkubieren Sie diese für 10 min bei RT.
- Nehmen Sie die Sensoren aus der PE-Lösung und spülen Sie die Sensoren zwischen jedem Tauchbeschichtungsschritt intensiv mit hochreinem Wasser.
Hinweis: Der neue Oberflächenmodifikation aus mindestens drei PE-Schicht endet mit positiv geladenen PEI. - Nach dieser externen Modifikation platzieren Sie die Sensoren im Inneren des Durchflussmodul und ins Gleichgewicht kommen die Sensoren durch Spülen mit hochreinem Wasser vor dem Start der Experimente.
- SLP1 Monolayer Umkristallisation:
- Aufzulösen SLP1 in 4 M Harnstoff zum Umwandeln Polymeren in Monomeren.
- Zentrifugieren monomerisiert Proteine bei 15.000 × g, 4 ° C für 1 Stunde, um größere Agglomerate zu entfernen Protein.
- Mischen das solubilisiert und zentrifugiert SLP1 Stand mit Umkristallisieren Puffer auf eine endgültige Proteinkonzentration von 0,2 g / L.
Hinweis: Das Kalzium abhängig Rekristallisation SLP1 (Selbstmontage) beginnt mit der Zugabe des recrystallization Puffer. Daher pumpen die gemischte Lösung mit einer Fließgeschwindigkeit von 125 ul / min zu den Sensoren (im Strömungsmodulen platziert) unmittelbar. Die Rekristallisation nach stabilen Werten der Frequenz und Verlust Verschiebungen wurden innerhalb von QCM-D-Experimente nachgewiesen wurde. - Nach erfolgreicher Protein Umkristallisation oben auf den PE-modifizierten Sensoren innerhalb der Strömungsmodule Spülen der beschichteten Sensoren Umkristallisation Puffer oder ultra waterintensively mit einer Fließgeschwindigkeit von 125 ul / min, bis stabile Werte der Frequenz und der Verlust Verschiebungen wurden nachgewiesen.
Hinweis: Der SiO 2 Oberflächenmodifizierung mit PE zur späteren Sorptionsexperimenten auf SLP1 Monoschicht und AFM-Untersuchungen ist in Abbildung 1 visualisiert.

Abbildung 1. Schematischer Aufbau PE Oberflächenmodifizierung und SLP1 MonolayerBeschichtung; Diese Zahl hat sich von Suhr, M. et al modifiziert. (2015) 19 mit Genehmigung von Springer. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Metall und Metall NP Interaktion:
Anmerkung: Die Sorption mit dem Au-Metallsalzlösung (HAuCl 4 ∙ 3 H 2 O) wurde in einer Konzentration von 1 mM oder 5 mM bei pH = 6,0 mit 0,9% NaCl-Lösung durchgeführt. Au-NP-Adsorption wurde mit unverdünntem Au-NPs in 1,6 mM Tri-Natrium-Citrat-Puffer bei pH ≈ 5,0 getan.- Nach erfolgreicher SLP1 Beschichtung in den Flow-Module, spülen Sie die erhaltenen SLP1 Schicht intensiv mit 0,9% NaCl-Lösung, bis stabile Werte für Frequenz und Verlustverschiebungen festgestellt wurden.
- Pumpe den vorbereiteten Metalllösung (1 mM) und NP-Lösung für die Leistungsmodule mit einer Fließgeschwindigkeit von 125 ul / min und verfolgen die Massen Adsorption an der Slp1 Schicht. Massen Adsorption kann direkt durch die Verfolgung der Frequenzverschiebungen für den Sauerbrey Gleichung (Gleichung 1) ermittelt werden.
- Nach Abschluss der Metalle und Metall NP Wechselwirkung, spülen Sie die Schicht mit Metall / NP freien Puffer zu schwach gebundenen oder schwach befestigt Metalle oder Nanopartikel zu entfernen.
Wichtig: eine Darstellung der Versuchsaufbau ist in Figur 2 gezeigt.

Abbildung 2. Schematischer Aufbau QCM-D-Setup unter Verwendung von Flow Modul QFM 401 * 66. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Datenerfassung und Auswertung:
- Notieren Sie sich die Verschiebungen in der Frequenz in Hz (Af n) und Verlustleistung (& Delta; D n) Innerhalb der QCM-D-Experimente unter Verwendung von QCM-D spezifische Software.
- Verwenden Sie für die Auswertung des adsorbierten Massensensitivität (Delta; m) die Sauerbrey-Gleichung / Modell (Gleichung 1) 65 66, das gilt für ohne Reibung auf der Sensoroberfläche zu der n-ten Oberschwingung angewendet gekoppelt dünn und Hartfolien ist. Der Begriff C (Sauerbrey konstant) für das verwendete 5 MHz AT-Quarzsensor 17,7 ng ∙ ∙ Hz -1 cm -2 68. Für starre, gleichmäßig verteilt, und ausreichend dünn adsorbierten Schichten zu verwenden Gleichung 1 als eine gute Annäherung.
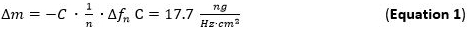
- Führen Sie zusätzliche Modellierung nach der Kelvin-Voigt-Modell gilt für viskoelastische Moleküle 68-71 mit dem herstellerspezifischen Software und vergleichen die Ergebnisse mit dem der Sauerbrey-Modell.
- Für die Berechnung der Schichtdicke und Masse Adsorption Verwendungals wichtige Modellparameter eine Schichtdichte der adsorbierten Schicht von 1,35 g cm -3 ∙ entsprechend zuvor für S-Schicht-Proteine 72-75 beschriebenen Werte. Verwenden Sie den gleichen Wert für die Berechnung der Metall-Wechselwirkung mit dem proteinhaltigen Schicht.
7. AFM-Messungen
- Führen Studien mit vollständig in der Lage AFM auf einer umgekehrten Lichtmikroskop.
- Nehmen Sie AFM-Aufnahmen in flüssiger mit dem Umkristallisieren Puffer oder ultrareinem Wasser direkt auf die beschichtete QCM-D-Sensoren.
- Spülen Sie die Sensoren mit hochreinem Wasser nach der QCM-D-Experimente und legen Sie sie im Inneren des AFM Fluidzelle. Daher geschlossenes Flüssigkeitszelle mit einem Gesamtvolumen von etwa 1,5 ml. Halten der Temperatur der Fluidzelle konstant bei 30 ° C.
- Verwenden einen Ausleger mit einer Resonanzfrequenz von ≈ 25 kHz in Wasser und einer Steifigkeit von <0,1 N / m. Einstellen der Abtastgeschwindigkeit zwischen 2,5 und 10 & mgr; m / sec.
- Nehmen Sie Bilder in dynamischen Kontaktmodus, während der Ausleger durch ein Piezo auf ihrer Resonanzfrequenz angeregt wird. Bestimmen des Abstandes des Auslegers an die Oberfläche der Schwingungsdämpfungs 76.
Achtung: Höhe Bilder mit z-Skala gezeigt, während der z-Werte die genaue Topographie der Oberfläche. Amplitude (Pseudo 3D) Bilder ohne z-Skala gezeigt, weil Amplitude z-Werte hängen von Scan-Parameter und tragen begrenzte Informationen. Die Analyse der Bilder wurde unter Verwendung von drei verschiedenen Auswertungssoftware 77 getan.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Kultivierung von Mikroorganismen und SLP1 Charakterisierung
Die aufgezeichneten Daten des Bakterienwachstums zeigt das Ende der exponentiellen Wachstumsphase bei etwa 5 Stunden. Frühere Untersuchungen haben gezeigt, dass SLP1 können von diesem Zeitpunkt der Ernte (4,36 g / L nasser Biomasse (≈ 1,45 g / L (BDW)) mit einer maximalen Ausbeute 19 isoliert werden. Dennoch Optimierung der Kultivierung...
Access restricted. Please log in or start a trial to view this content.
Diskussion
In dieser Arbeit untersuchten die Bindung von Au auf S-Layer-Proteine wurde unter Verwendung einer Kombination von verschiedenen analytischen Methoden untersucht. Insbesondere die Bindung von Au ist sehr attraktiv, nicht nur für die Wiedergewinnung von Au aus dem Bergbau, Wasser oder Prozesslösungen, sondern auch für die Konstruktion von Materialien, zB sensorischen Oberflächen. Für Studien der Wechselwirkung Au (Au (III) und Au (0) -NPs) mit suspendierten und umkristallisiert Monoschicht von SLP1, d...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die vorliegende Arbeit wurde teilweise durch die IGF-Projekt "S-Sieve" (490 ZBG / 1) durch das BMWi und des BMBF-Projektes "Aptasens" (BMBF / DLR 01RB0805A) finanziert finanziert. Besonderen Dank an Tobias J. Günther für seine wertvolle Hilfe bei der AFM-Studien und um Erik V. Johnstone zum Lesen des Manuskripts als englischer Muttersprachler. Ferner würde der Autor dieses Papieres gerne Aline Ritter und Sabrina Gurlit (vom Institut für Ressourcenökologie zur Unterstützung bei der ICP-MS-Messungen) zu danken, Manja Vogel, Nancy Unger, Karen E. Viacava und die Gruppe Biotechnologie des Helmholtz-Institut Freiberg für Ressourcentechnologie.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000 - 6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein = 90 %, = 40,000 units/mg protein (Sigma) |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50 - 100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50,000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
Referenzen
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. Atimtay, T. A., Sikdar, S. K. , Springer. 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B. Environmental Microbe-Metal Interactions. Lovely, D. R. , ASM Press. Washington. 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , Forschungszentrum Rossendorf. Dresden. (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , Technische Universität Dresden. (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, Rice University . Houston. 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. Gold : science and applications. , CRC Press - Taylor&Francis Group. (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, Dr Dietrich Steinkopff Verlag. (1992).
- Günther, T. J. S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , Technische Universität Dresden. (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. Methods for general and molecular bacteriology. , American Society for Microbiology. 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C. [6] Quantitation of protein. Methods in Enzymology. Deutscher, M. P. 182, Academic Press. 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. ICP Mass Spectrometry - The 30-Min to ICP-MS. , PerkinElmer. USA. (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. Colloidal Gold - Principles, Methods and Applications. , Academic Press. (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E. Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. Buffle, J., van Leeuwen, H. P. 2, Lewis Publishers. 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705(2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , Technische Universität Dresden. (2003).
- Jennings, T., Strouse, G. Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , Springer. 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten