このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
SLP1ポリマーと単層のAuのインタラクションから
要約
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
要約
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
概要
原因エレクトロニクス、触媒、バイオセンサ、または医療機器のようないくつかのアプリケーションのための金の使用の増加に、この貴金属の需要はここ数年の時間6-9かけて成長してきました。重鎖または貴金属、最も環境汚染は継続的なプロセスであるが、金だけでなく、他の多くの貴重な重金属は、鉱業活動を通じて、希薄濃度の工業排水を経て環境中に放出され、廃棄物処理7,8,10されています主に技術的な活動によって引き起こされます。これは、自然の生態系の重要な干渉につながり、潜在的に人間の健康9を脅かします。これらの負の結果を知ることは、工業廃水からの金属のリサイクルに汚染された生態系や改善点から金属を除去するための新しい技術の探索を推進しています。沈殿又はイオン交換のような十分に確立された物理化学的方法には、特に高で、それほど効果的ではありませんLYは、溶液7,8,11に希釈しました。バイオソープションは、いずれかの生きているか死んバイオマスで、廃水処理10,12のための魅力的な代替です。そのような生物学的材料の使用は、毒性化学物質の消費量を低減することができます。多くの微生物は、蓄積又は金属を固定するために記載されています。例えば、Lysinibacillusのスフェリカスの細胞が(L.スファエリカス )JG-A12は、貴金属のための高い結合能力を示している、例えば、パラジウム(II)、白金(II)、金(III)、及びPbのような他の有毒金属(II)またはU(VI)4,13、クロム(VI)14のためのバチルス・メガテリウムの細胞、金のために白金(II)およびPd(II)15、及びクロレラ下品ためのサッカロマイセス・セレビシエの細胞(III)とU(VI)16 、17。金(III)、パラジウム(II)、およびPt(II)のような前の金属の結合はまた、 デスルホビブリオ18およびL.ためのdesulfuricansについて報告されていますスフェリカス JG-B53 19,20。それにもかかわらず、ではないアルリットルの微生物は、金属を大量に結合して、収着材料としての用途は限ら12,21です。また、容量の金属結合は、異なるパラメータ、 例えば、細胞組成物、使用されるバイオコンポーネント、または環境や実験条件(pH、イオン強度、温度など)に依存します。単離された細胞壁断片22,23の研究は、膜脂質、ペプチドグリカン、タンパク質、または他の構成要素と同様に、複雑な構築全細胞8,21のプロセスを結合金属を理解するのに役立ちます。
この研究に着目セル構成要素は、S層タンパク質です。 S層タンパク質は、多くの細菌及び古細菌の外側細胞エンベロープの一部であり、それらは、約15を構成する - これらの生物の全タンパク質質量の20%。環境への最初のインターフェイスとして、これらの細胞の化合物は、強く、細菌の吸着特性3に影響を与えます 。 40の範囲の分子量を有するS層タンパク質kDaでの数百の細胞内で生産され、それらは脂質膜または高分子の細胞壁成分に層を形成することができる場合に外部組み立てられます。一旦単離されると、ほぼ全てのS層タンパク質は自発的に界面で、または平面または管状の構造体3を形成する面に、懸濁液中で自己集合する固有の特性を有しています。タンパク質の単分子層の厚さは、細菌に依存し5の範囲内である- 25nmで24。一般に、形成されたS層タンパク質の構造は、35ナノメートル3,24に対して斜め(P1またはP2)、正方形(P4)、または六角形(P3またはP6)2.5の格子定数との対称性を有することができます。格子形成は、二価の陽イオンに依存して、主のCa 2+ 25,26、ラフ、Jらに多くのケースであるように思われます。 S層タンパク質ベースのエンジニアナノ構造における産業用アプリケーションに基づくナノコンポジット。 (編Tijana Z.グローブ&Aitziber L. Cortajarena)(スプリンガー、2016(提出))。それにもかかわらず、特に例えば、Ca 2+およびMg 2+などの二価カチオンのモノマーの折り畳み、モノマー-モノマー相互作用、格子を形成し、異なる金属の役割の完全な反応カスケードは、まだ完全には理解されていません。
グラム陽性菌株L. 27(新系統発生的分類した後、バチルス・スファエリカスから改称) スフェリカス JG-B53はウラン鉱山廃棄物の山「ハーバーランド」(Johanngeorgenstadt、ザクセン、ドイツ)4,28,29から単離しました。その機能S層タンパク質(SLP1)は正方格子、116 kDaで30の分子量、および細菌細胞31生きに ≈10nmの厚さを有しています。以前の研究では、約10nmの厚さで閉じ、安定したタンパク質層のインビトロでの形成は10分未満19で達成されました。関連菌株L.スフェリカス JG-A12は、また「ハーバーランド "パイルからの分離株は、高い金属結合能力を有し、その単離されたS層タンパク質は、Auのような貴金属のための高い化学的および機械的安定性と優れた吸着率を示した(III)、白金(II)、およびPd(II)4,32,33。貴金属のこの結合は、いくつかの金属について多かれ少なかれ特異的であり、ポリマーの外側及び内側タンパク質表面上及び細孔内の官能基、イオン強度、およびpH値の利用可能性に依存します。 、OH - 、PO 4 - - 、SO 4 - 、およびSO-タンパク質による金属相互作用に関連する官能基は、COOH-、NH 2です。原理的には、金属結合能力は、アプリケーション、 ラフ、Jらの広いスペクトルを開きます。 S層タンパク質ベースのエンジニアナノ構造における産業用アプリケーションに基づくナノコンポジット。 (編Tijana Z.グローブ&Aitziber L. Cortajarena)(スプリンガー、2016年(提出))。 例えば、除去又は回復のためbiosorptiveコンポーネントとして溶解毒性または有価金属の、合成または触媒反応、およびバイオ感覚層3,5,18,33のような他の生体工学材料のため、定期的に構造化金属ナノ粒子(NPS)の定義された堆積のためのテンプレート。 Auのような規則的に配置されたNPアレイ(0)-NPsはCO酸化34-37ための分子エレクトロニクスやバイオセンサー、超高密度記憶装置、および触媒に至るまでの主要な用途のために使用することができます。このようなアプリケーションや、これらの材料のスマートなデザインの開発は、基礎となる金属結合メカニズムのより深い理解を必要とします。
このようなバイオベース材料の開発のための前提条件は、生体分子と技術面38,39との間の界面層の信頼できる実装です。例えば、高分子電解質は、S層タンパク質39の再結晶化のための界面層として使用されているレイヤー・バイ・レイヤー(のLbL)技術40,41に組み付け。このようなインタフェースは、再現可能かつ定量的な方法でタンパク質コーティングを実行するための比較的簡単な方法を提供しています。接着剤プロモーターと変更することなく、種々の実験を行うことで、コーティング速度、層の安定性、および生体分子19,42、ラフ、J.らと金属との相互作用に関する記述することが可能です。 S層タンパク質ベースのエンジニアナノ構造における産業用アプリケーションに基づくナノコンポジット。 (編Tijana Z.グローブ&Aitziber L. Cortajarena)(スプリンガー、2016年(提出))。しかし、タンパク質吸着およびタンパク質 - 表面相互作用の複雑なメカニズムは完全に理解されていません。特に立体構造、パターンの向き、コーティング密度の情報がまだ不足しています。
消費モニタリング(QCM-D)技術で水晶マイクロバランスは、タンパク質吸着、コーティング速度を研究するためのツール、および対話プロとして近年注目を集めていますナノメートルスケール19,43-45上セス。この技術は、リアルタイムで大量の吸着の詳細な検出を可能にし、タンパク質格子19,20,42,46-48に機能性分子のタンパク質自己集合プロセスと結合するための指標として用いることができます。また、QCM-Dの測定は、天然の生物学的条件下でのタンパク質性の層と金属の相互作用の過程を研究する可能性を開きます。最近の研究において、Euのような選択された金属とS層タンパク質の相互作用(III)、金(III)、パラジウム(II)、およびPtは(II)QCM-D 19,20で検討されています。吸着したタンパク質層は、グラム陽性細菌の細胞壁の単純化モデルとしての役割を果たすことができます。この単一の成分の研究では、金属相互作用のより深い理解に寄与することができます。しかし、単にQCM-D実験は、タンパク質に金属の表面構造と影響に関する記述を許可していません。他の技術は、そのような情報を得るために必要です。 One POSイメージングバイオナノ構造のための任及び構造特性情報を取得するには、原子間力顕微鏡(AFM)です。
提示研究の目的は、特にL. SLP1に、S層タンパク質に金(Au(III)とAu(0)-NPs)の収着を調査することでしたスフェリカス JG-B53。 ICP-MSを使用して5.0とQCM-Dを使用して固定化されたS-層と - 実験は、2.0のpH範囲内のバッチスケールで懸濁タンパク質を用いて行きました。さらに、格子の安定性に対する金属塩溶液の影響は、その後のAFM研究で調査しました。これらの技術の組み合わせは、特定の金属親和性について細菌細胞全体のイベントを結合についての詳細を学ぶためのツールとして、in vitroでの金属相互作用プロセスのより良い理解に貢献しています。この知識だけでなく、環境保護のための金属の回収のために適用可能なフィルター材料の開発と再の保全のために重要です49だけでなく、様々な技術的なアプリケーションのための高度に秩序化された金属NPのアレイの開発のためのソース。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1.微生物および栽培条件
注:すべての実験は、無菌条件下で行われたL.。スフェリカス JG-B53は、凍結保存培地29,30から得られました。
- 300ミリリットルのクリーンベンチの下に転送凍結保存培養物(1.5ミリリットル)の滅菌栄養ブロス(NB)メディア(3グラム/ Lの肉エキス、5グラム/ Lペプトン、10グラム/ LのNaCl)。その後、培養のために前培養物を得るために、30℃で少なくとも6時間溶液を攪拌します。
- 70 Lに、pH値= 7.0で、30℃をNB培地で好気的条件下で細菌を育てるには、蒸気インプレースバイオリアクターをスケールされました。したがって、≈57 L脱イオン水で原子炉を埋めます。バイオリアクターに直接固体NBメディアを追加し、溶解(濃度は、上記参照)。
- さらにメディアをオートクレーブ(122°C、温度保持時間30分)、培養中の泡の形成を抑制するために培地に消泡剤(30μL/ LのNB-メディア)を追加原子炉施設の内部。
- メディアをクールダウンし、完全な酸素飽和度を実行します。 (1 MH 2 SO 4と2 M NaOHを用いて)pHを7.0に調整し、300ミリリットル前培養の自動接種を開始します。接種ポイントで栽培パラメータのデータの記録を開始します。栽培中の例えば オンラインパラメータ、溶存酸素レベル(2 DO)、酸及び塩基付加、およびpH値を記録します。
- 非侵襲的な濁度測定によりオンライン細菌の増殖を監視します。
- 栽培の毎時間後に追加のサンプリングを行い、そのようなバイオ乾燥重量(BDW) とオフラインの光学密度(OD)としてさらにパラメータを決定。したがって、無菌条件下で各サンプリング点で20ミリリットルの培養ブロスを収集します。
- 600nmでの吸収の光度測定によってオフラインでODを決定します。ブランク値として無菌ろ過NB培地を使用してください。船尾にER吸着に到達することは> 0.4は、ランベルト・ベールの法則の直線以下の細胞懸濁液を希釈します。
- 細菌懸濁液を5mlのBDW遠心分離機1の決意を室温で5分間、5,000×gで(細胞密度に応じて)。質量安定性までの加熱炉で105℃で得られた細胞ペレットを乾燥させ、ペレットの質量を測定します。
- 細菌の増殖を確認するため、クロスコンタミネーションコントロールとして400〜1000倍の倍率(それぞれ位相差コンデンサー2および3)に光位相コントラスト研究顕微鏡で顕微鏡画像を取ります。
- オンラインで検出された指数増殖期に達した後、2、オンライン濁度を行う15,000×gでフロースルー遠心分離によりバイオマスを収穫、4℃、標準緩衝液(50 mMトリス、10mMのMgCl 2を、3 mMので二回バイオマスを洗いますNaN 3、pH値= 7.5)。
注:得られたバイオマスのペレットを-18&#で保存することができます176; C分離のためのさらなる使用まで。
2. S層タンパク質の単離および精製
注意:以前に2,19,30,32,50,51説明したように適応した方法に従ってSLP1ポリマーを精製します。
- 4℃で冷却氷浴下分散機(レベル3、10分)を使用して、鞭毛を削除するには:(1()w / vの1)標準緩衝液で栽培から得られる洗浄し、解凍し、粗バイオマスを均質化します。
- 懸濁液(8,000×gで、20分間、4°C)を遠心分離し、標準的な緩衝液で2回得られたペレットを洗浄し(1:1(W / V))。洗浄、遠心分離(8,000×gで、20分間、4℃)した後、標準的なバッファーを用いてペレットを再懸濁(1:1(W / V))、懸濁液にDNアーゼIIおよびRNase(0.4単位/ gのバイオマス)を追加し、崩壊します高圧ホモジナイザー1,000バーで細胞。その後、27,500×gで1時間4℃のサスペンションを遠心します。
注:研究MIとコントロール細胞懸濁液をcroscope。 3無傷の細胞400倍の倍率で顕微鏡の視野に表示されている - 2未満のときに破裂が完了します。 - 標準緩衝液で2回ペレットを洗浄(1:1(w / vで))し、再び遠心分離を行います。その後、標準的な緩衝液中にペレットを再懸濁し(2:1(W / V))、1%トリトンX-100と混合し、脂質沈着物を可溶化するために連続振盪(100 rpm)で下に20分間それをインキュベートします。
- 遠心分離機溶液(27,500×gで、1時間、4℃)、標準緩衝液で得られたペレットを3回洗浄し(1:1(W / V))。
- 標準緩衝液中で6時間、追加の遠心分離(27,500×gで、1時間、4℃)後に得られたペレットをインキュベートし(1:1(W / V))ペプチドグリカン50で結合を加水分解するためには0.2g / Lのリゾチームと混合。さらに懸濁液にDNアーゼIIおよびRNase(各0.4単位/ gのバイオマス)を追加します。
- 遠心分離後(45,500×gで、4℃、1時間)は、Tの低容量と上部白タンパク質相を再懸濁彼は、タンパク質サブユニットを含有する上清(<30 ml)を遠心分離します。
- 6 M塩酸グアニジン(6 MのGuHCl、50mMのトリス、pH値= 7.2)で1:1に混合することにより、白色の懸濁液を可溶化します。解決策は明るくなります。
- 追加の高速遠心分離(45,500×gで、1時間、4℃)に続いてのGuHCl処理液の滅菌濾過(0.2μm)を実行します。
- 透析膜チューブ(MWCO 50,000ダルトン)に上清を移し、48時間再結晶化バッファー(1.5 mMトリス、10mMのCaCl 2を、pH値= 8.0)に対してそれを透析しました。
- 45,500×gで、1時間4℃でチューブと遠心分離機に白の再結晶タンパク質ポリマー溶液を移します。超純水(<30ミリリットル)の低容量でペレットを再懸濁。
- その後、透析膜チューブに懸濁液を移し、バッファーの内容を削除するために24時間超純水に対して透析を行います。
注:いくつかのバッファの変更や超純水During透析が不可欠です。 - 凍結乾燥機で精製SLP1を凍結乾燥。
実験3.特性とSLP1の定量
注:収着およびコーティング実験のためSLP1濃度は、UV-VIS分光光度法により定量しました。
- 直接光度計の低い測定台座の上に溶解SLP1サンプルのピペット2μL。タンパク質についての特性、波長280 nmの吸着最大でタンパク質濃度を決定します。 SLP1濃度を決定するために、0.61の吸光係数を使用してください。基準測定用SLP1無料のソリューションを使用してください。
- 実験(1 G / L及び0.2グラム/ Lのために所望の濃度に(0.9%のNaClを使用してバッチモードで吸着実験はpH = 6.0およびQCM-D実験は、再結晶化バッファを使用するため、でpH = 8.0)緩衝液でタンパク質を希釈それぞれ)。
- 標準bioanalによってSLP1品質および分子量を分析Laemmli、UK 52記載ytical方法ドデシル硫酸ナトリウムポリアクリルアミド電気泳動(SDS-PAGE)。
- 10%ポリアクリルアミド分離ゲルを用いたAu(0)-NPのインキュベーション後に、実験および例えば内SLP1を使用する前に、SDS-PAGEを行います。
- サンプルバッファーで栽培またはタンパク質サンプルの≈10μlのSDS-サンプルミックスの場合(1.97グラムTRISは、5 mgのブロモフェノールブルー、5.8ミリリットルグリセリン、1グラムのSDS、βメルカプトエタノール2.5ミリリットルを、50ミリリットルの超純水で満たす)で比1:1(v / v)のゲルポケットに95℃で4分間のインキュベーションの後、混合物をピペット。
- 60 Vの電圧で動作し、SDS-PAGE 30分のサンプルは、分離ゲルを通過したら、120 Vに収集ゲルと変化電圧を渡すまで。
- ゲル系からゲルを外し、固定液(10%酸性酸、50%無水エタノール)に1時間超純水と場所で洗い流し。その後、超純水でゲルをすすぎます。
- ステインゲル適応非特異コロイドクマシーブリリアントブルー法53,54を使用します。 72,73を脱色した後、製造業者のプロトコルに従って、ゲルドキュメンテーションシステムによって、SDS-PAGEの画像を撮影します。
バッチモードおよび金属定量4.収着実験
- バッチ吸着実験のために金属塩を希釈および1mMの初期金属濃度とは1g / Lの最終SLP1濃度にSLP1 / NaCl溶液と混合、H 2 O 3∙のHAuCl 4の金(III)ストック溶液を調製。 SLP1のない追加の陰性対照とトリプレットで実験を行います。吸着実験のために5ミリリットルの全容量を使用してください。
- (低濃HClおよびNaOH溶液でpHを調整)24時間2.0〜5.0の間で異なる事前調整されたpH値で、室温で連続的にサスペンションを振ります。
- 吸着した後、20分間の遠心15,000×gで、4℃でのサンプル)SEPARへ上澄み液からSLP1を食べました。
- 溶解したタンパク質の単量体を除去するために、20分間、15,000×gで4℃での限外濾過チューブに上清(MWCO 50,000 Da)で遠心これを転送します。
- ICP-MS 19,20によって得られたろ液中の金属濃度を決定し、SLP1乾燥質量によって収着金属のバック計算の結果を使用しています。原理を測定する方法及び使用済みICP-MSの構成要素の機会が、文献55に記載されました。
- 内部標準(1 mg / mlの)とマトリックスとロジウムとして1%のHNO 3を用いて、ICP-MS測定用の試料と参照を準備します。
5.金-NPの合成と粒子サイズの決意
注:クエン酸は、Au(0)-NPはMühlpfordt、H.らの前述の適合方法に従って合成した安定しました。 (1982)の直径を有する球状粒子を得た10 - 15ナノメートル56,57 。
- NPの形成のために、安定化の25mMのHAuCl 4∙3 H 2 Oの在庫を準備します。
- 19.75ミリリットル超純水に、このストック溶液の250μLを希釈し、連続振とう下で15分間、61℃でこれらをインキュベートします。
- 第二ストック溶液5ml(12mMのタンニン酸、7 mMのクエン酸ナトリウム二水和物、0.05 mMのK 2 CO 3)を用意し、15分間61℃で別々に2 番目のソリューションをインキュベートします。
- 定数は、溶液1に2 番目の原液を攪拌下に追加します。 61℃で少なくとも10分間、反応混合物を撹拌しました。その後、溶液を冷却し、QCM-D実験内SLP1格子上のNPコーティングのためにそれを使用します。
注:得られたAu(0)-NPは、典型的に形成されたAu(0)58 -NPsの検出のために使用される520nmでの吸光度の最大でUV-VIS分光法で特徴づけました。溶液を4℃で保存することができます。 - 形成の大きさを分析また、動的光散乱として知られて光子相関分光法(PCS)によって金(0)-NP。
- NPサイズの決意について、層流ボックス内で無塵の条件でキュベットに合成金(0)-NP溶液1.5mlを転送し、サイズおよびゼータ電位、粒子寸法測定器でそれを分析します。 PCSおよび試料調製の詳細な説明はSchurtenberger、P.らに記載されています。 (1993)59、ジャイナ、R。ら。 (2015)60。
6. QCM-Dの実験 - SLP1格子の上表面上SLP1コーティングとAu-NP吸着
注:測定は、最大4つの流れモジュールを搭載したQCM-Dを用いて行きました。すべてQCM-D実験は、25℃で125μL/分の一定の流速で行いました。 SLP1コーティングおよび金属/ NPのインキュベーションは≈5 MHzでの基本周波数とSiO 2の圧電ATカット水晶センサ(Ø14ミリメートル)で行いました。すすぎ工程およびアドオンソリューションのitionは、代表的な結果の一部を図にマークされています。 QCM-D実験はSLP1の再結晶化により、後に金属と金属のNPの相互作用に続いて使用されるセンサーのクリーニングや表面改質で始まるステップの方法によりステップとして記述することができます。
- 清掃手順:
- センサーダミーと流体セルを装備。ポンプ少なくとも20 mlのスルーQCM-D及びチューブシステム(超純水(v / v)の2%の洗浄剤)、アルカリ性液体洗浄剤の(モジュールごとにそれぞれ)。その後システムを介して超純水の五倍の体積を(各モジュールあたり)ポンプ(300μL/ minに速度をアップフロー)。製造業者のプロトコルに従って、クリーニングを行ってください。
- 2%SDS溶液中でのインキュベーション(少なくとも20分)により、フローモジュール外のSiO 2のセンサーを清掃し、超純水61,62と、その後数回のセンサーをすすぎます。
- フィルタリングコンプの結晶を乾燥させ空気をressedと20分63,64のためのオゾン洗浄室に配置します。
- すべての有機内容を削除するために二回の洗浄手順を繰り返します。
- センサ表面から結合金属を除去するには、1 M HNO 3でセンサーをすすぎます。その後、超純水ですすぎ、すべての手順を実行します。
- 高分子電解質によってセンサ表面改質:
注意:表面改質はいずれかの内部(手順を流れる)またはフローモジュール(のLbL技術)の外に行うことができます。これらの実験の範囲内の表面を変更するには、以下の方法を使用しました。- 3グラムによって記事に特別に使用されるシステムについて前述のLbL技術40,41を用いて、ディップコーティングを介したポリエチレンイミン(PEI、MW 25,000)とポリスチレンスルホン酸(PSS、MW7万)の交互のPE層の/ Lのセンサーを変更Suhrの、M。ら。 (2014年)19。
- 深いワットで適切なPE-ソリューション内部のセンサーを配置エルプレートし、室温で10分間これらをインキュベートします。
- PE-溶液からセンサーを取り出し、超純水で集中的にすべてのディップコーティング工程の間にセンサーをすすぎます。
注意:新たな表面改質は、正に荷電したPEIで少なくとも三つのPE層の終端から成ります。 - この外部変更後の流れモジュール内のセンサーを配置し、実験を開始する前に、超純水でリンスすることによってセンサーを平衡化。
- SLP1単層の再結晶:
- モノマーのポリマーへの変換のための4 M尿素SLP1を溶解します。
- 単量タンパク質15,000×gで1時間4℃で遠心分離し、より大きなタンパク質凝集物を除去します。
- 0.2g / Lの最終タンパク質濃度に再結晶化緩衝液で可溶化し、遠心分離SLP1上清を混合します。
注:SLP1(自己組織化)のカルシウムによって再結晶化は、RECの添加により開始しますrystallizationバッファ。したがって、すぐに(流れモジュールの内部に配置)センサ125μL/ minの流量で混合した溶液をポンプ。再結晶は、QCM-D実験内で検出された周波数と消費シフトの安定した値の後に行われます。 - 周波数と消費シフトの安定した値が検出されるまでの流れモジュール内部のPE-修正センサの上部に成功したタンパク質の再結晶後125μL/ minの流量でwaterintensively再結晶バッファまたは超純でコーティングされたセンサーをすすぎます。
注:SLP1単層およびAFMの研究への吸着後の実験のためにPEのSiO 2表面改質は 、図1に可視化されます。

図1.回路図デザインのPE表面改質とSLP1単層のコーティング;この図はSuhrの、M。らから変更されています。 (2015年)19スプリンガーから許可を得て。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 金属および金属NP相互作用:
注:Au金属塩溶液(のHAuCl 4∙3 H 2 O)との吸着は、pH = 6.0で0.9%NaCl溶液で1 mMのまたは5mMの濃度で行いました。金-NP吸着は、pH≈5.0で1.6 mMの三ナトリウム - クエン酸緩衝液中で希釈されていない金-NPを用いて行きました。- 周波数及び散逸シフトの安定した値が検出されるまでのフローモジュールに成功SLP1コーティングした後、0.9%NaCl溶液で激しく得SLP1層をリンス。
- 125μL/ minの流量でフローモジュールに準備された金属溶液(1ミリモル)及びNP溶液をポンプおよびSLに大量の吸着を追跡P1層。質量吸着のSauerbrey式( 式1)を参照して周波数シフトを追跡することにより直接検出することができます。
- 金属および金属NPの相互作用を完了した後、弱い結合又は弱い添付金属またはナノ粒子を除去するために、金属/ NP空きバッファを持つ層をすすぎます。
注:実験の図を図2に示されています。

図2 * 66 401フロー・モジュールQFMを使用して、QCM-Dのセットアップの概略設計 。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- データの記録と評価 :
- ヘルツ(たΔfn)と損失(ΔDnは周波数の変化を記録します)QCM-D固有のソフトウェアを使用して、QCM-D実験内。
- 倍音n番目に適用されるセンサ表面に摩擦なし接続された薄くて硬質フィルムに対して有効である吸着質量感度(量Δm)のSauerbrey方程式/モデル( 式1)65 66の評価のために使用します。カット水晶センサーで使用する5 MHzのための項C(のSauerbrey定数)は17.7 ngの∙ヘルツ-1∙cm -2で68です。剛性のために、均等に分布しており、十分に薄い吸着層は、良好な近似として式(1)を使用しています。
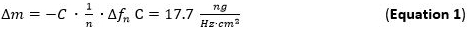
- メーカー固有のソフトウェアとの粘弾性分子68〜71の有効なケルビン・フォークトモデルに応じて追加のモデリングを行い、のSauerbreyモデルのそれと結果を比較します。
- 層の厚さの計算および質量吸着用重要なモデルパラメータとして1.35の吸着層の密度G∙cm -3のS層タンパク質72〜75について前述した値に相当します。タンパク質性の層と金属の相互作用の計算のために同じ値を使用します。
7. AFM測定
- 倒立光学顕微鏡で完全に行うことができ、AFMを用いた研究を行います。
- コーティングされたQCM-Dセンサに直接再結晶化緩衝液または超純水を用いた液体のレコードAFM像。
- QCM-D実験後に超純水でセンサを洗浄し、AFM流体セルの内部に配置します。したがって、約1.5ミリリットルの総容量で、閉じた流体セルを使用しています。 30℃での流体セルの温度を一定に保ちます。
- 水に≈25 kHzでの共振周波数と<0.1 N / Mの剛性とカンチレバーを使用してください。 2.5から10μm/秒の間のスキャン速度を調整します。 動的接触モードで画像を取ります。 76減衰振動によって表面にカンチレバーの距離を決定します。
注:Z値は、表面の正確な形状を表している高さの画像は、zスケールで示しています。振幅Z値は、走査パラメータに依存し、限られた情報を負担するため、振幅(擬似3D)画像は、zスケールなしで示されています。画像の解析は、3つの異なる評価ソフトウェアの77を用いて行きました 。
Access restricted. Please log in or start a trial to view this content.
結果
微生物およびSLP1キャラの育成
細菌増殖の記録されたデータは、約5時間で指数増殖期の終わりを示します。以前の研究は、それにもかかわらず、定義されたメディアコンポーネントを使用して、培養の最適化またはfed-。最大収率19 4.36グラム/ L(SLP1は収穫のこの時点から単離することができることを?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この研究では、異なる分析方法の組み合わせを用いて調べたS層タンパク質の金の結合を研究しました。具体的には、金の結合は、例えば 、感覚面鉱業水またはプロセス溶液から金を回収するだけでなく、材料の建設のためだけでなく、非常に魅力的です。 Auの相互作用の研究のために金(Au(III)及びAu(0)-NPs)に懸濁し、SLP1の単層を再結晶化して、タンパク質が持っていたが単離?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、開示することは何もありません。
謝辞
本研究の一部はBMWiとBMBFプロジェクト」Aptasens」(BMBF / DLR 01RB0805A)が資金を提供し、IGF-プロジェクト「S-ふるい」(490 ZBG / 1)によって資金を供給されました。英語のネイティブスピーカーとして原稿を読み取るためのAFM研究中およびエリックV.ジョンストンへの彼の貴重な助けのためのトビアス・J・ギュンターに感謝します。さらに、この論文の著者は、Manjaフォーゲル、ナンシーアンガー、カレンE. Viacavaとヘルムホルツ研究所のグループバイオテクノロジー(ICP-MS測定における支援のためのリソースエコロジー研究所から)アリーンリッターとサブリナGurlitに感謝したいと思います資源技術のためのフライベルク。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000 - 6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein = 90 %, = 40,000 units/mg protein (Sigma) |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50 - 100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50,000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
参考文献
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. Atimtay, T. A., Sikdar, S. K. , Springer. 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B. Environmental Microbe-Metal Interactions. Lovely, D. R. , ASM Press. Washington. 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , Forschungszentrum Rossendorf. Dresden. (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , Technische Universität Dresden. (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, Rice University . Houston. 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. Gold : science and applications. , CRC Press - Taylor&Francis Group. (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, Dr Dietrich Steinkopff Verlag. (1992).
- Günther, T. J. S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , Technische Universität Dresden. (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. Methods for general and molecular bacteriology. , American Society for Microbiology. 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C. [6] Quantitation of protein. Methods in Enzymology. Deutscher, M. P. 182, Academic Press. 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. ICP Mass Spectrometry - The 30-Min to ICP-MS. , PerkinElmer. USA. (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. Colloidal Gold - Principles, Methods and Applications. , Academic Press. (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E. Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. Buffle, J., van Leeuwen, H. P. 2, Lewis Publishers. 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705(2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , Technische Universität Dresden. (2003).
- Jennings, T., Strouse, G. Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , Springer. 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved