Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Au-Interaction des SLP1 Polymères et monocouche de
Dans cet article
Résumé
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
Résumé
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
Introduction
En raison de l'utilisation croissante de l'or pour plusieurs applications comme l'électronique, les catalyseurs, les biocapteurs, ou des instruments médicaux, à la demande de ce métal précieux a augmenté au cours du temps de ces dernières années 6-9. Or, ainsi que beaucoup d'autres métaux précieux et lourds sont libérés dans l'environnement par les effluents industriels à des concentrations diluées, à travers des activités minières, et l'élimination des déchets 7,8,10, bien que la plupart contamination de l'environnement par des métaux lourds ou précieux est un processus continu principalement causés par des activités technologiques. Cela conduit à une interférence significative des écosystèmes naturels et pourrait menacer la santé humaine 9. La connaissance de ces résultats négatifs favorise la recherche de nouvelles techniques pour éliminer les métaux provenant des écosystèmes et des améliorations dans le recyclage des métaux contaminés des eaux usées industrielles. Bien établies méthodes physico-chimiques comme la précipitation ou échange d'ions ne sont pas si efficaces, surtout en hauteLy dilué solutions 7,8,11. Biosorption, soit avec la vie ou la biomasse morte, est une alternative intéressante pour le traitement des eaux usées 10,12. L'utilisation de ces matériaux biologiques peut réduire la consommation de produits chimiques toxiques. De nombreux micro-organismes ont été décrits à accumuler ou d'immobiliser les métaux. Par exemple, les cellules de Lysinibacillus sphaericus (L. sphaericus) JG-A12 ont montré des capacités de liaison élevée pour les métaux précieux, par exemple, Pd (II), Pt (II), Au (III), et d'autres métaux toxiques comme le plomb (II) ou U (VI) 4,13, les cellules de Bacillus megaterium pour Cr (VI) 14, les cellules de Saccharomyces cerevisiae de Pt (II) et Pd (II) 15, et Chlorella vulgaire de Au (III) et U (VI) 16 , 17. La liaison des métaux précédents comme Au (III), Pd (II), et Pt (II) a également été rapportée pour Desulfovibrio desulfuricans 18 et L. sphaericus JG-B53 19,20. Néanmoins, pas all microbes lient des quantités élevées de métaux et leur application en tant que matériau de sorption est limitée 12,21. En outre, la capacité de liaison du métal dépend de différents paramètres, par exemple, la composition de la cellule, la bio-composant utilisé, ou de l'environnement et des conditions expérimentales (pH, force ionique, température, etc.). L'étude de fragments de paroi cellulaire isolés 22,23, comme les lipides membranaires, peptidoglycane, des protéines ou d'autres composants, aide à comprendre le processus de cellules entières construites complexes 8,21 liaison du métal.
Les composants de la cellule ont porté sur dans cette étude sont des protéines de la couche S. Les protéines de la couche S sont des parties de l'enveloppe cellulaire externe de nombreuses bactéries et archaebactéries, et ils constituent environ 15 - 20% de la masse totale en protéines de ces organismes. Comme la première interface pour l'environnement, ces composés cellulaires influencent fortement les propriétés de sorption 3 bactériennes. Les protéines de la couche S avec des poids moléculaires allant de quaranteà des centaines de kDa sont produites à l'intérieur de la cellule, mais sont assemblés à l'extérieur où ils sont capables de former des couches sur les membranes lipidiques ou polymériques composants de la paroi cellulaire. Une fois isolé, presque tous de la couche S protéines ont la propriété intrinsèque d'auto assembler spontanément en suspension, au niveau des interfaces, ou sur des surfaces planes ou formant tubulaires structures 3. L'épaisseur de la monocouche de protéine dépend de la bactérie et est dans une plage de 5 à 25 nm 24. En général, les structures des protéines de la couche S formés peuvent avoir une oblique (P1 ou P2), carré (p4), ou hexagonal (p3 ou p6) symétrie avec des constantes de réseau de 2,5 à 35 nm 3,24. La formation du réseau semble être dans de nombreux cas, dépendant des cations divalents et principalement sur Ca2 + 25,26, Raff, J. et al. S-couche de nanocomposites à base pour des applications industrielles à base de protéines dans Engineered nanostructures. (eds Tijana Z. Grove et Aitziber L. Cortajarena) (Springer, 2016 (soumis)). Néanmoins, la cascade de réaction pleine de monomère pliage, l'interaction monomère-monomère, la formation d'un réseau, et le rôle des différents métaux, en particulier des cations bivalents tels que Ca 2+ et Mg 2+, ne sont pas encore pleinement compris.
La souche de bactéries gram-positives L. sphaericus JG-B53 (renommé de Bacillus sphaericus après nouvelle classification phylogénétique) 27 a été isolé à partir de la pile de déchets des mines d'uranium "Haberland" (Johanngeorgenstadt, Saxe, Allemagne) 4,28,29. Son fonctionnelle de la protéine S-couche (SLP1) possède un réseau carré, un poids moléculaire de 116 kDa 30, et une épaisseur de ≈ 10 nm sur 31 cellules bactériennes vivant. Dans des études antérieures, la formation in vitro d'une couche de protéine fermée et stable d'une épaisseur d'environ 10 nm a été obtenue en moins de 10 min 19. La souche liée L. sphaericus JG-A12, également un isolat de la pile "Haberland", possède des capacités de liaison élevés des métaux et de sa protéine isolée de la couche S a montré un bon taux de sorption haute stabilité chimique et mécanique et pour les métaux précieux comme l'Au (III), Pt (II), et Pd (II) 4,32,33. Cette liaison de métaux précieux est plus ou moins spécifique pour certains métaux et dépend de la disponibilité des groupes fonctionnels sur la surface de protéine extérieure et intérieure du polymère et dans ses pores, la force ionique et le pH. Groupes fonctionnels pertinents pour l'interaction de métal par les protéines sont COOH-, NH 2 -, OH-, PO 4 -, SO 4 -, et SO-. En principe, les capacités de liaison métalliques ouvrent un large éventail d'applications, Raff, J. et al. S-couche de nanocomposites à base pour des applications industrielles à base de protéines dans Engineered nanostructures. (eds Tijana Z. Grove et Aitziber L. Cortajarena) (Springer, 2016 (soumis)). par exemple, en tant que composants biosorptive pour l'élimination ou la valorisationde métaux précieux ou toxiques dissoutes, des modèles pour la synthèse ou le dépôt de nanoparticules défini régulièrement structurés métalliques (IP) pour la catalyse, et d'autres matériaux de bio-ingénierie comme couches bio-sensorielle 3,5,18,33. NP tableaux disposés régulièrement comme Au (0) -NPs pourraient être utilisés pour des applications majeures allant de l'électronique moléculaire et les biocapteurs, des dispositifs de stockage ultra-haute densité, et des catalyseurs pour le CO-oxydation 34-37. Le développement de ces applications et la conception intelligente de ces matériaux nécessite une compréhension plus profonde des mécanismes contraignants de métal sous-jacent.
Une condition préalable pour le développement de ces matériaux à base de bio-est de la mise en œuvre fiable d'une couche d'interface entre la biomolécule et la surface technique 38,39. Par exemple, les polyélectrolytes assemblés avec la couche par couche (LBL) 40,41 technique ont été utilisées en tant que couche d'interface pour la recristallisation des protéines de la couche S 39 . Une telle interface offre une façon relativement facile à réaliser le revêtement de protéine d'une manière reproductible et quantitative. En effectuant des expériences différentes avec et sans modification avec les promoteurs adhésifs, il est possible de faire des déclarations concernant la cinétique de revêtement, la stabilité de la couche, et l'interaction des métaux avec des biomolécules 19,42, Raff, J. et al. S-couche de nanocomposites à base pour des applications industrielles à base de protéines dans Engineered nanostructures. (eds Tijana Z. Grove et Aitziber L. Cortajarena) (Springer, 2016 (soumis)). Cependant, le mécanisme complexe de l'adsorption des protéines et l'interaction protéine-surface soit pas complètement compris. Surtout informations sur la conformation, l'orientation du motif, et les densités de revêtement est toujours manquant.
Microbalance à cristal de quartz avec la surveillance de dissipation (QCM-D) technique a attiré l'attention ces dernières années comme un outil pour l'étude de l'adsorption des protéines, de la cinétique de revêtement, et l'interaction proles processus à l'échelle du nanomètre 19,43-45. Cette technique permet la détection de masse en détail adsorption en temps réel, et peut être utilisé comme un indicateur pour le processus d'auto-assemblage de protéines et de couplage de molécules fonctionnelles sur 19,20,42,46-48 réseaux de protéines. En outre, les mesures QCM-D ouvrent la possibilité d'étudier les processus d'interaction de métal avec la couche protéique dans des conditions biologiques naturelles. Dans une étude récente, l'interaction de la protéine S-couche avec des métaux choisis comme Eu (III), Au (III), Pd (II), et Pt (II) a été étudié avec QCM-D 19,20. La couche de protéine adsorbée peut servir comme un modèle simplifié d'une paroi cellulaire des bactéries gram-positives. L'étude de ce seul composant peut contribuer à une meilleure compréhension de l'interaction de métal. Cependant, uniquement expériences QCM-D ne permettent pas de déclarations concernant les structures et les influences de métaux à la protéine de surface. D'autres techniques sont nécessaires pour obtenir ces informations. Un POSbilité pour l'imagerie bio-nanostructures et l'obtention d'informations sur les propriétés structurelles est la microscopie à force atomique (AFM).
L'objectif de l'étude présentée était d'enquêter sur la sorption de l'or (Au (III) et Au (0) -NPs) aux protéines de la couche S, en particulier SLP1 de L. sphaericus JG-B53. Des expériences ont été faites avec des protéines en suspension sur l'échelle de lots dans une gamme de pH de 2,0 à 5,0 en utilisant l'ICP-MS et S-couches immobilisées en utilisant QCM-D. En outre, l'influence de la solution de sel métallique sur la stabilité du réseau a été étudié par des études ultérieures de la FAM. La combinaison de ces techniques contribue à une meilleure compréhension des processus in vitro dans d'interaction de métal comme un outil pour apprendre plus sur les événements de cellules bactériennes entières concernant les affinités de liaison métalliques spécifiques. Cette connaissance est essentielle non seulement pour le développement de matériaux filtrants applicables pour la récupération des métaux pour la protection de l'environnement et la conservation des re49 sources, mais aussi pour le développement de réseaux de IP métalliques hautement ordonnés pour diverses applications techniques.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Microorganismes et la culture Conditions
Note:. Toutes les expériences ont été effectuées dans des conditions stériles L. sphaericus JG-B53 a été obtenu à partir d'une culture de cryo-conservé 29,30.
- La culture (1,5 ml) sous le banc propre transfert cryo-conservés jusqu'à 300 ml de bouillon nutritif stérile (NB) médias (3 g / L extrait de viande, 5 g / l de peptone, 10 g / l de NaCl). Ensuite agiter la solution pendant au moins 6 heures à 30 ° C pour obtenir la pré-culture pour la culture.
- Cultiver les bactéries dans des conditions aérobies dans les médias NB à pH = 7,0, 30 ° C dans un bioréacteur de 70 L escaladèrent la vapeur en place. Par conséquent, remplir le réacteur avec ≈ 57 L d'eau déminéralisée. Ajouter et dissoudre médias NB solide directement dans bioréacteur (concentrations voir ci-dessus).
- En outre ajouter un agent antimousse (30 pl / L NB-médias) pour les médias pour supprimer la formation de mousse lors de la culture, puis l'autoclave (122 ° C, température de maintien de temps de 30 min) les médiasà l'intérieur de l'installation du réacteur.
- Refroidir les médias et effectuer la saturation complète de l'oxygène. Ajuster le pH à 7,0 (en utilisant une MH 2 SO 4 et 2 M de NaOH) et commencer l'inoculation automatique de la 300 ml de pré-culture. Commencez l'enregistrement de données de paramètres de culture au point d'inoculation. Connectez paramètres en ligne par exemple, le niveau d'oxygène dissous (OD 2), plus acide et de base, et des valeurs de pH au sein de la culture.
- Surveiller la croissance bactérienne en ligne par des mesures de turbidité non invasives.
- Effectuer un prélèvement supplémentaire après chaque heure de la culture et de déterminer autre paramètre, comme le poids à sec bio (BDW) et une densité optique déconnecté (DO). Par conséquent, recueillir 20 ml de bouillon de culture à chaque point d'échantillonnage dans des conditions stériles.
- Déterminer déconnecté OD par des mesures photométriques de l'adsorption à 600 nm. Utilisez-NB moyen filtré stérile comme une valeur vide. À l'arrièreer atteindre adsorption> 0,4 dilué la suspension cellulaire suivant la linéarité de la loi de Lambert-Beer.
- Pour la détermination de BDW une centrifugeuse de 5 ml de suspension bactérienne (en fonction de la densité cellulaire) à 5000 g pendant 5 min à température ambiante. Sécher le culot cellulaire obtenu à 105 ° C dans un four de chauffage jusqu'à stabilité masse et mesurer la masse de granules.
- Prendre des images microscopiques en phase de recherche optique microscope à contraste 400 et 1000 fois grossissement (contraste de phase de condenseur 2 et 3 respectivement) pour le contrôle de la croissance bactérienne et à titre de témoin de contamination croisée.
- Après avoir atteint la phase de croissance exponentielle détecté par ligne DO 2 et la turbidité en ligne, récolter la biomasse par centrifugation à flux continu à 15.000 xg, 4 ° C et laver la biomasse à deux reprises avec un tampon standard (TRIS 50 mM, MgCl2 10 mM, 3 mM NaN3, pH = 7,5).
Remarque: Le culot de biomasse obtenue peut être stocké à -18 & #176; C jusqu'à utilisation ultérieure pour l'isolement.
2. La protéine de la couche S Isolement et purification
Remarque: Purifier SLP1 polymères selon un procédé adapté tel que décrit précédemment 2,19,30,32,50,51.
- Homogénéiser la biomasse brut lavé et décongelé obtenu à partir de la culture dans un tampon standard (1: 1 (p / v)) pour éliminer flagelles en utilisant un disperseur (niveau 3, 10 min) dans un bain de glace de refroidissement à 4 ° C.
- Centrifuger la suspension (8000 xg, 4 ° C pendant 20 min) et on lave le culot deux fois avec du tampon obtenu standard (1: 1 (p / v)). Après lavage et centrifugation (8000 xg, 4 ° C pendant 20 min), remettre en suspension le culot dans un tampon standard (1: 1 (p / v)), ajouter de la DNase II et de la RNase (0,4 unité / g de biomasse) de la suspension et se désintègrent les cellules à 1000 bars avec un homogénéisateur haute pression. Ensuite centrifuger la suspension à 27 500 xg, 4 ° C pendant 1 heure.
Remarque: Contrôle suspension de cellules avec les mi de recherchecroscope. Rupture est terminée lorsque moins de 2 - 3 cellules intactes sont visibles dans le champ du microscope au grossissement 400 fois de la vue. - Laver le culot deux fois avec un tampon standard (1: 1 (p / v)) et effectuer une nouvelle centrifugation. Ensuite resuspendre le culot dans un tampon standard (2: 1 (p / v)) en mélange avec 1% de Triton X-100 et incuber pendant 20 min sous agitation successifs (100 rpm) à solubiliser les dépôts lipidiques.
- Centrifuger la solution (27 500 xg, 4 ° C pendant 1 heure) et laver le culot obtenus trois fois avec un tampon standard (1: 1 (p / v)).
- Incuber le culot obtenu après centrifugation supplémentaire (27 500 xg, 4 ° C pendant 1 heure) pendant 6 heures dans un tampon standard (1: 1 (p / v)) mélangé à 0,2 g / l de lysozyme, pour hydrolyser des liaisons de peptidoglycane 50. En outre ajouter de la DNase et de la RNase II (chaque 0,4 unités / g de biomasse) à la suspension.
- Après centrifugation (45 500 xg, 4 ° C, 1 h), remettre en suspension la phase de protéine de blanc supérieur avec un faible volume de til surnageant de centrifugation (<30 ml) contenant de sous-unités protéiques.
- Solubiliser la suspension blanche par mélange de 1: 1 avec 6 M de chlorhydrate de guanidine (GuHCl 6 M, Tris 50 mM, pH = 7,2). La solution devient lumineux.
- Effectuer une filtration stérile (0,2 pm) de la solution traitée GuHCl suivie d'une centrifugation à grande vitesse supplémentaire (45 500 xg, 4 ° C pendant 1 heure).
- Transférer le surnageant dans des tubes à membrane de dialyse (MWCO de 50 000 Dalton) et dialysées contre le tampon de ce recristallisation (TRIS 1,5 mM, CaCl2 10 mM, pH = 8,0) pendant 48 heures.
- Transférer la solution de polymère protéique recristallisée blanc dans des tubes et centrifuger à 45 500 xg, 4 ° C pendant 1 heure. Remettre en suspension le culot dans un petit volume d'eau ultrapure (<30 ml).
- Ensuite, transférer la suspension dans des tubes membranaires de dialyse et d'effectuer une dialyse contre de l'eau ultra pure pendant 24 heures pour éliminer le contenu de la mémoire tampon.
Remarque: Plusieurs changements de tampon ou de l'eau ultra pure durant la dialyse sont indispensables. - Lyophiliser la SLP1 purifié dans un lyophilisateur.
3. caractérisation et la quantification des SLP1 pour les expériences
Remarque: concentration SLP1 pour des expériences de sorption et de revêtement ont été quantifiés par spectrophotométrie UV-Vis.
- Pipette 2 pl de l'échantillon dissous SLP1 directement sur le socle de mesure inférieure du photomètre. Déterminer la concentration en protéine à un maximum d'adsorption à une longueur d'onde de 280 nm, caractéristique des protéines. Utiliser le coefficient d'extinction de 0,61 pour déterminer la concentration SLP1. Utiliser une solution libre pour SLP1 mesures de référence.
- Diluer la protéine avec du tampon (pour des expériences de sorption en mode batch utilisant 0,9% de NaCl, pH = 6,0 et pour des expériences QCM-D utilisent tampon de recristallisation, pH = 8,0) à la concentration désirée pour les expériences (1 g / L et 0,2 g / L respectivement).
- Analyser SLP1 la qualité et le poids moléculaire par la norme bioanalProcédé ytical sodium dodécyl sulfate polyacrylamide (SDS-PAGE) décrit par Laemmli, Royaume-Uni 52.
- Effectuer SDS-PAGE avant d'utiliser SLP1 dans les expériences et, par exemple, après Au (0) -NP incubation en utilisant 10% de gels de séparation de polyacrylamide.
- Pour SDS-échantillons mélange ≈ 10 pi de la culture ou de la protéine échantillon avec un tampon d'échantillon (1,97 g de Tris, 5 mg de bleu de bromophénol, 5,8 ml de glycérine, 1 g de SDS, 2,5 ml β-mercaptoéthanol, se remplissent de l'eau ultrapure à 50 ml) dans un rapport de 1: 1 (v / v) et la pipette le mélange après 4 min d'incubation à 95 ° C dans les poches de gel.
- Exécuter SDS-PAGE 30 min sous une tension de 60 V jusqu'à ce que les échantillons passent le gel et le changement de collecte tension 120 V, une fois le passage du gel de séparation.
- Retirer les gels du système de gel, rincer à l'eau ultra pure et lieu pendant 1 heure dans une solution de fixation (acide acide de 10%, 50% d'éthanol absolu). Ensuite, rincer les gels avec de l'eau ultra-pure.
- Gels Stainen utilisant un colloïdale non spécifique adapté Coomassie méthode au bleu de 53,54. Après décoloration 72,73, prendre des images de SDS-PAGE par le système de documentation de gel selon le protocole du fabricant.
4. Les expériences de sorption en mode batch et la quantification de Métal
- Pour le lot des expériences de sorption préparent Au (III) solution stock de HAuCl4 ∙ 3 de H 2 O, diluer le sel de métal et le mélanger avec la solution SLP1 / NaCl à une concentration de métal initiale de 1 mM et la concentration finale SLP1 de 1 g / L . Effectuer des expériences dans des triplets avec un contrôle négatif supplémentaire sans SLP1. Utiliser un volume total de 5 ml pour des expériences de sorption.
- Secouez la suspension en continu à la température ambiante à différentes valeurs pré-ajusté pH entre 2,0 à 5,0 pendant 24 heures (ajuster le pH avec une faible solution de HCl et NaOH concentré).
- Après sorption, centrifuger les échantillons à 15 000 xg, 4 ° C pendant 20 min) à SEPARmangé SLP1 à partir du surnageant.
- Transférer le surnageant dans des tubes d'ultrafiltration (MWCO 50 000 Da) et centrifuger à 15 000 xg ce, 4 ° C pendant 20 min pour éliminer les monomères protéiques dissous.
- Déterminer la concentration de métaux dans le filtrat résultant par ICP-MS 19,20 et utiliser les résultats pour le dos-calcul de sorption métallique par la masse sèche SLP1. Principes de mesure, les possibilités de la méthode et des composants de l'occasion ICP-MS ont été décrits dans la littérature 55.
- Préparation des échantillons et des références pour les mesures ICP-MS en utilisant 1% de HNO 3 et du rhodium en tant que matrice comme étalon interne (1 mg / ml).
5. Synthèse de Au-NP et Détermination de la taille des particules
Remarque: Au Citrate stabilisé (0) -NP ont été synthétisés selon une méthode décrite précédemment par adaptée Mühlpfordt, H. et al. (1982) pour obtenir des particules sphériques avec un diamètre de 10 - 15 nm 56,57 .
- Préparer un stabilisée mM HAuCl 25 4 ∙ 3 H 2 O stock pour la formation NP.
- Diluer 250 pi de cette solution mère dans 19,75 ml d'eau ultra pure et incuber ces à 61 ° C pendant 15 min sous agitation successives.
- Préparer 5 ml d'une deuxième solution de réserve (12 mM d'acide tannique, 7 mM de citrate de sodium di-hydrate, 0,05 mM de K 2 CO 3) et incuber la solution 2 ème séparément à 61 ° C pendant 15 min.
- Ajouter sous constante agitation de la solution stock de 2 ème à la solution d'un. On agite le mélange réactionnel pendant au moins 10 min à 61 ° C. Ensuite refroidir la solution et l'utiliser pour NP revêtement sur SLP1 réseau à l'intérieur des expériences QCM-D.
Note: Au résultant (0) -NP ont été caractérisés par spectroscopie UV-VIS au maximum d'absorbance de 520 nm, typiquement utilisé pour la détection de forme Au (0) 58 -NPs. La solution peut être conservé à 4 ° C. - Analyse de la taille de la formeAu (0) -NP par spectroscopie par corrélation de photons (PCS) qui est également connu comme diffusion de lumière dynamique.
- Pour la détermination de la taille NP, transférer 1,5 ml de Au synthétisé (0) -NP solution dans des cuvettes dans des conditions exemptes de poussière dans une zone d'écoulement laminaire et de l'analyser avec une taille des particules et potentiel calibreur zêta. Une description détaillée de PCS et préparation de l'échantillon est donnée dans Schurtenberger, P. et al. (1993) 59 et Jain, R. et al. (2015) 60.
6. QCM-D Essais - SLP1 revêtement sur des surfaces et Au-NP adsorption sur SLP1 Lattice
Note: Les mesures ont été effectuées avec un QCM-D équipé avec jusqu'à quatre modules d'écoulement. Toutes les expériences QCM-D ont été réalisées avec un débit constant de 125 pi / min à 25 ° C. SLP1 revêtement métallique et / NP incubation ont été effectuées sur SiO 2 capteurs piézoélectriques AT-coupe quartz (Ø 14 mm) avec une fréquence fondamentale de ≈ 5 MHz. Étapes de rinçage et d'ajouterition de la solution sont marqués dans les chiffres de la partie représentative des résultats. Les expériences QCM-D pourraient être décrites comme une étape par étape en commençant par le nettoyage et la modification de la surface des capteurs utilisés suivie d'une recristallisation SLP1 et par la suite l'interaction de NP métal et le métal.
- Procédures de nettoyage:
- Equiper les cellules du liquide avec des mannequins de capteurs. Pompe à au moins 20 ml (chacun par module) d'un agent de nettoyage liquide alcalin (2% nettoyant en eau ultra-pure (v) / v) par le système QCM-D et le tube. Ensuite pomper le volume cinq fois (chaque par module) d'eau ultra pure dans le système (débit jusqu'à 300 pi / min). Effectuer le nettoyage conformément au protocole du fabricant.
- Nettoyer les capteurs de SiO 2 à l'extérieur des modules de débit par incubation (20 min au moins) dans une solution de SDS à 2% et ensuite rincer les capteurs à plusieurs reprises avec de l'eau ultrapure 61,62.
- Sécher les cristaux avec comp filtréeressed air et placez-les dans une chambre de nettoyage d'ozone pendant 20 min 63,64.
- Répétez la procédure de nettoyage deux fois pour éliminer tous les contenus organiques.
- Pour éliminer les métaux consolidés à partir de la surface du capteur rincer les capteurs avec 1 M HNO 3. Ensuite, effectuer toutes les étapes de rinçage avec de l'eau ultra-pure.
- Capteur Modification de surface par Polyelectrolytes:
Remarque: La modification de surface peut se faire soit à l'intérieur (circuler à travers la procédure) ou à l'extérieur du module de flux (technique LBL). Dans ces expériences de la manière suivante pour modifier les surfaces a été utilisé.- Modifiez les capteurs à 3 g / L d'une alternance de couches de PE de polyéthylène (PEI, MW 25000) et le polystyrène sulfonate (PSS, MW 70000) via le revêtement par immersion en utilisant la technique LbL 40,41 décrit précédemment pour le système utilisé spéciale dans l'article de Suhr, M. et al. (2014) 19.
- Placez les capteurs à l'intérieur du PE-solution appropriée dans une profonde well plaques et incuber ceux-ci pendant 10 min à température ambiante.
- Prenez les capteurs de PE-solution et rincer les capteurs entre chaque étape de revêtement par immersion intensive avec de l'eau ultra-pure.
Remarque: La nouvelle modification de surface se compose d'au moins trois PE couche terminaison avec chargée positivement PEI. - Après cette modification externe placer des capteurs à l'intérieur du module de débit et équilibrer les capteurs par rinçage avec de l'eau ultrapure avant de commencer les expériences.
- SLP1 monocouche recristallisation:
- Dissoudre SLP1 à 4 M d'urée pour convertir polymères en monomères.
- Centrifuger les protéines à 15 000 xg monomerized, 4 ° C pendant 1 heure pour éliminer les plus gros agglomérats de protéines.
- Mélanger le surnageant et on le centrifuge SLP1 solubilisée avec le tampon de recristallisation à une concentration finale en protéines de 0,2 g / L.
Remarque: Le calcium selon recristallisation de SLP1 (auto-assemblage) commence par addition de la recrystallization tampon. Par conséquent, pomper la solution mixte avec un débit de 125 ul / min pour les capteurs (placé à l'intérieur des modules d'écoulement) immédiatement. La recristallisation se fait après des valeurs stables de la fréquence et de dissipation des changements ont été détectées dans des expériences QCM-D. - Après avoir réussi recristallisation de protéines au-dessus des capteurs de PE modifiée à l'intérieur des modules de débit rincer les capteurs enrobés avec du tampon de recristallisation ou ultrapure waterintensively avec un débit de 125 ul / min jusqu'à ce que des valeurs stables de la fréquence et de dissipation des changements ont été détectés.
Remarque: La modification de la surface de SiO 2 avec du PE pour les expériences ultérieures de sorption SUR DES monocouches et AFM études SLP1 est visualisé sur la figure 1.

Figure 1. Schéma Design du PE Modification de surface et SLP1 monocoucheRevêtement; Ce chiffre a été modifié de Suhr, M. et al. (2015) 19 avec l'autorisation de Springer. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Métal et Métal NP Interaction:
Remarque: La sorption de la solution de sel de métal Au (HAuCl 4 ∙ 3 H 2 O) a été réalisée à des concentrations de 1 mM ou 5 mM à pH = 6,0 à 0,9% de NaCl. Au-NP adsorption a été fait avec non dilué au-IP dans 1,6 mM de tampon tri-sodium-citrate à pH ≈ 5,0.- Après succès revêtement SLP1 dans les modules de débit, rincer la couche SLP1 obtenu intensivement avec une solution de NaCl à 0,9% jusqu'à ce que les valeurs stables de la fréquence et de dissipation des changements ont été détectés.
- Pomper la solution préparée en métal (1 mM) et une solution de NP les modules d'écoulement avec un débit de 125 ul / min et l'écoulement de suivre l'adsorption de masse à la Slcouche de p1. Adsorption de masse peut être détectée directement par le suivi des décalages de fréquence se référant à l'équation Sauerbrey (équation 1).
- Après avoir terminé l'interaction de métal et NP métallique, rincer avec la couche tampon sans métal / NP pour enlever faibles des métaux ou des nanoparticules attachées liés ou faibles.
Remarque: Une illustration du montage expérimental est représenté sur la figure 2.

Figure 2. Schéma de conception de l'installation QCM-D à l'aide du module de flux QFM 401 * 66. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Enregistrement des données et de l'évaluation:
- Enregistrer les changements dans la fréquence en Hz (Af n) et la dissipation (AD n) Dans les expériences QCM-D en utilisant QCM-D logiciel spécifique.
- Utilisation pour évaluation de la sensibilité masse adsorbée (Δm) de l'équation / modèle Sauerbrey (Equation 1) 65 66 qui est valable pour des films minces et rigides couplés sans frottement à la surface du capteur appliqué à la n-ième harmonique. Le terme C (Sauerbrey constant) utilisé pour la 5 MHz au niveau du capteur de quartz de coupe est de 17,7 ng ∙ Hz -1 ∙ cm -2 68. Pour rigide, répartis uniformément, et suffisamment minces couches adsorbées utiliser l'équation 1 comme une bonne approximation.
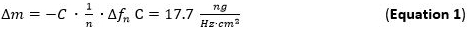
- Effectuer la modélisation supplémentaires selon le modèle de Kelvin-Voigt valable pour molécules viscoélastiques 68-71 avec le logiciel spécifique au fabricant et de comparer les résultats avec celui du modèle Sauerbrey.
- Pour le calcul de l'épaisseur de la couche et l'utilisation d'adsorption de massecomme paramètre de modélisation importante une densité de couche de la couche adsorbée de 1,35 g cm -3 ∙ correspondant à des valeurs décrites ci-dessus pour les protéines de la couche S 72-75. Utiliser la même valeur pour le calcul de l'interaction avec le métal de la couche protéique.
7. Mesures de l'AFM
- Réaliser des études avec tout à fait capable AFM sur un microscope optique inversé.
- Images AFM d'enregistrement à l'état liquide à l'aide du tampon de recristallisation ou de l'eau ultra pure directement sur les capteurs revêtus QCM-D.
- Rincer les capteurs avec de l'eau ultra pure après des expériences QCM-D et de les placer à l'intérieur de la cellule fluide AFM. Par conséquent, en utilisant une cellule de fluide fermé avec un volume total d'environ 1,5 ml. Gardez la température de la constante de cellule fluide à 30 ° C.
- Utiliser un cantilever avec une fréquence de résonance de 25 kHz ≈ dans l'eau et une raideur de <0,1 N / m. Réglez la vitesse de balayage entre 2,5 et 10 um / sec.
- prendre des images en mode de contact dynamique pendant que le cantilever est excité par une piézo à sa fréquence de résonance. Déterminer la distance de la poutre à la surface par l'oscillation d'amortissement 76.
Remarque: Les images de hauteur sont illustrées avec z-échelle tout en valeurs z représentent la topographie exacte de la surface. Amplitude (pseudo 3D) images sont montrées sans z-z-échelle en raison des valeurs d'amplitude dépendent de paramètres de numérisation et portent des informations limitées. Analyse des images a été fait à l'aide de trois logiciels d'évaluation différente de 77.
Access restricted. Please log in or start a trial to view this content.
Résultats
La culture de micro-organismes et SLP1 Caractérisation
Les données enregistrées de la croissance bactérienne indique la fin de la phase exponentielle de croissance à environ 5 heures. Enquêtes précédentes ont montré que SLP1 peut être isolé à partir de ce moment de la récolte (4,36 g / biomasse humide L (≈ 1,45 g / L (BDW)) avec un rendement maximal 19. Néanmoins, l'optimisation ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans ce travail étudié la liaison aux protéines de Au S-couche a été étudiée en utilisant une combinaison de différentes méthodes analytiques. En particulier, la fixation de Au est très intéressante, non seulement pour la récupération des eaux de Au miniers ou des solutions de traitement, mais également pour la construction de matériaux, par exemple des surfaces sensorielles. Pour les études de l'UA interaction (Au (III) et Au (0) -NPs) avec sursis et monocouche de SLP1 recristallisé, la pr...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ont rien à révéler.
Remerciements
Le présent travail a été partiellement financé par l'IGF-projet "S-Sieve" (490 ZBG / 1) financé par l'BMWi et le BMBF-projet "Aptasens" (BMBF / DLR 01RB0805A). Un merci spécial à Tobias J. Günther pour son aide précieuse pendant les études de l'AFM et à Erik V. Johnstone pour lire le manuscrit comme une langue maternelle anglaise. En outre, l'auteur de cet article tient à remercier Aline Ritter et Sabrina Gurlit (de l'Institut pour l'écologie des ressources de l'aide pour les mesures par ICP-MS), Manja Vogel, Nancy Unger, Karen E. Viacava et de la biotechnologie de groupe de la Helmholtz-Institut Freiberg pour Technology Resource.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000 - 6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein = 90 %, = 40,000 units/mg protein (Sigma) |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50 - 100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50,000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
Références
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. Atimtay, T. A., Sikdar, S. K. , Springer. 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B. Environmental Microbe-Metal Interactions. Lovely, D. R. , ASM Press. Washington. 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , Forschungszentrum Rossendorf. Dresden. (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , Technische Universität Dresden. (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, Rice University . Houston. 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. Gold : science and applications. , CRC Press - Taylor&Francis Group. (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, Dr Dietrich Steinkopff Verlag. (1992).
- Günther, T. J. S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , Technische Universität Dresden. (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. Methods for general and molecular bacteriology. , American Society for Microbiology. 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C. [6] Quantitation of protein. Methods in Enzymology. Deutscher, M. P. 182, Academic Press. 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. ICP Mass Spectrometry - The 30-Min to ICP-MS. , PerkinElmer. USA. (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. Colloidal Gold - Principles, Methods and Applications. , Academic Press. (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E. Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. Buffle, J., van Leeuwen, H. P. 2, Lewis Publishers. 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705(2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , Technische Universität Dresden. (2003).
- Jennings, T., Strouse, G. Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , Springer. 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon