A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Au-אינטראקציה של הפולימרים Slp1 וחד שכבתי מ
In This Article
Summary
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
Abstract
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
Introduction
בשל השימוש הגובר של זהב עבור מספר יישומים כמו אלקטרוניקה, זרזים, חיישנים, או מכשירים רפואיים, הביקוש של מתכת יקרה זו גדל במשך הזמן כמה השנים האחרונות 6-9. זהב, כמו גם רבות מתכות יקרות וכבדות אחרות משתחררים לסביבה באמצעות שפכים תעשייתיים בריכוזים לדלל, באמצעות פעילויות כרייה, וסילוק פסולת 7,8,10, למרות שרוב הזיהום סביבתי על ידי מתכות כבדות או יקרות הוא תהליך מתמשך נגרמים בעיקר על ידי פעילות טכנולוגית. זה מוביל להפרעה משמעותית של מערכות אקולוגיות טבעיות ועלול לאיים על בריאות אדם 9. ידיעת תוצאות השליליות אלה מקדם את החיפוש אחר שיטות חדשות להסרת מתכות ממערכות אקולוגיות ושיפורים מזוהמים במחזור מתכות משפכים תעשייתיים. שיטות פיסיקלי כימיות מבוססות היטב כמו משקעים או חילוף יונים הן לא כל כך יעילות, במיוחד בתחום ההייly מדולל פתרונות 7,8,11. Biosorption, גם עם חיים או מת ביומסה, היא חלופה אטרקטיבית לטיפול בשפכים 10,12. השימוש בחומרים ביולוגיים כזה יכול להפחית את הצריכה של כימיקלים רעילים. מיקרואורגניזמים רבים תוארו לצבור או לשתק מתכות. לדוגמא, תאים של sphaericus Lysinibacillus (L. sphaericus) JG-A12 הראו יכולות גבוהות מחייבות למתכות יקרות, למשל, פ"ד (II), Pt (II), Au (III), ומתכות רעילות אחרות כמו Pb (II) או U (VI) 4,13, תאים של megaterium Bacillus לCr (VI) 14, תאים של שמר אפייה לPt (II) וPd (II) 15, ווולגרי כלורלה לAu (III) וU (VI) 16 , 17. הכריכה של מתכות קודמות כמו Au (III), פ"ד (II), וPt (II) דווח גם לDesulfovibrio desulfuricans 18 ולL. sphaericus JG-B53 19,20. עם זאת, לא אלהחיידקים l לקשור כמויות גבוהות של מתכות ויישומם כחומר sorptive מוגבלים 12,21. יתר על כן, מחייבת קיבולת מתכת תלויה בפרמטרים שונים, למשל, הרכב תא, ביו-רכיב המשמש, או סביבתי ותנאי ניסוי (pH, כוח יוני, וכו 'טמפרטורה). המחקר של דופן תא שברים המבודדים 22,23, כמו שומני קרום, פפטידוגליקן, חלבונים, או רכיבים אחרים, מסייע להבין את המתכת מחייבת תהליכים של תאים שלמים נבנו מורכבים 8,21.
מרכיבי התא התמקדו במחקר זה הם חלבוני S-שכבה. חלבוני S-שכבה הם חלקים של מעטפת התא החיצונית של חיידקים וחיידקים קדומים רבים, והם מהווים כ -15 - 20% ממסת החלבון הכוללת של אורגניזמים אלה. כממשק הראשון לסביבה, תרכובות תאים אלה משפיעות בחוזקה על תכונות ספיחת חיידקי 3. חלבוני S-שכבה עם משקולות מולקולריות הנעות בין ארבעיםלמאות kDa מיוצרים בתוך התא, אבל הם התאספו מחוץ בו הם יכולים ליצור שכבות על ממברנות שומנים בדם או מרכיבי דופן תא פולימרים. ברגע בודד, כמעט כל S-שכבת חלבונים הרכוש המהותי לאופן ספונטני עצמי להרכיב בהשעיה, בממשקים, או על משטחים ויוצרים מבנים מישוריים או כמו צינור-3. עובי monolayer החלבון תלוי בחיידקים והוא בטווח של 5-25 ננומטר 24. באופן כללי, מבני חלבון S-שכבה נוצרו יכולים להיות אלכסוני (P1 או P2), ריבוע (P4), או משושה (P3 או P6) סימטריה עם קבועי סריג של 2.5-35 3,24 ננומטר. נראה היווצרות הסריג להיות במקרים רבים תלויים בקטיונים דו ערכיים ובעיקר על Ca 2 + 25,26, רף, ג 'ואח'. S-שכבת nanocomposites מבוסס עבור יישומים תעשייתיים הבמבוסס על החלבון מהונדס ננו. (עורכים Tijana ז גרוב ואיית'יבר ל Cortajarena) (Springer, 2016 (שהוגש)). עם זאת, המפל מלא התגובה של קיפול מונומר, אינטראקציה מונומר-מונומר, ההיווצרות של סריג, והתפקיד של מתכות שונות, בעיקר של קטיונים דו ערכיים כגון Ca 2 + וMg 2 +, עדיין לא הבין באופן מלא.
המתח גרם-חיובי ל sphaericus JG-B53 (שם מsphaericus Bacillus לאחר סיווג פילוגנטי החדש) 27 היה מבודד מערימת פסולת כריית אורניום "Haberland" (Johanngeorgenstadt, סקסוניה, גרמניה) 4,28,29. חלבון S-השכבה הפונקציונלית שלה (Slp1) בעל סריג מרובע, משקל מולקולרי של 116 kDa 30, ועובי של 10 ננומטר ≈ על תאי חיים חיידקים 31. במחקרים קודמים, ההיווצרות במבחנה של שכבת חלבון סגורה ויציבה בעובי של כ -10 ננומטר הושגה בפחות מ -10 דקות 19. הזן הקשורים ל sphaericus JG-A12, גם לבודד מהערימה "Haberland", בעל יכולות גבוהה מחייבות מתכת וחלבון S-השכבה המבודדת שלה הוכיח כימי גבוהות ויציבות מכאנית ושיעורי ספיחה טובים למתכות יקרות כמו Au (III), Pt (II), וPd (II) 4,32,33. זה מחייב מתכות יקרות הוא פחות או יותר ספציפי לכמה מתכות ותלויות בזמינות של קבוצות פונקציונליות על פני החלבון החיצוני ופנימי של הפולימר ובנקבוביות שלה, כוח יוני, וערך ה- pH. קבוצות פונקציונליות רלוונטיות לאינטראקציה מתכת על ידי החלבונים הן COOH-, NH 2 -, OH-, PO 4 -, SO 4 -, וכך-. באופן עקרוני, יכולות מחייבות מתכת לפתוח ספקטרום רחב של יישומים, רף, ג 'ואח'. S-שכבת nanocomposites מבוסס עבור יישומים תעשייתיים הבמבוסס על החלבון מהונדס ננו. (עורכים Tijana ז גרוב ואיית'יבר ל Cortajarena) (Springer, 2016 (שהוגש)). לדוגמא, כרכיבי biosorptive להסרת או שחזורשל מתכות רעילות או בעל ערך מומס, תבניות לסינתזה או בתצהיר מוגדר של חלקיקים מובנים באופן קבוע מתכתיים (NPS) לקטליזה, וחומרים מהונדסים יו אחרים כמו שכבות ביו-חושי 3,5,18,33. מערכים מסודרים באופן קבוע NP כמו Au (0) -NPs יכולים לשמש ליישומים מרכזיים החל אלקטרוניקה מולקולרית וחיישנים, התקני אחסון צפיפות ultrahigh, וזרזים לCO-חמצון 34-37. הפיתוח של יישומים כגון ועיצוב חכם של חומרים אלה מחייב הבנה עמוקה יותר של המנגנונים המחייבים המתכת הבסיסית.
תנאי מוקדם לפיתוח של חומרים מבוסס ביו כזה הוא היישום אמין של שכבת ממשק בין biomolecule והמשטח הטכני 38,39. לדוגמא, פוליאלקטרוליטים התאספו עם 40,41 טכניקת השכבה אחר שכבה (LBL) שימשו כשכבת ממשק לגיבוש מחדש של חלבוני S-שכבה 39 . כגון ממשק מציע דרך קלה יחסית לביצוע ציפוי החלבון בדרך לשחזור וכמותיים. על ידי ביצוע ניסויים שונים עם וללא שינוי עם יזמי דבק, אפשר להצהיר הצהרות בנוגע לקינטיקה ציפוי, יציבות שכבה, ואינטראקציה של מתכות עם מולקולות ביולוגיות 19,42, רף, ג 'ואח'. S-שכבת nanocomposites מבוסס עבור יישומים תעשייתיים הבמבוסס על החלבון מהונדס ננו. (עורכים Tijana ז גרוב ואיית'יבר ל Cortajarena) (Springer, 2016 (שהוגש)). עם זאת, המנגנון המורכב של חלבון הספיחה והאינטראקציה חלבון-פני השטח אינו מובן לחלוטין. במיוחד מידע על קונפורמציה, אוריינטצית דפוס, וצפיפות ציפוי עדיין חסר.
microbalance גביש קוורץ עם ניטור פיזור (QCM-D) טכניקה משך תשומת לב בשנים האחרונות ככלי ללימוד חלבון ספיחה, קינטיקה ציפוי, ופרו אינטראקציהcesses בקנה המידה ננומטרי 19,43-45. טכניקה זו מאפשרת לגילוי מפורט של ספיחה המונית בזמן אמת, ויכולה לשמש כאינדיקציה לתהליך חלבון הרכבה העצמית והצימוד של מולקולות תפקודיות ברשתות חלבון 19,20,42,46-48. בנוסף, מדידות QCM-D לפתוח את האפשרות ללמוד תהליכי אינטראקציה מתכת עם השכבה חלבוניים בתנאים ביולוגיים טבעיים. במחקר שנערך לאחרונה, את האינטראקציה של חלבון S-השכבה עם מתכות נבחרו כמו האיחוד האירופי (III), Au (III), פ"ד (II), וPt (II) נחקר עם QCM-D 19,20. שכבת חלבון adsorbed יכולה לשמש כמודל מופשט של דופן תא של חיידקי גרם חיובי. המחקר של מרכיב אחד זה יכול לתרום להבנה עמוקה יותר של אינטראקציה מתכת. עם זאת, רק ניסויי QCM-D לא מאפשרים הצהרות לגבי מבני משטח והשפעות של מתכות לחלבון. טכניקות אחרות הן הכרחיות כדי להשיג מידע כזה. קופה אחתsibility ליו-ננו הדמיה ומידע על קבלת תכונות מבניות הוא במיקרוסקופ הכוח האטומי (AFM).
מטרתו של המחקר שהוצג הייתה לחקור את הספיחה של זהב (Au (III) וAu (0) -NPs) לחלבוני S-שכבה, בSlp1 המסוים של ל ' sphaericus JG-B53. ניסויים נעשו עם חלבונים תלויים על קנה מידה אצווה בטווח pH של 2.0-5.0 באמצעות ICP-MS ועם S-שכבות משותקות באמצעות QCM-D. בנוסף, ההשפעה של תמיסת מלח מתכת על יציבות הסריג נחקרה במחקרים AFM שלאחר מכן. השילוב של טכניקות אלה תורם להבנה טובה יותר של תהליכים באינטראקצית מתכת מבחנה ככלי ללמידה נוסף על אירועים מחייבים בתאים שלמים של חיידקים לגבי זיקות מתכת ספציפיות. ידע זה הוא לא רק חיוני לפיתוח של חומרי מסנן ישימים עבור ההתאוששות של מתכות להגנה על סביבה ושימור מחדשמקורות 49, אלא גם לפיתוח של מערכים של צירופים ומתכתיים הורה מאוד עבור יישומים טכניים שונים.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. תנאי מיקרואורגניזם וטיפוח
הערה:. כל הניסויים נעשו בתנאים סטריליים ל sphaericus JG-B53 התקבל מתרבות שהשתמר cryo 29,30.
- ההעברה cryo-השתמר תרבות (1.5 מיליליטר) מתחת לספסל הנקי ל -300 מיליליטר מרק מזין סטרילי (NB) תקשורת (תמצית בשר 3 G / L, 5 גר '/ peptone L, 10 גר' / ליטר NaCl). לאחר מכן מערבב את הפתרון במשך לפחות 6 שעות על 30 מעלות צלזיוס להשיג מראש התרבות לטיפוח.
- לטפח את החיידקים בתנאים אירוביים בתקשורת NB ב- pH = 7.0, 30 מעלות צלזיוס בL 70 טיפס bioreactor קיטור במקום. לכן, למלא את הכור עם ≈ 57 מים ללא יוני L. להוסיף ולפזר תקשורת NB המוצקה ישירות בbioreactor (ריכוזים ראו לעיל).
- בנוסף להוסיף סוכן antifoam (30 μl / NB-מדיה L) לתקשורת כדי לדכא את היווצרות קצף במהלך טיפוח, אז החיטוי (122 מעלות צלזיוס, טמפרטורה מחזיקה זמן 30 דקות) בתקשורתבתוך מתקן הכור.
- להתקרר התקשורת ולבצע ריווי חמצן מלא. התאם את ה- pH 7.0 (באמצעות 1 MH 2 SO 4 ו- 2 M NaOH) ולהתחיל את החיסון האוטומטי של טרום-תרבות 300 מיליליטר. התחל הקלטת נתונים של פרמטרים טיפוח בנקודת החיסון. התחבר פרמטרים מקוונים למשל, רמת חמצן מומסת (DO 2), בנוסף חומצה ובסיס, ו- pH-ערכים בטיפוח.
- צג התפתחות החיידקים באינטרנט על ידי מדידות עכירות לא פולשנית.
- לבצע דגימה נוספת לאחר כל שעה של טיפוח ולקבוע פרמטר נוסף כגון משקל ביו יבש (BDW) וצפיפות מחובר אופטית (OD). לכן, לאסוף 20 מיליליטר מרק טיפוח בכל נקודה בתנאים סטריליים דגימה.
- לקבוע OD מחובר על ידי מדידות photometric של הספיחה ב 600 ננומטר. השתמש NB-בינוני filtrated סטרילי כערך ריק. מאחוראה להגיע ספיחה> 0.4 לדלל את ההשעיה התא הבא הליניאריות של חוק למברט-באר.
- לקביעת צנטריפוגות BDW 1 עד 5 מיליליטר של השעיה חיידקים (תלוי בתא צפיפות) בXG 5000 במשך 5 דקות ב RT. ייבש את התא גלולה שהושג ב 105 מעלות צלזיוס בחימום תנור עד יציבות מסה ולמדוד את מסת גלולה.
- קח תמונות מיקרוסקופיות עם מיקרוסקופ מחקר לעומת שלב אופטי ב400 ו -1000 הגדלה של פי (לעומת שלב הקבל 2 ו -3 בהתאמה) לבדיקה של התפתחות החיידקים וכביקורת זיהום צולב.
- לאחר שהגיע לשלב הצמיחה המעריכית זוהה על ידי מקוון לעשות 2 ועכירות באינטרנט, לקצור את ביומסה על ידי צנטריפוגה זרימה דרך ב15,000 XG, 4 מעלות צלזיוס ולשטוף ביומסה פעמיים עם חיץ סטנדרטי (50 מ"מ טריס, 10 מ"מ MgCl 2, 3 מ"מ 3 נאן, pH = 7.5).
הערה: גלולה ביומסה הושגה ניתן לאחסן ב -18 & #176; C עד שימוש נוסף לבידוד.
בידוד חלבון 2. S-שכבה וטיהור
הערה: לטהר פולימרים Slp1 פי שיטה מותאמת כפי שתואר לעיל 2,19,30,32,50,51.
- Homogenize ביומסה הגולמי שטפה והפשרה שהושגה מטיפוח במאגר סטנדרטי (1: 1 (w / v)) כדי להסיר שוטונים באמצעות disperser (רמה 3, 10 דקות) באמבט קרח קירור ב 4 מעלות צלזיוס.
- צנטריפוגה ההשעיה (8000 XG, 4 מעלות צלזיוס למשך 20 דקות) ולשטוף את הכדור שהושג פעמיים עם חיץ סטנדרטי (1: 1 (w / v)). לאחר הכביסה וצנטריפוגה (8000 XG, 4 מעלות צלזיוס למשך 20 דקות), resuspend גלולה במאגר סטנדרטי (1: 1 (w / v)), להוסיף DNase השני וRNase (0.4 יחידות / ביומסה ז) להשעיה ולהתפורר התאים בבר 1,000 עם homogenizer בלחץ גבוה. לאחר מכן צנטריפוגה ההשעיה ב27,500 XG, 4 מעלות צלזיוס במשך שעה 1.
הערה: השעיה תא בקרה עם מיל המחקרcroscope. קרע הושלם כאשר פחות מ 2 - 3 תאים שלמים גלויים בתחום התצוגה של מיקרוסקופ בהגדלה של פי 400. - שטוף את הכדור פעמיים עם חיץ סטנדרטי (1: 1 (w / v)) ולבצע צנטריפוגה שוב. לאחר מכן resuspend גלולה במאגר סטנדרטי (2: 1 (w / v)) מעורבב עם 1% Triton X-100 ודגירה זה במשך 20 דקות תחת (100 סל"ד) רועד הרצופים לsolubilize פיקדונות שומנים.
- צנטריפוגה הפתרון (27,500 XG, 4 מעלות צלזיוס במשך שעה 1) ולשטוף פעמים גלולה שהושגו שלוש עם חיץ סטנדרטי (1: 1 (w / v)).
- דגירה גלולה שהושג לאחר צנטריפוגה נוספת (27,500 XG, 4 מעלות צלזיוס במשך שעה 1) במשך 6 שעות במאגר סטנדרטי (1: 1 (w / v)) מעורבב עם 0.2 g / L יזוזים, לhydrolyze קשרים ב -50 פפטידוגליקן. בנוסף להוסיף DNase השני וRNase (כל 0.4 יחידות / ביומסה ז) להשעיה.
- לאחר צנטריפוגה (45,500 XG, 4 ° C, 1 שעה), resuspend שלב החלבון הלבן העליון עם נפח נמוך של tהוא supernatant צנטריפוגה (<30 מיליליטר) יחידות משנה חלבון מכיל.
- Solubilize ההשעיה הלבנה על ידי ערבוב 1: 1 עם 6 מ 'hydrochloride guanidine (6 מ' GuHCl, 50 מ"מ טריס, pH = 7.2). הפתרון הופך בהיר.
- בצע סינון סטרילי (0.2 מיקרומטר) של הפתרון שטופל GuHCl אחרי צנטריפוגה נוספת במהירות גבוהה (45,500 XG, 4 מעלות צלזיוס במשך שעה 1).
- מעבירים את supernatant לצינורות קרום דיאליזה (MWCO 50,000 דלתון) ודיאליזה זה נגד מאגר recrystallization (1.5 מ"מ טריס, 10 מ"מ CaCl 2, pH = 8.0) במשך 48 שעות.
- מעבירים את פתרון פולימר חלבון recrystallized הלבן לתוך צינורות וצנטריפוגות ב 45,500 XG, 4 מעלות צלזיוס במשך שעה 1. Resuspend גלולה בהיקף נמוך של המים ultrapure (<30 מיליליטר).
- לאחר מכן, להעביר את ההשעיה לתוך צינורות קרום דיאליזה ולבצע דיאליזה נגד המים ultrapure עבור 24 שעות כדי להסיר תוכן חיץ.
שים לב: מספר שינויים של ד חיץ או המים ultrapureהדיאליזה uring היא הכרחיות. - Lyophilize Slp1 המטוהרים במייבש הקפאה.
3. אפיון וכימות של Slp1 לניסויים
הערה: ריכוז Slp1 לניסויי ספיחה וציפוי היה לכמת על ידי spectrophotometry UV-VIS.
- פיפטה 2 μl של מדגם Slp1 המומס ישירות על הכן המדידה התחתון של פוטומטר. קביעת ריכוז חלבון במקסימום ספיחה באורך גל של 280 ננומטר, אופייני לחלבונים. השתמש במקדם ההכחדה של 0.61 כדי לקבוע ריכוז Slp1. להשתמש בפתרון חופשי Slp1 למדידות התייחסות.
- לדלל את החלבון עם החיץ (לניסויי ספיחה במצב אצווה להשתמש 0.9% NaCl, pH = 6.0 ולניסויי QCM-D להשתמש חיץ recrystallization, pH = 8.0) לריכוז רצוי לניסויים (ז 1 / L 0.2 g / L בהתאמה).
- ניתוח איכות Slp1 ומשקל מולקולרי על ידי bioanal הסטנדרטיאלקטרופורזה ytical נתרן שיטת polyacrylamide סולפט dodecyl (SDS-PAGE) תוארה על ידי Laemmli, בריטניה 52.
- בצע SDS-PAGE לפני שימוש Slp1 בתוך ניסויים ולמשל, Au לאחר הדגירה -NP (0) באמצעות ג'לי הפרדת polyacrylamide 10%.
- לתערובת SDS-דגימות ≈10 μl של מדגם הטיפוח או חלבון עם חיץ מדגם (טריס 1.97 גר ', bromophenol 5 מ"ג כחול, 5.8 מיליליטר גליצרין, SDS 1 גרם, 2.5 מיליליטר β-mercaptoethanol, למלא במי ultrapure 50 מיליליטר) ב יחס של 1: 1 (V / V) ופיפטה את התערובת לאחר דגירה 4 דקות ב 95 מעלות צלזיוס לכיסי ג'ל.
- הפעלת SDS-PAGE 30 דקות במתח של 60 V עד הדגימות לעבור את הג'ל אוסף ושינוי המתח 120 V עובר ג'ל ההפרדה פעם.
- הסר את ג'לי ממערכת ג'ל, לשטוף עם מים ultrapure ומקום עבור שעה 1 לפתרון קיבעון (10% חומצת חומץ, 50% אתנול אבסולוטי). לאחר מכן, יש לשטוף את ג'לי עם מים ultrapure.
- ג'לי כתםבאמצעות colloidal נוקבים מותאם Coomassie 53,54 שיטה כחולות מבריקות. לאחר destaining 72,73, לקחת תמונות SDS-PAGE על ידי מערכת תיעוד ג'ל על פי הפרוטוקול של היצרן.
4. ניסויי ספיחה במצב אצווה וכימות מתכת
- ליצוו ניסויי ספיחה להכין Au (III) פתרון מניות מ4 HAuCl ∙ 3 H 2 O, לדלל את המלח המתכת ולערבב אותו עם פתרון Slp1 / NaCl לריכוז ראשוני מתכת של 1 מ"מ וריכוז Slp1 הסופי של 1 גרם / L . לבצע ניסויים בשלישייה עם ביקורת שלילית נוספת ללא Slp1. השתמש בהיקף כולל של 5 מיליליטר לניסויי ספיחה.
- לנער את ההשעיה ברציפות ב RT בערכי pH מותאם מראש שונים בין 2.0-5.0 למשך 24 שעות (להתאים את ה- pH עם פתרון HCl וNaOH מרוכז נמוך).
- לאחר ספיחה, צנטריפוגה הדגימות ב 15,000 XG, 4 מעלות צלזיוס למשך 20 דקות) לseparאכלתי Slp1 מsupernatant.
- מעבירים את supernatant לתוך צינורות אולטרה סינון (MWCO 50,000 Da) ו צנטריפוגות זה ב15,000 XG, 4 מעלות צלזיוס במשך 20 דקות כדי להסיר מונומרים חלבון מומסים.
- קבע את ריכוז המתכת בתסנין וכתוצאה מכך על ידי ICP-MS 19,20 ולהשתמש בתוצאות לגב-חישוב sorbed מתכת על ידי המסה היבשה Slp1. מדידת עקרונות, הזדמנויות של השיטה והמרכיבים של ICP-MS המשומש תוארו בספרות 55.
- הכן דגימות ואזכור למדידות ICP-MS באמצעות 1% HNO 3 כמטריצה ורודיום כסטנדרט פנימי (1 מ"ג / מיליליטר).
5. סינתזה של Au-NP וקביעת גודל חלקיקים
הערה: ציטראט התייצב Au (0) -NP היה מסונתז על פי שיטה מותאמת שתוארה קודם לכן על ידי Mühlpfordt, ח 'ואח'. (1982) כדי לקבל חלקיקים כדוריים בקוטר של 10 - 15 56,57 ננומטר .
- הכן התייצב 25 מ"מ HAuCl 4 ∙ 3 מניות H 2 O להיווצרות NP.
- לדלל 250 μl של פתרון מניות זה ב19.75 מיליליטר מים ultrapure דגירה אלה ב 61 מעלות צלזיוס במשך 15 דקות רצוף תחת רעד.
- הכן 5 מיליליטר של פתרון מניות שני (חומצת 12 מ"מ טאני, די-מימה נתרן ציטרט 7 מ"מ, 0.05 מ"מ K 2 CO 3) ודגירת פתרון 2 nd בנפרד 61 מעלות צלזיוס במשך 15 דקות.
- להוסיף בבחישה מתמדת פתרון מניות -2 לפתרון אחד. מערבבים את תערובת תגובה ללפחות 10 דקות על 61 מעלות צלזיוס. לאחר מכן לקרר את הפתרון ולהשתמש בו לציפוי NP על סריג Slp1 בתוך ניסויי QCM-D.
הערה: Au התוצאה (0) -NP התאפיינו בספקטרוסקופיה UV-VIS במקסימום ספיגה של 520 ננומטר, משמש בדרך כלל לגילוי של Au נוצר (0) -NPs 58. הפתרון יכול להיות מאוחסן על 4 מעלות צלזיוס. - לנתח את גודל יצרAu (0) -NP ידי ספקטרוסקופיה מתאם פוטון (PCS) אשר ידוע גם בשם פיזור אור דינאמי.
- לקביעת גודל NP, להעביר 1.5 מיליליטר של (0) -NP פתרון Au מסונתז לcuvettes בתנאים נטול אבק בזרימה למינרית תיבה ולנתח אותו עם גודל וסייזר חלקיקי פוטנציאל זטה. תיאור מפורט של מחשבים אישיים והכנת מדגם ניתן בורטנברגר, פ ואח '. (1993) 59 וJain, ר 'ואח'. (2015) 60.
6. ניסויים QCM-D - Slp1 ציפוי על משטחים וAu-NP ספיחה על Slp1 סריג
הערה: מדידות בוצעו עם QCM-D מצויד עם עד ארבעה מודולים זרימה. כל ניסויי QCM-D בוצעו עם קצב זרימה קבוע של 125 μl / דקה 25 מעלות צלזיוס. ציפוי Slp1 ומתכת דגירה / NP נעשו על חיישני SiO 2 פיזואלקטריים קוורץ AT-החתך (O 14 מ"מ) עם תדר בסיסי של ≈ 5 מגה-הרץ. שטיפת מדרגות ולהוסיףition של פתרון מסומנים בדמויות של חלק נציגי תוצאות. ניסויי QCM-D יכולים להיות מתוארים כצעד אחר צעד בדרך החל בניקוי ושינוי פני השטח של החיישנים המשמשים אחריו recrystallization Slp1 ומאוחר יותר על האינטראקציה NP מתכת ומתכת.
- ניקוי נהלים:
- לצייד את תאי נוזל עם בובות חיישן. משאבה לפחות 20 מיליליטר (כל לכל מודול) סוכן אלקליין נוזלי טיהור (ניקוי 2% במי ultrapure (V / V)) דרך מערכת QCM-D והצינור של. לאחר מכן לשאוב את הנפח פי חמישה (כל לכל מודול) של המים ultrapure באמצעות המערכת (קצב זרימה עד 300 μl / min). לבצע הניקוי על פי הפרוטוקול של היצרן.
- נקה את SiO 2 החיישנים מחוץ לזרימת מודולים על ידי דגירה (לפחות 20 דקות) בפתרון של 2% SDS ולשטוף את החיישנים אחר כך מספר פעמים עם המים ultrapure 61,62.
- ייבש את הגבישים עם comp המסונןressed אוויר ומניח אותם בתא ניקוי אוזון במשך 20 דקות 63,64.
- חזור על תהליך הניקוי פעמיים כדי להסיר את כל התוכן האורגני.
- כדי להסיר מתכות כרוכים ממשטח החיישן לשטוף את החיישנים עם 1 M HNO 3. לאחר מכן, לבצע את כל שלבי השטיפה במי ultrapure.
- שינוי פני שטח חיישן ידי פוליאלקטרוליטים:
הערה: שינוי פני שטח יכול להיעשות גם בתוך (לזרום דרך הליך) או מחוץ לזרימת מודול (טכניקת LBL). בתוך ניסויים אלה את הדרך לשנות את המשטחים הבאים הייתה בשימוש.- לשנות את החיישנים עם 3 גרם / L של שכבות PE לסירוגין של imine פוליאתילן (PEI, MW 25,000) וsulfonate פוליסטירן (PSS, MW 70,000) באמצעות ציפוי לטבול באמצעות טכניקת LBL 40,41 תוארה קודם לכן למערכת בשימוש המיוחדת במאמרו של זור, מ 'ואח'. (2014) 19.
- הנח את החיישנים בתוך PE-הפתרון המתאים בw העמוקצלחות ell דגירה אלה במשך 10 דקות ב RT.
- קח את החיישנים מPE-פתרון ולשטוף את החיישנים בין כל צעד ציפוי לטבול באינטנסיביות עם מים ultrapure.
הערה: שינוי פני השטח החדש מורכב מלפחות שלוש מסתיים שכבת PE עם PEI מטען החשמלי חיובי. - לאחר שינוי חיצוני זה למקם את החיישנים בתוך הזרימה מודול ולאזן את החיישנים על ידי שטיפה במי ultrapure לפני תחילת הניסויים.
- Slp1 חד שכבתי Recrystallization:
- ממיסים Slp1 ב 4 M אוריאה להמרת פולימרים למונומרים.
- צנטריפוגה חלבוני monomerized ב15,000 XG, 4 מעלות צלזיוס במשך שעה 1 כדי להסיר agglomerates חלבון גדול יותר.
- מערבבים את supernatant Slp1 solubilized וcentrifuged עם חיץ recrystallization לריכוז חלבון סופי של 0.2 g / L.
הערה: סידן בהתאם recrystallization של Slp1 (הרכבה עצמית) מתחיל על ידי תוספת של recמאגר rystallization. לכן, לשאוב את הפתרון המעורב עם קצב זרימה של 125 μl / דקה לחיישנים (ממוקם בתוך זרימת מודולים) באופן מיידי. הגיבוש מחדש נעשה לאחר ערכים יציבים של משמרות תדירות והפיזור התגלו בתוך ניסויי QCM-D. - לאחר גיבוש מחדש חלבון מוצלח על גבי החיישנים-שונה PE בתוך זרימת מודולים לשטוף את החיישנים המצופים עם חיץ recrystallization או ultrapure waterintensively עם קצב זרימה של 125 μl / דקה עד ערכים יציבים של משמרות תדירות ופיזור אותרו.
הערה: שינוי SiO 2 משטח עם PE לניסויי ספיחה מאוחר יותר על מחקרי monolayer וAFM Slp1 היא דמיינה באיור 1.

איור 1. סכמטי עיצוב של שינוי פני שטח PE וSlp1 חד שכבתיציפוי; נתון זה שונה מזור, מ 'ואח'. (2015) 19 באישור שפרינגר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- מתכת ומתכת NP אינטראקציה:
הערה: הספיחה עם תמיסת מלח מתכת Au (HAuCl 4 ∙ 3 H 2 O) בוצעה בריכוזים של 1 מ"מ או 5 מ"מ ב- pH = 6.0 בפתרונות NaCl 0.9%. ספיחת Au-NP נעשתה עם Au-צירופים וחיים ב1.6 מ"מ חיץ תלת-נתרן-ציטראט על 5.0 pH ≈.- לאחר ציפוי Slp1 מוצלח בזרימת מודולים, לשטוף את שכבת Slp1 הושגה באופן אינטנסיבי עם 0.9% NaCl פתרון עד ערכים יציבים של משמרות תדירות ופיזור אותרו.
- לשאוב את הפתרון מוכן מתכת (1 מ"מ) ופתרון NP לזרימת מודולים עם קצב זרימה של 125 μl / דקה ולעקוב אחר ספיחת המסה לSlשכבת P1. ספיחת מסה יכולה להיות מזוהה באופן ישיר על ידי מעקב משמרות התדירות מתייחסת למשוואת Sauerbrey (1 משוואה).
- לאחר שסיים את האינטראקציה המתכת והמתכת NP, לשטוף את השכבה עם חיץ חופשי מתכת / NP להסיר מתכות חלשות כבול או חלשות מצורפים או חלקיקים.
הערה: איור של ההתקנה הניסיונית מוצג באיור 2.

איור 2. סכמטי עיצוב של התקנת QCM-D באמצעות זרימת מודול QFM 401 * 66. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- נתונים הקלטה והערכה:
- רשום את המשמרות בתדירות בהרץ (n Δf) ופיזור (ΔD n) בתוך ניסויי QCM-D באמצעות QCM-D תוכנה ספציפית.
- להשתמש להערכת הרגישות ההמונית adsorbed המשוואה / מודל Sauerbrey (Δm) (1 משוואה) 65 66 שתקפות לסרטים דקים ונוקשה בשילוב ללא חיכוך על פני השטח החיישן להחיל n ה נימה. C הטווח (קבוע Sauerbrey) לMHz 5 בשימוש בחיישן קוורץ חתך הוא 17.7 ng ∙ הרץ -1 ∙ סנטימטר -2 68. לנוקשה, מופץ באופן שווה, ושכבות adsorbed דקות מספיק להשתמש 1 משוואה כקירוב טוב.
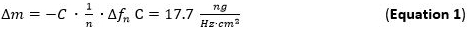
- בצע דוגמנות נוספת על פי מודל קלווין-Voigt תקף למולקולות viscoelastic 68-71 עם התוכנה ספציפית היצרן ולהשוות את התוצאות עם זה של מודל Sauerbrey.
- לחישוב עובי השכבה ושימוש ספיחת מסהכפרמטר חשוב דוגמנות צפיפות שכבה של שכבת adsorbed של 1.35 גר '∙ סנטימטר -3 מתאים לערכים שתוארו קודם לכן לחלבונים S-שכבת 72-75. השתמש באותו הערך לחישוב האינטראקציה מתכת עם השכבה חלבוניים.
7. מדידות AFM
- לבצע מחקרים עם מסוגל באופן מלא AFM על מיקרוסקופ אופטי הפוך.
- תמונות רשומות AFM בנוזל באמצעות חיץ recrystallization או המים ultrapure ישירות על חיישני QCM-D המצופה.
- יש לשטוף את החיישנים במי ultrapure לאחר ניסויי QCM-D ולמקם אותם בתוך תא נוזל AFM. לכן, שימוש בתא נוזל סגור בהיקף כולל של כ 1.5 מיליליטר. לשמור על הטמפרטורה של נוזל תא הקבוע על 30 מעלות צלזיוס.
- השתמש בשלוחה עם תדר תהודה של ≈ 25 קילוהרץ במים ונוקשות של <0.1 N / m. התאם את מהירות הסריקה בין 2.5 ו -10 מיקרומטר / sec.
- קח תמונות במצב מגע דינמי ואילו שלוחה מתלהבת מpiezo בתדר התהודה שלו. לקבוע את המרחק של שלוחה אל פני השטח על ידי תנודת דעיכת 76.
הערה: תמונות גובה מוצגות עם z בקנה מידה תוך Z-ערכים מייצגים את הטופוגרפיה של פני השטח המדויקת. משרעת תמונות (פסאודו 3D) מוצגות ללא z בקנה המידה כי Z-ערכי המשרעת תלויות בפרמטרי סריקה ונושאות מידע מוגבל. ניתוח של תמונות נעשה באמצעות שלוש תוכנת הערכה שונה של 77.
Access restricted. Please log in or start a trial to view this content.
תוצאות
טיפוח של מיקרואורגניזמים וSlp1 אפיון
הנתונים שנרשמו צמיחת חיידקים מציין את סוף שלב הצמיחה המעריכית בסביבות 5 שעות. חקירות קודמות הראו כי Slp1 יכול להיות מבודדת מנקודה זו של קציר (4.36 גר ...
Access restricted. Please log in or start a trial to view this content.
Discussion
בעבודה זו בחנה את הכריכה של Au לחלבוני S-שכבה נחקרה באמצעות שילוב של שיטות אנליטיות שונות. בפרט, מחייב Au הוא אטרקטיבי מאוד לא רק להתאוששות של Au ממי כרייה או פתרונות תהליך, אלא גם לבנייה של חומרים, למשל, משטחים חושיים. ללימודים של האינטראקציה Au (Au (III) וAu (0) -NPs) עם מושעה ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
העבודה הנוכחית מומנה בחלקה על ידי IGF-הפרויקט "S-המסננת" (490 ZBG / 1) ממומן על ידי BMWi וBMBF-פרויקט "Aptasens" (BMBF / DLR 01RB0805A). תודה מיוחדת לטוביאס ג 'גינטר לעזרה הרבה ערכו במהלך לימודי AFM ואריק V. ג'ונסטון לקריאת כתב היד כדובר אנגלית כשפה אם. יתר על כן, מחברו של מאמר זה מבקש להודות לאלין ריטר וסברינה Gurlit (ממכון לאקולוגית משאבים לסיוע במדידות ICP-MS), מניה פוגל, ננסי אונגר, קארן E. Viacava וביוטכנולוגיה הקבוצה של הלמהולץ-המכון פרייברג למשאבים וטכנולוגיה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000 - 6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein = 90 %, = 40,000 units/mg protein (Sigma) |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50 - 100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50,000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
References
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. Atimtay, T. A., Sikdar, S. K. , Springer. 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B. Environmental Microbe-Metal Interactions. Lovely, D. R. , ASM Press. Washington. 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , Forschungszentrum Rossendorf. Dresden. (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , Technische Universität Dresden. (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, Rice University . Houston. 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. Gold : science and applications. , CRC Press - Taylor&Francis Group. (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, Dr Dietrich Steinkopff Verlag. (1992).
- Günther, T. J. S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , Technische Universität Dresden. (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. Methods for general and molecular bacteriology. , American Society for Microbiology. 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C. [6] Quantitation of protein. Methods in Enzymology. Deutscher, M. P. 182, Academic Press. 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. ICP Mass Spectrometry - The 30-Min to ICP-MS. , PerkinElmer. USA. (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. Colloidal Gold - Principles, Methods and Applications. , Academic Press. (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E. Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. Buffle, J., van Leeuwen, H. P. 2, Lewis Publishers. 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705(2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , Technische Universität Dresden. (2003).
- Jennings, T., Strouse, G. Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , Springer. 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved