JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Slp1 중합체 및 단층의 AU-상호 작용
요약
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
초록
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
서문
전자 인해, 촉매, 바이오 센서, 또는 의료 기기 등 여러 가지 응용 프로그램에 대한 금의 사용 증가로,이 귀금속의 수요는 최근 몇 년 6-9 시간 동안 성장했다. 무거운 또는 귀금속에 의해 대부분의 환경 오염에 대한 진행 과정이지만 골드뿐만 아니라 많은 다른 귀금속과 중금속, 광업 활동을 통해, 묽은 농도의 산업 폐수를 통해 환경으로 배출, 폐기물 처리 7,8,10된다 주로 과학 기술 활동에 의해 발생. 이는 자연 생태계의 중요한 간섭에 이르게 잠재적으로 인간의 건강 (9)을 위협 할 수 있습니다. 이러한 부정적인 결과를 아는 것은 새로운 기술은 산업 폐수에서 금속을 재활용 오염 된 생태계와 개선에서 금속을 제거하는 대한 검색을 촉진합니다. 침전 또는 이온 교환 등의 노포 물리 화학적 방법은 특히 높은에서, 그렇게 효과적이지 않다LY 솔루션 7,8,11 희석. Biosorption는 하나의 생활 또는 죽은 바이오 매스로, 폐수 처리 (10, 12)에 대한 매력적인 대안이다. 생물학적 물질의 사용은 독성 화학 물질의 소비를 줄일 수있다. 많은 미생물이 축적 또는 금속을 고정화 기술되었다. 예를 들어, Lysinibacillus 스패 리 쿠스의 셀 (L. 스패) JG-A12은 귀금속, 높은 결합능을 도시 한 예를 들면, 팔라듐 (II), 백금 (II), 금 (III), 및 납과 같은 다른 독성 금속 (II) 또는 U (VI) 4,13, CR (VI) 14 바실러스 메가 테 리움의 세포), 금 (Au에 대한 백금 (II) 및 Pd (II) (15), 그리고 클로렐라 저속한위한 사카로 마이 세스 세레 비지에의 세포 (III)과 U (VI) (16) 17. 금과 같은 금속의 결합 이전 (III), (II)도 Desulfovibrio보고 된 팔라듐 (II), 및 Pt는 18 L.를위한 desulfuricans 스패 리 쿠스 JG-B53 (19, 20). 그럼에도 불구하고,하지 등L 미생물은 금속의 높은 금액을 결합하여 흡착 물질로서의 응용이 제한 12,21입니다. 또한, 용량을 결합 금속은 예를 들어, 다른 매개 변수, 세포 구성, 사용 된 바이오 구성 요소, 또는 환경 및 실험 조건 (PH, 이온 강도, 온도 등)에 따라 달라집니다. 고립 된 세포 벽 조각 (22, 23)의 연구는 막 지질, 펩티도 글리, 단백질, 또는 다른 구성 요소와 같이 복잡한 구성 전체 세포 8,21의 프로세스를 결합 금속을 이해하는 데 도움이됩니다.
이 연구에 초점을 맞추고 세포 구성 요소는 S-층 단백질이다. S-층 단백질은 많은 박테리아 및 고세균의 외부 세포 외피의 일부이며, 이들은 약 15 구성 - 이들 유기체의 총 단백질 질량의 20 %. 환경에 대한 제 1 인터페이스로서, 이러한 화합물은 세포 강하게 세균성 흡착 특성 (3)에 영향을 미친다. 분자량이 마흔에 이르기까지와 S-층 단백질kDa의 수백 개의 셀 내에서 발생되지만, 외부의 조립에 그들은 지질 또는 폴리머 막 세포벽 성분에 층을 형성 할 수있게한다. 고립되면, 거의 모든 S 계층 단백질이 자발적으로 인터페이스에서, 또는 평면 또는 튜브와 같은 구조 (3)을 형성하는 표면에, 정지에 자기 조립 고유 속성이 있습니다. 단백질 단일 층의 두께는, 세균에 따라, 5의 범위 내에 - 25 내지 24. 일반적으로, S-층 형성 단백질 구조는 35 내지 3,24에 경사 (P1 또는 P2), 정사각형 (P4), 또는 육방 정 (P3 또는 P6) 2.5의 격자 상수와 대칭을 가질 수있다. 격자 형성은 이가 양이온에 의존하고, 주로 칼슘 25, 26, 라프, J. 등의 많은 경우에 보인다. S-층 단백질을 기반으로 설계된 나노 구조의 산업용 애플리케이션에 기반 나노 복합체. (EDS Tijana (Z) 그 로브 및 Aitziber L. Cortajarena) (스프링, 2016 (제출)). 그럼에도 불구하고, 특히 칼슘 및 마그네슘 2+와 같은 이가 양이온 단량체 폴딩, 단량체 단량체의 상호 작용, 격자의 형성, 및 다른 금속의 역할의 전체 반응 캐스케이드는 아직 완전히 이해되지 않는다.
그람 양성 균주 L. 27 (새로운 계통 분류 후 바실러스 스패 리 쿠스에서 이름) 스패 리 쿠스 JG-B53는 우라늄 광산 폐기물 더미 "Haberland"(Johanngeorgenstadt, 작센, 독일) 4,28,29에서 분리 하였다. 기능적 S 층 단백질 (Slp1)가 정사각형 격자 116 30 kDa의 분자량, 및 박테리아 세포를 살아있는 31 ≈에 10 nm의 두께를 갖는다. 이전 연구에서, 약 10 nm의 두께를 가진 닫힌 안정된 단백질 층의 형성은 시험 관내에서 10 미만 19 분에서 달성되었다. 관련 균주 L. 스패 리 쿠스 JG-A12은, 또한 "Haberland"더미로부터 분리가 높은 금속 결합 능력을 보유하고 그 격리 S 층 단백질은 금과 같은 귀금속에 대한 높은 화학적, 기계적 안정성 및 우수한 수착 속도를 보여 주었다 (III), 백금 (II), 및 Pd (II) 4,32,33를. 귀금속의 결합이 어느 정도 특정 금속의 일부이고, 중합체의 외측 및 내측 표면에 단백질 및 기공의 관능기, 이온 강도의 가용성 및 pH 값에 의존한다. , OH-, PO 4 - -, SO 4 -, 및 SO-단백질에 의해 금속의 상호 작용을위한 관련 기능 그룹은 COOH-, NH 2이다. 원칙적으로, 금속 결합 용량은 응용 프로그램, 라프, 제이 등의 다양한 스펙트럼을 엽니 다. S-층 단백질을 기반으로 설계된 나노 구조의 산업용 애플리케이션에 기반 나노 복합체. (EDS Tijana (Z) 그 로브 및 Aitziber L. Cortajarena) (스프링 2016 (제출)). 예를 들어, 같은 제거 또는 복구를위한 biosorptive 구성 요소용해 독성 또는 유가 금속의 합성 또는 정기적으로 구조화 된 금속 나노 입자 NPS () 촉매를 들어, 바이오 감각 층 3,5,18,33 같은 다른 생물 공학 물질의 정의 증착을위한 템플릿. 금 등을 규칙적으로 배열 NP 어레이 (0) -NPs는 CO 산화 34-37위한 분자 전자 및 바이오 센서, 초 고밀도 저장 장치 등이 있으며, 촉매에서부터 주요 애플리케이션에 사용될 수있다. 이러한 응용 프로그램 및 이들 재료의 세련된 디자인의 개발은 기본 금속 바인딩 메커니즘의 깊은 이해를 필요로한다.
이러한 바이오 기초 물질의 개발을위한 전제 조건은 상기 생체 분자와 기술 (38, 39) 표면 사이의 계면 층의 신뢰성 구현이다. 예를 들어, 고분자 전해질 층은 S-39 단백질의 재결정 계면 층으로 사용 된 층별 (LBL) 기술 40,41 조립 SUP. 이러한 인터페이스는 재현성 및 정량 방법으로 단백질 코팅을 수행하는 비교적 쉬운 방법을 제공한다. 접착 촉진제와 함께 수정없이 상이한 실험을 수행함으로써, 코팅 동력학, 층의 안정성 및 생 분자 19,42, 라프, J. 등의 금속과의 상호 작용에 관한 설명은 할 수있다. S-층 단백질을 기반으로 설계된 나노 구조의 산업용 애플리케이션에 기반 나노 복합체. (EDS Tijana (Z) 그 로브 및 Aitziber L. Cortajarena) (스프링 2016 (제출)). 그러나, 단백질 흡착 단백질과 표면의 복잡한 상호 작용 메커니즘은 완전히 이해되지 않는다. 특히, 형태, 패턴 방향 및 코팅 밀도에 대한 정보는 아직 행방 불명입니다.
분산 모니터링 (QCM-D) 기술로 수정 진동자 마이크로 밸런스는 단백질 흡착, 코팅 동력학 연구를위한 도구와 상호 작용 친로서 최근 주목 받고있다나노 미터 크기 19,43-45에 세 스. 이 기술은 실시간 질량 흡착 상세한 검출을 허용하고, 단백질에 격자 19,20,42,46-48 단백질 자기 조립 공정 및 기능성 분자의 결합을위한 지표로 사용될 수있다. 또한, QCM-D 측정은 천연 생물학적 조건 하에서 단백질 성 금속 층 상호 작용 과정을 연구 할 수있는 가능성을 연다. 최근의 한 연구에있어서, Eu와 같은 선택된 금속과 S 층 단백질의 상호 작용 (III), 금 (III), 팔라듐 (II), 및 Pt가 (II) QCM-D (19, 20)과 함께 연구되어왔다. 흡착 된 단백질 층은 그람 양성 박테리아의 세포벽의 단순화 된 모델이 될 수있다. 이 단일 성분의 연구는 금속의 상호 작용에 대한 깊은 이해에 기여할 수있다. 그러나 전적으로 QCM-D 실험은 표면 구조와 단백질에 금속의 영향에 관한 진술을 허용하지 않습니다. 다른 기술들이 이러한 정보를 얻기 위해 필요하다. 하나의 POS구조적 특성에 촬상을위한 바이오 나노 대한 접근성 및 취득 정보는 원자력 현미경 (AFM)이다.
제시된 연구의 목적은 L.의 특정 Slp1에서 ((0) -NPs을 금 (III) 및 금) S-층 단백질에 금의 흡착을 조사했다 스패 리 쿠스 JG-B53. ICP-MS를 사용하여 5.0 QCM-D를 사용하여 고정화 S-레이어 - 실험은 2.0의 pH 범위에서 배치 규모에 현탁 단백질로 이루어졌다. 또한, 격자의 안정성에 금속염 용액의 영향이 후속 AFM 연구하여 조사 하였다. 이러한 기술들의 조합은 특정 금속 친화 관한 전체 박테리아 세포에 대한 이벤트를 바인딩에 대해 더 학습하기위한 도구로서 시험관 금속 상호 작용 과정의 이해에 기여한다. 이 기술뿐만 아니라 환경 보호를위한 금속의 회수를위한 적용 가능한 필터 재료의 개발 및 재의 보존을위한 중요(49)뿐만 아니라, 다양한 애플리케이션을위한 고도의 기술 순서 금속 NP에 어레이의 개발을위한 소스.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 미생물과 배양 조건
참고 :. 모든 실험은 무균 상태에서 시행 하였다 L. 스패 리 쿠스 JG-B53은 냉동 보존 된 문화 (29, 30)로부터 얻은 것입니다.
- 전송 300 ml의 멸균 영양 국물 (NB) 미디어 (3 G / L 고기 추출물, 5g / L 펩톤, 10g / L의 NaCl)에 클린 벤치에서 문화 (1.5 ml)에 냉동 보존. 이후 재배 예비 배양을 얻었다 30 ℃에서 최소한 6 시간 동안 용액을 교반 하였다.
- 70 L에서, pH는 7.0에서 30 ° C를주의 미디어에서 호기성 조건에서 박테리아를 배양 증기 제자리 생물 반응기를 조정. 따라서 ≈ 57 L의 탈 이온수로 반응기를 채우기. 생물 반응기에서 직접 고체 NB 미디어를 추가하고 용해 (농도는 위 참조).
- 또한 재배하는 동안 거품 형성을 억제하는 미디어에 소포제 (30 μL / L의 NB-미디어)를 추가 한 후 오토 클레이브 미디어 (122 ° C, 온도 시간 30 분 유지)반응기 내부 설비.
- 미디어를 냉각하고 완전한 산소 포화도를 수행합니다. (1 MH 2 SO 4, 2 M NaOH를 사용) 7.0으로 pH를 조정하고 300 ml의 사전 문화의 자동 접종을 시작합니다. 접종 시점에서 배양 파라미터의 데이터 기록을 시작한다. 재배 내에서 예를 들어 온라인 매개 변수, 용존 산소 수준 (2 할), 산 및 염기 또한, pH를-값의 로그를 취합니다.
- 비 침습적 탁도 측정에 의해 온라인으로 세균의 성장을 모니터링합니다.
- 재배의 모든 시간 후 추가 샘플링을 수행하고 바이오 건조 중량 (BDW)과 오프라인 광학 밀도 (OD)로 추가 매개 변수를 결정합니다. 따라서, 멸균 조건 하에서 각각의 샘플링 지점에서 20 ml의 배양 배지를 수집합니다.
- 600 nm에서 흡착의 광도 측정하여 오프라인 외경을 결정합니다. 빈 값으로 멸균 여과 NB-매체를 사용합니다. 선미어 흡착> 0.4 희석에게 램버트 - 맥주 법률의 선형성 다음 세포 현탁액에 도달.
- 박테리아 현탁액을 5 ml에 BDW 원심 분리기 (1)의 결정을 위해 RT에서 5 분 동안 5,000 XG에 (셀 밀도에 따라). 오븐 최대 질량 안정성 가열에 105 ° C에서 얻어진 세포 펠렛을 건조 및 펠릿의 질량을 측정한다.
- 박테리아 성장의 확인 및 교차 오염 제어와 같은 400, 1000 배 확대 (각각 위상차 콘덴서 2, 3)에 광학 상 대비 연구 현미경 현미경 이미지를 가져 가라.
- 온라인 검출 지수 성장기에 도달 한 후 2 온라인 탁도를 수행 15,000 XG, 4 ° C에서 관류 원심 매스 수확 및 표준 완충액 (50mM 트리스 회 매스 씻어 된 10 mM의 MgCl 2, 3 mM의 NaN의 3, pH는 7.5).
참고 : 얻어진 바이오 매스 펠릿 -18 & # 저장할 수 있습니다(176), 절연을위한 추가 사용까지 C.
2. S-층 단백질 분리 및 정제
주 : 앞서 2,19,30,32,50,51 바와 같이 구성된 방법에 따라 Slp1 중합체를 정제.
- 표준 완충액에서 배양으로부터 얻어진 세정 해동 조 매스 균질화 (1 : 1 (W / V))로 4 ℃에서 냉각 빙욕 하에서 분산기 (레벨 3, 10 분)를 이용하여 편모를 제거한다.
- 현탁액 (8000 XG, 20 분 동안 39 ° C)를 원심 분리하고 표준 완충액으로 두번 세척 얻어진 펠렛 (1 : 1 (W / V)). 세정, 원심 분리 (8,000 XG, 20 분, 4 ℃) 한 후, 기준 버퍼에 펠렛을 재현 탁 (1 : 1 (W / V)), 현탁액의 DNase II 및 된 RNase (0.4 단위 / g 바이오 매스)를 첨가하고, 붕해 고압 균질 1,000 바 세포. 그 후 27,500 XG, 1 시간 동안 4 ℃에서 현탁액을 원심 분리기.
주 : 연구 MI와 컨트롤 세포 현탁액을croscope. 3 그대로 세포를 400 배 배율의 현미경의 시야에서 볼 수 있습니다 - 이하 2 때 파열이 완료됩니다. - 표준 완충액으로 두 번 씻어 펠렛 (1 : 1 (W / V))로 다시 원심 분리를 수행한다. 이후 표준 버퍼에 펠렛을 재현 탁 (2 : 1 (W / V))로, 1 % 트리톤 X-100을 혼합하고, 지질 침착을 가용화 연속 진탕 (100 RPM) 하에서 20 분 정도 배양한다.
- 용액을 원심 분리기 (27,500 XG, 1 시간 동안 39 ° C) 및 표준 완충액으로 얻어진 펠릿 세 번 세척 (1 : 1 (W / V)).
- 표준 완충액에서 6 시간 동안 추가로 원심 분리 (27,500 XG, 1 시간 동안 4 ℃) 후의 펠릿을 인큐베이션 (1 : 1 (W / V)) 펩티도 50의 결합을 가수 분해하기 위해, 0.2 g / L의 리소자임, 혼합. 또한 서스펜션의 DNase II와의 RNase (각 0.4 단위 / g의 바이오 매스)를 추가합니다.
- 원심 분리 (45,500 XG, 4 ℃, 1 시간) 후 T의 낮은 볼륨으로 상부 흰색 단백질 상을 재현 탁그는 원심 상청 (<30 mL)에 함유 된 단백질 서브 유닛.
- 6 M 구아니딘 히드로 클로라이드 (6 M GuHCl, 50mM 트리스, pH는 7.2)으로 1 : 1 혼합하여 백색 현탁액을 용해. 용액을 밝게된다.
- 추가적인 고속 원심 분리 (45,500 XG, 1 시간 동안 39 ° C) 뒤에 GuHCl 처리 용액의 멸균 여과 (0.2 μm의)을 수행한다.
- 투석막 튜브에 상청 (MWCO 50,000 달톤)를 전송하고 48 시간 동안 재결정 완충액 (15 mM 트리스, 10 mM의 CaCl2를, pH는 8.0)에 대하여 투석을.
- 45,500 XG, 1 시간 동안 4 ℃에서 원심 분리 튜브로 백색 재결정 단백질 중합체 용액을 전송. 초순수 (<30 ㎖)의 낮은 체적 펠렛을 재현 탁.
- 그 후, 투석막 튜브에 서스펜션을 전송하고 버퍼의 컨텐츠를 제거하기 위해 24 시간 동안 초순수에 대한 투석을 수행합니다.
주 : 버퍼 또는 초순수 D의 여러 가지 변화를uring 투석은 필수적이다. - 동결 건조기에서 동결 건조를 정제 Slp1.
실험에 Slp1 3. 특성 및 정량
참고 : 흡착 및 코팅 실험 Slp1 농도는 UV-VIS 분광 광도계로 정량 하였다.
- 직접 광도계의 낮은 측정 받침대 위에 용해 Slp1 샘플의 피펫 2 μL. 단백질 특성, 280 nm의 파장에서 흡착 최대 단백질 농도를 결정합니다. Slp1 농도를 결정하기 위해 0.61의 흡광 계수를 사용한다. 참조 측정을위한 Slp1 무료 솔루션을 사용합니다.
- 실험 (1g / L과 0.2 G / L에 대한 원하는 농도 (0.9 % 염화나트륨을 사용하여 배치 모드에서 흡착 실험, pH는 6.0 및 QCM-D 실험이 재결정 버퍼를 사용하기 위해, pH는 8.0) 버퍼와 단백질을 희석 각기).
- 표준 bioanal 의해 Slp1 품질 및 분자량을 분석램리, UK (52)에 의해 기술 된 방법 ytical 나트륨 도데 실 설페이트 폴리 아크릴 아미드 전기 영동 (SDS-PAGE).
- 금 (0) -NP 배양 10 % 폴리 아크릴 아미드 분리 젤을 사용한 후, 실험 예에서 Slp1를 사용하기 전에 SDS-PAGE를 수행합니다.
- SDS-샘플 믹스 샘플 버퍼와 재배 또는 단백질 시료의 ≈10 μL에서 (1.97 g의 트리스, 블루 5 mg을 브로 모 페놀, 5.8 ml의 글리세린, 1g의 SDS, 2.5 ml의 β-머 캅토 에탄올, 50 ㎖에 초순수로 입력) 겔 주머니 95 ℃에서 4 분간 배양 후 1 (v / v)의 혼합물을 피펫 : 1의 비율.
- 샘플까지 60 V의 전압에서 실행 SDS-PAGE 30 분은 한 번 분리 겔을 통과하는 120 V로 수집 젤 변화 전압을 전달합니다.
- 겔 시스템으로부터 겔을 제거하는 고정 용액 (10 % 산성 산, 무수 에탄올 50 %)로 1 시간 초순수 및 장소 헹군다. 그 후, 초순수로 린스 젤.
- 얼룩 젤적응 불특정 콜로이드 쿠마 화려한 푸른 방법 (53, 54)를 사용하여. (72, 73)를 탈색 한 후, 제조 업체의 프로토콜에 따라 겔 문서 시스템에 의해 SDS-PAGE 이미지를 가져 가라.
배치 모드 및 금속 정량화 4. 흡착 실험
- 일괄 수착 실험 HAuCl 4에서의 Au (III) 원액 ∙ 3 H 2 O를 준비 금속염을 희석 및 1g / L의 1 mm의 초기 금속 농도와 최종 Slp1 농도 Slp1 / NaCl 용액과 섞어 . Slp1없이 추가 음성 대조군과 세 쌍둥이의 실험을 수행합니다. 흡착 실험을 5 ml의 총 부피를 사용합니다.
- 24 시간 (저 농축 염산과 수산화 나트륨 용액으로 pH를 조정)에 대한 2.0-5.0 사이의 서로 다른 사전 조정 된 pH 값에 실온에서 지속적으로 서스펜션을 흔들어.
- 흡착 후, 15,000 XG, 20 분 동안 4 ℃) separ하기에 원심 분리상층 액에서 Slp1을 먹었다.
- 용해 단백질 단량체를 제거하는 20 분 동안 15,000 XG에서 4 ℃를 한외 여과 튜브에 뜨는 (MWCO 50,000 다) 원심 분리기이를 전송합니다.
- ICP-MS (19, 20)에 의하여 얻어진 여과 액 중의 금속 농도를 결정하고 Slp1 건조 질량으로 흡착 된 금속 백 계산 결과를 사용한다. 원칙을 측정, 방법 및 사용 된 ICP-MS의 구성 요소의 기회 문학 55에 설명했다.
- 내부 표준 (1 ㎎ / ㎖)와 같은 매트릭스와 로듐으로 1 % HNO 3를 사용하여 ICP-MS 측정을위한 샘플 및 참조를 준비합니다.
5. AU-NP의 합성 및 입자 크기의 결정
주 : 구연산염은 금 (0)가 -NP Mühlpfordt, H. 등에 의해 전술 적응 방법에 따라 합성 하였다 안정화. (1982)의 직경을 갖는 구형 입자를 얻었다 10-15 나노 56,57 .
- NP 형성에 안정화 된 25 mM의 HAuCl 4 ∙ 3 H 2 O 주식을 준비합니다.
- 19.75 mL의 초순수에이 원액 250 ㎕의 희석 연속 진탕을 15 분 동안 61 ° C에서 배양 한이.
- 제 스톡 용액 5 ㎖ (12 mM의 탄닌산, 7 mM 시트르산 나트륨 디 하이드레이트, 3 0.05 mM의 K 2 CO)를 준비하고, 15 분 동안 61 ° C에서 별도로 2 차 용액을 배양.
- 상수는 솔루션 하나에 2 차 원액을 교반 추가합니다. 61 ℃에서 적어도 10 분 동안 반응 혼합물을 교반한다. 그 후 용액을 냉각 및 QCM-D 실험 내에서 Slp1 격자에 순이익 코팅을 위해 사용합니다.
주 : 얻어진 금 (0) -NP 전형적 (0) 58 -NPs 형성된 Au로 검출에 사용은 520nm의 흡광도 최대 UV-VIS 분광 특성화 하였다. 용액을 4 ℃에서 저장 될 수있다. - 형성의 크기를 분석또한 동적 광산란으로 알려진 광자 상관 분광법 (PCS)에 의한 AU (0) -NP.
- NP 크기의 결정을 위해, 층류 상자에 먼지가없는 상태에서 큐벳으로 합성 금 (0) -NP 용액 1.5 mL로 전송하고 크기 및 제타 전위 입자 크기 측정기로 분석한다. PCS 및 샘플 제조의 상세한 설명은 Schurtenberger, P. 등으로 주어진다. (1993) 59, 자이나교, R. 등. (2015) 60.
6. QCM-D 실험 - Slp1 격자 상 표면에 Slp1 코팅 및 AU-NP 흡착
주 : 측정은 최대 네 개의 흐름 모듈 장착 QCM-D와 함께 수행 하였다. 모든 QCM-D 실험은 25 ℃에서 125 μL / 분의 일정한 유속으로 수행 하였다. Slp1 코팅 및 금속 / NP 배양은 ≈ 5 MHz의 기본 주파수와 SiO2를 압전 AT 컷 석영 센서 (Ø 14mm)에서 수행 하였다. 단계를 세척 및 추가솔루션의 ition는 대표적인 결과 부분의 그림에 표시됩니다. QCM-D 실험 단계 방법에 의해 단계는 Slp1의 재결정에 의해 나중에 금속 및 금속 순이익의 상호 작용에 따라 사용되는 센서의 세정 및 표면 개질로 시작이라고 할 수있다.
- 절차 청소 :
- 센서 인형과 유체 세포를 착용. 펌프 적어도 20 ㎖를 통해 QCM-D와 튜브 시스템 (초순수 (v / v)의 2 %의 세제) 알칼리성 액체 세정제의 (모듈 당 각). 이후 시스템을 통해 초순수의 다섯 겹 볼륨을 (각 모듈 당) 펌프 (300 μL / 분 속도를 흐름). 제조 업체의 프로토콜에 따라 청소를 수행합니다.
- 2 % SDS 용액에서 배양 (20 분 이상)로 유동 모듈 외부의 SiO2 센서를 청소하고 초순수로 61, 62 이후 여러 번 씻어 센서.
- 필터링 빌려와 결정을 건조공기를 ressed 20 분 63, 64에 대한 오존 세척 실에 배치합니다.
- 모든 유기 내용을 제거 두 번 청소 절차를 반복합니다.
- 센서 표면에서 결합 된 금속을 제거하려면 1 M HNO 3 센서를 씻어. 그 후, 초순수 모든 헹굼 단계를 수행합니다.
- 고분자 전해질에 의해 센서 표면 개질 :
표면 개질 중 내부 수행 할 수 있습니다 (절차를 통과) 또는 흐름 모듈 외부 (LBL 기술) 참고. 이들 실험에서 표면을 수정하기 위해 다음 방법을 사용 하였다.- 3g하여 문서의 특별한 사용 시스템에 대해 이전에 설명 LBL 기술 40, 41를 사용하여 딥 코팅을 통해 폴리에틸렌 이민 (PEI, MW 25,000)와 폴리스티렌 설 폰산 (PSS, MW 70,000)의 교류 PE 층 / L로 센서를 수정 SUHR, M. 등. (2014) 19.
- 깊은 W에서 해당 PE-솔루션 내부에 센서를 배치ELL 접시와 실온에서 10 분 동안이 품어.
- PE-용액으로부터 센서를 가지고 초순수로 집중적마다 딥 코팅 공정 사이에 센서를 헹군다.
주 : 새로운 표면 개질은 양전하 PEI 갖는 적어도 세 개의 PE 층 종단 이루어져있다. - 이 수정 후 외부 유동 모듈 내부 센서를 배치하고 실험을 시작하기 전에 초순수 린스 센서 평형.
- Slp1 단일 플라이 재결정 :
- 단량체로 폴리머를 변환 4 M 요소에 Slp1을 녹인다.
- monomerized 단백질 15,000 XG, 1 시간 동안 4 ℃에서 원심 분리기는 더 큰 단백질 덩어리를 제거합니다.
- 0.2 g / L의 최종 단백질 농도로 재결정 완충액으로 용해 및 원심 Slp1 상등액을 혼합한다.
주 : Slp1 (자기 조립)의 재결정을 따라 칼슘의 첨가에 의해 촬영 시작rystallization 버퍼입니다. 따라서, 즉시 (플로우 모듈 내부에 배치) 센서 125 μL / 분의 유속으로 혼합 용액 펌프. 재결정은 QCM-D 실험 내에서 검출 된 주파수와 소비 변화의 안정된 값 후에 완료됩니다. - 플로우 모듈 내부 PE 변성 센서 위에 성공적 단백질 재결정 후의 주파수 및 분산 시프트 안정 값까지 125 μL / 분의 유속으로 waterintensively 재결정 버퍼 또는 초순수와 피복 센서 린스 것이 발견되었다.
참고 : Slp1 단층과 AFM 연구 상 이상 흡착 실험 PE와 SiO2를 표면 개질는 그림 1에서 보여집니다.

그림 1. 도식 디자인 PE의 표면 개질과 Slp1 단층코팅; 이 수치는 SUHR, M. 등에서 수정되었습니다. 스프링의 허가 (2015) 19. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 금속 및 금속 순이익 상호 작용 :
주 : 금 금속 염 용액이 수착 (HAuCl 4 ∙ 3 H 2 O)을 1 mm 이하 0.9 %의 NaCl 용액에서 pH에서 5 mM의 농도 = 6.0에서 수행 하였다. AU-NP 흡착은 pH가 ≈ 5.0에서 1.6 mM의 트라이 - 나트륨 구연산 버퍼에 희석 AU-NP에 함께 이루어졌다.- 주파수 및 분산 안정 시프트 값이 검출 될 때까지 유동 모듈 성공적인 Slp1 코팅 한 후, 0.9 % NaCl 용액으로 집중적 수득 Slp1 층을 헹군다.
- 125 μL / 분의 유속으로 유동 모듈 제조 된 금속 용액 (1 mM)을하고 NP 용액을 펌프 및 질량 SL에 흡착 추적P1 층. 질량 흡착 사우어 브레이 방정식 참조 주파수 천이 (수학 식 1)을 추적하여 직접 검출 할 수있다.
- 금속 및 금속 순이익 상호 작용을 완료 한 후, 약한 결합 또는 약한 부착 된 금속 또는 나노 입자를 제거하기 위해 금속 / NP 무료 버퍼 레이어를 씻어.
참고 : 실험 장치의 그림이 그림 2에 표시됩니다.

그림 2. * 66 (401) 흐름 모듈 QFM를 사용하여 QCM-D 설정의 도식 디자인. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 데이터 기록 및 평가 :
- 헤르츠 (Hz, Δf에 없음)과 소비 (ΔD N에서 주파수 변화를 기록한다) QCM-D는 특정 소프트웨어를 사용하여 QCM-D 실험 내에서.
- 배음 n 번째에 적용되는 센서 표면에 마찰없이 결합 얇고 단단한 필름 유효 흡착 질량 감도 (ΔM) 사우어 브레이 식 / 모델 (식 1) (65) (66)의 평가를 위해 사용합니다. 컷 수정 센서에서 사용되는 5 MHz의에 대한 용어 C (사우어 브레이 상수) 17.7 NG ∙ Hz에서 -1 ∙ CM -2 (68)이다. 강성 들어, 균일하게 분포하고, 충분히 얇은 흡착 층은 좋은 근사 식 1로 사용한다.
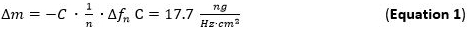
- 점탄성 분자 제조업체 특정 소프트웨어와 68-71 유효 켈빈 - 보이트 모델에 따라 추가 모델링을 수행하고 사우어 브레이 모델의 그것과 결과를 비교.
- 층 두께의 계산 및 물질의 흡착에 사용할중요한 모델링 파라미터로서 1.35의 흡착 층의 층 밀도 g ∙ cm -3 S 층 단백질 72-75 대한 전술 된 값에 대응. 단백질과 금속 층 상호 작용의 계산에 동일한 값을 사용한다.
7. AFM 측정
- 거꾸로 광학 현미경에 완벽하게 할 수있는 AFM과 함께 연구를 수행합니다.
- 직접 코팅 QCM-D 센서에 재결정 버퍼 또는 초순수를 사용하여 액체의 기록 AFM 이미지.
- QCM-D 실험 후 초순수로 센서를 씻어 AFM 유체 세포 내부에 배치합니다. 따라서, 약 1.5 ml의 총 부피로 유체 밀폐 셀을 사용한다. 30 ° C에서 유체 셀 상수의 온도를 유지한다.
- 물 ≈ 25 kHz의 공진 주파수와 <0.1 N / m의 강성을 가진 캔틸레버를 사용한다. 2.5 및 10 μm의 / 초 사이의 스캔 속도를 조정합니다. 동적 접촉 모드에서 이미지를 가져 가라. 76 댐핑 진동에 의해 표면에 캔틸레버의 거리를 결정한다.
주 : Z-값의 정확한 표면 토포 그래피를 나타내는 이미지를 동시에 높이가 Z 스케일로 도시된다. 진폭, Z 값은 스캔 매개 변수에 따라 제한된 정보를 부담하기 때문에 진폭 (의사 3D) 이미지는 Z-규모없이 표시됩니다. 이미지 분석은 세 가지 다른 평가 소프트웨어의 77를 사용하여 수행 하였다.
Access restricted. Please log in or start a trial to view this content.
결과
미생물과 Slp1 특성의 재배
박테리아의 성장의 기록 데이터는 약 5 시간의 지수 성장기의 끝을 나타낸다. 이전 조사는 Slp1 수확의이 점 (4.36 G / L 젖은 바이오 매스 (≈ 1.45 그램 / 리터 (BDW)) 최대 수율 (19)와 분리 될 수 있음을 보여 주었다. 그럼에도 불구하고, 정의 된 미디어 구성 요소 또는를 사용하여 재배...
Access restricted. Please log in or start a trial to view this content.
토론
이 연구에서 상이한 분석 방법의 조합을 이용하여 조사 하였다 S 층의 Au 단백질의 결합을 연구 하였다. 특히, 금의 결합은 광산 물 또는 공정 용액에서 금의 회복뿐만 아니라, 물질, 예를 들면, 감각 표면의 건설을위한뿐만 아니라 매우 매력적이다. 금 상호 작용의 연구를 위해 (금 (III) 및 금 (0) -NPs)에 현탁하고 Slp1의 단층을 재결정 화하여, 단백질이 가지고 격리된다. 따라서 본 연구는 그람...
Access restricted. Please log in or start a trial to view this content.
공개
저자가 공개하는 게 없다.
감사의 말
본 연구는 부분적으로 BMWi과 BMBF 프로젝트 "Aptasens"(BMBF / DLR 01RB0805A)에 의해 투자 IGF-프로젝트 "S-체"(490 ZBG / 1)에 의해 투자되었다. AFM 연구 중과 영어를 모국어 스피커로 원고를 읽는 에릭 V. 존스턴에 그의 귀중한 도움을 토비아스 J. 귄터 특별 감사. 또한, 본 논문의 저자 (ICP-MS 측정에 도움을 자원 생태 연구소)에서 알린 리터와 사브리나 Gurlit 감사드립니다, Manja 보겔, 낸시 엉거, 카렌 E. Viacava와 헬름홀츠 연구소의 그룹 생명 공학 자원 기술에 대한 프라이 부르크.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000 - 6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein = 90 %, = 40,000 units/mg protein (Sigma) |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50 - 100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50,000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
참고문헌
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. Atimtay, T. A., Sikdar, S. K. , Springer. 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B. Environmental Microbe-Metal Interactions. Lovely, D. R. , ASM Press. Washington. 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , Forschungszentrum Rossendorf. Dresden. (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , Technische Universität Dresden. (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, Rice University . Houston. 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. Gold : science and applications. , CRC Press - Taylor&Francis Group. (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, Dr Dietrich Steinkopff Verlag. (1992).
- Günther, T. J. S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , Technische Universität Dresden. (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. Methods for general and molecular bacteriology. , American Society for Microbiology. 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C. [6] Quantitation of protein. Methods in Enzymology. Deutscher, M. P. 182, Academic Press. 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. ICP Mass Spectrometry - The 30-Min to ICP-MS. , PerkinElmer. USA. (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. Colloidal Gold - Principles, Methods and Applications. , Academic Press. (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E. Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. Buffle, J., van Leeuwen, H. P. 2, Lewis Publishers. 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705(2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , Technische Universität Dresden. (2003).
- Jennings, T., Strouse, G. Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , Springer. 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유