Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Slp1 Polimerler ve Monolayer Au-etkileşimden
Bu Makalede
Özet
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
Özet
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
Giriş
Nedeniyle elektronik, katalizörler, biyosensörler, ya da tıbbi cihazlar gibi birçok uygulama için altın artan kullanımı, bu değerli metalin talebi son birkaç yıllık süre 6-9 üzerinde büyüdü. Ağır veya kıymetli madenlerin en çevresel kirlenme devam eden bir süreç olmasına rağmen Altın yanı sıra diğer birçok değerli ve ağır metaller, madencilik faaliyetleri ile, seyreltik konsantrasyonlarda endüstriyel atık yoluyla çevreye salınan ve atık 7,8,10 edilir özellikle teknolojik faaliyetlerinden kaynaklanan. Bu doğal ekosistemlerin önemli bir girişime yol açar ve potansiyel olarak insan sağlığı 9 tehdit edebilir. Bu olumsuz sonuçların bilinmesi yeni teknikler endüstriyel atık sulardan metallerin geri dönüşümü kontamine ekosistemler ve iyileştirmeler metallerin kaldırmak için arama teşvik etmektedir. Çökeltme veya iyon değişimi gibi köklü fiziko-kimyasal yöntemler, özellikle yüksek olarak, çok etkili değildirly çözümler 7,8,11 seyreltilmiştir. Biyosorpsiyon ya yaşayan ya da ölü biyokütle ile, atıksu arıtımı 10,12 cazip bir alternatif. Bu tür biyolojik malzemelerin kullanımı toksik kimyasalların tüketimini azaltabilirsiniz. Birçok mikroorganizmalar birikebilir ya da metalleri hareketsiz kılınması için tarif edilmiştir. Örneğin, Lysinibacillus spaericus'dan hücreleri (L. sphaericus) JG-A12 değerli metaller için yüksek bağlanma kapasiteleri göstermişlerdir, örneğin, Pd (II), Pt (II), Au (III), ve Pb gibi diğer toksik metaller (II) ya da U (VI) '4,13, Cr (VI) 14 Bacillus megaterium hücreleri, Au, Pt (II) ve Pd (II), 15 ve Chlorella vulgar için Saccharomyces cerevisiae hücreleri (III) ve U (VI)' ya 16 , 17. Au gibi önceki metallerin bağlanması (III), (II) Desulfovibrio rapor edilmiştir Pd (II), ve Pt 18 ve L. Desulfovibrio sphaericus JG-B53 19,20. Bununla birlikte, All mikroplar metallerin yüksek miktarda bağlama ve emmeyle malzeme olarak uygulama sınırlı 12,21 olduğunu. Ayrıca, bağlama kapasitesi, metal, örneğin, farklı parametreler, cep bileşimi olup, kullanılan biyo-bileşenli veya çevresel ve deneysel koşullar (pH, iyonik kuvvet, sıcaklık vs.) bağlıdır. Izole edilmiş hücre duvarı parçaları 22,23 arasında çalışması, membran lipidleri, peptidoglikan, proteinler veya diğer bileşenler gibi karmaşık yapılan bütün hücrelerin 8,21 süreçlerini bağlama metal anlamaya yardımcı olur.
Bu çalışmada odaklanmış hücre bileşenleri S katmanlı proteinlerdir. S-katmanlı proteinleri birçok bakteri ve arkelerin dış hücre zarfın parçaları vardır ve bunlar yaklaşık 15 oluşturmaktadır - bu organizmaların toplam protein kütlesinin% 20. Çevreye ilk arayüz olarak, bu hücre bileşikler güçlü bakteriyel emme özellikleri 3 etkilemektedir. Moleküler ağırlıklar kırk kadar S-tabaka proteinlerikDa'lık yüz hücre içinde üretilen, ancak dış tarafına monte edilmiş onlar lipid zarlar ya da polimerik hücre duvarı bileşenleri ile ilgili tabakaları oluşturmak mümkün olduğu. Izole sonra, hemen hemen tüm S katmanlı proteinleri kendiliğinden ara yüzlerde ya da düzlemsel ya da tüp benzeri yapılar 3 oluşturma yüzeyleri üzerine, süspansiyon içinde kendini düzenleyen içsel bir özelliği vardır. Protein tek tabaka kalınlığı bakteriler bağlıdır ve 5 aralığında olan - 25 nm 24. Genel olarak, oluşan S-katmanlı protein yapıları 35 nm 3,24 bir verev (p1 veya p2), kare (p4), ya da altıgen (p3 veya p6) 2.5 kafes sabitleri ile simetri olabilir. Kafes oluşumu, iki değerli katyonları bağlıdır ve esas olarak Ca2 + 25,26, Raff, J. ve diğerleri birçok durumda olduğu görülmektedir. S-katmanlı Protein temelli Engineered Nanoyapıların endüstriyel uygulamalar için esaslı nanokompozitler. (eds Tijana Z. Grove ve Aitziber L. Cortajarena) (Springer, 2016 (gönderilen)). Bununla birlikte, özellikle Ca2 + ve Mg2 + gibi divalent katyonlar monomer katlama, monomer etkileşimi, bir kafes oluşması ve farklı metaller rolünün tam tepkime zincirine, hala tam olarak anlaşılmamıştır.
Gram-pozitif suş L. 27 (yeni filogenetik sınıflandırmaya sonra Bacillus spaericus'dan yeniden adlandırılmış) sphaericus JG-B53 uranyum madenciliği atık yığını "Haberland" (Johanngeorgenstadt, Saksonya, Almanya) 4,28,29 izole edilmiştir. Fonksiyonel S katmanlı proteini (Slp1) kare kafes, 116 kDa'lık 30 kadar bir molekül ağırlığına, ve bakteri hücreleri 31 yaşamaya ≈ 10 nm'lik bir kalınlığa sahiptir. Daha önce yapılan çalışmalarda, yaklaşık 10 nm kalınlığında bir kapalı ve istikrarlı bir protein tabakasının in vitro oluşumunu en az 10 dakika 19 elde edildi. Ilgili suş L. sphaericus JG-A12, aynı zamanda "Haberland" yığın bir izolat, daha yüksek metal bağlanma kapasitesine sahip olan ve onun izole edilmiş bir S-tabaka proteini Au gibi değerli metaller için yüksek bir kimyasal ve mekanik kararlılık ve iyi emme oranları göstermiştir (III), Pt (II), ve Pd (II) 4,32,33. Değerli metallerin bağlantılarının çok veya daha az spesifik bir metal olduğu ve polimerin iç ve dış yüzeyi üzerinde, protein ve gözeneklerde fonksiyonel gruplar, iyonik kuvvet kullanılabilirliği ve pH değerine göre değişir. , OH-, PO 4 - - SO 4 - ve SO proteinler tarafından metal etkileşimi için, ilgili fonksiyonel gruplar COOH-, NH 2 bulunmaktadır. Prensip olarak, metal bağlanma kapasitesi uygulamalarda, Raff, J. ve diğerleri, geniş bir spektrum açın. S-katmanlı Protein temelli Engineered Nanoyapıların endüstriyel uygulamalar için esaslı nanokompozitler. (editörler Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (gönderilen)). Örneğin, olarak kaldırılması veya geri kazanımı için biosorptive bileşenlerçözünmüş toksik veya değerli metallerin, sentez veya düzenli yapılandırılmış metalik nanopartiküller (NPS) kataliz için, ve biyo-duyusal katmanlar 3,5,18,33 gibi diğer biyo-mühendislik malzemeleri tanımlı birikimi için şablonlar. Au gibi düzenli düzenlenmiş NP diziler (0) -NPs CO-oksidasyonu 34-37 moleküler elektronik ve biyosensörlere, ultrahigh yoğunluk depolama aygıtları ve katalizörler kadar önemli uygulamalar için kullanılabilir. Bu tür uygulamalar ve bu malzemelerin akıllı tasarım geliştirme altında yatan metal bağlama mekanizmaları daha derin bir anlayış gerektirmektedir.
Bu tür biyolojik bazlı malzemeler geliştirilmesi için bir ön koşuldur biyomolekül ve teknik yüzey 38,39 arasında bir ara-yüz tabakası güvenilir bir uygulamasıdır. Örneğin, polielektrolitler, S-tabaka proteinleri 39 arasında yeniden kristalizasyon için bir ara-yüz tabakası olarak kullanılmaktadır katman-katman (Lbl) tekniği 40,41 monte sup. Böyle bir arayüz, bir tekrar üretilebilir ve niceliksel bir şekilde protein bir kaplama yapılması için nispeten kolay bir yol sunar. Ve yapışkan promotörler ile değişiklik olmadan, farklı deneyler ile, kaplamanın kinetik, tabaka stabilitesini ve biyomoleküllerin 19,42, Raff, J. ve ark metallerin etkileşimi ile ilgili açıklama yapmak mümkündür. S-katmanlı Protein temelli Engineered Nanoyapıların endüstriyel uygulamalar için esaslı nanokompozitler. (editörler Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (gönderilen)). Bununla birlikte, protein adsorpsiyonu ve proteinsiz yüzey etkileşimi kompleks mekanizması tam olarak anlaşılmış değildir. Özellikle konformasyon, desen yönü ve kaplama yoğunlukları hakkında bilgi hala kayıp.
Dağıtma izlenmesi (QCM-D) tekniği ile Kuvars kristal mikroterazi bir protein adsorpsiyon, kaplama kinetik eğitim için bir araç, ve etkileşim yanlısı olarak son yıllarda dikkat çekennanometre ölçeğinde 19,43-45 üzerine süreçlerle. Bu teknik, gerçek zamanlı olarak kütle adsorpsiyon detaylı bir şekilde tespit eder ve protein örgüleri 19,20,42,46-48 protein kendinden montaj işlemi ve fonksiyonel moleküllerin bağlanması için bir gösterge olarak kullanılabilir. Buna ek olarak, QCM-D ölçümleri doğal biyolojik şartlarda proteinli tabaka ile metal etkileşim süreçlerini incelemek için olasılığını açık. Yeni bir çalışmada, Eu gibi seçilen metaller ile S-katmanlı protein etkileşimi (III), Au (III), Pd (II) ve Pt (II) QCM-D 19,20 ile ele alınmıştır. Emilmiş olan protein tabakası, gram-pozitif bakterilerin hücre duvarı basitleştirilmiş bir model olarak hizmet edebilir. Bu tek bileşenli çalışma metal etkileşimi daha derin bir anlayış katkıda bulunabilir. Ancak, sadece QCM-D deneyleri yüzey yapıları ve proteine metallerin etkileri ile ilgili ifadeleri izin vermez. Diğer teknikler, bilgi elde etmek için gereklidir. Bir posyapısal özelliklerine görüntüleme biyo-nanoyapılarda için gündeme gelince ve bilgi alma atomik kuvvet mikroskopisi (AFM) 'dir.
Bu çalışmada elde edilen amacı, L., özellikle Slp1 içinde, ((0) -NPs Au (III) ve Au) S-tabaka proteinleri altın emilimini araştırmaktır sphaericus JG-B53. ICP-MS kullanılarak 5.0 ve QCM-D kullanılarak immobilize S-tabakaları ile - Deneyler 2.0 arasında bir pH aralığı içinde toplu ölçekte süspansiyon protein ile yapıldı. Buna ek olarak, kafes stabilitesi üzerindeki metal tuzu çözeltisinin etkisi takip eden AFM çalışmalarla araştırılmıştır. Bu tekniklerin kombinasyonu belirli metal afinite ile ilgili tüm bakteri hücreleri olayları bağlayıcı hakkında daha fazla öğrenme için bir araç olarak in vitro metal etkileşim süreçlerinin daha iyi anlaşılmasına katkıda bulunur. Bu bilgi, sadece çevre koruma metallerin geri kazanımı için uygun filtre malzemeleri geliştirilmesi ve yeniden korunması için önemlidir49, aynı zamanda çeşitli teknik uygulamalar için çok düzenli metal NP dizilerinin geliştirilmesi için kaynaklar.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Mikroorganizma ve Yetiştirme Koşulları
Not:. Bütün deneyler steril koşullar altında yapılmıştır L. sphaericus JG-B53 cryo-korunmuş kültür 29,30 elde edilmiştir.
- Aktarım 300 ml steril besleyici et suyu (NB) ortam (3 g / L, et özü, 5 g / L pepton, 10 g / L NaCl), temiz tezgah altında kültür (1.5 mi) kriyo korunmuş. Daha sonra yetiştirme için ön kültür elde etmek için 30 ° C'de en az 6 saat boyunca çözelti karıştırın.
- Bir 70 L pH = 7,0 30 ° C NB ortam içinde aerobik koşullar altında bakteri yetiştirmek buhar yerinde biyoreaktör ölçeklendirilebilir. Bu nedenle, ≈ 57 L iyonu giderilmiş su reaktöre doldurulur. Biyoreaktörde doğrudan katı NB medya ekleyin ve çözülür (konsantrasyonlar yukarıya bakınız).
- Ayrıca ekimi sırasında köpük oluşumunu bastırmak için medyaya köpük önleyici ajan (30 ul / L NB-media) ekleyin, daha sonra otoklav medya (122 ° C, sıcaklık süresi 30 dakika tutan)Reaktör tesisi içinde.
- Medya sakinleşmek ve tam oksijen doygunluğunu gerçekleştirin. (1 MH 2 SO 4 ve 2 M NaOH ile) 7.0 pH ayarlamak ve 300 mi ön kültür otomatik aşılama başlar. Aşılama noktasında yetiştirme parametrelerin veri kaydını başlatın. Ekimi içinde, örneğin çevrimiçi parametreler, çözünmüş oksijen seviyesini (2 dO), asit ve baz ilavesi ve pH değerleri yapın.
- Non-invaziv bulanıklık ölçümleri ile çevrimiçi bakteri üremesini izleyin.
- Ekiminin her saat sonra ek örnekleme yapın ve bu tür biyo kuru ağırlık (BDW) ve çevrimdışı optik yoğunluk (OD) gibi diğer parametre belirlenir. Bu nedenle, steril koşullar altında, her bir numune alma noktası 20 mi kültür suyu toplar.
- 600 nm adsorpsiyon fotometrik ölçümler ile çevrimdışı OD belirleyin. Boş bir değer olarak steril süzülmüş NB-ortamı kullanın. Kıçtaer adsorpsiyon> 0.4 sulandırmak Lambert-Beer kanunun doğrusallık aşağıdaki hücre süspansiyonu ulaştı.
- Bakteriyel süspansiyon 5 ml BDW santrifüj 1 belirlenmesi için oda sıcaklığında 5 dakika boyunca 5000 x g'de (bir hücre yoğunluğuna bağlı olarak). Fırın kadar kitle istikrara ısıtma 105 ° C'de elde edilen hücre pelet kurulayın ve pelet kütlesini ölçmek.
- Bakteri üremesi kontrol etmek için ve bir çapraz kontaminasyon kontrolü olarak 400 ve 1000 kat büyütme (sırasıyla faz kontrast kondansatör 2 ve 3) optik faz kontrast araştırma mikroskobu ile mikroskobik görüntüleri çekin.
- Çevrim ile tespit üstel büyüme fazı ulaştıktan sonra 2 ve çevrimiçi bulanıklık dO, 15.000 x g'de, 4 ° C'de akış santrifüjleme ile hasat biyokütle ve standart tampon maddesi (50 mM TRIS, iki kez biyokütle yıkama, 10 mM MgC! 2, 3 mM NaN3, pH = 7.5).
Not: Elde edilen biyokütle pelet -18 & # saklanabilir176; izolasyonu için daha kullanıma kadar C.
2. S-katmanlı Protein İzolasyonu ve Saflaştırılması
Not: Önceden 2,19,30,32,50,51 tarif edildiği gibi bir uyarlanmış yönteme uygun olarak Slp1 polimerler arıtın.
- Standart tampon içinde kültivasyonu elde edilen yıkanmış ve çözüldü, ham biyokütle homojenize (1: 1 (a / h)), 4 ° C'de soğutucu buz banyosu altında dağıtıcı (seviye 3, 10 dk) ile flagella kaldırın.
- Süspansiyonu (8000 xg, 20 dak, 4 ° C) santrifüj ve standart tampon maddesi ile iki kez elde edilen pelet yıkayın (1: 1 (a / h)). Yıkama ve santrifüj (8000 x g, 20 dakika boyunca 4 ° C) sonra, standart tampon içinde tekrar süspansiyon pelet (1: 1 (a / h)), süspansiyona DNaz II ve RNaz (0.4 ünite / g biyomas) ekleyin ve parçalanma yüksek basınçlı homojenleştirici ile 1000 bar hücreleri. Daha sonra 27.500 xg, 1 saat süre ile 4 ° C 'de süspansiyon santrifüj.
Not: Araştırma mi Kontrol hücre süspansiyonucroscope. 3 sağlam hücreler 400 kat büyütme mikroskop görünümü alanında görünür - az 2 zaman rüptür tamamlanır. - Standart tamponu ile iki kere yıkayın pelet (1: 1 (w / v)) ve yeniden santrifüj uygulayın. Daha sonra, standart tampon içinde tekrar süspansiyon pelet (2: 1 (a / h)),% 1 Triton X-100 ile karıştırılmış ve lipid birikintilerini çözündürdüğü arda çalkalanarak (100 rpm) 20 dakika boyunca inkübe edin.
- Santrifüj çözeltisi (27.500 xg, 1 saat süre ile 4 ° C) ve standart tampon maddesi ile elde edilen topak üç kez yıkayın (1: 1 (a / h)).
- Standart tampon içinde 6 saat boyunca ek bir santrifüjleme (27.500 xg, 1 saat süre ile 4 ° C) sonra elde edilen pelet inkübe (1: 1 (a / h)) peptidoglikan 50'ye bağlantıları hidrolize etmek için, 0.2 g / L lizozim ile karıştırılır. Ayrıca süspansiyona DNaz II ve RNaz (her 0.4 ünite / g biyomas) ekleyin.
- Santrifüjleme (45.500 xg, 4 ° C, 1 saat) sonra, t düşük bir hacme üst beyazı proteinine faz tekrar süspansiyonO santrifüj Süpernatan (<30 mi) ihtiva eden protein alt-birimleri.
- 6 M guanidin hidroklorür (6 M GuHCl, 50 mM TRIS, pH = 7.2) ile 1: 1 karıştırılarak beyaz süspansiyon çözünürleştirilir. Çözelti, parlak hale gelir.
- Ek bir yüksek hızlı santrifüj (45,500 x g, 1 saat süre ile 4 ° C) ve ardından GuHCl ile muamele edilen çözelti steril filtrasyonu (0,2 um) uygulayın.
- Diyaliz zar borularından supernatant (MWCO 50.000 Dalton) aktarın ve 48 saat boyunca tekrar kristalleştirme tamponu (1,5 mM TRIS, 10 mM CaCI2, pH = 8.0) karşı diyaliz edilir.
- 45.500 x g'de 1 saat boyunca 4 ° C'de tüpler ve santrifüj içine beyaz rekristalize protein polimeri çözeltisini. Ultra-saf su (<30 mi) içindeki bir düşük bir hacim içinde pelletini.
- Daha sonra, diyaliz membran tüp içine süspansiyonu transfer ve tampon içeriği kaldırmak için 24 saat boyunca ultra saf suya karşı diyaliz gerçekleştirin.
Not: tampon ya da ultra saf su d birkaç değişiklikuring diyaliz vazgeçilmezdir. - Bir dondurarak kurutucu içinde liyofilize saflaştırılmıştır Slp1.
Deneylerin için Slp1 3. Karakterizasyonu ve Niceleme
Not: sorpsiyon ve kaplama deneyler için Slp1 konsantrasyonu UV-VIS spektrofotometrisi ile kantifiye edilmiştir.
- Doğrudan fotometre alt ölçüm kaide üzerine çözünmüş Slp1 örnek Pipet 2 ul. Proteinler için karakteristik 280 nm bir dalga boyunda emme maksimum protein konsantrasyonunu belirleyin. Slp1 konsantrasyonunu tespit etmek için 0,61 ve sönüm katsayısı kullanarak. Referans ölçümleri için Slp1 ücretsiz çözümü kullanın.
- Deneyler (1 g / L ve 0.2 g / L istenen konsantrasyona (% 0.9 NaCl kullanmak toplu modunda sorpsiyon deneyleri, pH = 6.0 ve QCM-D deneyleri yeniden kristalleştirme tamponu kullanmak için, pH = 8.0) tampon maddesi ile protein seyreltin sırasıyla).
- Standart Bioanal tarafından Slp1 kalitesi ve molekül ağırlığı analizLaemmli, UK 52 tarafından tarif edilen bir yöntem istenen analitik sodyum dodesil sülfat poliakrilamid jel elektroforezi (SDS-PAGE).
- Au (0) -np inkübasyon% 10 poliakrilamid jeller ayırma kullandıktan sonra, deney ve örneğin içinde Slp1 kullanmadan önce SDS-PAGE gerçekleştirin.
- SDS-numune karışımı için numune tamponu ile yapılan yetiştirme ya da protein numunesinin ≈10 ul (1.97 g TRIS, 5 mg mavi bromofenol, 5,8 ml gliserin, 1 g SDS, 2.5 ml β-merkaptoetanol, 50 ml ultra saf su ile doldurun) Jel ceplerine 95 ° C'de 4 dakika inkübe edildikten sonra 1 (h / h) ile pipet karışım: 1 lik bir oran.
- Örneklerin kadar 60 V bir voltajda Run SDS-PAGE 30 dakika sonra ayırma jeli geçen 120 V toplama jel ve değişim gerilimi geçmektedir.
- Jel sistemi jeller çıkarın sabitleme çözeltisi (% 10, asidik asit,% 50 saf etanol) içinde 1 saat süre ile, aşırı saf su ve yer ile durulayın. Daha sonra, saf su ile jeller yıkayın.
- Leke jellerBir uyarlanmış belirsiz kolloid Coomassie parlak mavi bir yöntem 53,54 kullanarak. 72,73 lekenin sonra, üreticinin protokolüne göre jel dokümantasyon sistemi ile SDS-PAGE fotoğraf çekmek.
Toplu modu ve Metal Niceleme 4. Emme Deneyleri
- Yığın için sorpsiyon deneyleri HAuCl 4 Au (III) stok çözeltisi ∙ 3 H2O hazırlamak metal tuzunu, seyreltik ve 1 g / L bir 1 mM başlangıç metal konsantrasyonu ve nihai Slp1 konsantrasyona Slp1 / NaCl çözeltisi ile karıştırarak . Slp1 olmayan, ek bir negatif kontrol ile üçlü deneyleri gerçekleştirmek. Sorpsiyon deneyleri için 5 ml'lik bir toplam hacim kullanın.
- 24 saat (düşükten konsantre edildi HCI ve NaOH çözeltisi ile pH ayarlanır) için, 5.0 ilâ 2.0 arasında farklı önceden ayarlanmış pH değerlerinde, oda sıcaklığında, sürekli süspansiyon çalkalayın.
- Sorpsiyon sonra, 15.000 x g'de 20 dakika boyunca 4 ° C) Separ en örnekleri santrifüjsüpernatanından Slp1 yedi.
- Çözünmüş protein monomerleri ayırmak amacıyla, 20 dakika boyunca, 15,000 x g'de 4 ° C ultrafiltrasyon tüpler içine süpernatant (MWCO 50.000 Da), ve santrifüj Bu aktarın.
- ICP-MS 19,20 ile sonuçlanan Filtrattaki metal konsantrasyonunu belirlemek ve Slp1 kuru kütlece Emdirilen metalin yeniden hesaplama sonuçlarını kullanın. Ilkeleri Ölçme, yöntem ve kullanılan ICP-MS bileşenlerinin fırsatlar literatürde 55 tarif edilmiştir.
- Dahili bir standart (1 mg / ml) halinde matris ve rodyum gibi% 1 HNO 3 kullanılarak ICP-MS ölçümleri için örnekler ve referans hazırlayın.
5. Au-NP sentezi ve Partikül Boyutu Belirlenmesi
Not: Sitrat Au (0) -np Mühlpfordt, H. et al tarafından tarif uyarlanmış yönteme uygun olarak sentezlendi stabilize. (1982), bir çapı olan küresel parçacıklar elde etmek üzere 10-15 nm 56,57 .
- NP oluşumu için bir stabilize edilmiş 25 mM HAuCl 4 ∙ 3 H2O stok hazırlayın.
- 19,75 mi ultra saf su içinde bu stok çözeltinin 250 ul seyreltilmiş ve arka arkaya çalkalama altında 15 dakika boyunca 61 ° C 'de bu inkübe edin.
- Ikinci bir stok çözeltisinden 5 ml (12 mM tanik asit, 7 mM sodyum sitrat, di-hidrat, 3 0.05 mM K 2 CO) hazırlayın ve 15 dakika boyunca 61 ° C 'de ayrı 2. çözelti inkübe edin.
- Sürekli çözüm birine 2. stok solüsyonu karıştırılarak ekleyin. 61 ° C'de en az 10 dakika boyunca reaksiyon karışımını karıştırın. Daha sonra çözüm soğumasını ve QCM-D deneyler içinde Slp1 kafes NP kaplama için kullanabilirsiniz.
Not: Elde edilen Au (0) -np tipik haliyle (0) 58 -NPs oluşan Au saptanması için kullanılan 520 nm absorbans en fazla UV-VIS spektroskopisi ile karakterize edilmiştir. Çözelti 4 ° C 'de muhafaza edilebilir. - Oluşturulan boyutunu analizAyrıca dinamik ışık saçılması olarak bilinen foton korelasyon spektroskopisi (PCS) Au (0) -np.
- NP büyüklüğünün belirlenmesi için, bir laminar akış kutu toz içermeyen koşullar altında küvetler içine sentez Au (0) -np çözeltisi 1,5 ml transferi ve bir boyuta ve zeta potansiyeli Partide Sizer ile analiz. PCS ve numune hazırlama ayrıntılı bir açıklaması Schurtenberger, P. et al verilmiştir. (1993) 59 ve Jain, R. ve diğ. (2015) 60.
6. QCM-D Deneyler - Slp1 Kafes üzerine Yüzeylerde Slp1 Kaplama ve Au-NP Adsorpsiyon
Not: Ölçümler en fazla dört akım modülleri ile donatılmış bir QCM-D ile gerçekleştirilmiştir. Tüm QCM-D deneyleri, 25 ° C'de 125 ul / dakikalık sabit bir akış oranı ile gerçekleştirilmiştir. Slp1 kaplama ve metal / NP inkübasyon ≈ 5 MHz'lik bir temel frekans SiO 2 piezoelektrik AT-kesim quartz sensörleri (çap 14 mm) üzerinde yapıldı. Adımları durulama ve ekleyinçözümün ition temsilcisi sonuçları parçası şekillerde işaretlenir. QCM-D deneyler adım yoluyla adım Slp1 rekristalizasyon ile ve daha sonra metal ve metal NP etkileşimi takip kullanılan sensörlerin temizliği ve yüzey modifikasyonu ile başlayan olarak tarif edilebilir.
- Prosedürler Temizleme:
- Sensör kuklaları ile sıvı hücreleri donatın. Pompa, en az 20 ml ile QCM-D, boru sistemi (ultra-saf su (h / h) içinde% 2 temizleyici) bir alkalin sıvı temizlik maddesinin (modül başına) ekstrakte edildi. Daha sonra sistem aracılığıyla ultra saf su beş kat hacmini (her modül başına) pompa (300 ul / dk hızı kadar akış). Üreticinin protokolüne uygun olarak bir temizlik gerçekleştirmek.
- % 2 SDS çözeltisi içinde inkübasyon (en az 20 dakika) akış modüllerin dışında SiO 2 Sensörleri temizleyin ve ultra saf su 61,62 ile sonradan birkaç kez sensörleri durulayın.
- Süzüldü comp kristaller Kuruhava sıkıştırıldı ve 20 dakika 63,64 için bir ozon temizleme odasına koyun.
- Tüm organik içeriği kaldırmak için iki kez temizlik işlemi tekrarlayın.
- Sensör yüzeyinden bağlı metalleri çıkarmak için 1 M HNO 3 ile sensörler durulayın. Daha sonra, ultra saf su ile durulama tüm adımları uygulayın.
- Polielektrolitlerin tarafından Sensör Yüzey Modifikasyonu:
Yüzey modifikasyonu ya içinde yapılabilir (prosedür akışını) ya da akış modülü dışında (LBL tekniği): Not. Bu deneyler içinde, yüzeylerin değiştirilmesinde şu şekilde kullanıldı.- 3 g makalesinde özel kullanılan sistem için daha önce açıklanan LBL tekniğini 40,41 ile daldırma kaplama yoluyla polietilen imin (PEI, MW 25.000) ve polistiren sülfonat (PSS, MW 70.000) dönüşümlü PE katmanlarının / L sensörler değiştirme Suhr, M. ve diğ. (2014) 19.
- Derin w uygun PE-çözelti içinde sensörleri yerleştirinell plakaları ve oda sıcaklığında 10 dakika boyunca bu inkübe edin.
- PE-çözümün dışına sensörleri alın ve ultra saf su ile yoğun, her daldırma kaplama aşaması arasındaki sensörleri durulayın.
Not: Yeni yüzey modifikasyonu, pozitif yüklü PEI ile en az üç PE tabakası sonlanan oluşur. - Bu harici modifikasyon sonra akış modülünün içinde alıcı yerleştirilmesi, deney başlamadan önce, aşırı saf su ile durulama sensörleri dengeye getirin.
- Slp1 tabakalı Yeniden kristallendirme:
- Monomerlere polimerlerin dönüştürmek için 4 M üre içinde Slp1 eritin.
- Monomerized proteinler 15.000 xg, 1 saat süre ile 4 ° C'de santrifüje tabi tutulur daha büyük bir protein içinde elle kurutulur.
- 0.2 g / L'lik nihai bir protein konsantrasyonuna kadar yeniden kristalleştirme tamponu ile çözündürülmüş ve santrifüjlenir Slp1 süpernatant karıştırın.
Not: Slp1 (self-montaj) yeniden kristalize bağlı kalsiyum rec eklenmesiyle başlarrystallization tamponu. Bu nedenle, hemen (akış modülleri içine yerleştirilir) sensörlerine 125 ul / dakikalık bir akış oranı ile karışık bir çözelti pompası. Yeniden kristalleşme QCM-D deneyleri içinde tespit edildi sıklığı ve dağılımı vardiya istikrarlı değerlerden sonra yapılır. - Akış modül içinde PE ile modifiye edilmiş sensör en başarılı proteini tekrar kristalleştirmeyi takiben, sıklığı ve dağılımı kaymaların sabit değerler kadar 125 ul / dakikalık bir akış oranı ile waterintensively rekristalizasyon tampon ya da ultra saf kaplanmış sensörler yıkayın tespit edilmiştir.
Not: Slp1 tek tabakalı ve AFM çalışmaları üzerine daha sonra emme deneyleri için PE ile SiO 2 yüzey modifikasyonu Şekil 1'de görüntülenmiştir.

Şekil 1. Şematik Tasarım PE Yüzey Modifikasyonu ve Slp1 MonolayerKaplama; Bu rakam, Suhr, M ve diğerleri modifiye edilmiştir. Springer izni ile (2015) 19. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Metal ve Metal NP Etkileşimi:
Not: Au metal tuzu çözeltisi ile sorpsiyon (HAuCl 4 ∙ 3H 2 O) 1 mM veya 0.9% NaCl çözeltisi içinde pH 5 mM = 6.0 konsantrasyonlarda gerçekleştirilmiştir. Au-NP adsorpsiyon pH ≈ 5.0 1.6 mM tri-sodyum-sitrat tampon maddesi içinde seyreltilmemiş Au-NP ile yapıldı.- Sıklığı ve dağılımı kaymaların stabil değerleri tespit edildi kadar akım modüllerinde başarılı Slp1 Kaplamadan sonra% 0.9 NaCI solüsyonu ile yoğun bir şekilde elde Slp1 katmanı yıkayın.
- 125 ul / dakikalık bir akış oranı ile akış modüllerine hazırlanmış metal çözeltisi (1 mM) ve NP çözeltisi Pompa ve Sl kütle adsorpsiyonu izlemekp1 tabakası. Kütle adsorpsiyon Sauerbrey denkleme atıfta frekans kaymalarının (Denklem 1) takip ederek, doğrudan tespit edilebilir.
- Metal ve metal NP etkileşimi tamamladıktan sonra, zayıf bağlı veya zayıf bağlı metalleri veya nanopartiküller kaldırmak için metal / NP ücretsiz tampon katmanı durulayın.
Not: deney düzeneği bir örneği, Şekil 2'de gösterilmiştir.

Şekil 2. * 66 401 Debi Modülü QFM kullanarak QCM-D Kur şematik tasarımı. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Veri Kayıt ve Değerlendirme:
- Hz (mesafe kadar taşınmış n) ve dağılımı (ΔD n frekans değişimleri kaydedin) QCM-D özel bir yazılım kullanarak QCM-D deneyleri içinde.
- Overtone n inci uygulanan sensör yüzeyine sürtünme olmadan birleştiğinde ince ve sert filmler için geçerlidir adsorbe kitle hassasiyet (Δm) Sauerbrey denklemi / model (Denklem 1) 65 66 değerlendirilmesi için kullanın. Kesim kuvars sensörü AT kullanılan 5 MHz için vadeli C (Sauerbrey sabit) 17.7 ng ∙ Hz -1 ∙ cm -2 68 olduğunu. Sert için, eşit dağıtılmış ve yeterince ince adsorbe katmanları iyi bir yaklaşım olarak Denklem 1 kullanın.
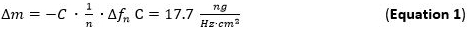
- Viskoelastik moleküllerin üreticisi özel bir yazılım ile 68-71 için geçerli Kelvin-Voigt modeline göre ek modelleme gerçekleştirin ve Sauerbrey modelinin bununla sonuçları karşılaştırın.
- Tabaka kalınlığının hesaplanması ve kütle soğurma kullanımı içinönemli modelleme parametre olarak 1.35 adsorbe katmanının katman yoğunluğu g ∙ cm -3 S-tabaka proteinleri 72-75 için daha önce tarif edilen değerlere tekabül etmektedir. Proteinli tabaka ile metal etkileşimi hesaplanması için aynı değeri kullanın.
7. AFM Ölçümleri
- Bir ters bir optik mikroskop tamamen yetenekli AFM ile çalışmalar yapmak.
- Doğrudan kaplanmış QCM-D sensörler yeniden kristalleşme tampon veya ultra saf su kullanılarak sıvı rekor AFM görüntüleri.
- QCM-D deneylerden sonra saf su ile durulayın sensörleri ve AFM sıvı hücre içinde koyun. Bu nedenle, yaklaşık 1.5 ml'lik toplam hacmi olan bir kapalı akışkan hücre kullanılır. 30 ° C de sıvı hücre sabiti sıcaklığı muhafaza edin.
- Su içinde ≈ 25 kHz'lik bir rezonans frekansına ve <0,1 N / m'lik bir sertliğe sahip bir konsol kullanın. 2.5 ve 10 mm / sn arasında tarama hızını ayarlayın. dinamik iletişim modunda görüntüleri çekin. 76 sönümleme salınım yüzeye konsolun mesafeyi belirleyin.
Not: z değerleri yüzeyin tam topografyasını temsil ederken Yükseklik görüntüleri z-skala ile gösterilir. Genlik z değerleri tarama parametrelerine bağlıdır ve sınırlı bilgi ayı nedeniyle Genlik (Pseudo 3D) görüntü z-ölçek olmadan gösterilmektedir. Görüntülerin analizi üç farklı değerlendirme yazılımı en 77 kullanılarak yapıldı.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Mikroorganizmalar ve Slp1 karakterizasyonu Yetiştirme
Bakteri büyümesinin kaydedilen veriler yaklaşık 5 saat sonra üslü büyüme fazında sonunu gösterir. Önceki araştırmalar Slp1 hasat Bu noktada (4,36 g / L, ıslak biyo-kütle (≈ 1,45 g / L (BDW)), maksimum verimle 19 ile izole edilebilir olduğunu göstermiştir. Bununla birlikte, tanımlanmış ortam bileşenleri kullanarak veya yet...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu çalışmada farklı analiz yöntemleri bir arada kullanarak araştırıldı S katmanlı proteinlere bağlanmasının Au incelenmiştir. Özellikle, Au bağlayıcı maden suları veya işlem çözeltilerinden Au geri kazanımı için değil, aynı zamanda malzeme, örneğin, duyu yüzeylerin inşası için de oldukça ilgi çekicidir. Au etkileşim çalışmaları için (Au (III) ve Au (0) -NPs) süspansiyon haline getirilmiş ve Slp1 tek tabaka yeniden kristalize olan protein sahip izole edilmesi. Bu nedenl...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Bu çalışma kısmen BMWi ve BMBF-proje "Aptasens" (BMBF / DLR 01RB0805A) tarafından finanse edilen IGF-projesi "S-Elek" (490 ZBG / 1) tarafından finanse edildi. AFM çalışmaları sırasında ve ana dili İngilizce olan konuşmacı olarak el yazması okumak için Erik V. Johnstone yaptığı değerli yardım için Tobias J. Günther Special thanks. Dahası, bu makalenin yazarı (ICP-MS ölçümlerde yardım için kaynak Ekoloji Enstitüsü) Aline Ritter ve Sabrina Gurlit teşekkür etmek istiyorum, Manja Vogel, Nancy Unger, Karen E. Viacava ve Helmholtz-Enstitüsü grup biyoteknoloji Kaynak Teknoloji Freiberg.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000 - 6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein = 90 %, = 40,000 units/mg protein (Sigma) |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50 - 100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50,000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
Referanslar
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. Atimtay, T. A., Sikdar, S. K. , Springer. 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B. Environmental Microbe-Metal Interactions. Lovely, D. R. , ASM Press. Washington. 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , Forschungszentrum Rossendorf. Dresden. (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , Technische Universität Dresden. (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, Rice University . Houston. 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. Gold : science and applications. , CRC Press - Taylor&Francis Group. (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, Dr Dietrich Steinkopff Verlag. (1992).
- Günther, T. J. S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , Technische Universität Dresden. (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. Methods for general and molecular bacteriology. , American Society for Microbiology. 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C. [6] Quantitation of protein. Methods in Enzymology. Deutscher, M. P. 182, Academic Press. 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. ICP Mass Spectrometry - The 30-Min to ICP-MS. , PerkinElmer. USA. (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. Colloidal Gold - Principles, Methods and Applications. , Academic Press. (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E. Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. Buffle, J., van Leeuwen, H. P. 2, Lewis Publishers. 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705(2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , Technische Universität Dresden. (2003).
- Jennings, T., Strouse, G. Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , Springer. 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır