È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Au-Interazione di SLP1 Polimeri e monostrato da
In questo articolo
Riepilogo
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
Abstract
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
Introduzione
A causa della crescente uso di oro per diverse applicazioni come l'elettronica, catalizzatori, biosensori o strumenti medici, la domanda di questo metallo prezioso è cresciuta nel tempo degli ultimi anni 6-9. L'oro così come molti altri metalli preziosi e pesanti vengono rilasciati nell'ambiente tramite scarichi industriali in concentrazioni diluite, attraverso attività minerarie, e lo smaltimento dei rifiuti 7,8,10, anche se la maggior contaminazione ambientale da metalli pesanti o preziosi è un processo in corso principalmente causato da attività tecnologiche. Questo porta ad una interferenza significativa di ecosistemi naturali e potrebbe minacciare la salute umana 9. La conoscenza di questi risultati negativi promuove la ricerca di nuove tecniche per rimuovere i metalli da ecosistemi e miglioramenti contaminati nel riciclaggio dei metalli dalle acque di scarico industriali. Metodi fisico-chimici ben affermati come precipitazione o scambio ionico non sono così efficaci, specialmente in altaly diluito soluzioni 7,8,11. Bioassorbimento, sia con la vita o la biomassa morti, è un'alternativa interessante per trattamento delle acque reflue 10,12. L'uso di tali materiali biologici può ridurre il consumo di prodotti chimici tossici. Molti microrganismi sono stati descritti per la costituzione o immobilizzare metalli. Per esempio, le cellule di Lysinibacillus sphaericus (L. sphaericus) JG-A12 hanno dimostrato elevate capacità di legame per i metalli preziosi, per esempio, Pd (II), Pt (II), Au (III), e altri metalli tossici come Pb (II) o U (VI) 4,13, cellule di Bacillus megaterium per Cr (VI) 14, le cellule di Saccharomyces cerevisiae per Pt (II) e Pd (II) 15, e Chlorella volgare Au (III) e U (VI) 16 , 17. Il legame di metalli precedenti, come Au (III), Pd (II), e Pt (II) è stato riportato anche per Desulfovibrio desulfuricans 18 e per L. sphaericus JG-B53 19,20. Tuttavia, non all microbi legano elevate quantità di metalli e la loro applicazione come materiale sorbitive è limitato 12,21. Inoltre, la capacità di legame del metallo dipende da diversi parametri, ad esempio, la composizione delle cellule, il bio-componente utilizzato, o ambientali e condizioni sperimentali (pH, forza ionica, temperatura etc.). Lo studio di frammenti di parete cellulare isolati 22,23, come lipidi di membrana, peptidoglicano, proteine o altri componenti, aiuta a comprendere il processo di complessi costruiti cellule intere 8,21 vincolante metallo.
I componenti cellulari focalizzati su in questo studio sono proteine S-layer. Proteine S-strato sono parti della busta esterna delle cellule di molti batteri e di archeobatteri, e costituiscono circa il 15 - 20% della massa di proteine totali di questi organismi. Come la prima interfaccia per l'ambiente, questi composti cellulari influenzano fortemente le proprietà di assorbimento batteriche 3. Proteine S-strato con peso molecolare compreso tra quarantaa centinaia di kDa sono prodotti all'interno della cellula, ma sono montati all'esterno dove sono in grado di formare strati sulle membrane lipidiche o componenti della parete cellulare polimerici. Una volta isolato, quasi tutti S-layer proteine hanno la proprietà intrinseca di auto-assemblarsi spontaneamente in sospensione, alle interfacce, o su superfici che formano strutture planari o tube-like 3. Lo spessore del monostrato proteine dipende batteri ed è in un intervallo di 5 - 25 nm 24. In generale, le strutture proteiche S-strato formato può avere un obliquo (P1 o P2), quadrato (P4), o esagonale (p3 o p6) simmetria con costanti reticolari 2,5 a 35 nm 3,24. La formazione reticolare sembra essere in molti casi dipendono cationi bivalenti e principalmente su Ca 2+ 25,26, Raff, J. et al. S-layer a base di nanocompositi per applicazioni industriali a base di proteine Engineered Nanostructures. (a cura di Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (presentato)). Tuttavia, la cascata reazione piena di monomero piegatura, interazione monomero-monomero, la formazione di un reticolo, e il ruolo dei diversi metalli, in particolare di cationi bivalenti come Ca 2+ e Mg 2+, non sono ancora del tutto chiaro.
Il ceppo gram-positivi L. sphaericus JG-B53 (rinominato da Bacillus sphaericus dopo nuova classificazione filogenetica) 27 è stato isolato dalla miniera di uranio rifiuti mucchio "Haberland" (Johanngeorgenstadt, Sassonia, Germania) 4,28,29. La sua funzionale proteina S-layer (SLP1) possiede un reticolo quadrato, un peso molecolare di 116 kDa 30, e uno spessore di ≈ 10 nm a vivere cellule batteriche 31. In studi precedenti, la formazione in vitro di uno strato proteico chiuso e stabile con uno spessore di circa 10 nm è stato raggiunto in meno di 10 min 19. Il ceppo correlate L. sphaericus JG-A12, anche un isolato dal mucchio "Haberland", possiede alta metallo capacità di legame e il suo isolato proteina S-layer ha mostrato un buon tasso di assorbimento chimica e stabilità meccanica e per i metalli preziosi come Au (III), Pt (II), e Pd (II) 4,32,33. Questo legame di metalli preziosi è più o meno specifici per alcuni metalli e dipende dalla disponibilità di gruppi funzionali sulla superficie esterna della proteina e interna del polimero e nei suoi pori, forza ionica, e il valore del pH. Gruppi funzionali rilevanti per l'interazione metallo da parte delle proteine sono COOH-, NH 2 -, OH-, PO 4 -, SO 4 - e SO-. In linea di principio, capacità di legame metallo aprono un ampio spettro di applicazioni, Raff, J. et al. S-layer a base di nanocompositi per applicazioni industriali a base di proteine Engineered Nanostructures. (a cura di Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (presentato)). ad esempio, come componenti biosorptive per la rimozione o recuperodi metalli tossici o pregiati disciolti, i modelli per sintesi o la deposizione di nanoparticelle definito regolarmente strutturati metalliche (NP) per la catalisi, e altri materiali bio-ingegneria, come bio-sensoriali strati 3,5,18,33. Array NP regolarmente organizzati come Au (0) -NPs potrebbero essere utilizzati per le principali applicazioni che spaziano dall'elettronica molecolare e biosensori, dispositivi di storage ad altissima densità, e catalizzatori per CO-ossidazione 34-37. Lo sviluppo di tali applicazioni e design intelligente di questi materiali richiede una comprensione più profonda dei meccanismi vincolanti metallo sottostante.
Un prerequisito per lo sviluppo di tali materiali bio-based è l'implementazione affidabile di un livello di interfaccia tra la biomolecola e la superficie tecnica 38,39. Ad esempio, polielettroliti assemblati con il layer-by-layer (LBL) 40,41 tecnica sono stati utilizzati come strato di interfaccia per ricristallizzazione proteine S-strato 39 . Tale interfaccia offre un modo relativamente semplice per eseguire il rivestimento proteico in modo riproducibile e quantitativa. Eseguendo esperimenti diversi con e senza modifiche con i promotori adesive, è possibile fare dichiarazioni riguardanti la cinetica di rivestimento, la stabilità strato, e l'interazione dei metalli con biomolecole 19,42, Raff, J. et al. S-layer a base di nanocompositi per applicazioni industriali a base di proteine Engineered Nanostructures. (a cura di Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (presentato)). Tuttavia, il complesso meccanismo di adsorbimento di proteine e interazione proteina-superficie non è completamente noto. Soprattutto informazioni sulla conformazione, l'orientamento del modello, e la densità di rivestimento è ancora mancante.
Cristallo di quarzo microbilancia con il monitoraggio di dissipazione (QCM-D) la tecnica ha attirato l'attenzione negli ultimi anni come uno strumento per lo studio delle proteine, la cinetica di rivestimento, e l'interazione proprocessi su scala nanometrica 19,43-45. Questa tecnica permette di rilevare dettagliata di adsorbimento di massa in tempo reale, e può essere utilizzato come indicatore per il processo di auto-assemblaggio di proteine e di accoppiamento molecole funzionali su reticoli proteine 19,20,42,46-48. Inoltre, le misure QCM-D aperta la possibilità di studiare processi di interazione del metallo con lo strato proteico in condizioni biologiche naturali. In un recente studio, l'interazione della proteina S-strato con metalli scelti come Eu (III), Au (III), Pd (II) e Pt (II) è stato studiato con QCM-D 19,20. Lo strato proteina adsorbita può servire come un modello semplificato di una parete cellulare di batteri gram-positivi. Lo studio di questo singolo componente può contribuire a una più profonda comprensione delle interazioni metallo. Tuttavia, esclusivamente QCM-D esperimenti non consentono dichiarazioni riguardanti strutture superficiali e le influenze dei metalli alle proteine. Altre tecniche sono necessarie per ottenere tali informazioni. Una posbilità per immagini bio-nanostrutture e informazioni sulle proprietà strutturali ottenere è la microscopia a forza atomica (AFM).
L'obiettivo dello studio presentato era studiare l'assorbimento di oro (Au (III) e Au (0) -NPs) alle proteine S-strato, in particolare SLP1 di L. sphaericus JG-B53. Gli esperimenti sono stati fatti con proteine sospesi su scala batch in un intervallo di pH di 2,0 - 5,0 mediante ICP-MS e con immobilizzati S livelli utilizzando QCM-D. Inoltre, l'influenza della soluzione di sale di metallo sulla stabilità lattice è stata studiata con successivi studi AFM. La combinazione di queste tecniche contribuisce a una migliore comprensione dei processi di interazione in vitro in metallo come strumento per saperne di più su eventi in cellule batteriche intere riguardanti affinità metalliche specifiche vincolanti. Questa conoscenza non è solo cruciale per lo sviluppo di materiali filtranti applicabili per il recupero di metalli per la tutela dell'ambiente e la conservazione del reFonti 49, ma anche per lo sviluppo di array di NP metalliche altamente ordinati per varie applicazioni tecniche.
Protocollo
1. di microrganismi e di coltivazione Condizioni
Nota:. Tutti gli esperimenti sono stati fatti in condizioni di sterilità L. sphaericus JG-B53 è stato ottenuto da una cultura crio-conservati 29,30.
- La cultura (1,5 ml) sotto il banco pulito trasferimento crio-conservati per 300 ml di brodo nutriente sterile (NB) media (3 g / L di estratto di carne, 5 g / l di peptone, 10 g / L di NaCl). Successivamente agitare la soluzione per almeno 6 ore a 30 ° C per ottenere la pre-coltura per la coltivazione.
- Coltivare i batteri in condizioni aerobiche in NB mezzi a pH = 7,0, 30 ° C in 70 L scalata a vapore in-place bioreattore. Pertanto, riempire il reattore con ≈ 57 l di acqua deionizzata. Aggiungere e sciogliere i media NB solido direttamente a bioreattore (concentrazioni vedi sopra).
- Inoltre aggiungere agente antischiuma (30 ml / L NB-media) per i media a sopprimere la formazione di schiuma durante la coltivazione, poi in autoclave (122 ° C, temperatura di mantenimento di 30 min) i mediaall'interno della struttura del reattore.
- Raffreddare i mezzi di comunicazione ed eseguire completa saturazione di ossigeno. Aggiustare il pH a 7,0 (1 utilizzando MH 2 SO 4 e 2 M NaOH) e avviare l'inoculazione automatica del 300 ml precoltura. Avviare la registrazione dei dati dei parametri di coltivazione nel punto di inoculazione. Log parametri online per esempio, il livello di ossigeno disciolto (DO 2), aggiunta di acido e di base, e del valore pH all'interno della coltivazione.
- Monitorare la crescita batterica in linea dalle misure di torbidità non invasive.
- Eseguire campionamento supplementare dopo ogni ora di coltivazione e determinare ulteriore parametro come il peso bio secco (BDW) e la densità ottica offline (OD). Pertanto, raccogliere 20 ml di brodo coltura in ciascun punto di campionamento in condizioni sterili.
- Determinare offline OD da misurazioni fotometriche di adsorbimento a 600 nm. Utilizzare sterile filtrata NB-mezzo come un valore vuoto. A poppaer raggiungendo adsorbimento> 0,4 diluire la sospensione cellulare segue la linearità della legge di Lambert-Beer.
- Per la determinazione del BDW centrifuga 1 a 5 ml di sospensione batterica (seconda densità delle cellule) a 5.000 xg per 5 minuti a temperatura ambiente. Essiccare il pellet cellulare ottenuta a 105 ° C in un forno di riscaldamento fino alla stabilità di massa e misurare la massa pellet.
- Prendere immagini microscopiche con ottica di fase microscopio di ricerca contrasto 400 e 1000 ingrandimenti volte (contrasto di fase condensatore 2 e 3, rispettivamente) per il controllo della crescita batterica e come controllo contaminazione incrociata.
- Dopo aver raggiunto la fase di crescita esponenziale rilevata dalla linea dO 2 e torbidità online, raccogliere la biomassa mediante centrifugazione flow-through a 15.000 xg, a 4 ° C e lavare la biomassa due volte con tampone standard (50 mM Tris, 10 mM MgCl 2, 3 mM NaN 3, pH = 7,5).
Nota: Il pellet biomassa ottenuta può essere conservato a -18 & #176; C sino al successivo utilizzo per l'isolamento.
2. S-layer Protein isolamento e purificazione
Nota: Purificare polimeri SLP1 secondo un metodo adatto come descritto in precedenza 2,19,30,32,50,51.
- Omogeneizzare la biomassa grezzo lavato e scongelato ottenuto dalla coltivazione in tampone standard (1: 1 (w / v)) per rimuovere flagelli usando un dispersore (livello 3, 10 min) sotto raffreddamento bagno di ghiaccio a 4 ° C.
- Centrifugare la sospensione (8.000 xg, a 4 ° C per 20 min) e lavare il pellet ottenuto due volte con tampone standard (1: 1 (w / v)). Dopo il lavaggio e la centrifugazione (8000 xg, a 4 ° C per 20 min), risospendere il pellet nel tampone standard (1: 1 (w / v)), aggiungere DNasi II e RNasi (0,4 unità / g biomassa) alla sospensione e disintegrano le cellule a 1.000 bar con un omogeneizzatore ad alta pressione. Successivamente centrifugare la sospensione a 27.500 xg, a 4 ° C per 1 ora.
Nota: sospensione cellulare di controllo con i mi di ricercacroscope. Rottura è completato quando meno di 2 - 3 cellule intatte sono visibili nel campo Vista del microscopio in 400 ingrandimenti piega. - Lavare due volte il pellet con tampone standard (1: 1 (w / v)) e ripetere la centrifugazione. Successivamente risospendere il pellet nel tampone standard (2: 1 (w / v)) mescolato con 1% Triton X-100 e incubare per 20 min sotto successive scuotimento (100 rpm) per solubilizzare depositi lipidici.
- Centrifugare la soluzione (27.500 xg, a 4 ° C per 1 ora) e lavare i pellet ottenuti tre volte con tampone standard (1: 1 (w / v)).
- Incubare il pellet ottenuto dopo centrifugazione supplementare (27.500 xg, a 4 ° C per 1 ora) per 6 ore in tampone standard (1: 1 (w / v)) miscelato con 0,2 g / L lisozima, per idrolizzare legami di peptidoglicano 50. Inoltre aggiungere DNasi II e RNasi (ogni 0,4 unità / g biomassa) alla sospensione.
- Dopo centrifugazione (45.500 xg, a 4 ° C, 1 ora), risospendere il fase proteica bianco superiore con un basso volume di tlui centrifugazione surnatante (<30 ml) contenenti subunità proteiche.
- Solubilizzare la sospensione bianca mescolando 1: 1 con 6 M guanidina cloridrato (6 M GuHCl, 50 mM Tris, pH = 7,2). La soluzione diventa luminoso.
- Eseguire filtrazione sterile (0,2 micron) della soluzione trattata GuHCl seguita da una centrifugazione ad alta velocità supplementare (45.500 xg, a 4 ° C per 1 ora).
- Trasferire il surnatante in provette di membrana di dialisi (MWCO 50.000 Dalton) e dializzato contro tampone ricristallizzazione (TRIS 1,5 mm, 10 mM CaCl 2, pH = 8.0) per 48 ore.
- Trasferire la soluzione di bianco polimero proteico ricristallizzato in provette e centrifugare a 45.500 xg, 4 ° C per 1 ora. Risospendere il pellet in un basso volume di acqua ultrapura (<30 ml).
- Successivamente, trasferire la sospensione in tubi di membrana di dialisi e di eseguire una dialisi contro acqua ultrapura per 24 ore per rimuovere i contenuti del buffer.
Nota: Diversi cambiamenti di tampone o acqua ultrapura durante la dialisi sono indispensabili. - Lyophilize il SLP1 purificato in un liofilizzatore.
3. Caratterizzazione e quantificazione di SLP1 per gli esperimenti
Nota: la concentrazione SLP1 per assorbimento e rivestimento esperimenti sono stati quantificati mediante spettrofotometria UV-VIS.
- Pipettare 2 ml di campione SLP1 disciolto direttamente sul piedistallo di misura inferiore del fotometro. Determinare la concentrazione di proteine di adsorbimento massima alla lunghezza d'onda di 280 nm, caratteristico per le proteine. Utilizzare il coefficiente di estinzione di 0.61 per determinare la concentrazione SLP1. Utilizzare soluzione gratuita SLP1 per misurazioni di riferimento.
- Diluire la proteina con il tampone (per esperimenti di adsorbimento in modalità batch utilizzano 0,9% NaCl, pH = 6,0 e per esperimenti QCM-D utilizzano buffer di ricristallizzazione, pH = 8,0) alla concentrazione desiderata per esperimenti (1 g / L e 0,2 g / L rispettivamente).
- Analizzare la qualità SLP1 e peso molecolare dal bioanal normaelettroforesi ytical metodo di sodio dodecil solfato poliacrilammide (SDS-PAGE) descritta da Laemmli, Regno Unito 52.
- Eseguire SDS-PAGE prima di utilizzare SLP1 entro esperimenti e ad esempio, dopo Au (0) -NP incubazione utilizzando 10% gel di separazione poliacrilammide.
- Per SDS-campioni mix ≈10 ml di campione coltivazione o di proteine con il tampone (1.97 g TRIS, 5 mg di bromofenolo blu, 5,8 ml di glicerina, 1 g di SDS, 2,5 ml di β-mercaptoetanolo, si riempiono di acqua ultrapura a 50 ml) in un rapporto di 1: 1 (v / v) e pipetta la miscela dopo 4 min di incubazione a 95 ° C nelle tasche gel.
- Run SDS-PAGE 30 min ad una tensione di 60 V finché i campioni passano la raccolta gel e variazione di tensione di 120 V, una volta superato il gel di separazione.
- Rimuovere il gel dal sistema di gel, sciacquare con acqua ultrapura e luogo per 1 ora in una soluzione di fissaggio (acido acido 10%, il 50% di etanolo assoluto). In seguito, lavare il gel con acqua ultrapura.
- Gel Stainutilizzando un colloidale non specifica adapted Coomassie brillante metodo blu 53,54. Dopo la decolorazione 72,73, scattare immagini SDS-PAGE da parte del sistema di documentazione gel secondo il protocollo del produttore.
4. Gli esperimenti di adsorbimento in batch mode e quantificazione metallo
- Per lotto esperimenti di assorbimento preparano Au (III) soluzione madre da HAuCl4 ∙ 3 H 2 O, diluire il sale metallico e mescolare con la soluzione SLP1 / NaCl ad una concentrazione di metallo iniziale di 1 mm e concentrazione finale SLP1 di 1 g / l . Effettuare esperimenti in terzine con un controllo negativo supplementare senza SLP1. Utilizzare un volume totale di 5 ml per esperimenti di assorbimento.
- Agitare la sospensione continuamente a RT a diversi valori di pH preregolate tra 2,0-5,0 per 24 ore (regolare il pH con una soluzione di HCl e NaOH bassa concentrazione).
- Dopo assorbimento, centrifugare i campioni a 15.000 xg, 4 ° C per 20 min) a Separmangiato SLP1 da surnatante.
- Trasferire il surnatante in provette di ultrafiltrazione (MWCO 50.000 Da) e centrifugare a 15.000 xg questo, 4 ° C per 20 minuti per rimuovere i monomeri disciolti proteine.
- Determinare la concentrazione di metalli nel filtrato risultante da ICP-MS 19,20 e utilizzare i risultati per il back-calcolo sorbito metallo dalla massa secca SLP1. Misurare i principi, le opportunità del metodo e dei componenti dei macchinari usati per ICP-MS sono stati descritti in letteratura 55.
- Preparare i campioni e riferimenti per le misure ICP-MS con 1% HNO 3 come matrice e rodio come standard interno (1 mg / ml).
5. Sintesi di Au-NP e Determinazione della dimensione delle particelle
Nota: citrato stabilizzato Au (0) -NP sono stati sintetizzati secondo un metodo descritto in precedenza adattato da Mühlpfordt, H. et al. (1982) per ottenere particelle sferiche con un diametro di 10 - 15 nm 56,57 .
- Preparare una stabilizzato 25 HAuCl mm 4 ∙ 3 H 2 O stock per la formazione NP.
- Diluire 250 ml di questa soluzione in 19,75 ml di acqua ultrapura e incubare questi a 61 ° C per 15 minuti sotto i successivi agitazione.
- Preparare 5 ml di una seconda soluzione madre (12 mm di acido tannico, di 7 mm di citrato di sodio-idrato, 0.05 K mM 2 3 CO) e incubare la soluzione 2 ° separatamente a 61 ° C per 15 minuti.
- Aggiungere sotto costante agitazione la soluzione di riserva 2 al soluzione one. Mescolare la miscela di reazione per almeno 10 min a 61 ° C. Successivamente raffreddare la soluzione ed utilizzarla per il rivestimento NP su SLP1 reticolo all'interno QCM-D esperimenti.
Nota: Il Au risultante (0) -NP stati caratterizzati mediante spettroscopia UV-VIS al massimo assorbimento di 520 nm, tipicamente utilizzati per la rilevazione di formato Au (0) -NPs 58. La soluzione può essere conservato a 4 ° C. - Analizzare le dimensioni del formatoAu (0) -NP mediante spettroscopia di correlazione fotonica (PCS) che è anche conosciuto come dispersione dinamica della luce.
- Per la determinazione delle dimensioni NP, trasferire 1,5 ml di Au sintetizzato (0) -NP soluzione nella cuvette in condizioni privo di polvere in una scatola flusso laminare e analizzare con una dimensione e potenziale zeta sizer particella. Una descrizione dettagliata di PCS e preparazione del campione è dato in Schurtenberger, P. et al. (1993) 59 e Jain, R. et al. (2015) 60.
6. QCM-D Esperimenti - SLP1 rivestimento sulle superfici e Au-NP adsorbimento su SLP1 Lattice
Nota: Le misurazioni sono state effettuate con una QCM-D dotato di un massimo di quattro moduli di flusso. Tutti gli esperimenti QCM-D sono stati eseguiti con una portata costante di 125 microlitri / min a 25 ° C. Rivestimento SLP1 e metallo / NP incubazione sono stati fatti su SiO 2 sensori piezoelettrici di quarzo AT-cut (Ø 14 mm) con una frequenza fondamentale di ≈ 5 MHz. Risciacquo passi e aggiungereition di soluzione sono contrassegnati nelle figure dei risultati parte rappresentativa. Gli esperimenti QCM-D potrebbe essere descritto come un passo per passo modo che inizia con la pulizia e la modificazione superficiale dei sensori utilizzati seguita da ricristallizzazione SLP1 e successivamente sull'interazione NP metallo e metallo.
- Procedure di pulizia:
- Dotare le cellule del liquido con manichini del sensore. Pompa almeno 20 ml (ciascuno per modulo) di un agente detergente liquido alcalino (2% detergente in acqua ultrapura (v / v)) attraverso il sistema QCM-D e tubo. Successivamente pompare il volume di cinque volte (ciascuna per modulo) di acqua ultrapura attraverso il sistema (portata fino a 300 ml / min). Eseguire la pulizia secondo il protocollo del produttore.
- Pulire i SiO 2 sensori di fuori dei moduli di flusso mediante incubazione (almeno 20 min) a 2% soluzione di SDS e sciacquare i sensori in seguito più volte con acqua ultrapura 61,62.
- Asciugare i cristalli con comp filtrataressed aria e metterli in una camera di pulizia di ozono per 20 min 63,64.
- Ripetere la procedura di pulizia due volte per rimuovere tutti i contenuti organici.
- Per rimuovere i metalli legati dalla superficie del sensore sciacquare i sensori con 1 M HNO 3. Successivamente, eseguire tutte le operazioni di risciacquo con acqua ultrapura.
- Sensore modifica della superficie per polielettroliti:
Nota: modifica di superficie può essere effettuato sia all'interno (fluire attraverso procedura) o all'esterno del modulo di flusso (tecnica LBL). All'interno di questi esperimenti è stata utilizzata la seguente modo per modificare le superfici.- Modificare i sensori con 3 g / L di strati alternati di PE di polietilenimminico (PEI, MW 25.000) e polistirene sulfonato (PSS, MW 70.000) tramite dip coating utilizzando LBL tecnica 40,41 descritto in precedenza per il sistema utilizzato speciale nell'articolo di Suhr, M. et al. (2014) 19.
- Posizionare i sensori all'interno del PE-soluzione appropriata in profonda well piastre e incubare questi per 10 minuti a RT.
- Prendete i sensori di PE-soluzione e sciacquare i sensori tra ogni tuffo rivestimento passo intensamente con acqua ultrapura.
Nota: La nuova modifica superficie è costituita da almeno tre strati PE terminante con carica positiva PEI. - Dopo questa modifica esterna posizionare i sensori all'interno del modulo di flusso ed equilibrare i sensori risciacquando con acqua ultrapura prima di iniziare gli esperimenti.
- SLP1 monostrato Ricristallizzazione:
- Sciogliere SLP1 a 4 M di urea per convertire i polimeri in monomeri.
- Centrifugare le proteine a 15.000 xg monomerized, 4 ° C per 1 ora per rimuovere agglomerati di proteine più grandi.
- Mescolare il surnatante SLP1 solubilizzato e centrifugato con tampone ricristallizzazione ad una concentrazione proteica finale di 0,2 g / L.
Nota: Il calcio seconda ricristallizzazione SLP1 (auto-assemblaggio) inizia con l'aggiunta del recBuffer rystallization. Pertanto, la soluzione mista pompa con una portata di 125 ml / min per i sensori (posto all'interno moduli di flusso) immediatamente. La ricristallizzazione avviene dopo che i valori stabili di frequenza e di dissipazione turni sono stati individuati all'interno QCM-D esperimenti. - Dopo successo ricristallizzazione proteina sulla cima dei sensori PE-modificato all'interno dei moduli di flusso sciacquare i sensori rivestiti con tampone ricristallizzazione o ultrapura waterintensively con una portata di 125 ml / minuto fino a valori stabili di spostamenti di frequenza e di dissipazione sono stati rilevati.
Nota: La modifica SiO 2 superficie con PE per esperimenti di assorbimento successive Onto SLP1 monostrato e AFM studi viene visualizzato nella figura 1.

Figura 1. Schema di disegno di PE modifica della superficie e SLP1 monostratoPaint; Questa cifra è stata modificata da Suhr, M. et al. (2015) 19 con il permesso di Springer. Cliccate qui per vedere una versione più grande di questa figura.
- Metallo e metallo NP Interazione:
Nota: L'assorbimento con soluzione di sale di metallo Au (HAuCl4 ∙ 3 H 2 O) è stata effettuata in concentrazione 1 mM o 5 mM a pH = 6.0 in soluzioni di NaCl 0,9%. Au-NP assorbimento è stato fatto con puro Au-NP in 1,6 mm di buffer tri-sodio-citrato a pH ≈ 5.0.- Dopo il rivestimento SLP1 successo nei moduli di flusso, sciacquare lo strato SLP1 ottenuto intensamente con 0,9% NaCl finché sono stati rilevati valori stabili di spostamenti di frequenza e di dissipazione.
- Pompa la soluzione preparata in metallo (1 mM) e la soluzione NP ai moduli di flusso con una portata di 125 ml / min e monitorare l'adsorbimento di massa alla Sllivello p1. Adsorbimento di massa può essere rilevato direttamente tracciando i turni di frequenza che si riferiscono alla equazione Sauerbrey (equazione 1).
- Dopo aver completato l'interazione metallo e NP metallo, lavare lo strato di metallo / NP buffer libero per rimuovere deboli metalli o nanoparticelle collegate rilegati o deboli.
Nota: Un'illustrazione del setup sperimentale è mostrato in Figura 2.

Figura 2. Schema di disegno di Setup QCM-D utilizzando il modulo di flusso QFM 401 * 66. Cliccate qui per vedere una versione più grande di questa figura.
- Registrazione dei dati e valutazione:
- Registrare i cambiamenti di frequenza in Hz (Af n) e la dissipazione (ΔD n) Entro gli esperimenti QCM-D utilizzando QCM-D software specifico.
- Utilizzare per la valutazione della sensibilità di massa adsorbita (Δm) l'equazione / modello di Sauerbrey (Equazione 1) 65 66 valido per film sottili e rigidi accoppiati senza attrito sulla superficie del sensore applicato al n ° armonico. Il termine C (costante Sauerbrey) per l'usato 5 MHz a sensore di quarzo taglio è del 17,7 ng ∙ Hz -1 ∙ cm -2 68. Per rigida, distribuiti in modo uniforme, e gli strati adsorbiti sufficientemente sottili utilizzano Equazione 1 come una buona approssimazione.
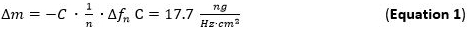
- Eseguire ulteriore modellazione secondo il modello di Kelvin-Voigt valido per molecole viscoelastici 68-71 con il software specifico produttore e confrontare i risultati con quella del modello Sauerbrey.
- Per il calcolo dello spessore dello strato e l'uso di adsorbimento di massaimportante parametro modellazione una densità strato dello strato adsorbito di 1,35 g ∙ cm -3 corrispondente ai valori descritti in precedenza per le proteine S-strato 72-75. Utilizzare lo stesso valore per il calcolo di interazione metallo con lo strato proteinico.
7. Misure AFM
- Effettuare studi con pienamente in grado AFM su un microscopio ottico invertito.
- Registra immagini AFM in liquido usando il tampone ricristallizzazione o acqua ultrapura direttamente sui sensori QCM-D rivestiti.
- Sciacquare i sensori con acqua ultrapura dopo gli esperimenti QCM-D e metterli all'interno della cellula fluido AFM. Pertanto, utilizzare una cella chiusa di fluido con un volume totale di circa 1,5 ml. Mantenere la temperatura del fluido costante di cella a 30 ° C.
- Utilizzare un cantilever con una frequenza di risonanza di ≈ 25 kHz in acqua e una rigidità di <0,1 N / m. Regolare la velocità di scansione tra 2,5 e 10 micron / sec.
- Prendere immagini in modalità contatto dinamico mentre il cantilever è eccitato da un piezoelettrico sulla propria frequenza di risonanza. Determinare la distanza del cantilever alla superficie dall'oscillazione smorzamento 76.
Nota: Le immagini vengono visualizzate con altezza z scala mentre valori z rappresentano la topografia esatta della superficie. Amplitude immagini (pseudo 3D) sono indicati senza z scala perché z valori di ampiezza dipendono i parametri di scansione e portano informazioni limitate. L'analisi delle immagini è stata effettuata utilizzando tre software di valutazione diverso di 77.
Risultati
Coltivazione di microrganismi e SLP1 Caratterizzazione
I dati registrati di crescita batterica indica la fine della fase di crescita esponenziale a circa 5 ore. Studi precedenti hanno dimostrato che SLP1 può essere isolato da questo punto di raccolta (4,36 g / L biomassa umida (≈ 1,45 g / L (BDW)) con una resa massima 19. Tuttavia, l'ottimizzazione della coltivazione utilizzando componenti o ...
Discussione
In questo lavoro ha studiato il legame di Au alle proteine S-layer è stata studiata utilizzando una combinazione di diversi metodi di analisi. In particolare, il legame di Au è molto interessante non solo per il recupero di Au da acque minerarie o soluzioni di processo, ma anche per la costruzione di materiali, ad esempio, superfici sensoriali. Per gli studi di interazione Au (Au (III) e Au (0) -NPs) con sospensione e ricristallizzata monostrato di SLP1, la proteina doveva essere isolato. Perta...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il presente lavoro è stato parzialmente finanziato dal IGF-progetto "S-Sieve" (490 ZBG / 1), finanziato dal BMWi e BMBF-progetto "Aptasens" (BMBF / DLR 01RB0805A). Un ringraziamento speciale a Tobias J. Günther per il suo prezioso aiuto durante gli studi AFM e di Erik V. Johnstone per aver letto il manoscritto come un madrelingua inglese. Inoltre, l'autore di questo articolo ringrazia Aline Ritter e Sabrina Gurlit (da Istituto di ecologia delle risorse per l'assistenza nelle misurazioni ICP-MS), Manja Vogel, Nancy Unger, Karen E. Viacava e la biotecnologia del gruppo del Helmholtz-Institut Freiberg per Technology Resource.
Materiali
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| Calcium chloride Dihydrate (CaCl2 ∙ 2H2O) | Merck KGaA | 1.02382 | --- |
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000-6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Gold(III) chloride trihydrate (HAuCl4 ∙ 3H2O) | Sigma-Aldrich Co. LLC. | 520918 | Danger |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein =90 %, =40,000 units/mg protein (Sigma) |
| Magnesium chloride Hexahydrate (MgCl2 ∙ 6H2O) | Merck KGaA | 1.05833 | --- |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50-100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Tri-sodium citrate dihydrate (C6H5Na3O7 ∙ 2H2O) | CARL ROTH GmbH+CO.KG | 3580.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50.000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
Riferimenti
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R., Atimtay, T. A., Sikdar, S. K. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. , 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B., Lovely, D. R. . Environmental Microbe-Metal Interactions. , 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. . Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. . Gold : science and applications. , (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, (1992).
- Günther, T. J. . S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. . Methods for general and molecular bacteriology. , 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C., Deutscher, M. P. [6] Quantitation of protein. Methods in Enzymology. 182, 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. . ICP Mass Spectrometry - The 30-Min to ICP-MS. , (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. . Colloidal Gold - Principles, Methods and Applications. , (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E., Buffle, J., van Leeuwen, H. P. . Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. 2, 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. . Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705 (2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. . Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , (2003).
- Jennings, T., Strouse, G. . Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon