Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Au-Взаимодействие SLP1 Полимеры и монослоя от
В этой статье
Резюме
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
Аннотация
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
Введение
В связи с увеличением использования золота в течение нескольких приложений, таких как электроника, катализаторы, биосенсоров, или медицинских инструментов, спрос этого драгоценного металла выросла за время последних нескольких лет 6-9. Золото, а также многие другие драгоценные и тяжелые металлы попадают в окружающую среду с помощью промышленных стоков в разбавленных концентрациях, через горнодобывающей деятельности и утилизации отходов 7,8,10, хотя большинство загрязнение окружающей среды тяжелыми металлами или драгоценными это непрерывный процесс в основном обусловлено технической деятельности. Это приводит к значительному вмешательству природных экосистем и потенциально может угрожать здоровью человека 9. Зная эти негативные последствия способствует поиск новых методов для удаления металлов из загрязненных экосистем и улучшения в переработке металлов из промышленных сточных вод. Налаженные физико-химические методы, такие как осаждение или ионного обмена, не так эффективны, особенно в высокийLY разбавляют решения 7,8,11. Биосорбция, либо с живых или мертвых биомассы, является привлекательной альтернативой для очистки сточных вод 10,12. Использование таких биологических материалов может уменьшить потребление токсичных химических веществ. Многие микроорганизмы были описаны накапливать или иммобилизации металлов. Например, клетки Lysinibacillus sphaericus (Л. sphaericus) JG-A12 показали высокие обязательные потенциала на драгоценные металлы, например, Pd (II), Pt (II) Au (III) и другие токсичные металлы, такие как Pb (II) или U (VI), 4,13, клетки Bacillus megaterium для Cr (VI) 14, клетки Saccharomyces CEREVISIAE для Pt (II) и Pd (II) 15, и хлореллы вульгарным для Au (III) и U (VI), 16 17. Связывание предыдущих металлов, таких как Au (III), Pd (II) и Pt (II), также сообщалось для Desulfovibrio desulfuricans 18 и для L. sphaericus JG-B53 19,20. Тем не менее, не альл микробы связать большое количество металлов и их применение в качестве материала сорбционной ограничено 12,21. Кроме того, связывающая способность металла зависит от различных параметров, например, состав ячейки, используется био-компонентов, или окружающей среды и экспериментальных условиях (рН, ионной силы, температуры и т.д.). Изучение отдельных фрагментов клеточной стенки 22,23, как мембранных липидов, белков пептидогликана, или других компонентов, помогает понять процессы комплекс, построенный целых клеток 8,21 связывания металла.
Компоненты клеточных сосредоточены на в этом исследовании, S-слой белков. S-слоя белков являются частями внешней клеточной оболочки многих бактерий и архебактерий, и они составляют около 15 - 20% от общей массы белка этих организмов. В качестве первого интерфейса для окружающей среды, эти клеточные соединения сильно влияют на бактериальные сорбционными свойствами 3. S-слоя белков с молекулярными массами в пределах от сорокадо сотен кДа производятся внутри клетки, но собраны пределами, где они способны образовывать слои на липидные мембраны или полимерных компонентов клеточной стенки. После выделения, почти все S-слой белки имеют внутреннее свойство спонтанно самоорганизуются в суспензии, на границах или на поверхностях, образующих плоские или трубчатые структуры, подобные 3. Толщина белка монослоя зависит от бактерий и находится в пределах диапазона от 5 - 25 нм 24. В общем, образованные белковые структуры S-слой может иметь косой (Р1, Р2), квадрат (Р4), или шестиугольной (P3 и P6) симметрии с постоянной решетки от 2,5 до 35 нм 3,24. Формирование решетки, кажется, во многих случаях в зависимости от двухвалентных катионов и в основном на Ca 2+ 25,26, Рафф, J. и др. S-слой на основе нанокомпозитов для промышленного применения в основе белка Engineered наноструктур. (ред Тияна З. Роща & Aitziber Л. Cortajarena) (Спрингер, 2016 (представлен)). Тем не менее, полное реакция каскад мономера складывания, мономер-мономер взаимодействия, формирование решетки, и роли различных металлов, особенно двухвалентных катионов, таких как Са 2+ и Mg 2+, до сих пор полностью не поняты.
Грамм-положительные штамм L. sphaericus JG-B53 (переименован из Bacillus sphaericus после нового филогенетического классификации) 27 был выделен из уранового отвал "Хаберланд" (Johanngeorgenstadt, Саксония, Германия) 4,28,29. Его функциональное S-слоя белков (SLP1) обладает квадратную решетку, молекулярную массу 116 кДа, 30 и толщину ≈ 10 нм на живые клетки бактерий 31. В предыдущих исследованиях, формирование в пробирке закрытом и стабильного слоя белка с толщиной приблизительно 10 нм было достигнуто менее чем за 10 мин 19. Соответствующее штамма L. sphaericus JG-А12, также изолят от "Хаберланд" кучи, обладает высокой металлические обязательные потенциала и его изолированный белок S-слой показал высокую химическую и механическую стабильность и хорошие темпы сорбции на драгоценные металлы, как Au (III) Pt (II) и Pd (II) 4,32,33. Эта привязка драгоценных металлов является более или менее специфичные для некоторых металлов и зависит от наличия функциональных групп на наружной и внутренней поверхности белка полимера и в его поры, ионной силы и рН. Соответствующие функциональные группы для обработки металлов взаимодействия по белков являются COOH-, NH 2 -, ОН, ПО 4 -, SO 4 - и SO-. В принципе, связывание металлов мощности открыть широкий спектр применений, Рафф, J. и др. S-слой на основе нанокомпозитов для промышленного применения в основе белка Engineered наноструктур. (ред Тияна З. Роща & Aitziber Л. Cortajarena) (Спрингер, 2016 (представлен)). например, как biosorptive компоненты для удаления или восстановлениярастворенных токсичных или ценных металлов, шаблоны для синтеза или определенной осаждения регулярно структурированных металлических наночастиц (NPS) для катализа и других био-инженерии материалов, таких как био-сенсорная слоев 3,5,18,33. Регулярно расположенные массивы NP как Au (0) -NPs могут быть использованы для основных приложений, начиная от молекулярной электроники и биосенсоров, сверхвысоких устройств хранения плотность, и катализаторов для окисления СО-34-37. Разработка таких приложений и смарт-дизайн этих материалов требует глубокого понимания основных металлических обязательных механизмов.
Необходимым условием для развития таких био-материалов на основе является надежным реализация интерфейса слой между биомолекулы и технического поверхности 38,39. Например, полиэлектролиты собран с слой за слоем (LBL) 40,41 техники были использованы в качестве интерфейса слоя для перекристаллизации S-слоя белков 39 . Такой интерфейс предлагает относительно легкий путь, чтобы выполнить белка покрытие воспроизводимым и количественно. Выполняя различные эксперименты с и без модификации с клеем промоутеров, это можно сделать заявления относительно покрытия кинетики, стабильность слой и взаимодействие металлов с биомолекул 19,42, Рафф, J. и др. S-слой на основе нанокомпозитов для промышленного применения в основе белка Engineered наноструктур. (ред Тияна З. Роща & Aitziber Л. Cortajarena) (Спрингер, 2016 (представлен)). Тем не менее, сложный механизм адсорбции белка и белка поверхности взаимодействия не изучены. Особенно информация о конформации, ориентации потоков, и плотности покрытия по-прежнему отсутствует.
Пьезокварцевые с мониторингом диссипации (QCM-D) техника привлекла внимание в последние годы в качестве инструмента для изучения адсорбции белка, покрытие кинетики и взаимодействия PROпроцессов на нанометровом масштабе 19,43-45. Этот метод позволяет для детального обнаружения массового адсорбции в режиме реального времени, и может быть использовано в качестве индикатора белка самосборки процесса и сочетания функциональных молекул белка на решетках 19,20,42,46-48. Кроме того, QCM-D измерения открыть возможность для изучения процессов взаимодействия металла с белковым слоем в естественных биологических условиях. В недавнем исследовании, взаимодействие белка S-слоя с выбранными металлов, таких как Eu (III), Аи (III), Pd (II) и Pt (II), был изучен с МККМ-D 19,20. Слой адсорбированный белок может служить в качестве упрощенной модели клеточной стенки грамположительных бактерий. Изучение этого одного компонента может способствовать более глубокому пониманию взаимодействия металл. Тем не менее, исключительно QCM-D эксперименты не позволяют заявления о поверхностных структур и влияния металлов в белок. Другие методы, необходимые для получения такой информации. Один посность для визуализации биологических наноструктур и получения информации о структурных свойств атомно-силовой микроскопии (АСМ).
Целью представленной работы было изучение сорбции золота (Au (III) и Au (0) -NPs) для S-слоя белков, в частности SLP1 Л. sphaericus JG-B53. Эксперименты проводились со взвешенными белков на пакетном масштабе в диапазоне рН от 2,0 - 5,0 с помощью ICP-MS и с иммобилизованными S-слоев с помощью QCM-D. Кроме того, влияние раствора соли металла на устойчивость решетки была исследована с последующими исследованиями АСМ. Сочетание этих методов способствует лучшему пониманию процессов пробирке взаимодействия металл в качестве инструмента для получения дополнительной информации о связывании события на целых бактериальных клеток в отношении конкретных металлических сродства. Это знание не только решающее значение для развития действующих фильтрующих материалов для восстановления металлов для защиты окружающей среды и сохранения реисточники 49, но также для развития массивов высоко упорядоченных металлических наночастиц для различных технических приложений.
Access restricted. Please log in or start a trial to view this content.
протокол
1. микроорганизма и условий выращивания
Примечание:. Все эксперименты были проведены в стерильных условиях Л. sphaericus JG-B53 была получена из крио сохранились культуры 29,30.
- Передача крио-сохраняется культуры (1,5 мл) под чистом столе до 300 мл стерильной питательный бульон (NB) сред (3 г / л экстракта мяса, 5 г / л пептона, 10 г / л NaCl). Затем Раствор перемешивают в течение по крайней мере 6 ч при 30 ° С для получения предварительной культуры для выращивания.
- Развивайте бактерии в аэробных условиях в NB СМИ при рН = 7,0, 30 ° C в 70 л масштабируется пара в месте биореактор. Поэтому, заполните реактор ≈ 57 л деионизированной воды. Добавить и растворить твердую NB медиа непосредственно в биореакторе (концентрации см. Выше)
- Кроме того добавьте пеногаситель (30 мкл / л NB-медиа) в средствах массовой информации, чтобы подавить образование пены во время выращивания, то автоклав (122 ° С, температура время выдержки 30 мин) СМИвнутри реакторной установки.
- Охладить СМИ и выполнять полное насыщение кислородом. Доводят рН до 7,0 с использованием 1 (H 2 SO 4 и 2 M NaOH) и начать автоматическое инокуляции 300 мл предварительной культуры. Начало записи данных параметров культивирования в точке прививки. Вход через Интернет параметры например, уровень растворенного кислорода (DO 2) присоединения кислот и оснований и рН-значения в пределах культивирования.
- Монитор бактериального роста в Интернете, неинвазивных измерений мутности.
- Выполнение дополнительных проб после каждого часа культивирования и определит дальнейшее параметр, например, био сухого веса (BDW) и в автономном режиме оптической плотности (OD). Таким образом, собирают 20 мл бульона культивирования в каждой точке отбора проб в стерильных условиях.
- Определить форума OD по фотометрических измерений адсорбции при 600 нм. Используйте стерильную отфильтрованный NB-среду как пустое значение. Кормовойэ достижения адсорбции под> 0.4 развести клеточной суспензии следующий линейности закона Ламберта-Бера.
- Для определения BDW центрифуги 1 до 5 мл бактериальной суспензии (в зависимости от плотности клеток) при 5000 х г в течение 5 мин при комнатной температуре. Сушат полученный осадок клеток при 105 ° С в нагревательной печи до массового стабильности и измерения массы гранул.
- Возьмите микроскопические изображения с оптическим фазовым контрастом исследования микроскопом в 400 и 1000 кратном увеличении (фазовый контраст конденсатора 2 и 3, соответственно) для проверки бактериального роста и в качестве контроля перекрестного загрязнения.
- После достижения экспоненциальной фазе роста, обнаруженного в Интернете сделать 2 и онлайн мутность, урожай биомассы с помощью проточной центрифугированием при 15000 х г, 4 ° С и мыть биомассу дважды стандартном буфере (50 мМ Трис, 10 мМ MgCl 2, 3 мМ NaN 3, рН = 7,5).
Примечание: Полученный осадок биомассы можно хранить при -18 & #176; С до дальнейшего использования для изоляции.
2. S-слой белка Выделение и очистка
Примечание: Очищают SLP1 полимеров в соответствии с адаптированной методике, описанной ранее 2,19,30,32,50,51.
- Однородный промытый и размороженный сырой биомассы, полученной из культуры в стандартном буфере (1: 1 (вес / объем)), чтобы удалить жгутики с помощью диспергатора (уровень 3, 10 мин) при охлаждении на ледяной бане при температуре 4 ° С.
- Центрифуга суспензии (8000 XG, 4 ° C в течение 20 мин) и промывают осадок дважды полученный с помощью стандартного буфера (1: 1 (вес / объем)). После промывки и центрифугирования (8000 х г, 4 ° С в течение 20 мин), ресуспендируют осадок в стандартном буфере (1: 1 (вес / объем)), добавьте ДНКазы II и РНКазы (0.4 ед / г биомассы) к суспензии и распадаются клетки при 1000 бар в гомогенизаторе высокого давления. Затем центрифугируют при 27500 подвеску мкг, 4 ° С в течение 1 часа.
Примечание: управления клеточной суспензии с научно-исследовательскими миcroscope. Разрыв завершается, когда менее чем за 2 - видны в поле зрения микроскопа в 400 кратном увеличении 3 неповрежденные клетки. - Промыть гранулу дважды стандартном буфере (1: 1 (вес / объем)) и выполнять центрифугирование снова. После ресуспендируют осадок в стандартном буфере (2: 1 (вес / объем)), смешанный с 1% Тритон Х-100 и инкубируют ее 20 мин при последовательном встряхивании (100 оборотов в минуту), чтобы растворить липидных отложений.
- Центрифуга раствор (27500 мкг, 4 ° С в течение 1 ч) и мыть Полученный осадок три раза стандартном буфере (1: 1 (вес / объем)).
- Инкубируйте Осадок, полученный после дополнительной центрифугированием (27500 х г, 4 ° С в течение 1 ч) в течение 6 ч в стандартном буфере (1: 1 (вес / объем)) в смеси с 0,2 г / л лизоцима, чтобы гидролизовать связи в пептидогликана 50. Кроме того добавьте ДНКазы II и РНКазы (каждый 0,4 единиц / г биомассы) в суспензии.
- После центрифугирования (45500 х г, 4 ° C, 1 час), ресуспендируют верхнюю белую белковую фазу с низким объемом тон центрифугирования супернатант (<30 мл), содержащие субъединицы. белка
- Солюбилизации белую суспензию путем смешивания 1: 1 с 6 М гидрохлорида гуанидина (6 М GuHCl, 50 мМ Трис, рН = 7,2). Решение становится ярким.
- Выполнение стерильной фильтрации (0,2 мкм) GuHCl обработанного раствора с последующим дополнительным высокоскоростным центрифугированием (45500 х г, 4 ° C в течение 1 часа).
- Передача супернатант к диализной мембраны трубок (MWCO 50000 Дальтон) и диализовали против его рекристаллизации буфера (1,5 мМ Трис, 10 мМ CaCl 2, рН = 8,0) в течение 48 ч.
- Передача белого рекристаллизованную белок полимерного раствора в пробирки и центрифуге при 45,500 мкг, 4 ° С в течение 1 часа. Ресуспендируют осадок в небольшом объеме сверхчистой воды (<30 мл).
- Впоследствии, передать суспензии в диализных мембран труб и выполнить диализ против сверхчистой воды в течение 24 часов, чтобы удалить содержимое буфера.
Примечание: Некоторые изменения буфера или сверхчистой воды Dтором диализа не обойтись. - Лиофилизировать очищенный SLP1 в сублимационная сушилка.
3. Характеристика и Количественная SLP1 для экспериментов
Примечание: концентрация SLP1 для сорбции и покрытий экспериментов количественно UV-VIS спектрометрии.
- Внесите 2 мкл образца, растворенного в SLP1 непосредственно на нижнюю измерения пьедестала фотометр. Определить концентрацию белка в адсорбционном максимум при длине волны 280 нм, характерной для белков. Используйте коэффициент экстинкции 0,61 для определения концентрации SLP1. Используйте SLP1 бесплатное решение для справочных измерений.
- Развести белка буфером (для сорбции экспериментов в периодическом режиме используют 0,9% NaCl, рН = 6,0 и для QCM-D Эксперименты использовать рекристаллизации буфера, рН = 8,0) до требуемой концентрации для экспериментов (1 г / л и 0,2 г / л соответственно).
- Анализ SLP1 качество и молекулярную массу от стандартной bioanalytical электрофореза метод додецилсульфат натрия полиакриламидном (SDS-PAGE) описывается Laemmli, UK 52.
- Выполните SDS-PAGE перед использованием SLP1 в экспериментах и, например, после Аи (0) -np Инкубационный с использованием 10% гели разделения в полиакриламидном.
- Для SDS-образцов смеси ≈10 мкл выращивания или белка образца с буфером для образцов (1,97 г Трис, 5 мг бромфенола синий, 5,8 мл глицерина, 1 г SDS, 2,5 мл -меркаптоэтанол, заполните сверхчистой водой до 50 мл) в отношение 1: 1 (объем / объем) и пипетку смеси после 4 мин инкубации при 95 ° С в карманы геля.
- Выполнить SDS-PAGE 30 мин при напряжении 60 В до образцов пройти коллекция геля и изменения напряжения до 120 V, проходящий раз гель разделения.
- Удалить гели из системы гель, промыть водой и сверхчистой месте в течение 1 ч в фиксирующем растворе (10% уксусная кислота, 50% абсолютного этанола). Впоследствии, ополосните гели с особо чистой воды.
- Пятно гелис помощью адаптированного неспецифическую коллоидный Кумасси бриллиантовый синий метод 53,54. После Обесцвечивание 72,73, снимать, SDS-PAGE системой гель документации в соответствии с протоколом производителя.
4. Сорбционные Эксперименты в пакетном режиме и количественной Metal
- Для партии сорбционные эксперименты подготовить Au (III) маточного раствора из HAuCl 4 ∙ 3 H 2 O, разбавленной соли металла и смешать его с раствором SLP1 / NaCl в начальной концентрации металла 1 мм, а конечной концентрации SLP1 1 г / л , Выполнение экспериментов в триплетов с дополнительным отрицательным контролем без SLP1. Использование общего объема 5 мл для сорбции экспериментов.
- Встряхните приостановления непрерывно РТ в различных заранее отрегулировать рН между 2,0 до 5,0 в течение 24 ч (отрегулируйте рН с низкой концентрации HCl и NaOH раствора).
- После сорбции, Центрифуга образцов при 15000 х г, 4 ° C в течение 20 мин), чтобы Separели SLP1 из супернатанта.
- Передача супернатант в ультрафильтрационных трубок (MWCO 50000 Да) и центрифуги при 15000 этот мкг, 4 ° C в течение 20 мин для удаления растворенных мономеров белка.
- Определить концентрацию металла в результате фильтрата ICP-MS 19,20 и использовать результаты для задней расчета сорбированного металла в сухой массе SLP1. Измерение принципы, возможности метода и компонентов используемого ICP-MS были описаны в литературе 55.
- Подготовка образцов и ссылки для измерений ICP-MS с использованием 1% HNO 3 в качестве матрицы и родия в качестве внутреннего стандарта (1 мг / мл).
5. Синтез Au-НП и определение размера частиц
Примечание: цитрат стабилизировалась Au (0) -np были синтезированы в соответствии с адаптированной методике, описанной ранее Mühlpfordt H. и др. (1982), чтобы получить сферические частицы с диаметром 10 - 15 нм 56,57 .
- Подготовка стабилизируется 25 мМ HAuCl 4 ∙ 3 H 2 O акции для формирования НП.
- Развести 250 мкл исходного раствора этом в 19,75 мл сверхчистой воды и инкубируют их на 61 ° С в течение 15 мин при последовательном встряхивании.
- Подготовьте 5 мл второго раствора (12 мм дубильные кислоты, 7 мМ цитрата натрия ди-гидрата, 0,05 мМ K 2 CO 3) и инкубировать 2-й решение отдельно в 61 ° С в течение 15 мин.
- Добавить при постоянном перемешивании 2-й маточного раствора в раствор одного. Реакционную смесь перемешивают в течение по крайней мере 10 мин при 61 ° С. После охлаждения раствор и использовать его для НП покрытия на SLP1 решетки в QCM-D экспериментов.
Примечание: в результате Au (0) -np характеризовались UV-VIS-спектроскопии на оптической плотности не более 520 нм, обычно используемый для обнаружения образованного Au (0) -NPs 58. Раствор можно хранить при температуре 4 ° С. - Анализ размер образовавшийсяAu (0) -np по фотонной корреляционной спектроскопии (PCS), который также известен как динамического светорассеяния.
- Для определения размера НП, передать 1,5 мл синтезированного Au (0) -np раствора в кюветах в условиях без пыли в коробке потока ламинарного и проанализировать его с размером и дзета-потенциала частиц классификатор. Подробное описание PCS и пробоподготовки дано в Schurtenberger P. и др. (1993) 59 и Джейн, R. и др. (2015) 60.
6. QCM-D Эксперименты - SLP1 покрытие на поверхностях и Аи-НП Адсорбция на SLP1 решеткой
Примечание: Измерения проводились с МККМ-D, оснащенного до четырех модулей потока. Все QCM-D были проведены эксперименты с постоянной скоростью потока 125 мкл / мин при 25 ° С. SLP1 покрытия и металл / НП Инкубационный были сделаны на SiO 2 пьезоэлектрических АТ-среза кварца датчиков (Ø 14 мм) с основной частотой ≈ 5 МГц. Промывка шаги и добавитьition решения обозначены на рисунках представительного результатов части. В QCM-D эксперименты могут быть описаны как шаг за шагом образом, начиная с очистки и модификации поверхности, используемых датчиков с последующим SLP1 перекристаллизации, а затем на металла и металлопродукции НП взаимодействия.
- Очистка процедуры:
- Одета в жидкости клетки с датчиков манекенов. Насос по крайней мере, 20 мл (каждый на модуль) щелочного жидкого моющего средства (2% моющего средства в сверхчистой воде (объем / объем)) через QCM-D и трубки системы. Впоследствии насос пятикратный объем (каждый на модуль) в особо чистой воды через систему (расход до 300 мкл / мин). Выполните очистку в соответствии с протоколом производителя.
- Очистите SiO 2 датчиков вне модулей потока путем инкубации (по крайней мере, 20 мин) в 2% -ном растворе SDS и промойте датчики впоследствии несколько раз сверхчистой водой 61,62.
- Высушите кристаллы с фильтрованной компеволосы погладила воздух и поместите их в камеру очистки озоном в течение 20 мин 63,64.
- Повторите процедуру очистки в два раза, чтобы удалить все органические содержимое.
- Чтобы удалить связанные металлы из поверхности датчика ополосните датчики с 1 М HNO 3. Впоследствии, выполнять все действия с промывки сверхчистой воды.
- Датчик модификацию поверхности полиэлектролитов:
Примечание: Модификация поверхности может быть сделано либо в (течь через процедуру) или вне модуля потока (Lbl метод). В этих экспериментах была использована следующая способ модификации поверхностей.- Измените датчики с 3 г / л чередующихся слоев ПЭ полиэтиленимином (PEI, МВт 25,000) и полистиролсульфоната (PSS, МВт 70,000) через окунанием с помощью LBL технику 40,41 описанной ранее для специальной используемой системой в статье Зур, М. и др. (2014) 19.
- Поместите датчики внутри соответствующей PE-решения в глубоком WELL пластины и инкубировать их в течение 10 мин при комнатной температуре.
- Возьмите датчики из PE-решения и промойте датчики между каждой стадии нанесения покрытия погружением интенсивно с особо чистой воды.
Примечание: Новая модификация поверхность состоит из, по меньшей мере три слоя полиэтиленовой завершающий с положительно заряженным PEI. - После этого внешнего модификации разместить датчики внутри модуля потока и уравновешивают датчиков путем промывки сверхчистой водой перед началом экспериментов.
- SLP1 однослойная перекристаллизации:
- Растворите SLP1 в 4 М мочевины для преобразования полимеров на мономеры.
- Центрифуга monomerized белки при 15000 х г, 4 ° С в течение 1 часа, чтобы удалить крупные белковые агломераты.
- Смешайте солюбилизированного и центрифугировали супернатант SLP1 с рекристаллизации буфере до конечной концентрации белка 0,2 г / л.
Примечание: в зависимости кальция рекристаллизации SLP1 (самосборки) начинается с того РЭЦrystallization буфера. Таким образом, насос смешанного раствора с расходом 125 мкл / мин до датчиков (помещенной внутри модулей потока) немедленно. Перекристаллизацию сделано после стабильных значений были обнаружены в QCM-D экспериментов частоты и рассеивания сдвигов. - После успешного перекристаллизации белка в верхней части ПЭ-модифицированных датчиков внутри модулей потока промыть покрытием датчики с буфером перекристаллизации или сверхчистых waterintensively с расходом 125 мкл / мин до стабильных значений частоты и диссипации сдвигов были обнаружены.
Примечание: модификация поверхности SiO 2 с PE для более поздних сорбции экспериментов на SLP1 монослойных и АСМ исследований визуализируется на рисунке 1.

Рисунок 1. Схема Дизайн PE модификации поверхности и SLP1 монослояПокрытие; Эта цифра была изменена с Suhr, М. и др. (2015) 19 с разрешения Springer. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Металлов и НП Взаимодействие:
Примечание: сорбции с раствором соли металла Au (HAuCl 4 ∙ 3 Н 2 О) проводили в концентрации 1 мМ или 5 мМ при рН = 6,0 в 0,9% NaCl решений. Au-НП адсорбции было сделано с неразбавленным Au-парков в 1,6 мм три-натрия цитрат буфера при рН ≈ 5,0.- После успешного SLP1 покрытия в модулях потока, промыть, полученный слой SLP1 интенсивно 0,9% раствора NaCl, пока не были обнаружены устойчивые значения частоты и рассеивания сдвигов.
- Насос приготовленный раствор металла (1 мм) и раствор NP к модулям потока с расходом 125 мкл / мин и отслеживать массовое адсорбции на SlP1 слой. Масс-адсорбции могут быть обнаружены непосредственно путем отслеживания сдвиги частоты, относящиеся к уравнению (Сауэрбрей уравнение 1).
- После завершения металлов и NP взаимодействие, промыть слой металла / NP свободного буфера для удаления слабых связанные или слабые приложенные металлов или наночастиц.
Примечание: иллюстрации экспериментальной установки показана на рисунке 2.

Рисунок 2. Схематическое Дизайн QCM-D Flow установки с использованием модуля Qfm 401 * 66. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Запись данных и оценка:
- Запишите изменения в частоте в Гц (; F н) и диссипации (ΔD п) В QCM-D экспериментов с использованием МККМ-D специальное программное обеспечение.
- Используйте для оценки адсорбированного массовой чувствительности (Δm) Сауэрбрей уравнение / модели (уравнение 1) 65 66, которая действует для тонких и жестких пленок в сочетании без трения на поверхности датчика, приложенного к п-й обертон. Термин С (Сауэрбрей постоянная) для используемого 5 МГц при кварцевого датчика вырезать 17,7 нг ∙ Гц -1 ∙ см -2 68. Для жесткой, равномерно распределяется, и достаточно тонкие слои адсорбированных использовать уравнение 1 в хорошем приближении.
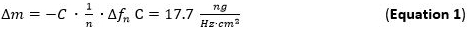
- Выполните дополнительного моделирования в зависимости от модели Кельвина-Фойгта действительный для вязкоупругих молекул 68-71 с производителем специального программного обеспечения и сравнить результаты с тем модели Сауэрбрей.
- Для расчета толщины слоя и массового использования адсорбциикак важный параметр моделирования плотности слой адсорбированного слоя 1,35 г ∙ см -3 соответствующие значениям, описанных ранее для S-слоя белков 72-75. Используйте то же для расчета металлической взаимодействия с белковым слоем.
7. АСМ измерения
- Выполните исследования с полностью способным АСМ на перевернутом оптического микроскопа.
- Запись АСМ-изображения в жидкости, используя буфер рекристаллизации или особо чистой воды непосредственно на покрытых QCM-D датчиков.
- Промыть датчики с особо чистой воды после QCM-D экспериментов и поместить их внутрь жидкости клетки АСМ. Таким образом, применять закрытую жидкости клетки с общим объемом около 1,5 мл. Поддерживать температуру постоянной жидкости клеток при 30 ° С.
- Использование консоли с резонансной частотой ≈ 25 кГц в воде и жесткости <0,1 Н / м. Отрегулируйте скорость сканирования между 2,5 и 10 мкм / сек. Возьмите изображения в динамическом режиме в то время как контакт кантилевера возбуждаются пьезоэлементом на ее резонансной частоте. Определить расстояние кантилевера к поверхности с помощью гашения колебаний 76.
Примечание: Высота изображения показаны г-масштабе, а Z-значения представляют собой точную топографию поверхности. Амплитуда (Псевдо 3D) изображения показаны без г-масштабе, потому что амплитуда Z-значения зависят от параметров сканирования и несут ограниченную информацию. Анализ изображений проводили с помощью трех различных программное обеспечение для оценки о 77.
Access restricted. Please log in or start a trial to view this content.
Результаты
Выращивание микроорганизмов и SLP1 Характеристика
Записанные данные роста бактерий указывает на конец экспоненциальной фазе роста на уровне около 5 ч. Предыдущие исследования показали, что SLP1 может быть выделен из этой точки ?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этой работе изучали связывание АС S-слоя белков была исследована с использованием комбинации различных аналитических методов. В частности, связывание Au является очень привлекательным не только для восстановления золота из шахтных вод или технологических решений, но и для строитель?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Настоящая работа была частично финансируется IGF-проекта «С-Сито" (490 ZBG / 1), финансируемой BMWi и BMBF-проекта "Aptasens" (BMBF / DLR 01RB0805A). Особая благодарность Тобиас Дж Гюнтер для его ценную помощь во время АСМ исследований и Эрик Джонстон В. за чтение рукописи, как носителем английского языка. Кроме того, автор этой статьи хотелось бы поблагодарить Алине Риттер и Sabrina Gurlit (от Института экологии ресурсов для помощи в измерениях ICP-MS), Маня Фогель, Нэнси Унгер, Карен Е. Viacava и группа биотехнологии Гельмгольца-Института Фрайберг для Технология ресурсов.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000 - 6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein = 90 %, = 40,000 units/mg protein (Sigma) |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50 - 100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50,000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
Ссылки
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. Atimtay, T. A., Sikdar, S. K. , Springer. 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B. Environmental Microbe-Metal Interactions. Lovely, D. R. , ASM Press. Washington. 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , Forschungszentrum Rossendorf. Dresden. (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , Technische Universität Dresden. (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, Rice University . Houston. 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. Gold : science and applications. , CRC Press - Taylor&Francis Group. (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, Dr Dietrich Steinkopff Verlag. (1992).
- Günther, T. J. S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , Technische Universität Dresden. (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. Methods for general and molecular bacteriology. , American Society for Microbiology. 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C. [6] Quantitation of protein. Methods in Enzymology. Deutscher, M. P. 182, Academic Press. 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. ICP Mass Spectrometry - The 30-Min to ICP-MS. , PerkinElmer. USA. (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. Colloidal Gold - Principles, Methods and Applications. , Academic Press. (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E. Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. Buffle, J., van Leeuwen, H. P. 2, Lewis Publishers. 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705(2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , Technische Universität Dresden. (2003).
- Jennings, T., Strouse, G. Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , Springer. 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены