É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Au-Interação de Slp1 Polímeros e monocamada de
Neste Artigo
Resumo
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
Resumo
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
Introdução
Devido ao crescente uso de ouro para diversas aplicações como eletrônica, catalisadores, biossensores, ou instrumentos médicos, a procura deste metal precioso tem crescido ao longo dos últimos anos de tempo 6-9. Ouro, bem como muitos outros metais preciosos e pesados são liberados no ambiente através de efluentes industriais em concentrações diluídas, por meio de atividades de mineração, e eliminação de resíduos 7,8,10, embora a maioria contaminação ambiental por metais pesados ou preciosos é um processo em curso causada principalmente por atividades tecnológicas. Isto leva a uma interferência significativa dos ecossistemas naturais e pode potencialmente ameaçar a saúde humana 9. Conhecendo esses resultados negativos promove a busca por novas técnicas para remover metais de ecossistemas e melhorias contaminados na reciclagem de metais de efluentes industriais. Métodos físico-químicos bem estabelecidos como precipitação ou permuta de iões não são tão eficazes, especialmente em altaly diluída soluções 7,8,11. Biossorção, quer com a vida ou biomassa morta, é uma alternativa atraente para o tratamento de águas residuais 10,12. O uso de tais materiais biológicos pode reduzir o consumo de produtos químicos tóxicos. Muitos microrganismos têm sido descritos para acumular ou imobilizar metais. Por exemplo, células de Lysinibacillus sphaericus (L. sphaericus) JG-A12 mostraram capacidades de ligação elevadas para os metais preciosos, por exemplo, Pd (II), Pt (II), Au (III), e outros metais tóxicos como o Pb (II) ou L (VI) 4,13, células de Bacillus megaterium para o Cr (VI), 14, células de Saccharomyces cerevisiae para Pt (II) e Pd (II) 15, e Chlorella vulgar para Au (III) e U (VI) 16 , 17. A ligação de metais anteriores como Au (III), Pd (II) e Pt (II), também tem sido relatado para Desulfovibrio desulfuricans 18 e para L. sphaericus JG-B53 19,20. No entanto, não all micróbios vincular quantidades elevadas de metais e sua aplicação como material de sorção é limitada 12,21. Além disso, a capacidade de ligação do metal depende de diferentes parâmetros, por exemplo, a composição celular, o bio-componente usado, ou condições ambientais e experimentais (pH, força iónica, temperatura, etc.). O estudo dos fragmentos da parede celular isolado 22,23, como lípidos da membrana, peptidoglycan, proteínas ou outros componentes, ajuda a compreender os processos de células inteiras construídas complexas 8,21 vinculativo metal.
Os componentes celulares com foco em neste estudo são proteínas S-layer. Proteínas S-camada são partes do envelope celular externo de muitas bactérias e archaea, e que constituem cerca de 15 - 20% da massa de proteína total destes organismos. À medida que a primeira interface para o meio ambiente, estes compostos celulares influenciam fortemente as propriedades de sorção bacterianas 3. Proteínas S-layer com pesos moleculares variando de quarentaa centenas de kDa são produzidos dentro da célula, mas são montados no exterior, onde eles são capazes de formar camadas nas membranas lipídicas ou poliméricas componentes da parede celular. Uma vez isolado, quase todos os S-layer proteínas têm a propriedade intrínseca à espontaneamente auto-montar em suspensão, nas interfaces, ou em superfícies planas ou formando tubo-como estruturas 3. A espessura da monocamada de proteína depende das bactérias e está dentro de uma gama de 5 - 24 25 nm. Em geral, as estruturas de proteínas S-camada formada pode ter uma oblíqua (P1 ou P2), quadrada (P4) ou hexagonal (P3 ou P6) simetria com constantes de rede de 2,5 a 35 nm, 3,24. A formação da estrutura parece ser, em muitos casos dependentes de catiões divalentes e principalmente sobre Ca 2+ 25,26, Raff, J. et ai. S-camada de nanocompósitos à base para aplicações industriais em à base de proteínas Engineered Nanoestruturas. (eds Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (submetido)). No entanto, a cascata de reacção cheio de dobragem monómero, monómero interação-monómero, a formação de uma estrutura, e o papel dos diferentes metais, especialmente de catiões divalentes, tais como Ca 2+ e Mg 2+, não são ainda totalmente compreendidas.
A estirpe de bactérias gram-positivas L. sphaericus JG-B53 (renomeado de Bacillus sphaericus após nova classificação filogenética) 27 foi isolada dos resíduos pilha mineração de urânio "Haberland" (Johanngeorgenstadt, Saxônia, Alemanha) 4,28,29. Sua funcional da proteína S-camada (Slp1) possui uma rede quadrada, um peso molecular de 116 kDa, 30, e uma espessura de 10 nm ≈ em células de bactérias que vive 31. Em estudos anteriores, a formação in vitro de uma camada de proteína fechado e estável com uma espessura de aproximadamente 10 nm foi alcançada em menos de 10 min 19. A tensão relacionada L. sphaericus JG-A12, também um isolado da pilha "Haberland", possui capacidades de ligação de alta de metal e seu isolado S-camada de proteína tem mostrado uma boa taxas de sorção de alta estabilidade química e mecânica e para os metais preciosos como Au (III), Pt (II), e Pd (II) 4,32,33. Esta ligação de metais preciosos é mais ou menos específicos para alguns metais e depende da disponibilidade de grupos funcionais sobre a superfície da proteína exterior e interior do polímero e nos seus poros, força iónica, e o valor de pH. Grupos funcionais relevantes para a interação do metal por as proteínas são COOH-, NH 2 -, OH-, PO 4 -, SO 4 -, e SO. Em princípio, as capacidades de ligação a metais abrir um amplo espectro de aplicações, Raff, J. et ai. S-camada de nanocompósitos à base para aplicações industriais em à base de proteínas Engineered Nanoestruturas. (eds Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (submetido)). por exemplo, como componentes biosorptive para remoção ou recuperaçãode metais tóxicos ou valiosos dissolvidos, modelos para a síntese ou a deposição de nanopartículas definido regularmente estruturados metálicos (PN) para a catálise e outros materiais bio-engenharia, como camadas de bio-sensorial 3,5,18,33. Matrizes NP regularmente organizados como Au (0) -NPs poderia ser usado para grandes aplicações que vão desde a eletrônica molecular e biossensores, dispositivos de armazenamento densidade extremamente altas, e catalisadores para o CO-oxidação 34-37. O desenvolvimento de tais aplicações e design inteligente desses materiais exige uma compreensão mais profunda dos mecanismos de ligação de metal subjacentes.
Um pré-requisito para o desenvolvimento de tais materiais de base biológica é a implantação confiável de uma camada de interface entre a biomolécula ea superfície técnica 38,39. Por exemplo, polielectrólitos montado com a camada-por-camada (LbL) 40,41 técnica têm sido utilizados como uma camada de interface para a recristalização das proteínas S-camada 39 . Uma tal interface proporciona uma maneira relativamente fácil de realizar o revestimento de proteína de uma forma reprodutível e quantitativa. Através da realização de diferentes experimentos com e sem modificação com promotores adesivas, é possível fazer afirmações sobre a cinética de revestimento, estabilidade camada, e interação de metais com biomoléculas 19,42, Raff, J. et al. S-camada de nanocompósitos à base para aplicações industriais em à base de proteínas Engineered Nanoestruturas. (eds Tijana Z. Grove & Aitziber L. Cortajarena) (Springer, 2016 (submetido)). No entanto, o mecanismo complexo da adsorção de proteína e interacção de proteína à superfície não é completamente compreendido. Especialmente informações sobre a conformação, a orientação padrão, e densidades de revestimento ainda está desaparecido.
Quartz microbalança de cristal com monitoramento dissipação (QCM-D) técnica tem atraído atenção nos últimos anos como uma ferramenta para o estudo de adsorção de proteínas, cinética de revestimento, e interação proprocessos em escala nanométrica 19,43-45. Esta técnica permite a detecção detalhada de adsorção em massa em tempo real, e pode ser usado como um indicador para o processo de auto-montagem de proteínas e acoplamento de moléculas funcionais em redes proteicas 19,20,42,46-48. Além disso, as medições QCM-D em aberto a possibilidade de estudar os processos de interação do metal com a camada proteica em condições biológicas naturais. Em um estudo recente, a interacção da proteína S-camada com metais seleccionados tais como Eu (III), Au (III), Pd (II) e Pt (II) foi estudada com QCM-D 19,20. A camada de proteína adsorvida pode servir como um modelo simplificado de uma parede celular de bactérias gram-positivas. O estudo deste componente único pode contribuir para uma compreensão mais profunda da interação metal. No entanto, unicamente experimentos QCM-D não permitem declarações relativas a estruturas de superfície e influências de metais para a proteína. Outras técnicas são necessárias para obter essas informações. Um poslidade de imagem para bio-nano-estruturas e obtenção de informações sobre as propriedades estruturais é a microscopia de força atômica (AFM).
O objectivo do estudo foi investigar apresentada a sorção de ouro (Au (III) e Au (0) -NPs) para proteínas S-camada, em particular Slp1 de L. sphaericus JG-B53. As experiências foram efectuadas com proteínas suspensos na escala em lotes numa gama de pH 2,0 - 5,0 utilizando ICP-MS e imobilizadas com S-camadas usando QCM-D. Além disso, a influência de uma solução de sal de metal sobre a estabilidade da estrutura foi investigada com estudos subsequentes AFM. A combinação destas técnicas contribui para uma melhor compreensão dos processos de interação in vitro de metal como uma ferramenta para aprender mais sobre os eventos em células bacterianas inteiras sobre afinidades de metal específicos de ligação. Este conhecimento é crucial não só para o desenvolvimento de materiais de filtro válidos para a recuperação de metais para a protecção do ambiente ea conservação dos refontes 49, mas também para o desenvolvimento de matrizes de nanopartículas metálicas altamente ordenadas para várias aplicações técnicas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. microorganismo e Cultivo Condições
Nota:. Todas as experiências foram realizadas sob condições estéreis L. sphaericus JG-B53 foi obtido a partir de uma cultura criopreservados 29,30.
- Transferência de crio-preservado de cultura (1,5 ml), sob a bancada limpa para 300 ml de caldo nutriente estéril (NB) meios (3 g / l de extracto de carne, 5 g / l de peptona, 10 g / L de NaCl). Depois agita-se a solução durante pelo menos 6 horas a 30 ° C para se obter a pré-cultura para o cultivo.
- Cultivar a bactéria em condições aeróbias em meio NB a pH = 7,0, 30 ° C num biorreactor de 70 L dimensionado de vapor no local. Portanto, encher o reactor de 57 L com ≈ água desionizada. Adicionar e dissolver mídia NB sólido diretamente em biorreator (concentrações veja acima).
- Além disso adicionar agente anti-espuma (30 mL / L NB-media) para a mídia para suprimir a formação de espuma durante a cultura, então autoclave (122 ° C, temperatura de manutenção de tempo de 30 min) os meios de comunicaçãono interior do reactor de instalação.
- Esfriar a mídia e executar completa saturação de oxigênio. Ajustar o pH para 7,0 (utilizando 1 H 2 SO 4 e 2 M de NaOH) e começar a inoculação automática do 300 ml de pré-cultura. Iniciar a gravação de dados de parâmetros de cultivo no ponto de inoculação. Log parâmetros on-line por exemplo, o nível de oxigênio dissolvido (OD 2), adição de ácido e base, e os valores do pH no cultivo.
- Monitorar o crescimento bacteriano em linha por as medições da turvação não-invasivos.
- Operações de amostragem adicional após cada hora de cultivo e ainda determinar parâmetros como o peso bio seco (BDW) e densidade óptica offline (OD). Portanto, recolher 20 ml de caldo de cultivo em cada ponto de amostragem em condições estéreis.
- Determinar OD off-line por meio de medições fotométricas da adsorção a 600 nm. Use estéril filtrada NB-meio como um valor em branco. À réer atingindo adsorção> 0,4 diluir a suspensão de células após a linearidade da lei de Lambert-Beer.
- Para a determinação da BDW centrífuga de 1 a 5 ml de suspensão bacteriana (dependendo da densidade celular) a 5000 xg durante 5 min à temperatura ambiente. Seca-se a pelete de células obtida a 105 ° C num forno de aquecimento até a estabilidade de massa e medir a massa da pelota.
- Tome imagens microscópicas com fase óptica microscópio de pesquisa contraste em 400 e 1.000 ampliação vezes (contraste de fase condensador 2 e 3, respectivamente) para a verificação do crescimento bacteriano e como controle de contaminação cruzada.
- Depois de atingir a fase de crescimento exponencial detectado por linha de DO2 e turbidez em linha, a colheita da biomassa por centrifugação de fluxo a 15000 xg, 4 ° C e lava-se a biomassa duas vezes com tampão padrão (50 mM Tris, 10 mM de MgCl 2, 3 mM NaN3, pH = 7,5).
Nota: O sedimento biomassa obtida pode ser armazenada a -18 & #176; C até posterior utilização para o isolamento.
2. S-camada de isolamento e purificação de proteínas
Nota: Purifica-se polímeros Slp1 acordo com um método adaptado, tal como descrito anteriormente 2,19,30,32,50,51.
- Homogeneizar a biomassa em bruto e lavou-se obtido a partir de cultura descongelado em tampão padrão (1: 1 (w / v)) para remover flagelos, utilizando um dispersor (nível 3, 10 min), sob arrefecimento em banho de gelo a 4 ° C.
- Centrifugar a suspensão (8000 xg, 4 ° C durante 20 min) e lava-se o sedimento, obtido duas vezes com tampão padrão (1: 1 (w / v)). Após a lavagem e centrifugação (8000 xg, 4 ° C durante 20 min), ressuspender o sedimento em tampão padrão (1: 1 (w / v)), adicionar DNase II e RNase (0,4 unidades / g de biomassa) para a suspensão e se desintegram as células a 1.000 bar com um homogeneizador de alta pressão. Depois centrifugar a suspensão a 27.500 xg, a 4 ° C durante 1 h.
Nota: suspensão de células de Controle com os mi pesquisacroscope. A rotura é concluída quando menos de 2 - 3 células intactas são visíveis no campo de visão do microscópio, em ampliação de 400 vezes. - Lava-se a pelete duas vezes com tampão padrão (1: 1 (w / v)) e realizar a centrifugação novamente. Em seguida ressuspender o sedimento em tampão padrão (2: 1 (w / v)) misturado com 1% de Triton X-100 e incubar durante 20 min sob sucessivas agitação (100 rpm) para solubilizar depósitos lipídicos.
- Centrifugar a solução (27.500 xg, a 4 ° C durante 1 hora) e lavar os pellets obtidos três vezes com tampão padrão (1: 1 (w / v)).
- Incubar o pellet obtido após centrifugação adicional (27.500 xg, a 4 ° C durante 1 h), durante 6 h em tampão padrão (1: 1 (w / v)) misturado com 0,2 g / l de lisozima, para hidrolisar as ligações em peptidoglicano 50. Adicionalmente adicionar DNase e RNase II (cada 0,4 unidades / g de biomassa) para a suspensão.
- Depois de centrifugação (45.500 xg, 4 ° C, 1 hora), ressuspender a fase de proteína branco superior com um baixo volume de tele centrifugação sobrenadante (<30 ml) contendo subunidades de proteínas.
- Solubiliza-se a suspensão branca através da mistura 1: 1 com 6 M de cloridrato de guanidina (6 M GuHCl, 50 mM Tris, pH = 7,2). A solução torna-se brilhante.
- Efectuar a filtração estéril (0,2 um) da solução tratada GuHCl seguido de uma centrifugação de alta velocidade adicional (45.500 xg, a 4 ° C durante 1 hr).
- Transferir o sobrenadante para tubos de membrana de diálise (MWCO 50.000 Dalton) e dialisadas contra tampão de recristalização (TRIS 1,5 mM, CaCl2 10 mM, pH = 8,0) durante 48 horas.
- Transferir a solução de polímero branco proteína recristalizado em tubos e centrifugar a 45.500 xg, a 4 ° C durante 1 h. Ressuspender o sedimento num pequeno volume de água ultrapura (<30 ml).
- Em seguida, transferir a suspensão para dentro de tubos de diálise de membrana e efectuar uma diálise contra água ultra-pura, durante 24 h para remover o conteúdo de tampão.
Nota: Várias mudanças de tampão ou água ultrapura durante diálise são indispensáveis. - Liofilizar o Slp1 purificado num secador por congelação.
3. caracterização e quantificação de Slp1 para Experimentos
Nota: concentração Slp1 para sorção e revestimento experiências foram quantificados por espectrofotometria de UV-VIS.
- Pipetar 2 ul de amostra dissolvida Slp1 directamente sobre o pedestal de medida menor do fotómetro. Determinar a concentração de proteína a adsorção máxima num comprimento de onda de 280 nm, característicos de proteínas. Utilizar o coeficiente de extinção de 0,61 para determinar a concentração Slp1. Use Slp1 solução gratuita para medições de referência.
- Dilui-se a proteína com o tampão (para as experiências de sorção no modo de lote utilizam 0,9% de NaCl, pH = 6,0 e para experiências QCM-D usar tampão de recristalização, pH = 8,0) até à concentração desejada para as experiências (1 g / L e 0,2 g / L respectivamente).
- Analisar a qualidade Slp1 e peso molecular pelo Bioanal padrãoytical método de electroforese de sódio dodecil sulfato de poliacrilamida (SDS-PAGE), descrita por Laemmli, Reino Unido 52.
- Execute SDS-PAGE antes de usar Slp1 dentro de experimentos e por exemplo, depois de Au (0) -np incubação utilizando 10% de gel de poliacrilamida de separação.
- Por SDS-amostras de mistura = 10 ul da cultura ou a proteína da amostra com tampão de amostra (1,97 g de Tris, 5 mg de azul de bromofenol, 5,8 ml de glicerina, 1 g de SDS, 2,5 ml β-mercaptoetanol, encher com água ultrapura até 50 ml) em uma proporção de 1: 1 (v / v) e pipeta-se a mistura após 4 minutos de incubação a 95 ° C para os bolsos de gel.
- Executar SDS-PAGE a 30 min a uma tensão de 60 V até que as amostras passam a tensão de gel e recolha de mudança de 120 V, uma vez que passa do gel de separação.
- Remover os geles a partir do sistema de gel, lavar com água ultrapura e lugar durante 1 hora em solução de fixação (ácido acídico 10%, 50% de etanol absoluto). Em seguida, lavar os géis com água ultrapura.
- Géis Manchausando uma coloidal inespecífica adaptado Coomassie brilhante método azul 53,54. Após descoloração 72,73, tirar imagens de SDS-PAGE pelo sistema de documentação de gel de acordo com o protocolo do fabricante.
4. Experimentos de sorção em Batch-modo e Metal Quantificação
- Por lote experimentos de sorção preparar Au (III), solução de estoque de HAuCl 4 ∙ 3 H 2 O, dilui-se o sal de metal e misturá-lo com a solução Slp1 / NaCl a uma concentração de metal inicial de 1 mM e concentração final Slp1 de 1 g / L . Realizar experimentos em trigêmeos com um controle negativo adicional sem Slp1. Utilizar um volume total de 5 ml para experiências de sorção.
- Agitar a suspensão à TA continuamente a diferentes valores de pH pré-ajustada entre 2,0 a 5,0, durante 24 h (ajustar o pH com solução de HCl a partir de NaOH e concentradas).
- Após adsorção, as amostras de centrifugar a 15.000 xg, 4 ° C durante 20 min) para SEPARSlp1 comeu a partir do sobrenadante.
- Transferir o sobrenadante para tubos de ultrafiltração (MWCO 50.000 Da) e centrifuga-se a 15.000 xg esta, 4 ° C durante 20 min para remover monómeros de proteína dissolvida.
- Determinar a concentração de metal no filtrado resultante por ICP-MS 19,20 e usar os resultados para back-cálculo de metais sorvido pela massa seca Slp1. Medindo princípios, as oportunidades do método e componentes da usados ICP-MS foram descritos na literatura 55.
- Preparar as amostras para medições de referência e ICP-MS, utilizando 1% de HNO3 como matriz e ródio como padrão interno (1 mg / mL).
5. Síntese de Au-NP e Determinação do Tamanho de Partículas
Nota: Citrato de Au estabilizadas (0) -np foram sintetizados de acordo com um método adaptado descrito anteriormente por Mühlpfordt, H. et ai. (1982) para se obterem partículas esféricas com um diâmetro de 10 - 15 nm, 56,57 .
- Prepare uma estabilizada HAuCl 25 mM 4 ∙ 3 H 2 O estoque para a formação NP.
- Diluir 250 ul desta solução estoque em 19,75 ml de água ultrapura e incubar estes a 61 ° C durante 15 min sob agitação sucessiva.
- Prepare 5 ml de uma solução-mãe de segunda (12 mM de ácido tânico, 7 mM de citrato de sódio di-hidratado, 0,05 mM de K 2 CO 3) e incubar a solução 2 nd separadamente a 61 ° C durante 15 min.
- Adicionar sob constante agitação da solução estoque 2ª a solução one. Agita-se a mistura reaccional durante pelo menos 10 min a 61 ° C. Depois arrefecer a solução e usá-lo para NP revestimento sobre Slp1 estrutura dentro experimentos QCM-D.
Nota: O Au resultante (0) -np foram caracterizados por espectroscopia de UV-VIS no máximo de absorvância a 520 nm, normalmente usado para a detecção de formado Au (0) -NPs 58. A solução pode ser armazenada a 4 ° C. - Analisar o tamanho do formadoAu (0) -np por espectroscopia de correlação do fotão (PCS), que é também conhecida como dispersão de luz dinâmica.
- Para a determinação do tamanho NP, transferir 1,5 mL da sintetizados Au (0) -np solução em cuvetes sob condições isentas de pó em uma caixa de fluxo laminar e analisá-lo com um tamanho e potencial zeta das partículas Sizer. Uma descrição detalhada do PCS e preparação da amostra é dado em Schurtenberger, P. et ai. (1993) 59 e Jain, R. et ai. (2015) 60.
6. Experiências QCM-D - Slp1 revestimento nas superfícies e Au-NP adsorção Slp1 Malha
Nota: As medições foram realizadas com um QCM-D equipado com até quatro módulos fluxo. Todas as experiências QCM-D foram realizadas com uma taxa de fluxo constante de 125 ul / min a 25 ° C. Revestimento Slp1 e metal / NP incubação foram feitos em SiO2 piezoelétricos sensores de quartzo AT-corte (Ø 14 mm) com uma freqüência fundamental de ≈ 5 MHz. Enxaguar etapas e adicionarition de solução estão marcados nas figuras do resultado parte representativa. As experiências QCM-D poderia ser descrito como uma forma passo a passo começando com a limpeza e a modificação da superfície dos sensores utilizados, seguido por recristalização Slp1 e, mais tarde, a interacção NP de metal e metal.
- Procedimentos de limpeza:
- Equipar as células do líquido com manequins de sensores. Bomba de pelo menos 20 ml (cada um por módulo) de um agente de limpeza líquido alcalino (2% em purificadores de água ultrapura (/ v) v) através do sistema de QCM-D e tubo. Em seguida bombear o volume de cinco vezes (por cada módulo) de água ultrapura através do sistema (caudal de até 300 ul / min). Realizar a limpeza de acordo com o protocolo do fabricante.
- Limpar as SiO 2 sensores de fora dos módulos de fluxo por incubação (pelo menos 20 minutos) na solução de SDS a 2% e enxaguar os sensores depois várias vezes com água ultrapura 61,62.
- Secam-se os cristais com amostra filtradaressed ar e colocá-los em uma câmara de limpeza de ozônio durante 20 min 63,64.
- Repita o procedimento de limpeza duas vezes para remover todos os conteúdos orgânicos.
- Para remover metais ligada da superfície do sensor enxaguar os sensores com 1 M de HNO3. Em seguida, execute todas as etapas de lavagem com água ultrapura.
- Sensor de superfície Modificação por polieletrólitos:
Nota: A modificação da superfície pode ser feito tanto no interior (fluir através de procedimento) ou fora do módulo de fluxo (técnica de automontagem). Dentro destas experiências da seguinte forma para modificar as superfícies foi usada.- Modificar os sensores com 3 g / L de camadas alternadas de PE de imina de polietileno (PEI, MW 25.000) e de sulfonato de poliestireno (PSS, MW 70.000) através de revestimento por imersão utilizando a técnica LbL 40,41 previamente descrito para o sistema utilizado especial no artigo de Suhr, M. et ai. (2014) 19.
- Coloque os sensores dentro da solução-PE apropriado em w profundaell placas e incuba-se estes durante 10 min a RT.
- Tome os sensores fora da PE-solução e lave os sensores entre cada passo de revestimento por imersão intensamente com água ultrapura.
Nota: A nova modificação de superfície é constituído por pelo menos três camadas de PE com terminação PEI carregado positivamente. - Após esta modificação externa colocar os sensores no interior do módulo de fluxo e equilibrar os sensores por enxaguamento com água ultrapura antes de começar as experiências.
- Slp1 monocamada recristalização:
- Dissolver Slp1 em 4 M de ureia para a conversão de polímeros em monómeros.
- Centrifugar as proteínas monomerized a 15.000 xg, 4 ° C durante 1 h para remover aglomerados de proteínas maiores.
- Misturar-se o sobrenadante e centrifugou-se Slp1 solubilizado com tampão de recristalização a uma concentração final de proteína de 0,2 g / L.
Nota: O cálcio dependendo da recristalização Slp1 (auto-montagem) é iniciado por adição do rectampão rystallization. Portanto, bombear a solução mista com um caudal de 125 ul / min para os sensores (colocado no interior dos módulos de fluxo) imediatamente. A recristalização é feita após os valores estáveis de frequência e de dissipação de turnos foram detectados dentro experimentos QCM-D. - Após recristalização a partir de proteínas bem sucedido em cima dos sensores-PE modificados no interior dos módulos de fluxo de lavagem os sensores revestidos com tampão de recristalização ou waterintensively ultrapura com uma taxa de fluxo de 125 mL / min até que os valores estáveis de frequência e de dissipação foram detectadas mudanças.
Nota: O SiO2 modificação da superfície com PE para experimentos de sorção posteriores Onto Slp1 estudos monocamada e AFM é visualizado na Figura 1.

Figura 1. Esquema Projeto de PE modificação da superfície e Slp1 MonolayerRevestimento; Este valor foi modificado a partir Suhr, M. et al. (2015) 19 com a permissão da Springer. Por favor clique aqui para ver uma versão maior desta figura.
- Metais e NP Interação:
Nota: A sorção com a solução de sal de metal Au (HAuCl 4 ∙ 3 H2O) foi realizada em concentrações de 1 mM ou 5 mM a pH = 6,0 a 0,9% em soluções de NaCl. Au-NP adsorção foi feito com não diluído Au-NPs em 1,6 mM tampão tri-sódio-citrato em pH ≈ 5.0.- Após o revestimento Slp1 sucesso nos módulos de fluxo, lavar a camada Slp1 obtido intensamente com solução de NaCl 0,9% até foram detectados valores estáveis de frequência e de dissipação de turnos.
- Bombear a solução preparada de metal (1 mM) e uma solução de NP para os módulos de fluxo com uma taxa de fluxo de 125 mL / min e controlar a massa de adsorção para o Slcamada p1. Adsorção de massa pode ser detectada diretamente, acompanhando as mudanças de freqüência referentes à equação de Sauerbrey (equação 1).
- Depois de completar a interação metal e de metal NP, lavar a camada de metal / NP tampão livre para remover metais ou fracos nanopartículas ligadas ou fracos em anexo.
Nota: Uma ilustração da configuração experimental é mostrado na Figura 2.

Figura 2. desenho esquemático da instalação QCM-D usando Fluxo Módulo QFM 401 * 66. Por favor clique aqui para ver uma versão maior desta figura.
- Gravação de Dados e Avaliação:
- Grave as mudanças na freqüência em Hz (Af n) e dissipação (ΔD n) Dentro dos experimentos QCM-D usando QCM-D de software específico.
- Use para avaliação da sensibilidade de massa adsorvida (Dm) do Sauerbrey equação / modelo (Equação 1) 65 66 que é válido para filmes finos e rígidos acoplados sem atrito à superfície do sensor aplicada ao n º harmônico. O termo C (constante Sauerbrey) para o usado 5 MHz AT sensor de quartzo corte é de 17,7 ng ∙ Hz -1 ∙ cm -2 68. Para rígida, uniformemente distribuída, e as camadas adsorvidas suficientemente finas usar a Equação 1 como uma boa aproximação.
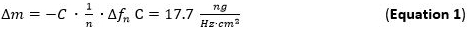
- Realizar modelagem adicional de acordo com o modelo de Kelvin-Voigt válido para moléculas viscoelásticas 68-71 com a fabricante de software específico e comparar os resultados com o do modelo Sauerbrey.
- Para o cálculo da espessura da camada e a utilização de massa de adsorçãomodelagem como parâmetro importante uma densidade de camada da camada adsorvida de 1,35 g cm -3 ∙ correspondente aos valores descritos anteriormente para as proteínas S de camada 72-75. Utilize o mesmo valor para o cálculo da interação do metal com a camada proteica.
7. As medições AFM
- Realizar estudos com plenamente capaz AFM em um microscópio óptico invertido.
- Gravação de imagens de AFM em líquido usando o buffer de recristalização ou água ultrapura diretamente nos sensores QCM-D revestidos.
- Lave os sensores com água ultrapura após experimentos QCM-D e colocá-los dentro da célula fluido AFM. Portanto, utilizar uma célula de fluido em circuito fechado com um volume total de cerca de 1,5 ml. Manter a temperatura do fluido constante da célula a 30 ° C.
- Usar um cantilever com uma frequência de ressonância de 25 kHz ≈ em água e uma rigidez de <0,1 N / m. Ajuste a velocidade de digitalização entre 2,5 e 10 m / seg.
- Tome imagens no modo de contato dinâmico enquanto o cantilever é animado por um piezo na sua freqüência de ressonância. Determinar a distância do cantilever para a superfície pela oscilação de amortecimento 76.
Nota: as imagens da altura são mostrados com z-escala, enquanto valores z representam a topografia da superfície exacta. Imagens amplitude (Pseudo 3D) são mostrados sem z-escala, porque z-valores de amplitude dependem de parâmetros de digitalização e dar informações limitadas. Análise de imagens foi feita utilizando três softwares de avaliação diferente do 77.
Access restricted. Please log in or start a trial to view this content.
Resultados
Cultivo de Microrganismos e Slp1 Caracterização
Os dados gravados do crescimento bacteriano indica o final da fase de crescimento exponencial em cerca de 5 horas. Investigações anteriores demonstraram que Slp1 pode ser isolado a partir deste ponto de colheita (4,36 g / L de biomassa húmida (≈ 1,45 g / L (BDW)) com um rendimento máximo de 19. No entanto, a optimização de cultivo usando comp...
Access restricted. Please log in or start a trial to view this content.
Discussão
Neste trabalho foi estudada a ligação às proteínas de Au-S camada foi investigada utilizando uma combinação de diferentes métodos analíticos. Em particular, a ligação de Au é muito atraente, não somente para a recuperação das águas de mineração de Au ou soluções de processo, mas também para a construção de materiais, por exemplo, superfícies sensoriais. Para os estudos da interacção Au (Au (III) e Au (0) -NPs) com suspensão e recristalizou-se em monocamada de Slp1, a proteína...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O presente trabalho foi parcialmente financiado pelo IGF-projeto "S-Peneira" (490 ZBG / 1) financiado pela BMWi eo BMBF-projeto "Aptasens" (BMBF / DLR 01RB0805A). Um agradecimento especial a Tobias J. Günther pelo valioso auxílio durante os estudos de AFM e para Erik V. Johnstone para ler o manuscrito como um falante nativo Inglês. Além disso, o autor deste papel gostaria de agradecer Aline Ritter e Sabrina Gurlit (do Instituto de Ecologia de Recursos para assistência em medições por ICP-MS), Manja Vogel, Nancy Unger, Karen E. Viacava e da biotecnologia grupo do Instituto Helmholtz- Freiberg para a Tecnologia de Recursos.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000 - 6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein = 90 %, = 40,000 units/mg protein (Sigma) |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50 - 100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50,000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
Referências
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. Atimtay, T. A., Sikdar, S. K. , Springer. 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B. Environmental Microbe-Metal Interactions. Lovely, D. R. , ASM Press. Washington. 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , Forschungszentrum Rossendorf. Dresden. (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , Technische Universität Dresden. (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, Rice University . Houston. 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. Gold : science and applications. , CRC Press - Taylor&Francis Group. (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, Dr Dietrich Steinkopff Verlag. (1992).
- Günther, T. J. S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , Technische Universität Dresden. (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. Methods for general and molecular bacteriology. , American Society for Microbiology. 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C. [6] Quantitation of protein. Methods in Enzymology. Deutscher, M. P. 182, Academic Press. 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. ICP Mass Spectrometry - The 30-Min to ICP-MS. , PerkinElmer. USA. (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. Colloidal Gold - Principles, Methods and Applications. , Academic Press. (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E. Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. Buffle, J., van Leeuwen, H. P. 2, Lewis Publishers. 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705(2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , Technische Universität Dresden. (2003).
- Jennings, T., Strouse, G. Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , Springer. 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados