Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Au-Interacción de SLP1 Polímeros y Monocapa de
En este artículo
Resumen
To obtain basic information on the sorption and recycling of gold from aqueous systems the interaction of Au(III) and Au(0) nanoparticles on S-layer proteins were investigated. The sorption of protein polymers was investigated by ICP-MS and that of proteinaceous monolayers by QCM-D. Subsequent AFM enables the imaging of the nanostructures.
Resumen
In this publication the gold sorption behavior of surface layer (S-layer) proteins (Slp1) of Lysinibacillus sphaericus JG-B53 is described. These biomolecules arrange in paracrystalline two-dimensional arrays on surfaces, bind metals, and are thus interesting for several biotechnical applications, such as biosorptive materials for the removal or recovery of different elements from the environment and industrial processes. The deposition of Au(0) nanoparticles on S-layers, either by S-layer directed synthesis 1 or adsorption of nanoparticles, opens new possibilities for diverse sensory applications. Although numerous studies have described the biosorptive properties of S-layers 2-5, a deeper understanding of protein-protein and protein-metal interaction still remains challenging. In the following study, inductively coupled mass spectrometry (ICP-MS) was used for the detection of metal sorption by suspended S-layers. This was correlated to measurements of quartz crystal microbalance with dissipation monitoring (QCM-D), which allows the online detection of proteinaceous monolayer formation and metal deposition, and thus, a more detailed understanding on metal binding.
The ICP-MS results indicated that the binding of Au(III) to the suspended S-layer polymers is pH dependent. The maximum binding of Au(III) was obtained at pH 4.0. The QCM-D investigations enabled the detection of Au(III) sorption as well as the deposition of Au(0)-NPs in real-time during the in situ experiments. Further, this method allowed studying the influence of metal binding on the protein lattice stability of Slp1. Structural properties and protein layer stability could be visualized directly after QCM-D experiment using atomic force microscopy (AFM). In conclusion, the combination of these different methods provides a deeper understanding of metal binding by bacterial S-layer proteins in suspension or as monolayers on either bacterial cells or recrystallized surfaces.
Introducción
Debido al creciente uso del oro para diversas aplicaciones como la electrónica, catalizadores, biosensores, o instrumentos médicos, la demanda de este metal precioso ha crecido en los últimos pocos años 6-9. Oro, así como muchos otros metales preciosos y pesados se liberan en el medio ambiente a través de efluentes industriales en concentraciones diluidas, a través de las actividades mineras, y la eliminación de residuos 7,8,10, aunque la mayor contaminación ambiental por metales pesados o preciosos es un proceso en curso causado principalmente por las actividades tecnológicas. Esto conduce a una interferencia significativa de los ecosistemas naturales y potencialmente podría amenazar la salud humana 9. Conocer estos resultados negativos promueve la búsqueda de nuevas técnicas para eliminar los metales de los ecosistemas y las mejoras en el reciclaje de metales contaminados por las aguas residuales industriales. Métodos físico-químicos bien establecidos como precipitación o intercambio de iones no son tan eficaces, especialmente en altoly diluye soluciones 7,8,11. Biosorción, ya sea con la vida o la biomasa muerta, es una alternativa atractiva para el tratamiento de aguas residuales 10,12. El uso de tales materiales biológicos puede reducir el consumo de productos químicos tóxicos. Muchos microorganismos se han descrito para acumular o inmovilizar metales. Por ejemplo, las células de Lysinibacillus sphaericus (L. sphaericus) JG-A12 han demostrado capacidades de unión altos para los metales preciosos, por ejemplo, Pd (II), Pt (II), Au (III), y otros metales tóxicos como el Pb (II) o U (VI) 4,13, las células de Bacillus megaterium para Cr (VI) 14, las células de Saccharomyces cerevisiae para Pt (II) y Pd (II) 15, y Chlorella vulgar para Au (III) y U (VI) 16 , 17. La unión de los metales anteriores como Au (III), Pd (II) y Pt (II) también se ha informado de Desulfovibrio desulfuricans 18 y para L. sphaericus JG-B53 19,20. Sin embargo, no all microbios unen altas cantidades de metales y su aplicación como material de sorción es limitada 12,21. Además, la capacidad de unión a metal depende de diferentes parámetros, por ejemplo, la composición celular, la bio-componente utilizado, o ambientales y las condiciones experimentales (pH, fuerza iónica, temperatura, etc.). El estudio de los fragmentos de pared celular aisladas 22,23, como los lípidos de membrana, peptidoglicano, proteínas u otros componentes, ayuda a entender el metal procesos de células enteras construidas complejas 8,21 vinculante.
Los componentes de la célula se centraron en en este estudio son las proteínas de la capa S. Proteínas de la capa S son partes de la envoltura celular externa de muchas bacterias y arqueas, y que constituyen aproximadamente el 15 - 20% de la masa total de proteínas de estos organismos. A medida que la primera interfaz para el medio ambiente, estos compuestos celulares influyen fuertemente en las propiedades de sorción 3 bacterianas. Proteínas de la capa S con pesos moleculares que van desde los cuarentaa cientos de kDa se producen dentro de la célula, pero se ensamblan exterior, donde son capaces de formar capas en las membranas de lípidos o componentes de la pared celular poliméricos. Una vez aislado, casi todos los S-capa proteínas tienen la propiedad intrínseca de auto-ensamblan espontáneamente en suspensión, en las interfaces, o en superficies planas que forman o estructuras similares a tubos 3. El espesor de la monocapa de la proteína depende de la bacteria y se encuentra dentro de una gama de 5 - 25 nm 24. En general, las estructuras de las proteínas S-capa formada pueden tener un oblicua (P1 o P2), cuadrada (p4), o hexagonal (p3 o p6) simetría con constantes de red de 2,5 a 35 nm 3,24. La formación de celosía parece ser en muchos casos dependientes de cationes divalentes y principalmente en Ca 2+ 25,26, Raff, J. et al. S-capa de nanocompuestos basados en aplicaciones industriales en a base de proteína Engineered Nanoestructuras. (eds Tijana Z. Grove y Aitziber L. Cortajarena) (Springer, 2016 (presentado)). Sin embargo, la cascada de la reacción completa de plegado monómero, la interacción monómero-monómero, la formación de un enrejado, y el papel de diferentes metales, especialmente de cationes divalentes tales como Ca 2+ y Mg 2+, todavía no se entiende completamente.
La cepa grampositivos L. sphaericus JG-B53 (renombrado de Bacillus sphaericus después de nueva clasificación filogenética) 27 se aisló de la minería del uranio pila de residuos "Haberland" (Johanngeorgenstadt, Sajonia, Alemania) 4,28,29. Su proteína S-capa funcional (SLP1) posee una red cuadrada, un peso molecular de 116 kDa 30, y un espesor de 10 nm sobre ≈ células de las bacterias que viven 31. En estudios anteriores, la formación in vitro de una capa de proteína cerrado y estable con un espesor de aproximadamente 10 nm se logró en menos de 10 min 19. La cepa relacionada L. sphaericus JG-A12, también un aislamiento de la pila "Haberland", posee capacidades de unión de alta de metal y su proteína aislada S-capa ha mostrado buenos índices de absorción alta estabilidad química y mecánica y para los metales preciosos como el Au (III), Pt (II), y Pd (II) 4,32,33. Esta unión de los metales preciosos es más o menos específica para algunos metales y depende de la disponibilidad de grupos funcionales en la proteína de superficie exterior e interior del polímero y en sus poros, la fuerza iónica, y el valor pH. Grupos funcionales relevantes para la interacción de metal por las proteínas son COOH, NH2 -, OH-, PO 4 -, SO 4 - y SO. En principio, la capacidad de unión a metal abren un amplio espectro de aplicaciones, Raff, J. et al. S-capa de nanocompuestos basados en aplicaciones industriales en a base de proteína Engineered Nanoestructuras. (eds Tijana Z. Grove y Aitziber L. Cortajarena) (Springer, 2016 (presentado)). por ejemplo, como componentes biosorptive para la eliminación o la recuperaciónde metales tóxicos o valiosos disueltos, plantillas para la síntesis o deposición definido de nanopartículas estructuradas regularmente metálicos (NPS) para la catálisis y otros materiales de bioingeniería como capas bio-sensorial 3,5,18,33. Arrays NP dispuestos regularmente como Au (0) -NPs podrían ser utilizados para las principales aplicaciones que van desde la electrónica molecular y biosensores, dispositivos de almacenamiento de densidad ultra alta, y catalizadores para la oxidación de CO-34-37. El desarrollo de este tipo de aplicaciones y el diseño inteligente de estos materiales requiere una comprensión más profunda de los mecanismos de unión de metales subyacentes.
Un requisito previo para el desarrollo de tales materiales de origen biológico es la implementación fiable de una capa de interfaz entre la biomolécula y la superficie técnica 38,39. Por ejemplo, polielectrolitos ensamblan con la capa por capa (LBL) 40,41 técnica se han utilizado como una capa de interfaz para la recristalización de las proteínas de la capa S-39 . Tal interfaz ofrece una forma relativamente fácil de realizar el recubrimiento de proteína de una manera reproducible y cuantitativa. Mediante la realización de diferentes experimentos con y sin modificación con promotores adhesivos, es posible hacer declaraciones con respecto a la cinética de revestimiento, la estabilidad de la capa, y la interacción de los metales con biomoléculas 19,42, Raff, J. et al. S-capa de nanocompuestos basados en aplicaciones industriales en a base de proteína Engineered Nanoestructuras. (eds Tijana Z. Grove y Aitziber L. Cortajarena) (Springer, 2016 (presentado)). Sin embargo, el complejo mecanismo de la adsorción de proteínas y la interacción proteína-superficie no se entiende completamente. Especialmente información sobre la conformación, la orientación de patrones, y densidades de recubrimiento sigue desaparecido.
Cuarzo microbalanza de cristal con el monitoreo de disipación (QCM-D) técnica ha llamado la atención en los últimos años como una herramienta para el estudio de la adsorción de proteínas, la cinética de revestimiento, y la interacción proprocesos en la escala nanométrica 19,43-45. Esta técnica permite la detección detallada de la adsorción de masas en tiempo real, y se puede utilizar como un indicador para el proceso de auto-montaje de proteínas y el acoplamiento de moléculas funcionales en redes de proteínas 19,20,42,46-48. Además, las mediciones QCM-D abren la posibilidad de estudiar los procesos de interacción de metal con la capa proteínica en condiciones biológicas naturales. En un estudio reciente, la interacción de la proteína S-capa con metales seleccionados como Eu (III), Au (III), Pd (II) y Pt (II) se ha estudiado con QCM-D 19,20. La capa de proteína adsorbida puede servir como un modelo simplificado de una pared celular de las bacterias gram-positivas. El estudio de este componente único puede contribuir a una mayor comprensión de la interacción metal. Sin embargo, únicamente los experimentos QCM-D no permiten declaraciones con respecto a las estructuras superficiales y las influencias de los metales a la proteína. Otras técnicas son necesarias para obtener dicha información. Uno posbilidad de imágenes bio-nanoestructuras y la obtención de información sobre las propiedades estructurales es la microscopía de fuerza atómica (AFM).
El objetivo del estudio presentado fue investigar la sorción de oro (Au (III) y Au (0) -NPs) a las proteínas de la capa S, en particular SLP1 de L. sphaericus JG-B53. Los experimentos se realizaron con las proteínas en suspensión en la escala de proceso por lotes en un intervalo de pH de 2,0 - 5,0 usando ICP-MS y con S-capas inmovilizadas utilizando QCM-D. Además, la influencia de la solución de sal de metal sobre la estabilidad de celosía se investigó con los estudios de AFM posteriores. La combinación de estas técnicas contribuye a una mejor comprensión de los procesos de interacción in vitro de metal en como una herramienta para aprender más acerca de los acontecimientos en las células bacterianas enteras respecto afinidades metálicos específicos vinculante. Este conocimiento no sólo es crucial para el desarrollo de materiales de filtración aplicables para la recuperación de metales para la protección ambiental y la conservación de la re49 fuentes, sino también para el desarrollo de matrices de NPs metálicas altamente ordenadas para diversas aplicaciones técnicas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Los microorganismos y Condiciones de cultivo
Nota:. Todos los experimentos se realizaron en condiciones estériles L. sphaericus JG-B53 se obtuvo de una cultura crio-conservado 29,30.
- Cultura (1,5 ml) en la mesa de trabajo limpia Transferencia crio-conservados a 300 ml de caldo nutriente estéril (NB) medios de comunicación (extracto de carne 3 g / l, 5 g / L de peptona, 10 g / L de NaCl). Después se agita la solución durante al menos 6 horas a 30 ° C para obtener el pre-cultivo para el cultivo.
- Cultivar las bacterias en condiciones aeróbicas en medios NB a pH = 7,0, 30 ° C en un 70 L escalado biorreactor de vapor en el lugar. Por lo tanto, llenar el reactor con ≈ 57 l de agua desionizada. Añadir y disolver medios NB sólida directamente en biorreactor (concentraciones véase más arriba).
- Adicionalmente añadir agente antiespumante (30 l / L NB-medios de comunicación) a los medios para suprimir la formación de espuma durante el cultivo, a continuación, el autoclave (122 ° C, temperatura de mantenimiento de tiempo de 30 min) los medios de comunicacióndentro de la instalación del reactor.
- Enfriar los medios de comunicación y realizar completa saturación de oxígeno. Ajustar el pH a 7,0 (usando 1 MH 2 SO 4 y 2 M de NaOH) e iniciar la inoculación automático de los 300 ml de precultivo. Iniciar el registro de datos de los parámetros de cultivo en el punto de inoculación. Entrar los parámetros en línea, por ejemplo, el nivel de oxígeno disuelto (OD 2), además de ácido y base, y valores de pH en el cultivo.
- Monitorear el crecimiento bacteriano en línea por las mediciones de turbidez no invasivos.
- Realizar un muestreo adicional después de cada hora de cultivo y determinar con mayor precisión los parámetros como el peso bio seco (BDW) y la densidad óptica en línea (OD). Por lo tanto, recoger 20 ml de caldo de cultivo en cada punto de muestreo en condiciones estériles.
- Determinar offline OD por mediciones fotométricas de la adsorción a 600 nm. Utilice NB-medio filtrado estéril como un valor en blanco. En popaer llegar adsorción> 0,4 diluido la suspensión celular después de la linealidad de la ley de Lambert-Beer.
- Para la determinación de BDW centrífuga de 1 a 5 ml de suspensión bacteriana (dependiendo de la densidad celular) a 5000 xg durante 5 min a TA. Secar el pellet celular obtenido a 105 ° C en un horno de calentamiento hasta la estabilidad en masa y medir la masa de pellets.
- Tomar imágenes microscópicas con microscopio de fase óptica investigación contraste en 400 y 1000 veces de ampliación (contraste de fase de condensador 2 y 3, respectivamente) para el control del crecimiento bacteriano y como un control de la contaminación cruzada.
- Después de alcanzar la fase de crecimiento exponencial detectada por línea no 2 y la turbidez en línea, la cosecha de la biomasa por centrifugación de flujo continuo a 15.000 xg, 4 ° C y se lava la biomasa dos veces con tampón estándar (mM TRIS 50 mM de MgCl 10 2, 3 mM NaN 3, pH = 7,5).
Nota: El sedimento biomasa obtenida se puede almacenar a -18 & #176; C hasta nuevo uso para el aislamiento.
2. S-capa Aislamiento y Purificación de Proteínas
Nota: Se purifica polímeros SLP1 de acuerdo con un método adaptado como se describió anteriormente 2,19,30,32,50,51.
- Homogeneizar la biomasa crudo lavado y descongelada obtenida a partir de cultivo en tampón estándar (1: 1 (w / v)) para eliminar los flagelos mediante el uso de un dispersor (nivel 3, 10 min) bajo enfriamiento baño de hielo a 4 ° C.
- Centrifugar la suspensión (8.000 xg, 4 ° C durante 20 min) y lavar el sedimento obtenido dos veces con tampón estándar (1: 1 (w / v)). Después del lavado y centrifugación (8.000 xg, 4 ° C durante 20 min), resuspender el precipitado en tampón estándar (1: 1 (w / v)), añadir la ADNasa II y RNasa (0,4 unidades / g de biomasa) a la suspensión y se desintegran las células a 1.000 bar con un homogeneizador de alta presión. Después se centrifuga la suspensión a 27.500 xg, 4 ° C durante 1 hr.
Nota: suspensión de células de control con los mi de investigacióncroscope. La ruptura se completa cuando menos de 2 - 3 células intactas son visibles en el campo de visión del microscopio en 400 veces magnificación. - Lavar el sedimento dos veces con tampón estándar (1: 1 (w / v)) y realizar la centrifugación de nuevo. Después resuspender el precipitado en tampón estándar (2: 1 (w / v)) mezclado con 1% de Triton X-100 y se incuba durante 20 min bajo sucesiva agitación (100 rpm) para solubilizar depósitos de lípidos.
- Centrifugar la solución (27.500 xg, 4 ° C durante 1 hr) y lavar los pellets obtenidos tres veces con tampón estándar (1: 1 (w / v)).
- Incubar el sedimento obtenido después de la centrifugación adicional (27.500 xg, 4 ° C durante 1 hr) durante 6 horas en tampón estándar (1: 1 (w / v)) mezclado con 0,2 g / L de lisozima, para hidrolizar enlaces en peptidoglicano 50. Añadir Además DNasa y RNasa II (cada uno 0,4 unidades / g de biomasa) a la suspensión.
- Después de la centrifugación (45.500 xg, 4 ° C, 1 hora), volver a suspender la fase de proteína de clara superior con un bajo volumen de tél sobrenadante de la centrifugación (<30 ml) que contienen subunidades de proteínas.
- Solubilizar la suspensión blanca mezclando 1: 1 con 6 M clorhidrato de guanidina (6 M GuHCl, 50 mM TRIS, pH = 7,2). La solución se vuelve brillante.
- Realizar la filtración estéril (0,2 micras) de la solución tratada GuHCl seguido de una centrifugación a alta velocidad adicional (45.500 xg, 4 ° C durante 1 hr).
- Transferir el sobrenadante a tubos de membrana de diálisis (MWCO 50.000 Dalton) y se dializó frente a tampón que recristalización (1,5 mM TRIS, 10 mM CaCl 2, pH = 8,0) durante 48 horas.
- Transferir la solución de polímero proteína recristalizada blanco en tubos y se centrifuga a 45.500 xg, 4 ° C durante 1 hora. Resuspender el precipitado en un bajo volumen de agua ultrapura (<30 ml).
- Después, transferir la suspensión en tubos de membrana de diálisis y realizar una diálisis contra agua ultrapura durante 24 horas para eliminar el contenido del búfer.
Nota: Varios cambios de tampón o agua ultrapura durante la diálisis son indispensables. - Liofilizar la SLP1 purificado en un liofilizador.
3. Caracterización y cuantificación de SLP1 para experimentos
Nota: concentración SLP1 de sorción y revestimiento experimentos se cuantificó por espectrofotometría UV-VIS.
- Pipetear 2 l de muestra disuelta SLP1 directamente sobre el pedestal de medición inferior del fotómetro. Determinar la concentración de proteína a la máxima adsorción a una longitud de onda de 280 nm, característico de las proteínas. Utilice el coeficiente de extinción de 0,61 para determinar la concentración SLP1. Utilice SLP1 solución gratuita para mediciones de referencia.
- Diluir la proteína con el tampón (para los experimentos de sorción en modo por lotes utilizan 0,9% de NaCl, pH = 6,0 y para los experimentos QCM-D utilizan tampón de recristalización, pH = 8,0) a la concentración deseada para experimentos (1 g / L y 0,2 g / L respectivamente).
- Analizar la calidad SLP1 y el peso molecular por el Bioanal estándarelectroforesis ytical método de sodio dodecil sulfato poliacrilamida (SDS-PAGE) descrito por Laemmli, UK 52.
- Realizar SDS-PAGE antes de usar SLP1 dentro experimentos y, por ejemplo, después de Au (0) incubación -NP usando 10% en geles de poliacrilamida de separación.
- Por SDS-muestras mezcla ≈10 l de la muestra de cultivo o la proteína con tampón de muestra (1,97 g TRIS, 5 mg de azul de bromofenol, 5,8 ml de glicerina, 1 g de SDS, 2,5 ml β-mercaptoetanol, se llenan de agua ultrapura a 50 ml) en una proporción de 1: 1 (v / v) y la pipeta la mezcla después de 4 minutos de incubación a 95 ° C en los bolsillos de gel.
- Run SDS-PAGE 30 min a una tensión de 60 V hasta que las muestras pasan la tensión de gel de colección y el cambio a 120 V, una vez que pasa el gel de separación.
- Retire los geles del sistema de gel, enjuague con agua ultrapura y lugar durante 1 hora en una solución de fijación (ácido ácida 10%, 50% de etanol absoluto). Después, enjuague los geles con agua ultrapura.
- Geles Stainutilizando una coloidal no específica adaptada Coomassie brillante método de 53,54 azul. Después de decoloración 72,73, tomar imágenes de SDS-PAGE por el sistema de documentación de gel de acuerdo con el protocolo del fabricante.
4. Los experimentos de sorción en el modo por lotes y cuantificación de metales
- Para el lote experimentos de sorción preparan Au solución madre (III) a partir de HAuCl4 ∙ 3 H 2 O, diluir la sal de metal y se mezcla con la solución SLP1 / NaCl a una concentración de metal inicial de 1 mM y concentración final SLP1 de 1 g / L . Realizar experimentos en tríos con un control negativo adicional sin SLP1. Utilizar un volumen total de 5 ml para los experimentos de sorción.
- Agitar la suspensión continuamente a RT a diferentes valores de pH pre-ajustado entre 2,0 a 5,0 durante 24 horas (ajustar el pH con solución de HCl y NaOH concentrado bajo).
- Después de la adsorción, centrifugar las muestras a 15.000 xg, 4 ° C durante 20 min) para la SEPARcomió SLP1 del sobrenadante.
- Transferir el sobrenadante a tubos de ultrafiltración (MWCO 50.000 Da) y se centrifuga a 15.000 xg este, 4 ° C durante 20 min para eliminar los monómeros de proteínas disueltas.
- Determinar la concentración de metal en el filtrado resultante por ICP-MS 19,20 y utilizar los resultados para back-cálculo de sorbido metal mediante la masa seca SLP1. Principios de medición, las oportunidades del método y los componentes de la segunda mano ICP-MS fueron descritos en la literatura 55.
- Preparar muestras y referencias para las mediciones de ICP-MS utilizando 1% HNO 3 como matriz y el rodio como patrón interno (1 mg / ml).
5. Síntesis de Au-NP y Determinación del Tamaño de Partículas
Nota: Citrato estabilizado Au (0) -NP se sintetizaron de acuerdo con un método adaptado descrito previamente por Mühlpfordt, H. et al. (1982) para obtener partículas esféricas con un diámetro de 10 - 15 nm 56,57 .
- Preparar un estabilizado mM HAuCl 25 4 ∙ 3 H 2 O stock para la formación NP.
- Diluir 250 ml de esta solución madre en 19.75 ml de agua ultrapura y se incuba estos a 61 ° C durante 15 min bajo sucesivas sacudidas.
- Preparar 5 ml de una segunda solución madre (12 mM de ácido tánico, 7 mM de citrato de sodio dihidrato, 0,05 mM de K 2 CO 3) y se incuba la solución 2 nd por separado a 61 ° C durante 15 min.
- Añadir bajo constante agitación de la solución madre 2 al solución única. Se agita la mezcla de reacción durante al menos 10 minutos a 61 ° C. Luego enfriar la solución y utilizarla para recubrimiento NP en SLP1 celosía dentro experimentos QCM-D.
Nota: El Au resultante (0) -NP se caracterizaron con espectroscopía UV-VIS en el máximo de absorbancia de 520 nm, típicamente utilizado para la detección de formado Au (0) -NPs 58. La solución puede ser almacenada a 4 ° C. - Analizar el tamaño de la formadaAu (0) -NP por espectroscopia de correlación de fotones (PCS), que también se conoce como dispersión de luz dinámica.
- Para la determinación del tamaño de la NP, transferir 1,5 ml de sintetizado Au (0) -NP solución en cubetas bajo condiciones libres de polvo en una caja de flujo laminar y analizarlo con un tamaño y potencial zeta medidor de partículas. Una descripción detallada de PCS y preparación de la muestra se da en Schurtenberger, P. et al. (1.993) 59 y Jain, R. et al. (2015) 60.
6. Los experimentos QCM-D - SLP1 Recubrimiento de Superficies y Au-NP adsorción en SLP1 Entramado
Nota: Las mediciones se llevaron a cabo con un QCM-D equipado con hasta cuatro módulos de flujo. Todos los experimentos QCM-D se realizaron con un caudal constante de 125 l / min a 25 ° C. Recubrimiento SLP1 y metal incubación / NP se realizaron en SiO sensores de cuarzo AT-corte 2 piezoeléctricos (Ø 14 mm) con una frecuencia fundamental de ≈ 5 MHz. Enjuague pasos y añadirition de solución están marcados en las figuras de los resultados de parte representativa. Los experimentos QCM-D podría ser descrito como un paso a modo paso comenzando con la limpieza y la modificación de la superficie de los sensores utilizados, seguido de recristalización SLP1 y más tarde en la interacción NP metal y metal.
- Procedimientos de limpieza:
- Equipar las células del líquido con maniquíes de sensores. Bomba de al menos 20 ml (cada uno por módulo) de un agente de limpieza líquido alcalino (2% limpiador en agua ultrapura (v / v)) a través del sistema QCM-D y el tubo. Después bombear el volumen de cinco veces (cada uno por módulo) de agua ultrapura a través del sistema (caudal de hasta 300 l / min). Realizar la limpieza de acuerdo con el protocolo del fabricante.
- Limpiar los SiO 2 sensores fuera de los módulos de flujo por incubación (al menos 20 min) en solución de SDS al 2% y enjuagar los sensores después varias veces con agua ultrapura 61,62.
- Seque los cristales con un borrador filtradaressed aire y colocarlos en una cámara de limpieza de ozono durante 20 minutos 63,64.
- Repita el procedimiento de limpieza dos veces para eliminar todos los contenidos orgánicos.
- Para eliminar los metales ligados desde la superficie del sensor enjuague los sensores con 1 M HNO 3. Después, realice todos los pasos de enjuague con agua ultrapura.
- Sensor modificación de la superficie por polielectrolitos:
Nota: la modificación de la superficie se puede hacer ya sea en el interior (fluya a través de procedimiento) o fuera del módulo de flujo (técnica LbL). Dentro de estos experimentos se utilizó la siguiente forma para modificar las superficies.- Modificar los sensores con 3 g / l de capas alternas de educación física de polietilenimina (PEI, MW 25.000) y sulfonato de poliestireno (PSS, MW 70.000) a través de recubrimiento por inmersión utilizando la técnica LbL 40,41 descrito anteriormente para el sistema utilizado especial en el artículo de Suhr, M. et al. (2014) 19.
- Coloque los sensores dentro de la solución de PE apropiado en profunda wELL placas e incubar estos para 10 min a TA.
- Tome los sensores de PE-solución y enjuague los sensores entre cada paso de recubrimiento por inmersión intensiva con agua ultrapura.
Nota: La nueva modificación de la superficie se compone de al menos tres capas de terminación PE con carga positiva PEI. - Después de esta modificación externa colocar los sensores en el interior del módulo de flujo y equilibrar los sensores de un enjuague con agua ultrapura antes de comenzar los experimentos.
- SLP1 monocapa recristalización:
- Disolver SLP1 en 4 M urea para la conversión de polímeros en monómeros.
- Centrifugar las proteínas monomerized a 15.000 xg, 4 ° C durante 1 hora para eliminar aglomerados más grandes de proteínas.
- Mezclar el sobrenadante y se centrifugó SLP1 solubilizado con tampón de recristalización a una concentración final de proteína de 0,2 g / L.
Nota: El calcio recristalización dependiendo de SLP1 (auto-montaje) se inicia mediante la adición del recbúfer rystallization. Por lo tanto, la bomba de la solución mezclada con un caudal de 125 l / min a los sensores (colocado dentro de los módulos de flujo) inmediatamente. La recristalización se realiza después de los valores estables de cambios de frecuencia y de disipación fueron detectados en experimentos QCM-D. - Después de la recristalización con éxito la proteína en la parte superior de los sensores modificado PE-dentro de los módulos de flujo enjuagar los sensores revestidos con tampón de recristalización o ultrapura waterintensively con un caudal de 125 l / min hasta que los valores estables de desplazamientos de frecuencia y la disipación se detectaron.
Nota: La modificación de la superficie SiO 2 con PE para los experimentos de sorción posteriores Onto SLP1 monocapa y AFM estudios se visualiza en la Figura 1.

Figura 1. Esquema Diseño de PE modificación de la superficie y SLP1 MonocapaRevestimiento; Esta cifra ha sido modificado desde Suhr, M. et al. (2015) 19 con permiso de Springer. Haga clic aquí para ver una versión más grande de esta figura.
- Metal y metal NP Interacción:
Nota: La sorción con la solución de sal de metal Au (HAuCl4 ∙ 3 H 2 O) se llevó a cabo en concentraciones de 1 mM o 5 mM a pH = 6,0 en 0,9% soluciones de NaCl. Au-NP adsorción se realizó con diluir Au-PN en 1,6 mM de tampón trisódico-citrato a pH ≈ 5,0.- Después del recubrimiento SLP1 éxito en los módulos de flujo, enjuague la capa SLP1 obtenido intensamente con solución de NaCl al 0,9% hasta que se detectaron valores estables de cambios de frecuencia y la disipación.
- Bombear la solución preparada de metal (1 mM) y la solución de NP a los módulos de flujo con un caudal de 125 l / min y realizar un seguimiento de la adsorción a la masa Slcapa p1. Masa de adsorción se puede detectar directamente mediante el seguimiento de los cambios de frecuencia se hace referencia a la ecuación de Sauerbrey (ecuación 1).
- Después de completar la interacción metal y NP metal, enjuagar la capa con tampón libre de metal / NP para eliminar metales débiles o nanopartículas unidos encuadernados o débiles.
Nota: Una ilustración de la configuración experimental se muestra en la Figura 2.

Figura 2. Esquema de diseño de la instalación QCM-D usando Flujo Módulo QFM 401 * 66. Haga clic aquí para ver una versión más grande de esta figura.
- Grabación de Datos y Evaluación:
- Registre los cambios en la frecuencia en Hz (Df n) y la disipación (Dd n) Dentro de los experimentos QCM-D mediante el uso de QCM-D de software específico.
- Uso para la evaluación de la sensibilidad de masa adsorbida (Delta M) la ecuación / modelo Sauerbrey (Ecuación 1) 65 66 que es válido para películas delgadas y rígidas acopladas sin fricción a la superficie del sensor aplicado a la n-ésimo armónico. El término C (Sauerbrey constante) para el usado 5 MHz en el sensor de cuarzo de corte es de 17,7 ng ∙ ∙ Hz -1 cm -2 68. Para rígida, distribuidas de manera uniforme, y las capas adsorbidas suficientemente delgadas utilizar la ecuación 1 como una buena aproximación.
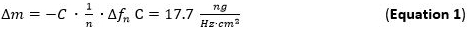
- Realizar el modelado adicional de acuerdo al modelo de Kelvin-Voigt válida para moléculas viscoelásticas 68-71 con el software específico del fabricante y comparar los resultados con los del modelo Sauerbrey.
- Para el cálculo del espesor de la capa y el uso de adsorción de masascomo parámetro de modelado importante una densidad de capa de la capa adsorbida de 1,35 g ∙ cm -3 correspondiente a los valores descritos anteriormente para las proteínas de la capa S 72-75. Utilice el mismo valor para el cálculo de la interacción de metal con la capa proteínica.
7. Medidas AFM
- Realizar estudios con plena capacidad AFM en un microscopio óptico invertido.
- Imágenes de AFM Records en líquido utilizando el tampón recristalización o agua ultrapura directamente en los sensores QCM-D recubiertos.
- Enjuague los sensores con agua ultrapura después de los experimentos QCM-D y colocarlos dentro de la célula de fluido AFM. Por lo tanto, utilizar una célula de fluido cerrada con un volumen total de aproximadamente 1,5 ml. Mantenga la temperatura de la constante de celda de fluido a 30 ° C.
- Utilice un voladizo con una frecuencia de resonancia de 25 kHz ≈ en agua y una rigidez de <0,1 N / m. Ajuste la velocidad de exploración entre 2,5 y 10 micras / seg.
- Tomar imágenes en el modo de contacto dinámico mientras que el voladizo es excitado por un piezo a su frecuencia de resonancia. Determine la distancia del voladizo a la superficie por la oscilación de amortiguación 76.
Nota: Las imágenes de altura indicadas z escala, mientras que los valores z representan la topografía exacta de la superficie. Amplitud imágenes (Pseudo 3D) se muestran sin z escala porque z valores de amplitud dependen de parámetros de análisis y dan información limitada. Análisis de imágenes se realizó utilizando los tres de software de evaluación diferente 77.
Access restricted. Please log in or start a trial to view this content.
Resultados
Cultivo de Microorganismos y SLP1 Caracterización
Los datos registrados del crecimiento bacteriano indica el final de la fase de crecimiento exponencial en alrededor de 5 hr. Investigaciones anteriores han demostrado que SLP1 se puede aislar desde este punto de cosecha (4,36 g / L biomasa húmeda (≈ 1,45 g / L (BDW)) con un rendimiento máximo 19. Sin embargo, la optimización del cultivo mediant...
Access restricted. Please log in or start a trial to view this content.
Discusión
En este trabajo estudiado la unión de Au a las proteínas de la capa S se investigó usando una combinación de diferentes métodos analíticos. En particular, la unión de Au es muy atractivo no sólo para la recuperación de Au de las aguas de minería o las soluciones del proceso, sino también para la construcción de materiales, por ejemplo, superficies sensoriales. Para los estudios de la interacción Au (Au (III) y Au (0) -NPs) con suspensión y monocapa de SLP1 recristalizado, la proteína tuv...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El presente trabajo fue parcialmente financiado por el IGF-proyecto "S-tamiz" (490 ZBG / 1), financiado por el BMWi y BMBF-proyecto "Aptasens" (BMBF / DLR 01RB0805A). Un agradecimiento especial a Tobias J. Günther por su valiosa ayuda durante los estudios de AFM y a Erik V. Johnstone por leer el manuscrito como un hablante nativo de Inglés. Además, el autor de este trabajo quiere agradecer a Aline Ritter y Sabrina Gurlit (del Instituto de Ecología de Recursos para la asistencia en las mediciones de ICP-MS), Manja Vogel, Nancy Unger, Karen E. Viacava y el Grupo de Biotecnología del Instituto Helmholtz- Freiberg de Tecnología de Recursos.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| equiment and software | |||
| Bioreactor, Steam In Place 70L Pilot System | Applikon Biotechnology, Netherlands | Z6X | Including dO2, pH sensors of Applikon Biotechnology and BioXpert software V2 |
| Noninvasive Biomass Monitor BugEye 2100 | BugLab, Concord (CA), USA | Z9X | --- |
| Spectrometer Ultrospec 1000 | Amersham Pharmacia Biotech, Great Britain | 80-2109-10 | Company now GE Healthcare Life Sciences |
| MiniStar micro centrifuge | VWR, Germany | 521-2844 | For centrifugation of cultivation samples |
| Research system microscope BX-61 | Olympus Germany LLC, Germany | 037006 | Microscope in combination with imaging software |
| Cell^P (version 3.1) | Olympus Soft Imaging Solutions LLC, Münster, Germany | --- | together with microscope |
| Powerfuge Pilot Separation System Serie 9010-S | Carr Centritech, Florida, USA | 9010PLT | For biomasse harvesting |
| T18 basic Ultra Turrax | IKA Labortechnik, Germany | 431-2601 | For flagella removal and sample homogenization |
| Sorvall Evolution RC Superspeed Centrifuge | Thermo Fisher Scientific, USA | 728411 | Used within protein isolation |
| Mobile high shear fluid processor, M-110EH-30 Pilot | Microfluidics, Massachusetts, USA | M110EH30K | Used for cell rupture |
| Alpha 1-4 LSC Freeze dryer | Martin Christ Freeze dryers LLC, Osterode, Germany | 102041 | --- |
| UV-VIS spectrophotometry (NanoDrop 2000c) | Thermo Fisher Scientific, USA | 91-ND-2000C-L | For determination of protein concentration |
| Mini-PROTEAN vertical electrophoresis chamber | Bio-Rad Laboratories GmbH, Munich, Germany | 165-3322 | For SDS-PAGE |
| VersaDoc Imaging System 3000 | Bio-Rad Laboratories GmbH, Munich, Germany | 1708030 | Used for imaging of SDS-PAGE gels |
| ICP-MS Elan 9000 | PerkinElmer, Waltham (MA), USA | N8120536 | For determination of metal concentration |
| Zetasizer Nano ZS | Malvern Instruments, Worcestershire United Kingdom | ZEN3600 | For determination of nanoparticle size |
| Q-Sense E4 device | Q-Sense AB, Gothenburg, Sweden | QS-E4 | ordered via LOT quantum design (software included with E4 platform) |
| Q-Soft 401 (data recording) | Q-Sense AB, Gothenburg, Sweden | ||
| Q-Tools 3 (data evaluation and modelling) | Q-Sense AB, Gothenburg, Sweden | ||
| QCM-D flow modules QFM 401 | Q-Sense AB, Gothenburg, Sweden | QS-QFM401 | ordered via LOT quantum design |
| QSX 303 SiO2 piezoelectric AT-cut quartz sensors | Q-Sense AB, Gothenburg, Sweden | QS-QSX303 | ordered via LOT quantum design |
| Ozone cleaning chamber | Bioforce Nanoscience, Ames (IA), USA | QS-ESA006 | ordered via LOT quantum design |
| Atomic Force Microscope MFP-3D Bio AFM | Asylum Research, Santa Barbara (CA), USA | MFP-3DBio | AFM measurements and imaging software |
| Asylum Research AFM Software AR Version 120804+1223 | Asylum Research, Santa Barbara (CA), USA | --- | imaging software included in Cat. No. MFP-3DBio |
| Igor Version Pro 6.3.2.3 Software | WaveMetrics, Inc., USA | --- | imaging software included in Cat. No. MFP-3DBio |
| BioHeater | Asylum Research, Santa Barbara (CA), USA | Bioheater | Sample heater for AFM measurements |
| Biolever mini cantilever, BL-AC40TS-C2 | Olympus Germany LLC, Germany | BL-AC40TS-C2 | Prefered cantilever for AFM measurements |
| WSxM 5.0 Develop 6.5 (2013) | Nanotec Electronica S.L. , Spain | freeware | Software for AFM analysis |
| Name | Company | Catalog Number | Comments |
| Detergents and other equiment | |||
| acidic acid, 100 %, p.A. | CARL ROTH GmbH+CO.KG | 3738.5 | Danger, flammable and corrosive liquid and vapour. Causes severe skin burns and eye damage. |
| Antifoam 204 | Sigma-Aldrich Co. LLC. | A6426 | For foam suppression |
| bromophenol blue, sodium salt | Sigma-Aldrich Co. LLC. | B5525 | --- |
| Coomassie Brilliant Blue R (C45H44N3NaO7S2) | CARL ROTH GmbH+CO.KG | 3862.1 | --- |
| Deoxyribonuclease II from porcine spleen | Sigma-Aldrich Co. LLC. | D4138 | Typ IV , 2,000 - 6,000 Kunitz units/mg protein |
| Ethanol, 95% | VWR, Germany | 20827.467 | Danger, flammable |
| glycerine, p.A. | CARL ROTH GmbH+CO.KG | 3783.1 | --- |
| Guanidine hydrochloride (GuHCl) | CARL ROTH GmbH+CO.KG | 0037.1 | --- |
| Hellmanex III | Hellma GmbH & Co. KG | 9-307-011-4-507 | --- |
| Hydrochloric acid (HCl) (37%) | CARL ROTH GmbH+CO.KG | 4625.2 | Danger; Corrosive, used for pH adjustment |
| Lysozyme from chicken egg white | Sigma-Aldrich Co. LLC. | L6876 | Lyophilized powder, protein = 90 %, = 40,000 units/mg protein (Sigma) |
| Magnetic stirrer with heating, MR 3000K | Heidolph Instruments GmbH & Co.KG, Germany | 504.10100.00 | Standard stirrer within experiment |
| NB-Media DM180 | Mast Diagnostica GmbH | 121800 | --- |
| Nitric acid (HNO3) | CARL ROTH GmbH+CO.KG | HN50.1 | Danger; Oxidizing, Corrosing |
| PageRuler Unstained Protein Ladder | ThermoScientific-Pierce | 26614 | --- |
| Poly(sodium 4-styrenesulfonat) (PSS) | Sigma-Aldrich Co. LLC. | 243051 | Average Mw ~70,000 |
| Polyethylenimine (PEI), branched | Sigma-Aldrich Co. LLC. | 408727 | Warning; Harmful, Irritant, Dangerous for the environment; average Mw ~25,000 |
| Potassium carbonate anhydrous (K2CO3) | Sigma-Aldrich Co. LLC. | 60108 | Warning; Harmful |
| Ribonuclease A from bovine pancreas | Sigma-Aldrich Co. LLC. | R5503 | Type I-AS, 50 - 100 Kunitz units/mg protein |
| Sodium azide (NaN3) | Merck KGaA | 106688 | Danger; very toxic and Dangerous for the environment |
| Sodium chloride (NaCl) | CARL ROTH GmbH+CO.KG | 3957.2 | --- |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich Co. LLC. | L-5750 | Danger; toxic |
| Sodium hydroxide (NaOH) | CARL ROTH GmbH+CO.KG | 6771.1 | Danger; Corrosive, used for pH regulation within cultivation and pH adjustment |
| Spectra/Por 6, Dialysis membrane, MWCO 50,000 | CARL ROTH GmbH+CO.KG | 1893.1 | --- |
| Sulfuric acid (H2SO4) | CARL ROTH GmbH+CO.KG | HN52.2 | Danger; Corrosive, used for pH regulation within cultivation |
| Tannic acid (C76H52O46) | Sigma-Aldrich Co. LLC. | 16201 | --- |
| TRIS HCl (C4H11NO3HCl) | CARL ROTH GmbH+CO.KG | 9090.2 | --- |
| Triton X-100 | CARL ROTH GmbH+CO.KG | 3051.3 | Warning; Harmful, Dangerous for the environment |
| VIVASPIN 500, 50,000 MWCO Ultrafiltration tubes | Sartorius AG | VS0132 | --- |
| β-mercaptoethanol | Sigma-Aldrich Co. LLC. | M6250 | Danger, toxic |
Referencias
- Merroun, M. L., Rossberg, A., Hennig, C., Scheinost, A. C., Selenska-Pobell, S. Spectroscopic characterization of gold nanoparticles formed by cells and S-layer protein of Bacillus sphaericus JG-A12. Mater. Sci. Eng. C. 27 (1), 188-192 (2007).
- Raff, J., Soltmann, U., Matys, S., Selenska-Pobell, S., Bottcher, H., Pompe, W. Biosorption of uranium and copper by biocers. Chem. Mat. 15 (1), 240-244 (2003).
- Sleytr, U. B., Schuster, B., Egelseer, E. M., Pum, D. S-Layers: Principles and Applications. FEMS Microbiol. Rev. , (2014).
- Pollmann, K., Raff, J., Merroun, M., Fahmy, K., Selenska-Pobell, S. Metal binding by bacteria from uranium mining waste piles and its technological applications. Biotechnol. Adv. 24 (1), 58-68 (2006).
- Raff, J., Selenska-Pobell, S. Toxic avengers. Nucl. Eng. Int. 51, 34-36 (2006).
- Tsuruta, T. Biosorption and recycling of gold using various microorganisms. J. Gen. Appl. Microbiol. 50 (4), 221-228 (2004).
- Sathishkumar, M., Mahadevan, A., Vijayaraghavan, K., Pavagadhi, S., Balasubramanian, R. Green Recovery of Gold through Biosorption, Biocrystallization, and Crystallization. Ind. Eng. Chem. Res. 49 (16), 7129-7135 (2010).
- Das, N. Recovery of precious metals through biosorption - A review. Hydrometallurgy. 103 (1-4), 180-189 (2010).
- Volesky, B. Biosorption and me. Water Res. 41 (18), 4017-4029 (2007).
- Vilar, V. J. P., Botelho, C. M. S., Boaventura, R. A. R. Environmental Friendly Technologies for Wastewater Treatment: Biosorption of Heavy Metals Using Low Cost Materials and Solar Photocatalysis. Security of Industrial Water Supply and Management.NATO Science for Peace and Security Series C-Environmental Security. Atimtay, T. A., Sikdar, S. K. , Springer. 159-173 (2010).
- Lovley, D. R., Lloyd, J. R. Microbes with a mettle for bioremediation. Nat. Biotechnol. 18 (6), 600-601 (2000).
- Schiewer, S., Volesky, B. Environmental Microbe-Metal Interactions. Lovely, D. R. , ASM Press. Washington. 329-362 (2000).
- Raff, J., Berger, S., Selenska-Pobell, S. Uranium binding by S-layer carrying isolates of the genus Bacillus. Annual Report 2006 Institute of Radiochemistry. , Forschungszentrum Rossendorf. Dresden. (2006).
- Srinath, T., Verma, T., Ramteke, P. W., Garg, S. K. Chromium (VI) biosorption and bioaccumulation by chromate resistant bacteria. Chemosphere. 48 (4), 427-435 (2002).
- Godlewska-Zylkiewicz, B. Biosorption of platinum and palladium for their separation/preconcentration prior to graphite furnace atomic absorption spectrometric determination. Spectroc. Acta Pt. B-Atom. Spectr. 58 (8), 1531-1540 (2003).
- Hosea, M., et al. Accumulation of elemental gold on the alga Chlorella-vulgaris. Inorg. Chim. A-Bioinor. 123 (3), 161-165 (1986).
- Vogel, M., et al. Biosorption of U(VI) by the green algae Chlorella vulgaris. in dependence of pH value and cell activity. Sci. Total Environ. 409 (2), 384-395 (2010).
- Creamer, N., Baxter-Plant, V., Henderson, J., Potter, M., Macaskie, L. Palladium and gold removal and recovery from precious metal solutions and electronic scrap leachates by Desulfovibrio desulfuricans. Biotechnol Lett. 28 (18), 1475-1484 (2006).
- Suhr, M., et al. Investigation of metal sorption behavior of Slp1 from Lysinibacillus sphaericus. JG-B53 - A combined study using QCM-D, ICP-MS and AFM. Biometals. 27 (6), 1337-1349 (2014).
- Suhr, M. Isolierung und Charakterisierung von Zellwandkomponenten der gram-positiven Bakterienstämme Lysinibacillus sphaericus JG-A12 und JG-B53 und deren Wechselwirkungen mit ausgewählten relevanten Metallen und Metalloiden. , Technische Universität Dresden. (2015).
- Spain, A., Alm, E. Implications of Microbial Heavy Metal Tolerance in the Environment. Reviews in Undergraduate Research. 2, Rice University . Houston. 1-6 (2003).
- Ledin, M. Accumulation of metals by microorganisms - processes and importance for soil systems. Earth-Sci. Rev. 51 (1-4), 1-31 (2000).
- Maruyama, T., et al. Proteins and Protein-Rich Biomass as Environmentally Friendly Adsorbents Selective for Precious Metal Ions. Environ. Sci. Technol. 41 (4), 1359-1364 (2007).
- Sara, M., Sleytr, U. B. S-layer proteins. J. Bacteriol. 182 (4), 859-868 (2000).
- Baranova, E., et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 487 (7405), 119-122 (2012).
- Teixeira, L. M., et al. Entropically Driven Self-Assembly of Lysinibacillus sphaericus S-Layer Proteins Analyzed Under Various Environmental Conditions. Macromol. Biosci. 10 (2), 147-155 (2010).
- Ahmed, I., Yokota, A., Yamazoe, A., Fujiwara, T. Proposal of Lysinibacillus boronitolerans gen. nov. sp. nov., and transfer of Bacillus fusiformis to Lysinibacillus fusiformis comb. nov. and Bacillus sphaericus to Lysinibacillus sphaericus comb. nov. Int. J. Syst. Evol. Microbiol. 57 (5), 1117-1125 (2007).
- Panak, P., et al. Bacteria from uranium mining waste pile: interactions with U(VI). J. Alloy. Compd. 271, 262-266 (1998).
- Selenska-Pobell, S., Kampf, G., Flemming, K., Radeva, G., Satchanska, G. Bacterial diversity in soil samples from two uranium waste piles as determined by rep-APD, RISA and 16S rDNA retrieval. Antonie Van Leeuwenhoek. 79 (2), 149-161 (2001).
- Lederer, F. L., et al. Identification of multiple putative S-layer genes partly expressed by Lysinibacillus sphaericus JG-B53. Microbiology. 159 ( Pt 6), 1097-1108 (2013).
- Günther, T. J., Suhr, M., Raff, J., Pollmann, K. Immobilization of microorganisms for AFM studies in liquids. RSC Advances. 4, 51156-51164 (2014).
- Fahmy, K., et al. Secondary Structure and Pd(II) Coordination in S-Layer Proteins from Bacillus sphaericus. Studied by Infrared and X-Ray Absorption Spectroscopy. Biophys. J. 91 (3), 996-1007 (2006).
- Pollmann, K., Merroun, M., Raff, J., Hennig, C., Selenska-Pobell, S. Manufacturing and characterization of Pd nanoparticles formed on immobilized bacterial cells. Lett. Appl. Microbiol. 43 (1), 39-45 (2006).
- Corti, C., Holliday, R. Gold : science and applications. , CRC Press - Taylor&Francis Group. (2010).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104 (1), 293-346 (2004).
- Tang, J., et al. Fabrication of Highly Ordered Gold Nanoparticle Arrays Templated by Crystalline Lattices of Bacterial S-Layer Protein. Chem. Phys. Chem. 9 (16), 2317-2320 (2008).
- Haruta, M. Size- and support-dependency in the catalysis of gold. Catal. Today. 36 (1), 153-166 (1997).
- Habibi, N., et al. Nanoengineered polymeric S-layers based capsules with targeting activity. Colloids and surfaces. B, Biointerfaces. 88 (1), 366-372 (2011).
- Toca-Herrera, J. L., et al. Recrystallization of Bacterial S-Layers on Flat Polyelectrolyte Surfaces and Hollow Polyelectrolyte Capsules. Small. 1 (3), 339-348 (2005).
- Decher, G., Lehr, B., Lowack, K., Lvov, Y., Schmitt, J. New nanocomposite films for biosensors - Layer-by-Layer adsorbed films of polyelectrolytes, proteins or DNA. Biosens. Bioelectron. 9 (9-10), 677-684 (1994).
- Decher, G., Schmitt, J. Fine-tuning of the film thickness of ultrathin multilayer films composed of consecutively alternating layers of anionic and cationic polyelectrolytes. Progress in Colloid & Polymer Science. 89 Trends in Colloid and Interface Science VI, Dr Dietrich Steinkopff Verlag. (1992).
- Günther, T. J. S-Layer als Technologieplattform - Selbstorganisierende Proteine zur Herstellung funktionaler Beschichtungen. , Technische Universität Dresden. (2015).
- Delcea, M., et al. Thermal stability, mechanical properties and water content of bacterial protein layers recrystallized on polyelectrolyte multilayers. Soft Matter. 4 (7), 1414-1421 (2008).
- Roach, P., Farrar, D., Perry, C. C. Interpretation of Protein Adsorption: Surface-Induced Conformational Changes. J. Am. Chem. Soc. 127 (22), 8168-8173 (2005).
- Zeng, R., Zhang, Y., Tu, M., Zhou, C. R., et al. Protein Adsorption Behaviors on PLLA Surface Studied by Quartz Crystal Microbalance with Dissipation Monitoring (QCM-D). Materials Science Forum. 610-613, 1219-1223 (2009).
- Bonroy, K., et al. Realization and Characterization of Porous Gold for Increased Protein Coverage on Acoustic Sensors. Anal. Chem. 76 (15), 4299-4306 (2004).
- Pum, D., Toca-Herrera, J. L., Sleytr, U. B. S-layer protein self-assembly. Int. J. Mol. Sci. 14 (2), 2484-2501 (2013).
- Weinert, U., et al. S-layer proteins as an immobilization matrix for aptamers on different sensor surfaces. Eng. Life Sci. , (2015).
- Umeda, H., et al. Recovery and Concentration of Precious Metals from Strong Acidic Wastewater. Mater. Trans. 52 (7), 1462-1470 (2011).
- Engelhardt, H., Saxton, W. O., Baumeister, W. 3-Dimensional structure of the tetragonal surface-layer of Sporosarcina-urea. J. Bacteriol. 168 (1), 309-317 (1986).
- Sprott, G. D., Koval, S. F., Schnaitman, C. A. Methods for general and molecular bacteriology. , American Society for Microbiology. 72-103 (1994).
- Laemmli, U. K. Cleavage of Structural Proteins during Assembly of Head Bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Stoscheck, C. [6] Quantitation of protein. Methods in Enzymology. Deutscher, M. P. 182, Academic Press. 50-68 (1990).
- Sleytr, U. B., Messner, P., Pum, D. Analysis of Crystalline Bacterial Surface-Layers by Freeze-Etching Metal Shadowing, Negative Staining and Ultra-Thin Sectioning. Method Microbiol. 20, 29-60 (1988).
- PerkinElmer. ICP Mass Spectrometry - The 30-Min to ICP-MS. , PerkinElmer. USA. (2001).
- Mühlpfordt, H. The preparation of colloidal Gold Nanoparticles using tannic-acid as an additional reducing agent. Experientia. 38 (9), 1127-1128 (1982).
- Hayat, M. A. Colloidal Gold - Principles, Methods and Applications. , Academic Press. (1989).
- Amendola, V., Meneghetti, M. Size Evaluation of Gold Nanoparticles by UV−vis Spectroscopy. The Journal of Physical Chemistry C. 113 (11), 4277-4285 (2009).
- Schurtenberger, P., Newman, M. E. Characterization of biological and environmental particles using static and dynamic light scattering in Environmental Particles. Buffle, J., van Leeuwen, H. P. 2, Lewis Publishers. 37-115 (1993).
- Jain, R., et al. Extracellular Polymeric Substances Govern the Surface Charge of Biogenic Elemental Selenium Nanoparticles. Environmental Science & Technology. 49 (3), 1713-1720 (2015).
- Harewood, K., Wolff, J. S. Rapid electrophoretic procedure for detection of SDS-released oncorna-viral RNA using polyacrylamide-agarose gels. Anal. Biochem. 55 (2), 573-581 (1973).
- Penfold, J., Staples, E., Tucker, I., Thomas, R. K. Adsorption of mixed anionic and nonionic surfactants at the hydrophilic silicon surface. Langmuir. 18 (15), 5755-5760 (2002).
- Krozer, A., Rodahl, M. X-ray photoemission spectroscopy study of UV/ozone oxidation of Au under ultrahigh vacuum conditions. J. Vac. Sci. Technol. A-Vac. Surf. Films. 15 (3), 1704-1709 (1997).
- Vig, J. R. UV ozone cleaning of surfaces. J. Vac. Sci. Technol. 3 (3), 1027-1034 (1985).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift Fur Physik. 155 (2), 206-222 (1959).
- Q-Sense - Biolin Scientific. Introduction and QCM-D Theory - Q-Sense Basic Training. , (2006).
- Edvardsson, M., Rodahl, M., Kasemo, B., Höök, F. A dual-frequency QCM-D setup operating at elevated oscillation amplitudes. Anal. Chem. 77 (15), 4918-4926 (2005).
- Hovgaard, M. B., Dong, M. D., Otzen, D. E., Besenbacher, F. Quartz crystal microbalance studies of multilayer glucagon fibrillation at the solid-liquid interface. Biophys. J. 93 (6), 2162-2169 (2007).
- Liu, S. X., Kim, J. T. Application of Kelvin-Voigt Model in Quantifying Whey Protein Adsorption on Polyethersulfone Using QCM-D. Jala. 14 (4), 213-220 (2009).
- Reviakine, I., Rossetti, F. F., Morozov, A. N., Textor, M. Investigating the properties of supported vesicular layers on titanium dioxide by quartz crystal microbalance with dissipation measurements. J. Chem. Phys. 122 (20), (2005).
- Voinova, M. V., Rodahl, M., Jonson, M., Kasemo, B. Viscoelastic acoustic response of layered polymer films at fluid-solid interfaces: Continuum mechanics approach. Phys. Scr. 59 (5), 391-396 (1999).
- Fischer, H., Polikarpov, I., Craievich, A. F. Average protein density is a molecular-weight-dependent function. Protein Sci. 13 (10), 2825-2828 (2004).
- Schuster, B., Pum, D., Sleytr, U. B. S-layer stabilized lipid membranes (Review). Biointerphases. 3 (2), FA3-FA11 (2008).
- Malmström, J., Agheli, H., Kingshott, P., Sutherland, D. S. Viscoelastic Modeling of Highly Hydrated Laminin Layers at Homogeneous and Nanostructured Surfaces: Quantification of Protein Layer Properties Using QCM-D and SPR. Langmuir. 23 (19), 9760-9768 (2007).
- Vörös, J. The Density and Refractive Index of Adsorbing Protein Layers. Biophys. J. 87 (1), 553-561 (2004).
- Hillier, A. C., Bard, A. J. ac-mode atomic force microscope imaging in air and solutions with a thermally driven bimetallic cantilever probe. Rev. Sci. Instrum. 68 (5), 2082-2090 (1997).
- Horcas, I., et al. WSXM: A software for scanning probe microscopy and a tool for nanotechnology. Rev. Sci. Instrum. 78 (1), 013705(2007).
- Merroun, M. L., Rossberg, A., Scheinost, A. C., Selenska-Pobell, S. XAS characterization of gold nanoclusters formed by cells and S-layer sheets of B. sphaericus JG-A12. Annual Report Forschungszentrum Rossendorf - Institute for Radiochemistry. , (2005).
- Jankowski, U., Merroun, M. L., Selenska-Pobell, S., Fahmy, K. S-Layer protein from Lysinibacillus sphaericus. JG-A12 as matrix for Au III sorption and Au-nanoparticle formation. Spectroscopy. 24 (1), 177-181 (2010).
- Selenska-Pobell, S., et al. Magnetic Au nanoparticles on archaeal S-Layer ghosts as templates. Nanomater. nanotechnol. 1 (2), 8-16 (2011).
- Caruso, F., Furlong, D. N., Kingshott, P. Characterization of ferritin adsorption onto gold. J. Colloid Interface Sci. 186 (1), 129-140 (1997).
- Ward, M. D., Buttry, D. A. In situ interfacial mass detection with piezoelectric transducers. Science. 249 (4972), 1000-1007 (1990).
- Höök, F., et al. Variations in coupled water, viscoelastic properties, and film thickness of a Mefp-1 protein film during adsorption and cross-linking: A quartz crystal microbalance with dissipation monitoring, ellipsometry, and surface plasmon resonance study. Anal. Chem. 73 (24), 5796-5804 (2001).
- Wahl, R. Reguläre bakterielle Zellhüllenproteine als biomolekulares Templat. , Technische Universität Dresden. (2003).
- Jennings, T., Strouse, G. Past, present, and future of gold nanoparticles in Bio-Applications of Nanoparticles. , Springer. 34-47 (2007).
- Beveridge, T., Fyfe, W. Metal fixation by bacterial cell walls. Can. J. Earth Sci. 22 (12), 1893-1898 (1985).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados