A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ديسيلولاريزيشن قلب البشري برمته داخل حقيبة الضغط في اتجاه معكوس
In This Article
Summary
يتيح هذا الأسلوب ديسيلولاريزيشن جهاز صلبة معقدة باستخدام بروتوكول بسيطة تستند إلى صدمة ناضح ونضح من المنظفات الأيونية مع انقطاع مصفوفة الجهاز الحد الأدنى. وهو يضم تقنية رواية ديسيلولاريزيشن لقلوب البشر داخل حقيبة مضغوط مع الرصد في الوقت الحقيقي للتدفق الخلوي وديناميات تدفق الحطام.
Abstract
الحل النهائي للمرضى الذين يعانون من قصور في القلب نهاية مرحلة من زرع الأعضاء. ولكن قلوب المانحة محدودة والكبت المناعي مطلوب، وفي نهاية المطاف يمكن أن يحدث الرفض. إنشاء وظيفية، القلب الاصطناعي-بيو ذاتي يمكن حل هذه التحديات. بيوفابريكيشن قلب يتألف من خلايا وسقالة خيار واحد. يمكن الحصول على سقالة طبيعية مع تكوين الأنسجة على حدة، فضلا عن هيكل الجزئي والكلى بقلوب ديسيلولاريزينج من البشر أو الحيوانات الكبيرة مثل الخنازير. ويشمل ديسيلولاريزيشن الغسيل الحطام الخلوية مع الحفاظ على المصفوفة خارج الخلية 3D والمفرج والسماح "سيلولاريزيشن" في تيميبوينت وقت لاحق. الاستفادة من الرواية لنا إيجاد ديسيلولاريزيشن نضح تلك الأجهزة المعقدة ممكن، قمنا بتطوير أسلوب "فسيولوجية" أكثر ديسيلولاريزي قلوب البشر غير الأولى بوضعها داخل حقيبة مضغوط، في المقلوب التوجه، تحت ضغط الخاضعة للرقابة. والغرض من استخدام حقيبة مضغوط إنشاء تدرجات الضغط عبر الصمام الابهري الاحتفاظ بها مغلقة وتحسين التروية احتشاء عضلة القلب. متزامنة تقييم ديناميات تدفق وإزالة الحطام الخلوية أثناء ديسيلولاريزيشن يسمح لنا برصد تدفق السوائل وتدفق الحطام، مما يولد سقالة التي يمكن استخدامها أما لإصلاح القلب بسيطة (مثلاً كتصحيح أو صمام سقالة) أو سقالة كل جهاز.
Introduction
قصور القلب يؤدي إلى ارتفاع معدل الوفيات في المرضى. هو خيار العلاج النهائي لفشل القلب نهاية مرحلة الزرع الو. ومع ذلك، هناك قائمة انتظار طويلة للزرع بسبب النقص في الهيئات المانحة، وزرع ما بعد الوجه المرضى العوائق التي تتراوح من الكبت المناعي مدى الحياة لرفض الجهاز المزمنة1،2. قلوب الهندسة الحيوية الوظيفية إعادة إسكانها يكونوا ديسيلولاريزيد قلوب البشرية الحجم مع مريض نفسه الخلايا ويمكن الالتفاف على هذه العقبات3.
خطوة رئيسية في "هندسة" قلب هو إنشاء السقالة مع بنية الأوعية الدموية ومتني المناسبة، وتكوينه ووظيفته لتوجيه المحاذاة وتنظيم خلايا تم تسليمها. حضور الإطار المناسب، ينبغي الاعتراف بالبيئة خلايا المصنف على السقالة وأداء وظيفة المتوقعة كجزء من هذا الجهاز. في رأينا، يضم الجهاز ديسيلولاريزيد المصفوفة خارج الخلية (ديكم) الخصائص اللازمة سقالة مثالية.
يمكن من الاستفادة من المفرج الجوهرية، مجمع الجامعة-الجهاز ديسيلولاريزيشن عن طريق أنتيجرادي أو نضح رجعية4 لإزالة المكونات الخلوية مع الحفاظ على المصفوفة خارج الخلية 3D حساسة والمفرج2، 5،،من67. المفرج وظيفية مهم في الهندسة الحيوية كلها أجهزة فقط كما الحال في فيفو، لتوزيع المواد الغذائية والتخلص من النفايات8. ديسيلولاريزيشن التروية التاجية وقد ثبت أن تكون فعالة في خلق قلوب ديسيلولاريزيد من الفئران4، أو الخنازير4،،من79،10،11 ،،من1213، والبشر5،،من714،،من1516. ومع ذلك، يمكن أن تعاني سلامة الصمامات والاذينين ومناطق أخرى "رقيقة".
يمكن الحصول على السقالات قلب الإنسان-حجم ديسيلولاريزيد من الخنازير باستخدام ضغط التحكم7،9،10،11،12 أو ضخ تدفق معدل التحكم13، 17 ومن الجهات المانحة البشرية باستخدام ضغط التحكم5،7،،من1415. ديسيلولاريزيشن قلوب البشرية المانحة يحدث على مدى 4-8 أيام تحت ضغط تسيطر على 80-100 ملم زئبقي في اتجاه مستقيم5،،من1516 أو أكثر من 16 يوما تحت ضغط تسيطر على 60 مم زئبق14 . تحت أنتيجرادي، ديسيلولاريزيشن الخاضعة لسيطرة الضغط، كفاءة الصمام الابهري يلعب دوراً حاسما في الحفاظ على كفاءة التروية التاجية وضغط مستقر في جذر الابهر. وكشفت عملنا السابق أن التوجه للقلب يؤثر على كفاءته التروية التاجية أثناء الإجراء ديسيلولاريزيشن، وبالتالي سلامة سقالة في نهاية9.
استمرارا لجهودنا السابقة العمل9، نقدم مفهوما جديداً حيث يتم إضافة حقيبة مثل تامور لتحسين ديسيلولاريزيشن قلب كل. يصف لنا ديسيلولاريزيشن قلوب البشر التي توضع داخل الحقائب المضغوط، الموجهة نحو عكسيا، وتحت ضغط تسيطر على 120 ملم زئبقي في جذر الابهر. ويشمل هذا البروتوكول رصد تدفق الشخصية ومجموعة من الوسائط إلى الخارج طوال فترة الإجراءات ديسيلولاريزيشن لتقييم كفاءة التروية التاجية، وإزالة الأنقاض الخلية. ثم تجري فحوصات الكيمياء الحيوية لاختبار فعالية هذه الطريقة.
Protocol
جميع التجارب التي تلتزم بالمبادئ التوجيهية للجنة الأخلاقيات من معهد القلب في ولاية تكساس.
1. إعداد الجهاز
ملاحظة: بالتعاون مع ليفيجيفت، مؤسسة مشتريات هيئة غير ربحية في ولاية تكساس (http://www.lifegift.org)، تبرعت بها قلوب البشر لا تصلح لزرع استخدمت للبحث مع موافقة الموافق عليها.
- عن طريق الوريد لشراء قلوب، لبث 30,000 يو الهيبارين إلى القلوب. خياطة قنية كارديوبليجيا في الشريان الاورطي وإرفاق خط التروية فرضت بشكل أمن. انثقب الأجوف فينا أدنى (IVC) للتنفيس عن قلب الحق. قطع الوريد الرئوي متفوقة الأيسر أو أطرافهم أذينية الأيسر للتنفيس عن الدوائر الأيسر من القلب.
- صب 1 لتر من كارديوبليجيا أو هيبارينيزيد المالحة. تشريح فروع قوس الاورطي، متفوقة الوريد الأجوف (SVC) والأخرى الأوردة الرئوية بالإفراج عن القلب من أي مرفق أنسجة الأوعية الدموية أو المحيطة بها. غمر قلب هيبارينيزيد جيدا في المحلول الملحي مثلج.
- فحص قلب الإنسان المتبرع بها (كل من الأسفل والخلف، الشكل 1). مكان القلب في علبة تشريح وفحص لأي أضرار هيكلية أو التشوهات التشريحية. إذا اشتريت لزرع الكبد و/أو الرئتين، قد يقدم القلب الأجوف فينا أدنى قصيرة و/أو عدم وجود الجدار الخلفي الأيسر أذينية.
- إجراء فحص داخلي للعيوب المحتملة-عيب الحاجز الاذيني (ASD) أو عيب الحاجز البطين (VSD) أو تشوه الصمام (الابهري والرئوي والتاجي، الثلاثي).
- في حالة وجود عيب الحاجز، تصحيح مع خيوط مناسبة (الشكل 2 أ، 2). ويلزم تصحيح عيوب الحاجز لرصد التقدم المحرز في ديسيلولاريزيشن عن طريق قياس التعكر تدفق الشريان الرئوي (السلطة الفلسطينية). يزيل تصحيح العيب الحاجز من اليسار إلى اليمين التحويلة، ومن ثم التدفق من السلطة الفلسطينية يمثل التدفق من الدوران التاجي عن طريق الجيوب الأنفية التاجي.
- سد أعلى وأدنى الوريد الأجوف مع خياطة الحرير 2-0 (الشكل 2).
- تشريح الشريان الاورطي (Ao) بعيداً عن السلطة الفلسطينية الرئيسية ل cannulation اللاحقة (الشكل 2D).
- إدراج الروابط، واستنادا إلى قطر السفينة، (الشكل 3) في Ao والسلطة الفلسطينية وأمن لهم مع خيوط الحرير 2-0 (الشكل 4 أ).
- إدراج خط أنابيب عبر الاذين الأيسر (الشكل 4 باء) ونحو البطين الأيسر (LV) (الشكل 3)، باستخدام واحدة من فتحات الأوردة الرئوية.
- قم بتوصيل خط ضخ الموصل في Ao وخط تدفق واحد في السلطة الفلسطينية (الشكل 3).
- مكان القلب مستعدا في حقيبة بوليستر في اتجاه معكوس (رأسا على عقب).
- وضع الحقيبة مع القلب في حاوية نضح وإغلاق الغطاء (الشكل 4).
- توصيل كل سطر من الأسطر إلى موانئ كل منهما في سداده المطاط (استناداً إلى قطر حاوية) وأدخله إلى غطاء الحاوية نضح لختم الحقيبة البوليستر (الشكل 4 و الشكل 5 (ب)).
- نتخلل x 1 فوسفات مخزنة المالحة (PBS) (136 مم كلوريد الصوديوم، 2.7 مم بوكل، 10 مم Na2هبو4 و 1.8 مم خ2ص4 في الماء المقطر، ودرجة الحموضة 7.4) عبر منفذ التسريب من سداده مطاطية للتحقق من تدفق من السلطة الفلسطينية ومن الخط إدراج في العائلة
- استخدم هذا التدفق لتنظيف الجهاز من أي آثار متبقية للدم في المفرج. إذا لم يلاحظ تدفق، تشديد خطوط الاتصال كما أنها قد تكون فضفاضة.
2-نظام الإعداد والإجراء ديسيلولاريزيشن الجهاز
- تجميع مفاعل حيوي ووضع في اتجاه مستقيم (الشكل 5). ويشمل نظام التروية كمبيوتر شخصي (PC)، النسبي-متكاملة-مشتق (PID) وحدة تحكم، مضخة تمعجية لضخ Ao، ومفاعل حيوي نضح، حاوية ضغط رأس للاحتفاظ بيرفوساتي LV (ل 2 المضخة زجاجة مع أسفل sidearm)، ومضخة تمعجية لتصريف السوائل الزائدة من الحاوية ضغط الرأس وجمع التدفق من السلطة الفلسطينية.
- في الغشاء المطاطي، توصيل خط ضخ وخط ضغط الرأس وخط تدفق السلطة الفلسطينية وخط تجفيف مفاعل حيوي إلى الموانئ السطحية المطاط غطاء يوضع على رأس مفاعل حيوي التروية (الشكل 5A).
- ديسيلولاريزي القلوب تحت ضغط مستمر من 120 ملم زئبق تقاس في جذر الابهر. ينبغي أن يكون الضغط يعني للوقف في 14-18 ملم زئبق طوال عملية ديسيلولاريزيشن كله.
- ديسيلولاريزي القلوب كما يلي: ح 4 الحل مكثف (500 ملم كلوريد الصوديوم)، ح 2 حل ناقص التوتر (20 مم كلوريد الصوديوم)، ح 120 من الصوديوم دوديسيل كبريتات (1% الحزب الديمقراطي الصربي) حل، ويغسل نهائي مع 120 لتر من 1 X PBS (الشكل 6A).
- ديسيلولاريزي القلوب تحت مراقبة الضغط المستمر (120 ملم زئبق). تتوقف على القلب ضخ معدل التدفق إلى Ao وهي، في المتوسط، 98.06±16.22 مل/دقيقة للحل مكثف، 76.14±7.90 مل/دقيقة للحل ناقص التوتر، 151.50±5.76 مل/دقيقة للحزب الديمقراطي الصربي ومل 185.24±7.10 بالدقيقة لبرنامج تلفزيوني. إجمالي حجم استهلاك كل كاشف المتوسطات L 23.36±5.70 مكثف حل ول 9.13±1.26 لحل ناقص التوتر.
- أوافيكم ل 60 النهائي من الحزب الديمقراطي الصربي 1% (ل 1 جرام من وزن القلب) حتى نهاية نضح الحزب الديمقراطي الصربي. ويبين الشكل 6A جدولاً زمنياً لعملية ديسيلولاريزيشن، والتماس نقاط النهاية لجمع البيانات: تدفق معدل الرصد (Ao والسلطة الفلسطينية) وتدفق جمع (غير السلطة الفلسطينية والسلطة الفلسطينية) من ضغط الرأس أثناء ديسيلولاريزيشن.
- إذ هي متصلة SVC و IVC، فإنه من المعقول أن نفترض أن جميع السوائل التي يتم جمعها من السلطة الفلسطينية هو نتيجة التروية التاجية الفعلية (الشكل 5 (ب)). تحديد كفاءة التروية التاجية بتقسيم معدل تدفق بيرفوساتي الخروج من السلطة الفلسطينية بمعدل تدفق للحل التي غرست مباشرة إلى Ao:
كفاءة التروية التاجية =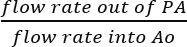 (%).
(%). - القيام بتحليل مقارن بيرفوساتي التي تم الحصول عليها من السلطة الفلسطينية والوقف والحلول التي غرست في التكرارات بتحميل 200 ميكروليتر كل بئر في صفيحة 96-جيدا أسفل واضحة وقراءة امتصاص في 280 نانومتر. تم العثور على قيمة امتصاص، المحدد تجريبيا بعد محاولة قيم مختلفة، لإعطاء الأفضل تطبيع القيم.
- استخدام التعكر لكاشف غرست النظيفة كعنصر التحكم. يمثل تبييض الحطام خلية التعكر بيرفوساتي إلى الخارج ويمكن قياسها كمياً على الفور خلال ديسيلولاريزيشن كأداة لتتبع عملية.
- أثناء الغسيل النهائي مع 10 لتر من 1 X PBS، إضافة 500 مل العقيمة معادلتها الاستيك 2.1% حمض الحل، تحييد مع هيدروكسيد الصوديوم 10N، مما يؤدي إلى 0.1% الاستيك حمض حلاً (v/v) في برنامج تلفزيوني. استخدام هذا الحل لتعقيم السقالة.
3-تقييم قلوب ديسيلولاريزيد
ملاحظة: بعد ديسيلولاريزيشن، سيتم استخدام قلوب الممثل لفحوصات التصوير والبيوكيميائية وعائية التاجية.
- إجراء تصوير الأوعية التاجية قلب الإنسان ديسيلولاريزيد الممثل لدراسة إينتاكتنيس المفرج الشريان التاجي. بإيجاز، باستخدام سريعاً، ديسيلولاريزيد الصورة في قلب الإنسان بعد حقن عامل التباين من خلال قنية أوستيال التاجية في الشرايين التاجية الرئيسية اليمنى واليسرى.
- تشريح القلب ديسيلولاريزيد للحصول على عينات من المناطق 19 تقييم المتبقية الحمض الخلوي الصبغي (DNA)، جليكوسامينوجليكان (هفوة) ومستويات المخزونات في أنسجة ديسيلولاريزيد. إزالة قاعدة القلب من البطينين وتشريح في البطينين إلى 4 أقسام متساوية (الشكل 6). تقسيم كل قسم إلى البطين الأيمن الأمامي والخلفي (RV)، LV الأمامي والخلفي، وحاجز إينتيرفينتريكولار (الحبس). يتم تشريح الأنسجة التي تحتوي على القمة في LV ورف لأخذ العينات.
- قطع عينات الأنسجة لفحوصات الحمض النووي، وأسكت، والحزب الديمقراطي الصربي (mg ~ 15 من الوزن الرطب).
- استخراج الحمض النووي المزدوج-الذين تقطعت بهم السبل (dsDNA) بهضم العينات في هيدروكسيد الصوديوم م 1 ح 3 في 65 درجة مئوية، وضبط الأس الهيدروجيني إلى 7 باستخدام العازلة تريس يدتا (TE) x 10 و 1 م حمض الهيدروكلوريك (HCl).
- قياس دسدنا استخدام دسدنا طقم المقايسة مع عجل الغدة الصعترية قياسية (انظر الجدول للمواد). قراءة عينات في تكرار استخدام قارئ ميكروسكوبية فلورية (الإثارة في 480 نانومتر والانبعاثات في 520 nm). حساب النسبة المئوية دسدنا المتبقية في قلوب ديسيلولاريزيد بمقارنة تركيز دسدنا في كل الأنسجة لأن في جيفيه (% المأخوذة).
- الحصول على الكمامات مسلفت إلى الحل عن طريق هضم عينات الأنسجة في حل استخراج غراء (0.2 M فوسفات الصوديوم العازلة مع يدتا ثنائية الصوديوم الملح، سيستين هيدروكلورايد، خلات الصوديوم، وغراء) عند 65 درجة مئوية لمدة 3 ساعات. قياس محتوى هفوة (من نسختين) باستخدام مجموعة "أدوات الفحص جليكوسامينوجليكان".
- ليوفيليزي عينات للمقايسة الحزب الديمقراطي الصربي في وزن جاف الفراغ وتدبير ساخنة. إضافة 200 ميليلتر من الماء عالي النقاوة لكل عينة المجففة ومجانسة لاستخراج بقايا الحزب الديمقراطي الصربي في الحل. خلط هذا الحل الحزب الديمقراطي الصربي لكلوروفورم وحل أزرق الميثيلين (12 مغ من الميثيلين الأزرق في 1 لتر من 0.01 M HCl). سيتم فصل الحزب الديمقراطي الصربي في الطبقة العضوية بالربط بصبغة أزرق الميثيلين.
- استخدام قارئ ميكروسكوبية الأسفار، قراءة امتصاص (655 nm) المعايير وعينات في تكرار لحساب الحزب الديمقراطي الصربي المتبقية. تطبيع هذه قيمة مخزونات النشر الاستراتيجي للأنسجة من الوزن الجاف.
- صورة عينات من مناطق سميكة (أي، LV، RV وحاجز) قلب الإنسان مع الفحص المجهري الضوئي غير الخطية (نلوم) تأكيد إزالة الخلوية بعد ديسيلولاريزيشن. ترد تفاصيل الإعداد نلوم في أعمالنا السابقة منشورات19،،من1820. يتيح لنا نلوم إلى خلية الصورة، الايلاستين، وألياف الكولاجين والميوسين من خلال يومين-فوتون الفلورية (الانتقالية) والثانية جيل التوافقي (SHG) قنوات دون استخدام أي خارجية وصمة عار أو صبغ21.
النتائج
بعد ديسيلولاريزيشن 7 أيام مع نضح الابهري أنتيجرادي تحت ضغط مستمر من 120 ملم زئبق، تحول قلب الإنسان شفافة (الشكل 6B). وكان تشريح القلب صارخ إلى أقسام 19 لتحليل الكيمياء الحيوية (الحمض النووي وهفوة والحزب الديمقراطي الصربي) (الشكل 6) لتقييم المنت?...
Discussion
على حد علمنا، هذا هو أول دراسة التقرير مقلوب ديسيلولاريزيشن من قلوب البشر داخل حقيبة مضغوط مع الوقت الفاصل بين رصد تدفق معدل وخلية إزالة الأنقاض. وتبقى الحقيبة تامور مثل التوجه للقلب مستقرة طوال فترة الإجراءات ديسيلولاريزيشن. غمر وعكس قلوب كله داخل حقيبة يمنع الجفاف ويقلل من الضغط المفرط...
Disclosures
الدكتور تايلور هو مؤسس ومساهم في ميروماتريكس الطبية، وشركة هذه العلاقة هو وفقا لسياسات تضارب المصالح التي تديرها جامعة مينيسوتا ومعهد تكساس للقلب؛ مؤلفين آخرين قد لا يوجد تضارب في الكشف عن.
Acknowledgements
أيد هذا البحث منح "الهبات هيوستن" و "صندوق تكساس للتكنولوجيا الناشئة". الكتاب تعترف وكالة المشتريات الجهاز ليفيجيفت, Inc. والأسر للمانحين لتقديم هذه الدراسة ممكن.
Materials
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture | Ethicon | SA85H | Suture used to ligate superior and inferior vena cava |
| 1/4" x 3/8" connector with luer | NovoSci | 332023-000 | Connect aorta and pulmonary artery |
| Masterflex platinum-cured silicone tubing | Cole-Parmer | HV-96410-16 | Tubing to connect heart chambers/veins |
| infusion and outflow line | Smiths Medical | MX452FL | For flowing solutions through the vasculature |
| Polyester pouch (Ampak 400 Series SealPAK Pouches) | Fisher scientific | 01-812-17 | Pericardium-like pouch for containing heart during decellularization |
| Snapware Square-Grip Canister | Snapware | 1022 | 1-liter Container used for perfusing heart |
| Black rubber stoppers | VWR | 59586-162 | To seal the perfusion container |
| Peristaltic pump | Harvard Apparatus | 881003 | To pump fluid through the inflow lines and to drain fluids |
| 2 L aspirator bottle with bottom sidearm | VWR | 89001-532 | For holding solutions/perfusate |
| Quant-iT PicoGreen dsDNA Assay kit | Life Technologies | P7589 | For quantifying dsDNA |
| Calf thymus standard | Sigma | D4522 | DNA standard |
| Blyscan Glycosaminoglycan Assay Kit | Biocolor Ltd | Blyscan #B1000 | GAG assay kit |
| Plate reader | Tecan | Infinite M200 Pro | For analytical assays |
| GE fluoroscopy | General Electric | OEC 9900 Elite | Angiogram |
| Visipaque | GE | 13233575 | Contrast agent |
References
- Writing Group Members. Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association. Circulation. 133 (4), 447-454 (2016).
- Zia, S., et al. Hearts beating through decellularized scaffolds: whole-organ engineering for cardiac regeneration and transplantation. Critical Reviews in Biotechnology. 36 (4), 705-715 (2016).
- Zimmermann, W. H. Strip and Dress the Human Heart. Circulation Research. 118 (1), 12-13 (2016).
- Ott, H. C., et al. Perfusion-decellularized matrix: Using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Sanchez, P. L., et al. Acellular human heart matrix: A critical step toward whole heart grafts. Biomaterials. 61, 279-289 (2015).
- Peloso, A., et al. Current achievements and future perspectives in whole-organ bioengineering. Stem Cell Research & Therapy. 6, 107 (2015).
- Guyette, J. P., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Momtahan, N., Sukavaneshvar, S., Roeder, B. L., Cook, A. D. Strategies and Processes to Decellularize and Cellularize Hearts to Generate Functional Organs and Reduce the Risk of Thrombosis. Tissue Engineering Part B-Reviews. 21 (1), 115-132 (2015).
- Lee, P. F., et al. Inverted orientation improves decellularization of whole porcine hearts. Acta Biomaterialia. , (2016).
- Momtahan, N., et al. Automation of Pressure Control Improves Whole Porcine Heart Decellularization. Tissue Eng Part C Methods. , (2015).
- Weymann, A., et al. Development and Evaluation of a Perfusion Decellularization Porcine Heart Model - Generation of 3-Dimensional Myocardial Neoscaffolds. Circulation Journal. 75 (4), 852-860 (2011).
- Weymann, A., et al. Bioartificial heart: A human-sized porcine model--the way ahead. PLoS One. 9 (11), e111591 (2014).
- Remlinger, N. T., Wearden, P. D., Gilbert, T. W. Procedure for decellularization of porcine heart by retrograde coronary perfusion. Journal of Visualized Experiments. (70), e50059 (2012).
- Guyette, J. P., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Sanchez, P. L., et al. Data from acellular human heart matrix. Data Brief. 8, 211-219 (2016).
- Garreta, E., et al. Myocardial commitment from human pluripotent stem cells: Rapid production of human heart grafts. Biomaterials. 98, 64-78 (2016).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Engineering Part C-Methods. 16 (3), 525-532 (2010).
- Larson, A. M., Yeh, A. T. Ex vivo characterization of sub-10-fs pulses. Optics Letters. 31 (11), 1681-1683 (2006).
- Lee, P. F., Yeh, A. T., Bayless, K. J. Nonlinear optical microscopy reveals invading endothelial cells anisotropically alter three-dimensional collagen matrices. Experimental Cell Research. 315 (3), 396-410 (2009).
- Lee, P. F., Bai, Y., Smith, R. L., Bayless, K. J., Yeh, A. T. Angiogenic responses are enhanced in mechanically and microscopically characterized, microbial transglutaminase crosslinked collagen matrices with increased stiffness. Acta Biomaterialia. 9 (7), 7178-7190 (2013).
- Wu, Z., et al. Multi-photon microscopy in cardiovascular research. Methods. 130, 79-89 (2017).
- Ramanathan, T., Skinner, H. Coronary blood flow. Continuing Education in Anaesthesia Critical Care & Pain. 5 (2), 61-64 (2005).
- Murthy, V. L., et al. Clinical Quantification of Myocardial Blood Flow Using PET: Joint Position Paper of the SNMMI Cardiovascular Council and the ASNC. Journal of Nuclear Cardiology. 25 (1), 269-297 (2018).
- Molina, D. K., DiMaio, V. J. Normal organ weights in men: Part I-the heart. The American Journal of Forensic Medicine and Pathology. 33 (4), 362-367 (2012).
- Molina, D. K., DiMaio, V. J. Normal Organ Weights in Women: Part I-The Heart. The American Journal of Forensic Medicine and Pathology. 36 (3), 176-181 (2015).
- Robertson, M. J., Dries-Devlin, J. L., Kren, S. M., Burchfield, J. S., Taylor, D. A. Optimizing cellularization of whole decellularized heart extracellular matrix. PLoS One. 9 (2), e90406 (2014).
- Robertson, M. J., Soibam, B., O'Leary, J. G., Sampaio, L. C., Taylor, D. A. Cellularization of rat liver: An in vitro model for assessing human drug metabolism and liver biology. PLoS One. 13 (1), e0191892 (2018).
- Baghalishahi, M., et al. Cardiac extracellular matrix hydrogel together with or without inducer cocktail improves human adipose tissue-derived stem cells differentiation into cardiomyocyte-like cells. Biochemical and Biophysical Research Communications. , (2018).
- Perea-Gil, I., et al. In vitro comparative study of two decellularization protocols in search of an optimal myocardial scaffold for recellularization. American Journal of Translational Research. 7 (3), 558-573 (2015).
- Freytes, D. O., O'Neill, J. D., Duan-Arnold, Y., Wrona, E. A., Vunjak-Novakovic, G. Natural cardiac extracellular matrix hydrogels for cultivation of human stem cell-derived cardiomyocytes. Methods Molecular Biology. 1181, 69-81 (2014).
- Oberwallner, B., et al. Preparation of cardiac extracellular matrix scaffolds by decellularization of human myocardium. Journal of Biomedical Materials Research Part A. 102 (9), 3263-3272 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved