É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Decellularization do coração humana dentro de uma bolsa pressurizada em uma orientação invertida
Neste Artigo
Resumo
Esse método permite a decellularization de um órgão complexo sólido usando um protocolo simples baseado em choque osmotic e perfusão de detergente iônico com o mínimo de órgão matriz de interrupção. É composto por uma técnica de novela decellularization para corações humanos dentro uma bolsa pressurizada com monitoramento em tempo real da saída de detritos de celular e dinâmica de fluxo.
Resumo
A solução definitiva para pacientes com insuficiência cardíaca de estágio final é o transplante de órgãos. Mas corações doadores são limitadas, imunossupressão é necessária e, finalmente, a rejeição pode ocorrer. Criando um funcional, coração artificial-bio autólogo poderia resolver esses desafios. Biofabrication de um coração composto por células e andaime é uma opção. Um andaime natural com composição de tecido-específica, bem como micro e macroarquitetura pode ser obtido por decellularizing corações de seres humanos ou animais de grandes porte como porcos. Decellularization envolve lavagem restos celulares ao mesmo tempo preservando a vasculatura e 3D da matriz extracelular e permitindo que "celularização" em um Commit depois. Capitalizando sobre nosso romance encontrar aquele decellularization de perfusão de órgãos complexos é possível, nós desenvolvemos um método mais "fisiológico" para decellularize os corações humanos não-transplantáveis, colocando-os dentro de uma bolsa pressurizada, em uma invertida orientação, sob pressão controlada. O propósito de usar uma bolsa pressurizada é criar gradientes de pressão através da válvula aórtica para mantê-lo fechado e melhorar a perfusão do miocárdio. Avaliação simultânea da dinâmica de fluxo e remoção de restos celulares durante decellularization permitida-nos monitorar tanto o fluido influxo e o efluxo de detritos, gerando assim um andaime que pode ser usado também para simples reparação cardíaca (por exemplo, como um patch ou andaime de válvula) ou como um andaime de todo o órgão.
Introdução
Insuficiência cardíaca leva a elevada taxa de mortalidade em pacientes. A opção final tratamento para insuficiência cardíaca de estágio final é allo-transplante. No entanto, há uma longa lista de espera para transplante devido a escassez de órgãos de doador, e rosto de pacientes pós-transplante barreiras que variam de imunossupressão ao longo da vida a rejeição de órgãos crônica1,2. Corações funcionais de bioengenharia pelo repovoamento decellularized corações de tamanho humano, com do próprio paciente células poderiam contornar estes obstáculos3.
Um grande passo em "engenharia" um coração é a criação de um andaime com adequada estrutura vascular e parenquimatosa, composição e função para orientar o alinhamento e organização de células entregues. Na presença de quadro apropriado, células semeadas no andaime devem reconhecer o ambiente e executar a função prevista como parte do órgão. Em nossa opinião, matriz extracelular de órgão decellularized (dECM) compreende as características necessárias de andaime ideal.
Utilizando a vasculatura intrínseca, complexo todo-órgão decellularization pode ser alcançado através de hemorragias anterógradas ou perfusão retrógrada4 para remover componentes celulares preservando o delicado 3D matriz extracelular e vasculatura2, 5,6,7. Uma vasculatura funcional é importante em órgãos inteiros de bioengenharia apenas como na vivo, para a distribuição de nutrientes e remoção de lixo8. Decellularization de perfusão coronariana tem sido provado para ser eficaz na criação de decellularized de corações de ratos4, ou porcos4,7,9,10,11 ,12,13e os seres humanos5,7,14,15,16. Ainda, a integridade das válvulas, átrios e outras regiões "finos" pode sofrer.
Decellularized coração humano-tamanho andaimes podem ser obtidas de porcos usando pressão controle7,9,10,11,12 ou infusão fluxo taxa controle13, 17 e de doadores humanos usando pressão de controle5,7,14,15. Decellularization de corações de doador humano ocorre em 4-8 dias sob pressão controlada em 80-100 mmHg na orientação vertical5,15,16 ou mais de 16 dias sob pressão controlada em 60 mmHg14 . Sob hemorragias anterógradas, decellularization pressão controlada, a competência da valva aórtica desempenha um papel crucial na manutenção da eficiência de perfusão coronariana e pressão estável na raiz da aorta. Nosso trabalho anterior revelou que a orientação do coração influencia sua eficiência de perfusão coronariana durante o procedimento de decellularization e, portanto, a integridade de andaime na final9.
Como uma continuação da nossa anterior trabalho9, apresentamos um novo conceito no qual um malote do pericárdio, como é adicionado para melhorar a decellularization de todo o coração. Descrevemos o decellularization de corações humanos colocadas dentro de bolsas pressurizadas, inversamente orientadas e sob pressão controlada em 120 mmHg na raiz da aorta. Este protocolo inclui o monitoramento do perfil de fluxo e coleção de mídia de saída ao longo do processo de decellularization para avaliar a eficiência de perfusão coronariana e remoção de detritos de células. Ensaios bioquímicos são então realizados para testar a eficácia do método.
Protocolo
Todos os experimentos respeitadas as orientações do Comitê de ética do Instituto do coração do Texas.
1. o órgão preparação
Nota: Em colaboração com LifeGift, uma organização de compras de órgãos sem fins lucrativos no Texas (http://www.lifegift.org), doou corações humanos não são adequadas para transplante foram usados para pesquisa com consentimento aprovado.
- Para adquirir os corações, infundi por via intravenosa 30.000 heparina de U para os corações. Firmemente suturar a cânula de cardioplegia na aorta e anexar uma linha de perfusão preso. Perfure a veia cava inferior (VCI) para desafogar o coração direito. Corte a veia pulmonar superior esquerda ou o apêndice atrial esquerdo para desafogar as esquerdo câmaras do coração.
- Infundi 1 L de cardioplegia ou soro fisiológico heparinizado. Disse ramos do arco aórtico, veia cava superior (SVC) e outras veias pulmonares para liberar o coração de qualquer anexo de tecido vascular ou circundante. Submergi o coração bem heparinizado em solução salina gelada.
- Inspecionar o coração humano doado (ambos anteriormente e posteriormente, Figura 1). Coloque o coração sobre uma bandeja de dissecação e verifique se há qualquer dano estrutural ou malformações anatômicas. Se o fígado ou os pulmões foram adquiridos para transplante, o coração pode apresentar uma pequena veia cava inferior e/ou ausência de parede posterior atrial esquerdo.
- Execute inspeção interna para possíveis defeitos - defeito do septo atrial (ASD), defeito do septo ventricular (VSD) ou malformação da válvula (aórtica, pulmonar, mitral, tricúspide).
- Se houver um defeito do septo, corrigi-lo com suturas apropriadas (Figura 2A, 2B). A correção de defeitos septais é necessária para monitorar o progresso de decellularization através de medição de turbidez de efluxo de artéria pulmonar (PA). Correção do defeito septal remove esquerda para a direita derivação, portanto, a saída da PA representa a saída da circulação coronária através do seio coronário.
- Ligate superior e inferior veia cava com sutura de seda 2-0 (Figura 2).
- Disse a aorta (Ao) longe o principal PA (Figura 2D) para canulação subsequente.
- Inserir os conectores, com base no diâmetro da embarcação, (Figura 3) Ao e PA... e fixe-os com suturas de seda 2-0 (Figura 4A).
- Inserir uma linha de tubulação através do átrio esquerdo (Figura 4B) e na direção do ventrículo esquerdo (LV) (Figura 3), usando um dos orifícios da veia pulmonar.
- Conecte uma linha de infusão ao conector colocado do Ao e a linha de saída para aquele no PA (Figura 3).
- Coloque o coração preparado em uma bolsa de poliéster na orientação invertida (de cabeça para baixo).
- Coloque a bolsa com o coração em um recipiente de perfusão e feche a tampa (Figura 4).
- Conecte cada uma das linhas às respectivas portas no batoque de borracha (com base no diâmetro do recipiente) e inseri-lo na tampa do recipiente da perfusão para selar o malote do poliéster (Figura 4 e Figura 5B).
- Perfundir 1 soro x de tampão fosfato (PBS) (136 mM NaCl, 2,7 mM KCl, Na2HPO4 de 10 mM e 1.8 mM KH2PO4 em água destilada, pH 7,4) através da porta de infusão da rolha de borracha para verificar se a saída do PA e da linha de inserido por LV.
- Use esse fluxo para limpar o órgão de quaisquer traços residuais de sangue na vasculatura. Se o fluxo não é observado, aperte as linhas de conexão, como eles podem ser soltos.
2. sistema instalação e procedimento de Decellularization de órgãos
- Montar o biorreator e coloque em uma orientação vertical (Figura 5). O sistema de perfusão inclui um computador pessoal (PC), controlador de proporcional-integral-derivativo (PID), uma bomba peristáltica para infusão Ao, um biorreator de perfusão, um recipiente de pressão cabeça para retenção de perfusato LV (frasco de aspirador L 2 com fundo braço lateral) e uma bomba peristáltica para drenar o excesso de líquido do recipiente pressão cabeça e coletar o efluxo de PA
- O septo de borracha, conecte a linha de infusão, linha de pressão-cabeça, linha PA-vazão e linha de drenagem de biorreator para os portos de superfície de borracha tampa colocados no topo do biorreator de perfusão (Figura 5A).
- Decellularize corações sob pressão constante de 120 mmHg medido na raiz da aorta. Pressão média do ve deve ser dentro de 14-18 mmHg durante todo o processo de decellularization toda.
- Decellularize corações como segue: 4 h de solução hipertónica (500 mM NaCl), 2h de solução hipotônica (20 mM NaCl), 120 h de solução de sódio Dodecil sulfato de sódio (1% SDS) e uma lavagem final com 120 L de 1X PBS (figura 6A).
- Decellularize os corações sob controle constante pressão (120 mmHg). A taxa de fluxo de infusão Ao depende do coração e é, em média, 98.06±16.22 mL/min. para solução hipertónica, 76.14±7.90 mL/min. para uma solução hipotónica, 151.50±5.76 mL/min. para SDS e 185.24±7.10 mL/min para a PBS. O volume total consumido de cada reagente em média 23.36±5.70 L de solução hipertônica e 9.13±1.26 L de solução hipotônica.
- Recircular o final 60 L de SDS 1% (1L por grama de peso do coração) até o final da perfusão de SDS. A figura 6A mostra um cronograma para o processo de decellularization, provocando pontos de extremidade para coleta de dados: fluxo de monitoração da taxa (Ao e PA) e coleção de vazão (PA e não-PA) da cabeça de pressão durante a decellularization.
- Desde que o SVC e IVC são ligados, é razoável supor que todo fluido coletado o PA é o resultado da perfusão coronariana real (Figura 5B). Determine a eficiência de perfusão coronariana dividindo-se diretamente a taxa de fluxo de perfusato fora o PA pela taxa de fluxo da solução infundida em Ao:
Eficiência de perfusão coronariana =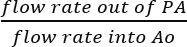 (%).
(%). - Executar análise comparativa entre o perfusato obtido a partir do PA e o LV e as soluções infundidas em duplicado por 200 μL por poço em uma placa de 96 poços de fundo claro de carregamento e leitura de absorbância em 280 nm. O valor de absorvância, empiricamente selecionado depois de experimentar diferentes valores, foi encontrado dar o melhor normalizado valores.
- Use o turbidity do reagente infundido limpo como o controle. A turbidez de perfusato a vazão representa o esmaecimento de detritos celulares e pode ser quantificada instantaneamente durante a decellularization como uma ferramenta de acompanhamento do processo.
- Durante a lavagem final com 10 L de 1X PBS, adicione 500 mL de estéril peracético 2,1% ácido solução neutralizada, neutralizada com NaOH 10N, levando a uma 0,1% peracético solução ácida (v/v) em PBS. Use esta solução para esterilizar o andaime.
3. avaliação dos corações Decellularized
Nota: Depois de decellularization, o representante corações serão usadas para ensaios de imagem e bioquímicos de angiografia coronária.
- Realize uma angiografia coronária do coração humano representante decellularized para examinar a integridade da vasculatura coronária. Brevemente, usando um fluoroscópio, imagem decellularized coração humano após a injeção do agente de contraste através da cânula ostial coronariana nas principais artérias coronárias direita e esquerdas.
- Disse o coração decellularized para obter amostras de 19 áreas para avaliar o restante Ácido desoxirribonucleico (DNA), glicosaminoglicano (GAG) e níveis de SDS em tecidos decellularized. Retire a base do coração do ventrículos e dissecar os ventrículos em 4 seções iguais (Figura 6). Divida cada seção no anterior e posterior do ventrículo direito (RV), o LV anterior e posterior e o septo interventricular (IVS). O tecido que contém o vértice é dissecado em o LV e RV para amostragem.
- Corte amostras de tecido para ensaios de DNA, mordaça e SDS (~ 15 mg de peso molhado).
- Extrair o DNA de cadeia dupla (dsDNA) por digestão de amostras em 1 M NaOH para 3h a 65 ° C e ajustar o pH para 7 usando 10 tampão Tris-EDTA (TE) de x e 1 M o ácido clorídrico (HCl).
- Quantificar dsDNA usando um dsDNA kit de ensaio com um padrão de timo de vitelo (ver Tabela de materiais). Leia as amostras em duplicado usando um leitor de microplacas de fluorescência (excitação a 480 nm e emissão em 520 nm). Calcule a porcentagem de dsDNA residual nos corações decellularized, comparando a concentração de dsDNA em cada tecido para que em fetos morto (% cadavérico).
- Obter GAGs sulfatados em solução por digestão de amostras de tecido em uma solução de extração de papaína (tampão de fosfato de sódio 0,2 M com cisteína da sal, HCl do dissódico EDTA, acetato de sódio e papaína) a 65 ° C por 3 horas. Medir o teor de GAG (em duplicado) usando um Kit de ensaio do glicosaminoglicano.
- Lyophilize amostras para ensaio de SDS em aquecida um vácuo e a medida do peso seco. Adicionar 200 µ l de água ultrapura para cada amostra seca e homogeneizar para extrair o SDS residual em solução. Misture esta solução de SDS de clorofórmio e uma solução de azul de metileno (12 mg de azul de metileno em 1 L de 0,01 M de HCl). A SDS vai separar na camada orgânica, ligando-se o corante azul de metileno.
- Usando um leitor de microplacas de fluorescência, leia a absorvância (655 nm) dos padrões e amostras em duplicado para calcular o SDS residual. Normalize esse valor de SDS de peso seco do tecido.
- Amostras de imagem de regiões grossas (i.e., LV, RV e septo) do coração humano com microscopia óptica não-linear (NLOM) para confirmar a remoção celular após decellularization. A configuração NLOM é detalhada em nosso anterior publicações18,19,20. NLOM permite-na célula de imagem, elastina, as fibras de colágeno e miosina através de seus dois fotões fluorescência (TPF) e canais de segunda geração harmônica (SHG) sem usar qualquer mancha ou tintura exógena21.
Resultados
Depois de um decellularization de 7 dias com hemorragias anterógradas perfusão aórtica sob pressão constante de 120 mmHg, o coração humano virou translúcido (Figura 6B). O coração foi grosseiramente dissecado em 19 seções para análise bioquímica (DNA, mordaça e SDS) (Figura 6) para avaliar o produto final de decellularized.
Durante todo o processo de decel...
Discussão
A nosso conhecimento, este é o primeiro estudo a decellularization relatório invertido de corações humanos dentro uma bolsa pressurizada com lapso de tempo, acompanhamento de remoção de entulhos de taxa e célula de fluxo. A bolsa do pericárdio, como mantém a orientação do coração estável durante todo o processo de decellularization. Submergindo e invertendo os corações inteiro dentro de uma bolsa impede a desidratação e minimiza a tensão excessiva na aorta (a partir de peso do coração) quando compara...
Divulgações
Dr. Taylor é o fundador e acionista da Miromatrix Medical, Inc. Esta relação é gerenciada em conformidade com as políticas de conflito de interesses, pela Universidade de Minnesota e Instituto do coração do Texas; os outros autores não têm nenhum conflito de interesses para divulgar.
Agradecimentos
Esta pesquisa foi apoiada pelo grant Endowment de Houston e o fundo de tecnologia emergente do Texas. Os autores reconhecem a agência de aquisição de órgãos LifeGift, Inc. e as famílias do doador para tornar possível este estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture | Ethicon | SA85H | Suture used to ligate superior and inferior vena cava |
| 1/4" x 3/8" connector with luer | NovoSci | 332023-000 | Connect aorta and pulmonary artery |
| Masterflex platinum-cured silicone tubing | Cole-Parmer | HV-96410-16 | Tubing to connect heart chambers/veins |
| infusion and outflow line | Smiths Medical | MX452FL | For flowing solutions through the vasculature |
| Polyester pouch (Ampak 400 Series SealPAK Pouches) | Fisher scientific | 01-812-17 | Pericardium-like pouch for containing heart during decellularization |
| Snapware Square-Grip Canister | Snapware | 1022 | 1-liter Container used for perfusing heart |
| Black rubber stoppers | VWR | 59586-162 | To seal the perfusion container |
| Peristaltic pump | Harvard Apparatus | 881003 | To pump fluid through the inflow lines and to drain fluids |
| 2 L aspirator bottle with bottom sidearm | VWR | 89001-532 | For holding solutions/perfusate |
| Quant-iT PicoGreen dsDNA Assay kit | Life Technologies | P7589 | For quantifying dsDNA |
| Calf thymus standard | Sigma | D4522 | DNA standard |
| Blyscan Glycosaminoglycan Assay Kit | Biocolor Ltd | Blyscan #B1000 | GAG assay kit |
| Plate reader | Tecan | Infinite M200 Pro | For analytical assays |
| GE fluoroscopy | General Electric | OEC 9900 Elite | Angiogram |
| Visipaque | GE | 13233575 | Contrast agent |
Referências
- Writing Group Members. Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association. Circulation. 133 (4), 447-454 (2016).
- Zia, S., et al. Hearts beating through decellularized scaffolds: whole-organ engineering for cardiac regeneration and transplantation. Critical Reviews in Biotechnology. 36 (4), 705-715 (2016).
- Zimmermann, W. H. Strip and Dress the Human Heart. Circulation Research. 118 (1), 12-13 (2016).
- Ott, H. C., et al. Perfusion-decellularized matrix: Using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Sanchez, P. L., et al. Acellular human heart matrix: A critical step toward whole heart grafts. Biomaterials. 61, 279-289 (2015).
- Peloso, A., et al. Current achievements and future perspectives in whole-organ bioengineering. Stem Cell Research & Therapy. 6, 107 (2015).
- Guyette, J. P., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Momtahan, N., Sukavaneshvar, S., Roeder, B. L., Cook, A. D. Strategies and Processes to Decellularize and Cellularize Hearts to Generate Functional Organs and Reduce the Risk of Thrombosis. Tissue Engineering Part B-Reviews. 21 (1), 115-132 (2015).
- Lee, P. F., et al. Inverted orientation improves decellularization of whole porcine hearts. Acta Biomaterialia. , (2016).
- Momtahan, N., et al. Automation of Pressure Control Improves Whole Porcine Heart Decellularization. Tissue Eng Part C Methods. , (2015).
- Weymann, A., et al. Development and Evaluation of a Perfusion Decellularization Porcine Heart Model - Generation of 3-Dimensional Myocardial Neoscaffolds. Circulation Journal. 75 (4), 852-860 (2011).
- Weymann, A., et al. Bioartificial heart: A human-sized porcine model--the way ahead. PLoS One. 9 (11), e111591 (2014).
- Remlinger, N. T., Wearden, P. D., Gilbert, T. W. Procedure for decellularization of porcine heart by retrograde coronary perfusion. Journal of Visualized Experiments. (70), e50059 (2012).
- Guyette, J. P., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Sanchez, P. L., et al. Data from acellular human heart matrix. Data Brief. 8, 211-219 (2016).
- Garreta, E., et al. Myocardial commitment from human pluripotent stem cells: Rapid production of human heart grafts. Biomaterials. 98, 64-78 (2016).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Engineering Part C-Methods. 16 (3), 525-532 (2010).
- Larson, A. M., Yeh, A. T. Ex vivo characterization of sub-10-fs pulses. Optics Letters. 31 (11), 1681-1683 (2006).
- Lee, P. F., Yeh, A. T., Bayless, K. J. Nonlinear optical microscopy reveals invading endothelial cells anisotropically alter three-dimensional collagen matrices. Experimental Cell Research. 315 (3), 396-410 (2009).
- Lee, P. F., Bai, Y., Smith, R. L., Bayless, K. J., Yeh, A. T. Angiogenic responses are enhanced in mechanically and microscopically characterized, microbial transglutaminase crosslinked collagen matrices with increased stiffness. Acta Biomaterialia. 9 (7), 7178-7190 (2013).
- Wu, Z., et al. Multi-photon microscopy in cardiovascular research. Methods. 130, 79-89 (2017).
- Ramanathan, T., Skinner, H. Coronary blood flow. Continuing Education in Anaesthesia Critical Care & Pain. 5 (2), 61-64 (2005).
- Murthy, V. L., et al. Clinical Quantification of Myocardial Blood Flow Using PET: Joint Position Paper of the SNMMI Cardiovascular Council and the ASNC. Journal of Nuclear Cardiology. 25 (1), 269-297 (2018).
- Molina, D. K., DiMaio, V. J. Normal organ weights in men: Part I-the heart. The American Journal of Forensic Medicine and Pathology. 33 (4), 362-367 (2012).
- Molina, D. K., DiMaio, V. J. Normal Organ Weights in Women: Part I-The Heart. The American Journal of Forensic Medicine and Pathology. 36 (3), 176-181 (2015).
- Robertson, M. J., Dries-Devlin, J. L., Kren, S. M., Burchfield, J. S., Taylor, D. A. Optimizing cellularization of whole decellularized heart extracellular matrix. PLoS One. 9 (2), e90406 (2014).
- Robertson, M. J., Soibam, B., O'Leary, J. G., Sampaio, L. C., Taylor, D. A. Cellularization of rat liver: An in vitro model for assessing human drug metabolism and liver biology. PLoS One. 13 (1), e0191892 (2018).
- Baghalishahi, M., et al. Cardiac extracellular matrix hydrogel together with or without inducer cocktail improves human adipose tissue-derived stem cells differentiation into cardiomyocyte-like cells. Biochemical and Biophysical Research Communications. , (2018).
- Perea-Gil, I., et al. In vitro comparative study of two decellularization protocols in search of an optimal myocardial scaffold for recellularization. American Journal of Translational Research. 7 (3), 558-573 (2015).
- Freytes, D. O., O'Neill, J. D., Duan-Arnold, Y., Wrona, E. A., Vunjak-Novakovic, G. Natural cardiac extracellular matrix hydrogels for cultivation of human stem cell-derived cardiomyocytes. Methods Molecular Biology. 1181, 69-81 (2014).
- Oberwallner, B., et al. Preparation of cardiac extracellular matrix scaffolds by decellularization of human myocardium. Journal of Biomedical Materials Research Part A. 102 (9), 3263-3272 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados