JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
거꾸로 방향 가압된 주머니 안에 전체 인간의 마음의 decellularization
요약
이 메서드는 decellularization의 삼투성 충격 및 최소한의 기관 매트릭스 중단 이온 세제의 관류에 따라 간단한 프로토콜을 사용 하 여 복잡 한 단단한 기관 수 있습니다. 그것은 흐름 역학 및 세포질 파편 유출의 실시간 모니터링으로 가압된 주머니 안에 인간의 마음에 대 한 소설 decellularization 기법으로를 구성 됩니다.
초록
말기 심장 마비 환자에 대 한 궁극적인 해결책은 장기 이식 이다. 하지만 기증자 마음은 제한 하 고 면역 억제가 필요 하 고, 궁극적으로 거부 발생할 수 있습니다. 기능 만들기, 헌 바이오 인공 심장 이러한 과제를 해결할 수 있습니다. Biofabrication 비 계 및 셀의 구성 하는 심장의 한 옵션입니다. 마이크로 및 매크로 아키텍처 뿐 아니라 조직 특정 구성 자연 비 계는 인간이 나 돼지 등 큰 동물에서 decellularizing 마음에 의해 얻어질 수 있다. Decellularization 3 차원 기질 및 맥 관 구조를 보존 하 고 나중 timepoint에 "cellularization"를 허용 하는 동안 세포 파편에 밖으로 세척 하는 작업이 포함 됩니다. 복잡 한 장기의 관류 decellularization 그를 찾는 우리의 소설에 대문자로 하는 것이 가능, 우리 비 transplantable 인간 심 혼에서 거꾸로 가압된 주머니 안에 배치 하 여 decellularize를 더 "생리" 방법 개발 방향, 제어 압력 하. 가압된 주머니를 사용 하 여의 목적은 대동맥 밸브 폐쇄 그것을 유지 하 고 향상 심근 관류를 통해 압력 그래디언트를 만드는 것입니다. 동시 평가 흐름 역학 및 decellularization 유체 유입 및 파편 유출 모니터링 하는 동안 세포 파편 제거, 간단한 심장 수리를 위해 사용 함으로써 생성 될 수 있는 비 계 (예: 패치로 또는 비 계 밸브) 또는 전체 기관 비 계.
서문
심장 마비 환자에서 높은 사망률에 지도 한다. 말기 심장 마비에 대 한 궁극적인 치료 옵션은 여 보세요-이식 합니다. 그러나, 공여 장기의 부족으로이 식 위한 긴 대기 목록 이며 환자 얼굴 후 이식 허들 만성 장기 거부1,2에 평생 면역 억제에 이르기까지 다양. 바이오 기능 마음 decellularized 인간 크기는 환자 자신의 마음을 다시 채우기로 셀3이러한 장애물 우회 수.
중요 한 단계 "공학"는 마음은 적절 한 혈관과 parenchymal 구조, 구성 및 맞춤 가이드 함수 비의 생성 및 전달된 세포의 조직. 적절 한 프레임 워크의 발판에 시드 셀 환경을 인식 하 고 그 장기의 일환으로 예상된 기능을 수행 해야 합니다. 우리의 의견에 decellularized 기관 기질 (dECM) 이상적인 발판의 필요한 특성을 함유 한다.
기본 맥 관 구조를 이용 하 여 복잡 한 전체 기관 decellularization antegrade 또는 퇴행 성 관류4 섬세 한 3D 기질 및 맥 관 구조2, 유지 하면서 세포 구성 요소 제거를 통해 달성 될 수 있다 5,,67. Vivo에서, 영양소 분배 및 폐기물 제거8기능 맥 관 구조 공학 전체 기관 다만에서 중요 하다. 관상 동맥 관류 decellularization 쥐4, 또는 돼지4,7,,910,11 decellularized 마음 만들기에 효과적인 것으로 입증 되었습니다. ,,1213및 인간5,7,14,,1516. 그러나, 밸브, 심 방 및 다른 "얇은" 영역 무결성은 겪을 수 있다.
인간 크기 decellularized 심장 건설 기계는 압력 제어7,9,10,,1112 또는 주입 흐름 속도 제어13, 를 사용 하 여 돼지에서 얻어질 수 있다 17 및 압력을 사용 하 여 인간 기증자에서 제어5,7,,1415. 수직 방향5,,1516 또는 60 mmHg14 에서 제어 하는 압력을 받고 16 일 이상 80-100 mmHg에서 제어 하는 압력을 받고 4-8 일 동안 발생 하는 인간 기증자 심 혼의 decellularization . Antegrade, 압력 제어 decellularization에서 대동맥 밸브 역량 관상 동맥 관류 효율성과 대동맥 루트에서 안정적인 압력 유지에 중요 한 역할을 하고있다. 우리의 이전 작품 심장의 방향을 따라서 끝9에서 비 계 무결성 decellularization 절차 동안 관상 동맥 관류 효율이 영향을 밝혔다.
우리의 이전 작품9의 계속으로 어떤 점에서 심장 모양의 주머니 전체 심장 decellularization 향상에 추가 됩니다 새로운 개념을 소개 합니다. 대동맥 루트에서 120 mmHg에서 제어 하는 압력을 받고 반대로 지향, 가압된 파우치 안에 배치 하는 인간 심 혼의 decellularization을 설명 합니다. 이 프로토콜 모니터링 흐름 프로필 및 decellularization 절차 관상 동맥 관류 효율성과 세포 파편 제거 평가를 통해 유출 미디어 컬렉션을 포함 합니다. 생 화 확 적인 분석 실험 방법의 효과 테스트 하려면 다음 수행 됩니다.
프로토콜
모든 실험에서 텍사스 심장 연구소 윤리 위원회 지침을 준수 됩니다.
1. 기관 준비
참고: 이식에 적합 하지 않은 LifeGift, 텍사스 (http://www.lifegift.org), 비영리 기관 조달 조직 기증 협력 인간의 마음에 승인 동의 연구를 위해 사용 되었다.
- 마음을 조달, 정 맥으로 마음을 30000 U 덤플링을 달 이다. 안전 하 게 대동맥 정 맥 cardioplegia 봉합 하 고 채워 관류 라인을 연결 합니다. 열 등 한 베 나 정 맥 (IVC) 올바른 마음을 환기 구멍 왼쪽된 우량한 폐 정 맥 또는 심장의 왼쪽된 챔버 환기 왼쪽된 심 방 돌출부를 잘라.
- Cardioplegia 또는 heparinized 염 분의 1 L 달 이다. 대동맥 아치 지점과 뛰어난 베 나 정 맥 (SVC), 기타 폐 정 맥 혈관 이나 주변 조직 첨부 파일에서 마음을 출시 해 부. 아이스 염에서 잘 heparinized 심장 잠수함
- 기증 된 인간의 심장 검사 (anteriorly와 뒤로, 그림 1). 해 쟁반에 마음을 놓고 어떤 구조적 손상 또는 해 부 기형에 대 한 검사 합니다. 간 및 폐 이식에 대 한 조달 했다, 마음 짧은 열 등 한 베 나 정 맥 또는 좌 심 방 후 벽의 부재와 함께 발생할 수 있습니다.
- 가능 결함-심 방 septal 결함 (ASD), 심 실 septal 결함 (VSD), 또는 밸브 (대동맥, 폐, mitral, tricuspid) 기형에 대 한 내부 검사를 수행 합니다.
- 있으면 septal 결함, 적절 한 봉합 (그림 2A, 2B) 수정. Septal 결함의 교정은 decellularization 폐 동맥 (PA) 유출 탁도 측정을 통해 진행 상황을 모니터링 필요 합니다. Septal 결함의 교정 왼쪽 오른쪽 우회로를 제거, 따라서, PA에서 유출 관상 부 비 동을 통해 관상 동맥 순환에서 유출을 나타냅니다.
- 2-0 비단 봉합 (그림 2C)와 뛰어난 및 하 부 베 나 정 맥 선
- 후속 cannulation에 주요 PA (그림 2D)에서 대동맥 (Ao)를 해 부.
- Ao와 PA로 선박, (그림 3)의 직경에 따라 커넥터를 삽입 하 고 2-0 비단 봉합 (그림 4A)와 그들을 보호.
- 폐 정 맥 orifices 중 하나를 사용 하 여 배관 라인 왼쪽된 심 실 (LV) (그림 3) 쪽으로 왼쪽된 아 트리 움 (그림 4B)를 삽입 합니다.
- 커넥터는 Ao와 PA (그림 3)에 있는 유출 라인에 배치 하는 주입 라인을 연결 합니다.
- 거꾸로 방향 폴리에스터 주머니로 준비 된 마음 (거꾸로) 놓습니다.
- 관류 컨테이너에 마음으로 주머니를 놓고 (그림 4C) 뚜껑을 닫습니다.
- 각각의 라인을 고무 마 개 (컨테이너의 직경에 따라)에 해당 포트에 연결 하 고 폴 리 에스테 주머니 (그림 4C 와 그림 5B) 인감을 관류 컨테이너의 뚜껑에 삽입 합니다.
- PA와 라인에서 유출 확인 고무 스 토퍼의 주입 포트를 통해 1 x 버퍼링 인산 염 (PBS) (136 m m NaCl, 2.7 m m KCl, 10mm 나2HPO4 , 증류수, pH 7.4에에서 1.8 m m KH2포4 ) perfuse 라스베가스에 삽입
- 이 흐름을 사용 하 여 청소는 맥 관 구조에 혈액의 잔여 흔적의 기관. 그들은 느슨한 될 수 흐름 관찰 되지 않는 경우 연결 라인 조입니다.
2. 시스템 설치 프로그램 및 기관 Decellularization 절차
- 생물을 조립 하 고 수직 방향 (그림 5)에 배치. 개인용 컴퓨터 (PC), 비례-적분-미분 (PID) 컨트롤러, Ao 주입에 대 한 연동 펌프, 관류 생물, LV perfusate 보존 (2 L 흡 인기 병 하단에 대 한 압력 머리 컨테이너 관류 시스템 포함 수급), 그리고 연동 펌프 압력 머리 컨테이너에서 과잉 액체를 배수 하 고 유출 펜에서 수집 하
- 고무 심장에 관류 생물 (그림 5A) 위에 고무 캡 표면 포트 주입 선, 압력 머리 선, PA 유출 라인과 생물 배수 라인을 연결 합니다.
- 대동맥 루트에서 측정 120 mmHg의 일정 한 압력 아래 마음 decellularize LV의 평균 압력은 전체 decellularization 과정을 통하여 14-18 mmHg 이내 이어야 한다.
- 다음과 같이 마음을 decellularize: 마 솔루션 (500 m m NaCl), 소형 솔루션 (20 mM NaCl) 나트륨 라우릴 황산 (1 %SDS) 솔루션의 120 h의 2 h 4 h 및 1 X PBS (그림 6A)의 120 l 최종 세척.
- 일정 한 압력 제어 (120 mmHg) 마음 decellularize Ao에 주입 유량 심장 종속적 이며, 평균 고 솔루션 98.06±16.22 mL/min, 소형 솔루션 76.14±7.90 mL/min, SDS를 위한 151.50±5.76 mL/min 및 PBS 위한 185.24±7.10 mL/min. 각 시 약의 총 소비 볼륨 평균 23.36±5.70 L 마 솔루션 및 소형 솔루션 9.13±1.26 L.
- SDS 관류의 끝까지 1 %SDS (심장 무게의 그램 당 1 L)의 최종 60 L을 recirculate. 그림 6A 보여준다 decellularization 프로세스에 대 한 타임 라인 데이터 컬렉션에 대 한 끝점을 도출: 흐름 속도 모니터링 (Ao 및 PA) 및 유출 컬렉션 (PA 및 비-PA) 압력 머리에서 decellularization 동안.
- 그것은 가정 하는 합리적 SVC, IVC는 출혈, 이후 실제 관상 동맥 관류 (그림 5B)의 결과 모든 액체는 PA에서 수집. Ao에 생긴된 솔루션의 흐름 속도 의해 perfusate PA에서의 흐름 속도 직접 나누어 관상 동맥 관류 효율성을 확인:
관상 동맥 관류 효율 =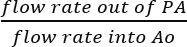 (%).
(%). - PA와 LV와 중복에서 주입된 솔루션에서 분명 하단 96 잘 접시에 잘 당 200 μ 로드 고 280에서 흡 광도 읽고 얻은 perfusate의 비교 분석을 수행 nm. 흡 광도 값, 서로 다른 값을 시도한 후 경험적으로 선택 최고에 게 정규화 된 값을 발견 했다.
- 깨끗 한 주입된 시의 탁도 사용 하 여 제어. 유출 perfusate의 탁도 세포 파편의 유실 나타내고 과정의 추적 도구로 decellularization 동안 즉시 측정할 수 있습니다.
- 1 X PBS의 10 l 최종 세척 하는 동안 살 균 무력화 2.1% 초 산 솔루션, 10N NaOH, 0.1% 초 산 솔루션 (v/v) PBS에 선도와 무력화의 500 mL를 추가 합니다. 이 솔루션을 사용 하 여 발판 소독.
3입니다. Decellularized 하트의 평가
참고: decellularization, 후 대표 마음 관상 동맥 혈관 촬영 이미징 및 생 화 확 적인 분석 실험을 위해 사용할 수 것입니다.
- 관상 동맥 맥 관 구조 intactness 검사 대표 decellularized 인간의 심장의 관상 동맥 혈관을 수행 합니다. 이미지는 짧게, 관상 동맥 ostial 정 주 오른쪽과 왼쪽 관상 동맥을 통해 대조 대리인의 주입 후 인간의 마음을 decellularized는 투시를 사용 하 여.
- 나머지 deoxyribonucleic 산 (DNA), glycosaminoglycan (개 그) decellularized 조직에 SDS 수준 평가를 19 지역에서 샘플을 decellularized 심장 해 부. 심에서 심장의 베이스를 제거 하 고 심 4 동등한 섹션 (그림 6 c)으로 해 부. 앞쪽에 및 사후 우 심 실 (RV), 앞쪽에 및 사후 LV 및 interventricular 심장 (IVS)에 각 섹션을 나눕니다. 조직 꼭대기를 포함 하는 샘플링에 대 한 LV와 RV에 해 부.
- 개 그, SDS, DNA 분석 실험 (~ 15 밀리 그램 젖은 무게의)에 대 한 조직 샘플을 잘라.
- 65 ° C에서 3 h 1 M NaOH에 샘플을 소화 하 여 이중 가닥 DNA (dsDNA)를 추출 하 고 7 10 x 트리 스-EDTA (테) 버퍼와 1 M 염 산 (HCl)를 사용 하 여 pH를 조정.
- 표준 송아지 thymus dsDNA 분석 결과 키트를 사용 하 여 dsDNA 계량 ( 재료의 표참조). 중복 형광 microplate 리더를 사용 하 여 샘플 읽기 (480 nm 및 520에 방출에서 여기 nm). 시체 (시체 %)에 각 조직에 dsDNA 농도 비교 하 여 decellularized 마음에 잔여 dsDNA의 비율을 계산 합니다.
- 3 시간 동안 65 ° C에서 papain 추출 솔루션 (EDTA disodium 소금, 시스테인 HCl와 0.2 M 나트륨 인산 염 버퍼, 나트륨 아세테이트, papain)에서 조직 샘플을 소화 하 여 솔루션으로 sulfated 개 그를 가져올. (중복)에서 개 그 콘텐츠 Glycosaminoglycan 분석 결과 키트를 사용 하 여 측정 합니다.
- 열띤된 진공 및 측정 건조 중량 분석 결과 SDS에 대 한 샘플 lyophilize 각 말린된 샘플을 초순의 200 µ L을 추가 하 고 솔루션으로 잔여 SDS 추출 균질. Chloroform을이 SDS 솔루션 및 메 틸 렌 블루 솔루션 (0.01 M HCl의 1 L에 메 틸 렌 블루의 12 mg) 믹스. SDS는 methylene 청색 염료에 바인딩하여 유기 층에는 별도 것입니다.
- 흡수도 읽고 형광 microplate 리더를 사용 하 여 (655 nm) 표준 및 중복 잔여 SDS를 계산 하는 샘플의. 조직 건조 중량을이 SDS 값 정상화.
- 두꺼운 지역 (즉, LV, RV 및 심장) decellularization 후 세포 제거 확인을 비선형 광학 현미경 (NLOM)와 인간의 마음에서에서 이미지 샘플. NLOM 설치는 우리의 이전 간행물18,,1920에 상세한입니다. NLOM 어떤 외 인 얼룩 또는 염료21을 사용 하지 않고 이미지 셀, 엘라 스 틴, 콜라겐과 myosin 섬유의 2 광자 형광 (TPF)와 두 번째 고조파 생성 (SHG) 채널을 통해 우리를 수 있습니다.
결과
Antegrade 120 mmHg의 일정 한 압력 대동맥 관류와 7 일 decellularization, 후 인간의 마음 반투명 (그림 6B) 아닙니다. 마음은 조잡 한 생화학 (DNA, 개 그와 SDS) 분석 (그림 6 c) 최종 decellularized 제품 평가를 위한 19 섹션으로 해 부.
Decellularization 과정 전반에 걸쳐 다양 한 압력으로 다른 솔루션의 ...
토론
우리의 지식을 하려면이 보고서 거꾸로 decellularization 가압된 주머니 안에 인간 심 혼의 흐름 속도 세포 파편 제거의 시간 경과 모니터링에 첫 번째 연구 이다. 심장 모양의 주머니는 심장의 방향을 decellularization 절차에 걸쳐 안정 유지합니다. 잠수 하 고 주머니 안에 전체 마음 반전 탈수를 방지 하 고 때 (심장 무게)에서 대동맥에 과도 한 부담을 최소화는 종래의 직 립 Langendorff 관류 decellularization ?...
공개
테일러 박사는 창시자 그리고 Miromatrix 의료 주식회사에서 주주 이 관계는 상충 정책에 따라 관리 하는 미네소타의 대학 및 텍사스 심장 연구소; 다른 작가를 공개 충돌의 관심 있다.
감사의 말
이 연구는 휴스턴 기부 그랜트와 텍사스 신흥 기술 기금에 의해 지원 되었다. 저자 인정 기관 조달 기관 LifeGift, 주식 회사와 본이 연구 가능한 만들기 위한 기증자의 가족.
자료
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture | Ethicon | SA85H | Suture used to ligate superior and inferior vena cava |
| 1/4" x 3/8" connector with luer | NovoSci | 332023-000 | Connect aorta and pulmonary artery |
| Masterflex platinum-cured silicone tubing | Cole-Parmer | HV-96410-16 | Tubing to connect heart chambers/veins |
| infusion and outflow line | Smiths Medical | MX452FL | For flowing solutions through the vasculature |
| Polyester pouch (Ampak 400 Series SealPAK Pouches) | Fisher scientific | 01-812-17 | Pericardium-like pouch for containing heart during decellularization |
| Snapware Square-Grip Canister | Snapware | 1022 | 1-liter Container used for perfusing heart |
| Black rubber stoppers | VWR | 59586-162 | To seal the perfusion container |
| Peristaltic pump | Harvard Apparatus | 881003 | To pump fluid through the inflow lines and to drain fluids |
| 2 L aspirator bottle with bottom sidearm | VWR | 89001-532 | For holding solutions/perfusate |
| Quant-iT PicoGreen dsDNA Assay kit | Life Technologies | P7589 | For quantifying dsDNA |
| Calf thymus standard | Sigma | D4522 | DNA standard |
| Blyscan Glycosaminoglycan Assay Kit | Biocolor Ltd | Blyscan #B1000 | GAG assay kit |
| Plate reader | Tecan | Infinite M200 Pro | For analytical assays |
| GE fluoroscopy | General Electric | OEC 9900 Elite | Angiogram |
| Visipaque | GE | 13233575 | Contrast agent |
참고문헌
- Writing Group Members. Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association. Circulation. 133 (4), 447-454 (2016).
- Zia, S., et al. Hearts beating through decellularized scaffolds: whole-organ engineering for cardiac regeneration and transplantation. Critical Reviews in Biotechnology. 36 (4), 705-715 (2016).
- Zimmermann, W. H. Strip and Dress the Human Heart. Circulation Research. 118 (1), 12-13 (2016).
- Ott, H. C., et al. Perfusion-decellularized matrix: Using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Sanchez, P. L., et al. Acellular human heart matrix: A critical step toward whole heart grafts. Biomaterials. 61, 279-289 (2015).
- Peloso, A., et al. Current achievements and future perspectives in whole-organ bioengineering. Stem Cell Research & Therapy. 6, 107 (2015).
- Guyette, J. P., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Momtahan, N., Sukavaneshvar, S., Roeder, B. L., Cook, A. D. Strategies and Processes to Decellularize and Cellularize Hearts to Generate Functional Organs and Reduce the Risk of Thrombosis. Tissue Engineering Part B-Reviews. 21 (1), 115-132 (2015).
- Lee, P. F., et al. Inverted orientation improves decellularization of whole porcine hearts. Acta Biomaterialia. , (2016).
- Momtahan, N., et al. Automation of Pressure Control Improves Whole Porcine Heart Decellularization. Tissue Eng Part C Methods. , (2015).
- Weymann, A., et al. Development and Evaluation of a Perfusion Decellularization Porcine Heart Model - Generation of 3-Dimensional Myocardial Neoscaffolds. Circulation Journal. 75 (4), 852-860 (2011).
- Weymann, A., et al. Bioartificial heart: A human-sized porcine model--the way ahead. PLoS One. 9 (11), e111591 (2014).
- Remlinger, N. T., Wearden, P. D., Gilbert, T. W. Procedure for decellularization of porcine heart by retrograde coronary perfusion. Journal of Visualized Experiments. (70), e50059 (2012).
- Guyette, J. P., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Sanchez, P. L., et al. Data from acellular human heart matrix. Data Brief. 8, 211-219 (2016).
- Garreta, E., et al. Myocardial commitment from human pluripotent stem cells: Rapid production of human heart grafts. Biomaterials. 98, 64-78 (2016).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Engineering Part C-Methods. 16 (3), 525-532 (2010).
- Larson, A. M., Yeh, A. T. Ex vivo characterization of sub-10-fs pulses. Optics Letters. 31 (11), 1681-1683 (2006).
- Lee, P. F., Yeh, A. T., Bayless, K. J. Nonlinear optical microscopy reveals invading endothelial cells anisotropically alter three-dimensional collagen matrices. Experimental Cell Research. 315 (3), 396-410 (2009).
- Lee, P. F., Bai, Y., Smith, R. L., Bayless, K. J., Yeh, A. T. Angiogenic responses are enhanced in mechanically and microscopically characterized, microbial transglutaminase crosslinked collagen matrices with increased stiffness. Acta Biomaterialia. 9 (7), 7178-7190 (2013).
- Wu, Z., et al. Multi-photon microscopy in cardiovascular research. Methods. 130, 79-89 (2017).
- Ramanathan, T., Skinner, H. Coronary blood flow. Continuing Education in Anaesthesia Critical Care & Pain. 5 (2), 61-64 (2005).
- Murthy, V. L., et al. Clinical Quantification of Myocardial Blood Flow Using PET: Joint Position Paper of the SNMMI Cardiovascular Council and the ASNC. Journal of Nuclear Cardiology. 25 (1), 269-297 (2018).
- Molina, D. K., DiMaio, V. J. Normal organ weights in men: Part I-the heart. The American Journal of Forensic Medicine and Pathology. 33 (4), 362-367 (2012).
- Molina, D. K., DiMaio, V. J. Normal Organ Weights in Women: Part I-The Heart. The American Journal of Forensic Medicine and Pathology. 36 (3), 176-181 (2015).
- Robertson, M. J., Dries-Devlin, J. L., Kren, S. M., Burchfield, J. S., Taylor, D. A. Optimizing cellularization of whole decellularized heart extracellular matrix. PLoS One. 9 (2), e90406 (2014).
- Robertson, M. J., Soibam, B., O'Leary, J. G., Sampaio, L. C., Taylor, D. A. Cellularization of rat liver: An in vitro model for assessing human drug metabolism and liver biology. PLoS One. 13 (1), e0191892 (2018).
- Baghalishahi, M., et al. Cardiac extracellular matrix hydrogel together with or without inducer cocktail improves human adipose tissue-derived stem cells differentiation into cardiomyocyte-like cells. Biochemical and Biophysical Research Communications. , (2018).
- Perea-Gil, I., et al. In vitro comparative study of two decellularization protocols in search of an optimal myocardial scaffold for recellularization. American Journal of Translational Research. 7 (3), 558-573 (2015).
- Freytes, D. O., O'Neill, J. D., Duan-Arnold, Y., Wrona, E. A., Vunjak-Novakovic, G. Natural cardiac extracellular matrix hydrogels for cultivation of human stem cell-derived cardiomyocytes. Methods Molecular Biology. 1181, 69-81 (2014).
- Oberwallner, B., et al. Preparation of cardiac extracellular matrix scaffolds by decellularization of human myocardium. Journal of Biomedical Materials Research Part A. 102 (9), 3263-3272 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유