Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
DÉCELLULARISATION du cœur humain à l’intérieur d’une poche sous pression dans une Orientation inversée
Dans cet article
Résumé
Cette méthode permet de DÉCELLULARISATION d’un organe solide complexe à l’aide d’un protocole simple basé sur un choc osmotique et la perfusion de détergent ionique avec une interruption minimale orgue matrice. Elle compose d’une technique de DÉCELLULARISATION roman pour les coeurs humains à l’intérieur d’une poche sous pression avec un suivi en temps réel du débit de flux dynamique et cellulaires de débris.
Résumé
La solution ultime pour les patients atteints d’insuffisance cardiaque terminale est une transplantation d’organe. Mais coeurs donneurs sont limitées, immunosuppression est nécessaire, et finalement le rejet peut se produire. Création d’une fonctionnelle, autologue coeur bio-artificiel pourrait résoudre ces défis. Biofabrication d’un cœur composé de cellules et l’échafaudage est une option. Un échafaudage naturel avec la composition spécifique des tissus, mais aussi les micro - et macro-architecture peut être obtenu par les coeurs decellularizing les humains ou les grands animaux comme le porc. DÉCELLULARISATION consiste à laver les débris cellulaires, tout en préservant les système vasculaire et la matrice extracellulaire 3D et permettant de « cellularisation » à un plus tard validant. Capitalisant sur notre roman trouver cette DÉCELLULARISATION de perfusion des organes complexes est possible, nous avons développé une méthode plus « physiologique » pour decellularize les coeurs humains non transplantables en les plaçant à l’intérieur d’une poche sous pression, dans une inversion orientation, sous pression contrôlée. À l’aide d’une poche sous pression vise à créer des gradients de pression à travers la valve aortique à garder fermée et améliorer la perfusion myocardique. Évaluation simultanée de la dynamique de l’écoulement et l’élimination de débris cellulaires lors DÉCELLULARISATION nous a permis de surveiller les transmissions apports et les retraits de débris, générant ainsi un échafaudage qui peut être utilisé soit pour une simple réparation cardiaque (par exemple comme un patch ou échafaudage de soupape) ou comme un échafaudage tout grand orgue.
Introduction
Insuffisance cardiaque entraîne une mortalité élevée chez les patients. L’option de traitement ultime pour l’insuffisance cardiaque terminale est allo-greffe. Cependant, il y a une longue liste d’attente pour une transplantation en raison de la pénurie d’organes de donneurs et les patients visage après la transplantation les obstacles qui vont de l’immunosuppression à orgue chronique rejet1,2. Cœurs fonctionnels bioingénierie de repeuplement DECELLULARISE coeurs à taille humaine avec un personnel du patient les cellules pourraient contourner ces obstacles3.
Une étape importante dans « engineering », un coeur est la création d’un échafaudage avec une structure vasculaire et parenchymateuse appropriée, composition et fonction pour guider l’alignement et l’Organisation des cellules livrées. En présence d’un cadre approprié, les cellules ensemencées sur l’échafaud devraient reconnaître l’environnement et remplir la fonction attendue dans le cadre de cet organe. À notre avis, matrice extracellulaire DECELLULARISE orgue (dECM) comprend les caractéristiques nécessaires de l’échafaudage idéal.
En utilisant la vascularisation intrinsèque, complexe DÉCELLULARISATION ensemble-organe peut être atteint via antérograde ou rétrograde perfusion4 pour supprimer les composants cellulaires tout en préservant la matrice extracellulaire 3D délicate et système vasculaire2, 5,6,7. Une vascularisation fonctionnelle est importante dans les organes entiers de bioingénierie justes comme in vivo, pour la distribution des éléments nutritifs et d’enlèvement des déchets8. DÉCELLULARISATION perfusion coronaire s’est avérée pour être efficace dans la création de DECELLULARISE coeurs de rats4ou cochons4,7,9,10,11 ,12,13et les humains5,7,14,15,16. Pourtant, l’intégrité des valves, oreillettes et autres régions « minces » peut souffrir.
Taille humaine DECELLULARISE coeur échafaudages peuvent être obtenus auprès de porcs à l’aide de pression contrôle7,9,10,11,12 ou infusion débit taux contrôle13, 17 et de donneurs humains en utilisant la pression de contrôle5,7,14,15. DÉCELLULARISATION de coeurs donneurs humains se produit plus de 4 à 8 jours sous pression contrôlée à 80-100 mmHg à orientation verticale5,15,16 ou plus de 16 jours sous pression contrôlée à 60 mmHg14 . Sous antérograde, DÉCELLULARISATION sous pression contrôlée, la compétence de la valve aortique joue un rôle crucial dans le maintien de l’efficacité de la perfusion coronaire et pression stable à la racine aortique. Nos travaux antérieurs ont révélé que l’orientation du cœur influe sur son efficacité de perfusion coronarienne au cours de la procédure de DÉCELLULARISATION et, par conséquent, l’intégrité de l’échafaudage à la fin9.
Dans le prolongement de notre précédent travail9, nous introduisons un nouveau concept dans lequel une pochette comme péricarde est ajoutée afin d’améliorer ensemble-coeur DÉCELLULARISATION. Nous décrivons la DÉCELLULARISATION de coeurs humains placés à l’intérieur de pochettes sous pression, orientés inversement et sous pression contrôlée à 120 mmHg à la racine aortique. Ce protocole comprend la surveillance de la collection des médias de flux sortant tout au long de la procédure de DÉCELLULARISATION afin d’évaluer l’efficacité de la perfusion coronaire et l’enlèvement des débris cellulaires et le profil d’écoulement. Des épreuves biochimiques sont ensuite effectuées pour vérifier l’efficacité de la méthode.
Protocole
Toutes les expériences respecté les directives du Comité éthique de l’Institut de cardiologie de Texas.
1. préparation de l’orgue
NOTE : En collaboration avec LifeGift, une organisation des achats sans but lucratif orgue au Texas (http://www.lifegift.org), a fait donnée des cœurs humains ne conviennent pas pour la transplantation ont été utilisés pour la recherche avec consentement approuvé.
- Pour se procurer des coeurs, par voie intraveineuse infuser 30 000 héparine U aux coeurs. Solidement la cardioplégie canule dans l’aorte de suture et fixer une ligne de perfusion fixées. Perforer la veine cave inférieure (VCI) pour évacuer le coeur droit. Couper la veine pulmonaire supérieure gauche ou l’auricule gauche pour évacuer les chambres à gauche du cœur.
- Laisser infuser 1 L de la cardioplégie ou du sérum physiologique hépariné. Disséquer les branches de l’aorte, veine cave supérieure (SVC) et autres veines pulmonaires pour libérer le cœur de toutes les pièces jointes des tissus environnants ou vasculaire. Plongez au cœur bien hépariné dans une solution saline glacé.
- Inspecter le coeur humain donné (aussi bien antérieurement et postérieurement, Figure 1). Placez le coeur sur un plateau de dissection et vérifier si des dommages structurels ou des malformations anatomiques. Si le foie ou des poumons ont été achetés à la transplantation, le coeur peut présenter avec une veine cave inférieure courte et/ou l’absence de paroi postérieure de l’oreillette gauche.
- Effectuer une inspection interne pour d’éventuels vices - communication interauriculaire (ASD), communication interventriculaire (VSD) ou malformation de la valve (aortique, pulmonaire, mitrale, tricuspide).
- S’il présent un défaut septal, corrigez-le avec des sutures (Figure 2 a, 2 b). La correction des défauts septaux est nécessaire pour suivre les progrès de DÉCELLULARISATION via des mesures de turbidité sortie artère pulmonaire (AP). Correction du défaut septal supprime gauche droite shunt, par conséquent, la sortie de PA représente l’écoulement de la circulation coronarienne dans le sinus coronaire.
- Ligaturer la veine cave supérieure et inférieure avec suture de soie de 2-0 (Figure 2).
- Disséquer l’aorte (Ao) loin de la PA principal (Figure 2D) pour canulation ultérieur.
- Insérez les connecteurs, basés sur le diamètre de la cuve, (Figure 3) en Ao et PA et fixez-les avec sutures soie 2-0 (Figure 4 a).
- Insérer une ligne de tuyaux grâce à l’oreillette gauche (Figure 4 b) et vers le ventricule gauche (VG) (Figure 3), en utilisant un des orifices de la veine pulmonaire.
- Se connecter à une ligne de perfusion au connecteur placé dans la zone d’occupation et la ligne de sortie à celle de l’autorité palestinienne (Figure 3).
- Placer le cœur disposé dans une pochette polyester orientation inversée (tête en bas).
- Placez la pochette avec le coeur dans un récipient de perfusion et fermer le couvercle (Figure 4).
- Chacune des lignes se connecter aux ports respectifs dans le bouchon en caoutchouc (basé sur le diamètre du conteneur) et l’insérer dans le couvercle du conteneur perfusion pour sceller la pochette polyester (Figure 4 et Figure 5 b).
- Perfuse de tampon phosphate salin (PBS) (136 mM NaCl, KCl 2,7 mM, 10 mM Na2HPO4 et 1,8 mM KH2PO4 dans l’eau distillée, pH 7,4) de le x 1 via le port de perfusion du bouchon en caoutchouc pour vérifier le débit sortant de l’autorité palestinienne et de la ligne inséré dans LV
- Utilisez ce flux pour nettoyer l’orgue de toute trace résiduelle de sang dans les vaisseaux. Si le débit n’est pas observé, serrer des câbles de raccordement qu’ils pourraient être lâches.
2. système d’installation et de la procédure de DÉCELLULARISATION orgue
- Assembler le bioréacteur et placer dans une orientation verticale (Figure 5). Le système de perfusion comprend un ordinateur personnel (PC), le contrôleur proportionnel-intégral-dérivé (PID), une pompe péristaltique pour perfusion Ao, un bioréacteur de perfusion, un réservoir de tête de pression pour rétention de perfusat LV (bouteille 2L aspirateur avec fond arme de poing) et une pompe péristaltique pour drainer l’excès de liquide dans le conteneur de tête de pression et de percevoir l’écoulement du PA
- Dans le septum en caoutchouc, connectez la ligne d’infusion et pression-tête de ligne, ligne PA-sortie ligne drainant bioréacteur jusqu’aux ports de surface de bouchon en caoutchouc placées sur le bioréacteur de perfusion (Figure 5 a).
- Decellularize coeurs sous pression constante de 120 mmHg, mesurée à la racine aortique. La pression moyenne du VG doit relever de 14 à 18 mmHg pendant tout le processus entier DÉCELLULARISATION.
- Decellularize coeurs comme suit : 4 h de solution hypertonique (500 mM NaCl), 2 h d’une solution hypotonique (20 mM NaCl), 120 h de solution de sodium dodecyl sulfate (SDS de 1 %) et un lavage final avec 120 L de solution de 1 PBS X (Figure 6 a).
- Decellularize les coeurs sous contrôle de la pression constante (120 mmHg). Débit de perfusion en Ao dépend du cœur et est, en moyenne, 98.06±16.22 mL/min pour une solution hypertonique, 76.14±7.90 mL/min pour une solution hypotonique, 151.50±5.76 mL/min pour le SDS et 185.24±7.10 mL/min pour PBS. Le volume total consommé de chaque réactif en moyenne 23.36±5.70 L d’une solution hypertonique et L 9.13±1.26 pour une solution hypotonique.
- Recycler la finale L 60 du SDS de 1 % (1 litre par gramme de poids du coeur) jusqu'à la fin de la perfusion de SDS. Figure 6 a montre un calendrier pour le processus de DÉCELLULARISATION, suscitant des points de terminaison pour la collecte de données : flux de monitorage du rythme (Ao et PA) et la collection de sortie (PA et non-PA) de la tête de pression pendant DÉCELLULARISATION.
- Puisque le SVC et IVC sont ligaturés, il est raisonnable de supposer que tous les fluides recueillis auprès de l’autorité palestinienne sont le résultat de la perfusion coronaire réel (Figure 5 b). Déterminer l’efficacité de la perfusion coronaire en divisant directement le débit du perfusat hors de l’autorité palestinienne par la vitesse d’écoulement de la solution perfusée dans Ao :
Efficacité de la perfusion coronaire =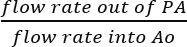 (%).
(%). - Effectuer une analyse comparative du perfusat obtenu de l’autorité palestinienne et le LV et les solutions infusées en double de chargement 200 μL / puits dans une plaque 96 puits à fond transparent et lecture d’absorbance à 280 nm. La valeur d’absorbance, sélectionnée empiriquement après avoir essayé différentes valeurs, a été trouvée pour donner le meilleur normalisé des valeurs.
- Utiliser la turbidité du réactif infusée propre comme le contrôle. La turbidité du perfusat sortant représente l’affouillement des débris cellulaires et peut être quantifiée instantanément pendant DÉCELLULARISATION comme un outil de suivi du processus.
- Pendant le lavage final avec 10 L de solution 1 PBS X, ajouter 500 mL de stérile solution d’acide peracétique 2,1 % neutralisée, neutralisée avec NaOH 10N, menant à une solution acide peracétique à 0,1 % (v/v) dans du PBS. Cette solution permet de stériliser l’échafaud.
3. évaluation des cœurs DECELLULARISE
Remarque : Après DÉCELLULARISATION, représentant coeurs servira pour des dosages biochimiques et d’imagerie angiographie coronarienne.
- Effectuer l’angiographie coronaire du coeur humain DECELLULARISE représentatif d’examiner le caractère intact de la vascularisation coronaire. En bref, à l’aide d’un fluoroscope, image DECELLULARISE coeur humain après injection d’agent de contraste dans une canule ostiale coronaire dans les principales artères coronaires gauche et droite.
- Disséquer le coeur DECELLULARISE pour obtenir des échantillons de 19 régions pour évaluer les restants d’acide désoxyribonucléique (ADN), les glycosaminoglycanes (GAG) et les niveaux SDS dans les tissus DECELLULARISE. Retirer la base du cœur des ventricules et disséquer les ventricules en 4 parties égales (Figure 6). Diviser chaque section dans le ventricule droit antérieur et postérieur (RV), le LV antérieur et postérieur et le septum interventriculaire (IVS). Les tissus contenant l’apex sont disséqué dans le LV et RV pour l’échantillonnage.
- Couper les échantillons de tissus pour des analyses ADN, GAG et le SDS (~ 15 mg de poids humide).
- Extraire l’ADN à double brin (dsDNA) par digestion des échantillons de 1 NaOH M pendant 3 h à 65 ° C et ajuster le pH à 7 à l’aide de tampons de Tris-EDTA (TE) x 10 et 1 M d’acide chlorhydrique (HCl).
- Quantifier l’ADN double brin en utilisant un ADN double brin trousse avec un standard de thymus de veau (voir Table des matières). Lire des échantillons en double à l’aide d’un lecteur de microplaques de fluorescence (excitation à 480 nm et d’émission à 520 nm). Calculer le pourcentage de dsDNA résiduelle dans les coeurs DECELLULARISE en comparant la concentration d’ADN double brin dans chacun des tissus cadavériques (cadavériques %) à celui.
- Obtenir des GAGs sulfatés dans la solution de digestion des échantillons de tissu dans une solution d’extraction papaïne (tampon de phosphate de sodium 0,2 M avec cystéine sel, chlorhydrate de disodium EDTA, acétate de sodium et papaïne) à 65 ° C pendant 3 heures. Mesurer les GAG contenu (en double) en utilisant un Kit de dosage de glycosaminoglycanes.
- Lyophiliser des échantillons pour l’analyse SDS dans une chauffée vide et mesure de poids sec. Ajouter 200 µL d’eau ultrapure à chaque échantillon séché et homogénéiser pour extraire le SDS résiduel en solution. Mélanger cette solution SDS au chloroforme et une solution de bleu de méthylène (12 mg de bleu de méthylène dans 1 L de 0,01 M HCl). Le SDS se sépareront dans la couche organique en se liant à la teinture au bleu de méthylène.
- À l’aide d’un lecteur de microplaques de fluorescence, lire l’absorbance (655 nm) des normes et des échantillons en double exemplaire pour calculer le SDS résiduel. Normaliser cette valeur SDS à poids sec des tissus.
- Échantillons d’image provenant de régions épaisses (c.-à-d., LV, RV et cloison) du coeur humain au microscope optique non linéaire (NLOM) pour confirmer la suppression cellulaire après DÉCELLULARISATION. Le programme d’installation NLOM est détaillée dans nos précédentes publications18,19,20. NLOM nous permet à la cellule d’image, l’élastine, les fibres de collagène et de la myosine à travers ses deux photons fluorescence (TPF) et la deuxième génération d’harmoniques (SHG) chaînes sans utiliser aucune tache ou colorant exogène21.
Résultats
Après une DÉCELLULARISATION 7 jours avec perfusion aortique antérograde sous pression constante de 120 mmHg, le cœur de l’homme tourna translucide (Figure 6 b). Le cœur a été grossièrement disséqué en 19 sections pour une analyse biochimique (ADN, GAG et SDS) (Figure 6) pour évaluer le produit final DECELLULARISE.
Tout au long du processus de DÉCELLULARISA...
Discussion
À notre connaissance, c’est la première étude à DÉCELLULARISATION rapport inversé de cœurs humains à l’intérieur d’une poche sous pression avec Time-lapse suivi de l’enlèvement des débris débit taux et cellules. La pochette du péricarde-comme conserve l’orientation du cœur stable tout au long de la procédure de DÉCELLULARISATION. Immerger et inversant les cœurs entiers à l’intérieur d’une poche empêche la déshydratation et minimise les contraintes excessives sur l’aorte (à partir du ...
Déclarations de divulgation
Dr Taylor est le fondateur et actionnaire de Miromatrix Medical, Inc. Cette relation est gérée conformément aux conflits d’intérêts politiques de l’Université du Minnesota et le Texas Heart Institute ; les autres auteurs n’ont aucun conflit d’intérêt à divulguer.
Remerciements
Cette recherche a été financée par l’octroi de fonds de dotation de Houston et le Texas Emerging Technology Fund. Les auteurs remercient l’Agence d’approvisionnement orgue LifeGift, Inc. et la famille du donateur pour la réalisation de cette étude.
matériels
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture | Ethicon | SA85H | Suture used to ligate superior and inferior vena cava |
| 1/4" x 3/8" connector with luer | NovoSci | 332023-000 | Connect aorta and pulmonary artery |
| Masterflex platinum-cured silicone tubing | Cole-Parmer | HV-96410-16 | Tubing to connect heart chambers/veins |
| infusion and outflow line | Smiths Medical | MX452FL | For flowing solutions through the vasculature |
| Polyester pouch (Ampak 400 Series SealPAK Pouches) | Fisher scientific | 01-812-17 | Pericardium-like pouch for containing heart during decellularization |
| Snapware Square-Grip Canister | Snapware | 1022 | 1-liter Container used for perfusing heart |
| Black rubber stoppers | VWR | 59586-162 | To seal the perfusion container |
| Peristaltic pump | Harvard Apparatus | 881003 | To pump fluid through the inflow lines and to drain fluids |
| 2 L aspirator bottle with bottom sidearm | VWR | 89001-532 | For holding solutions/perfusate |
| Quant-iT PicoGreen dsDNA Assay kit | Life Technologies | P7589 | For quantifying dsDNA |
| Calf thymus standard | Sigma | D4522 | DNA standard |
| Blyscan Glycosaminoglycan Assay Kit | Biocolor Ltd | Blyscan #B1000 | GAG assay kit |
| Plate reader | Tecan | Infinite M200 Pro | For analytical assays |
| GE fluoroscopy | General Electric | OEC 9900 Elite | Angiogram |
| Visipaque | GE | 13233575 | Contrast agent |
Références
- Writing Group Members. Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association. Circulation. 133 (4), 447-454 (2016).
- Zia, S., et al. Hearts beating through decellularized scaffolds: whole-organ engineering for cardiac regeneration and transplantation. Critical Reviews in Biotechnology. 36 (4), 705-715 (2016).
- Zimmermann, W. H. Strip and Dress the Human Heart. Circulation Research. 118 (1), 12-13 (2016).
- Ott, H. C., et al. Perfusion-decellularized matrix: Using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Sanchez, P. L., et al. Acellular human heart matrix: A critical step toward whole heart grafts. Biomaterials. 61, 279-289 (2015).
- Peloso, A., et al. Current achievements and future perspectives in whole-organ bioengineering. Stem Cell Research & Therapy. 6, 107 (2015).
- Guyette, J. P., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Momtahan, N., Sukavaneshvar, S., Roeder, B. L., Cook, A. D. Strategies and Processes to Decellularize and Cellularize Hearts to Generate Functional Organs and Reduce the Risk of Thrombosis. Tissue Engineering Part B-Reviews. 21 (1), 115-132 (2015).
- Lee, P. F., et al. Inverted orientation improves decellularization of whole porcine hearts. Acta Biomaterialia. , (2016).
- Momtahan, N., et al. Automation of Pressure Control Improves Whole Porcine Heart Decellularization. Tissue Eng Part C Methods. , (2015).
- Weymann, A., et al. Development and Evaluation of a Perfusion Decellularization Porcine Heart Model - Generation of 3-Dimensional Myocardial Neoscaffolds. Circulation Journal. 75 (4), 852-860 (2011).
- Weymann, A., et al. Bioartificial heart: A human-sized porcine model--the way ahead. PLoS One. 9 (11), e111591 (2014).
- Remlinger, N. T., Wearden, P. D., Gilbert, T. W. Procedure for decellularization of porcine heart by retrograde coronary perfusion. Journal of Visualized Experiments. (70), e50059 (2012).
- Guyette, J. P., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Sanchez, P. L., et al. Data from acellular human heart matrix. Data Brief. 8, 211-219 (2016).
- Garreta, E., et al. Myocardial commitment from human pluripotent stem cells: Rapid production of human heart grafts. Biomaterials. 98, 64-78 (2016).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Engineering Part C-Methods. 16 (3), 525-532 (2010).
- Larson, A. M., Yeh, A. T. Ex vivo characterization of sub-10-fs pulses. Optics Letters. 31 (11), 1681-1683 (2006).
- Lee, P. F., Yeh, A. T., Bayless, K. J. Nonlinear optical microscopy reveals invading endothelial cells anisotropically alter three-dimensional collagen matrices. Experimental Cell Research. 315 (3), 396-410 (2009).
- Lee, P. F., Bai, Y., Smith, R. L., Bayless, K. J., Yeh, A. T. Angiogenic responses are enhanced in mechanically and microscopically characterized, microbial transglutaminase crosslinked collagen matrices with increased stiffness. Acta Biomaterialia. 9 (7), 7178-7190 (2013).
- Wu, Z., et al. Multi-photon microscopy in cardiovascular research. Methods. 130, 79-89 (2017).
- Ramanathan, T., Skinner, H. Coronary blood flow. Continuing Education in Anaesthesia Critical Care & Pain. 5 (2), 61-64 (2005).
- Murthy, V. L., et al. Clinical Quantification of Myocardial Blood Flow Using PET: Joint Position Paper of the SNMMI Cardiovascular Council and the ASNC. Journal of Nuclear Cardiology. 25 (1), 269-297 (2018).
- Molina, D. K., DiMaio, V. J. Normal organ weights in men: Part I-the heart. The American Journal of Forensic Medicine and Pathology. 33 (4), 362-367 (2012).
- Molina, D. K., DiMaio, V. J. Normal Organ Weights in Women: Part I-The Heart. The American Journal of Forensic Medicine and Pathology. 36 (3), 176-181 (2015).
- Robertson, M. J., Dries-Devlin, J. L., Kren, S. M., Burchfield, J. S., Taylor, D. A. Optimizing cellularization of whole decellularized heart extracellular matrix. PLoS One. 9 (2), e90406 (2014).
- Robertson, M. J., Soibam, B., O'Leary, J. G., Sampaio, L. C., Taylor, D. A. Cellularization of rat liver: An in vitro model for assessing human drug metabolism and liver biology. PLoS One. 13 (1), e0191892 (2018).
- Baghalishahi, M., et al. Cardiac extracellular matrix hydrogel together with or without inducer cocktail improves human adipose tissue-derived stem cells differentiation into cardiomyocyte-like cells. Biochemical and Biophysical Research Communications. , (2018).
- Perea-Gil, I., et al. In vitro comparative study of two decellularization protocols in search of an optimal myocardial scaffold for recellularization. American Journal of Translational Research. 7 (3), 558-573 (2015).
- Freytes, D. O., O'Neill, J. D., Duan-Arnold, Y., Wrona, E. A., Vunjak-Novakovic, G. Natural cardiac extracellular matrix hydrogels for cultivation of human stem cell-derived cardiomyocytes. Methods Molecular Biology. 1181, 69-81 (2014).
- Oberwallner, B., et al. Preparation of cardiac extracellular matrix scaffolds by decellularization of human myocardium. Journal of Biomedical Materials Research Part A. 102 (9), 3263-3272 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon