需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
倒置方向下整个人的心脏在加压袋内的去细胞化
摘要
这种方法可以使用基于渗透冲击的简单协议和最小器官破坏矩阵的离子洗涤剂灌注, 使复杂的固体器官去极化。它包括一种新的人的心脏在加压袋内的去电磁化技术, 并实时监测流动动力学和细胞碎片流出。
摘要
终末期心力衰竭患者的最终解决方案是器官移植。但供体心脏是有限的, 免疫抑制是必需的, 并且拒绝可能发生。创建一个功能性的、自体的生物人工心脏可以解决这些挑战。由脚手架和细胞组成的心脏的生物制造是一种选择。一个天然的支架与组织特异性组成以及微观和宏观架构可以获得通过去细胞化的心脏从人类或大型动物, 如猪。去光化包括在保持3d 细胞外基质和血管的同时冲洗细胞碎片, 并允许在以后的时间点进行 "纤维素化"。利用我们的新发现, 复杂器官的灌注解离是可能的, 我们开发了一种更 "生理" 的方法, 通过将非可移植的人的心脏放置在一个加压袋, 在一个倒置的方向, 在可控压力下。使用加压袋的目的是在主动脉瓣上产生压力梯度, 以保持其关闭状态, 并改善心肌灌注。在去室去光化过程中同时评估流动动力学和细胞碎片清除, 使我们能够监测流体流入和碎片流出, 从而产生一个脚手架, 可用于简单的心脏修复 (例如, 作为一个补丁或阀支架) 或作为全器官脚手架。
引言
心力衰竭导致患者死亡率高。终末期心力衰竭的最终治疗方案是同种异体移植。然而, 由于供体器官短缺, 移植的等待列表很长, 患者面临着从终身免疫抑制到慢性器官排斥1,2的移植后障碍。生物工程功能性心脏通过用病人自己的细胞重新填充去细胞化的人类大小的心脏, 可以绕过这些障碍3。
"工程" 心脏的一个重要步骤是创建一个脚手架, 具有适当的血管和实质结构、组成和功能, 以指导所交付细胞的排列和组织。在适当的框架存在的情况下, 在脚手架上播种的细胞应能识别环境, 并作为该器官的一部分发挥预期的功能。在我们看来, 去细胞外基质 (decm) 包括理想支架的必要特性。
通过利用内在血管, 可以通过前置或逆行灌注4来去除细胞成分, 同时保留微妙的三维细胞外基质和血管 2, 5,6,7。功能血管在生物工程全器官中就像在体内一样, 对营养分配和废物清除都很重要。冠状动脉灌注去细胞减少已被证明是有效的创造去细胞化的心脏从大鼠4,或猪4,7, 9, 10,11 12, 13,和人类5,7, 14,15,16。然而, 阀门、心房和其他 "薄" 区域的完整性可能会受到影响。
用压力控制7、9、10、11、12或输液流量控制13 ,17和来自人类捐献者使用压力控制5,7, 14,15。人类供体心脏去细胞化发生在4-8 内, 压力控制在 0-100毫米汞柱,垂直方向5、15、16或16天以上, 压力控制在60毫米汞柱14.在压力控制的前去室化条件下, 主动脉瓣的能力对保持主动脉根部冠状动脉灌注效率和稳定压力起着至关重要的作用。我们以前的工作表明, 心脏的方向影响其冠状动脉灌注效率在脱肺过程中, 因此在最后9的脚手架完整性.
作为我们以前工作的延续 9, 我们引入了一个新的概念, 其中一个心包样袋添加, 以提高全心去渗。我们描述了人类心脏被放置在加压袋内的去细胞化, 反向定向, 主动脉根部的压力控制在120毫米汞柱。该协议包括监测整个去室化过程中的流动剖面和流出介质的收集, 以评估冠状动脉灌注效率和细胞碎片清除。然后进行生化检测, 以测试该方法的有效性。
研究方案
所有实验都遵循了德克萨斯心脏研究所的道德委员会准则。
1. 器官准备
注: 与德克萨斯州 (http://www.lifegift.org) 的非营利器官采购组织 life赠送组织合作, 在获得批准的情况下, 捐赠了不适合移植的人的心脏进行研究。
- 为了获得心脏, 静脉注射 30, 000 u 肝素到心脏。安全地缝合主动脉中的心绞痛插管, 并附加一条夹紧灌注线。穿孔下腔静脉 (ivc) 排出右心。切开左上肺静脉或左心房附属物, 以排出心脏的左腔。
- 注入1升心绞痛或肝素化盐水。解剖主动脉弓分支、上腔静脉 (svc) 和其他肺静脉, 从任何血管或周围组织附着释放心脏。将良好的肝素心脏浸入冰盐溶液中。
- 检查捐赠的人类心脏 (前后,图 1)。将心脏放在解剖托盘上, 检查是否有任何结构损伤或解剖畸形。如果肝和/或肺被采购移植, 心脏可能存在一个短的下腔静脉和/或没有左心房后壁。
- 对可能的缺陷进行内部检查-房间隔缺损 (asd)、室间隔缺损 (vsd) 或瓣膜 (主动脉、肺、二尖瓣、三尖瓣) 畸形。
- 如果存在间隔缺损, 请使用适当的缝合线进行校正 (图 2a, 2A)。通过肺动脉 (pa) 流出浊度测量, 需要对间隔缺损进行矫正, 以监测脱髓的进展。隔膜缺损的矫正消除左到右分流, 因此, 从 pa 流出代表从冠状动脉循环流出通过冠状窦。
- 配体上腔和下腔静脉与2-0 丝缝合 (图 2c)。
- 将主动脉 (aoo) 从主 pa (图 2d) 中解剖, 以便随后的插管。
- 根据容器的直径将连接器插入 ao 和 pa (图 3), 并用2-0 丝线固定连接器 (图 4a)。
- 使用肺静脉孔之一, 通过左心房 (图 4b) 和向左心室 (lv) 插入导管线 (图 3)。
- 将输液线连接到放置在 o 中的连接器, 将流出线连接到 pa 中的连接器 (图 3)。
- 将准备好的心脏放入一个倒置方向 (倒置) 的聚酯袋中。
- 将带心脏的眼袋放入灌注容器中, 然后合上盖子 (图 4c)。
- 将每条线路连接到橡胶塞子中的各个端口 (根据容器的直径), 并将其插入灌注容器的盖子, 以密封聚酯袋 (图4c 和图 5b)。
- 在蒸馏水中完美使用1x 磷酸盐缓冲盐水 (pbs) (136 mm ncl、2.7 mm kcl、10 mm na 2 hpo4和 1.8 mm kh kh2 po 4, ph 7.4), 通过橡胶塞子的输液口验证从 pa 和线路流出的情况插入 lv。
- 使用这种流动来清洁器官的任何残留的血液痕迹在血管。如果未观察到流量, 请拧紧连接线, 因为它们可能松动。
2. 系统设置和器官去电磁化程序
- 将生物反应器组装在垂直方向上放置 (图 5)。灌注系统包括个人电脑 (pc)、比例积分导数 (pid) 控制器、用于 o 输液的蠕动泵、灌注生物反应器、lv 灌注保留压力头容器 (带底部的2l 吸气瓶)和蠕动泵, 从压力头容器中排出多余的液体, 并从 pa 中收集流出的液体。
- 在橡胶隔膜中, 将输液线、压力头线、pa-流出线和生物反应器排水线连接到放置在灌注生物反应器顶部的橡胶盖表面端口 (图 5a)。
- 在主动脉根部测量的120毫米汞柱恒压下解吸心脏。在整个去电磁化过程中, lv 的平均压力应在14-18 毫米汞柱范围内。
- 解压心脏如下: 高渗溶液 4小时 (500 mm ncl), 低渗溶液 2小时 (20 mm ncl), 120 h 十二烷基硫酸钠 (1% sds) 溶液, 用 1x pbs 120 升进行最后清洗 (图 6a)。
- 在恒压控制下对心脏进行解码 (120 毫米汞柱)。注入到 o 的流量与心脏有关, 高渗溶液平均为 98.06±16.22 mlmmmp, 低渗溶液为 76.14±7.90 mL/min, sds 为 151.50±5.76 mL/min, pbs 为 18.24±710 ml/min。每种试剂的总消耗量相平均为高渗溶液 2336±5.70 l, 低渗溶液为 9.13±1.26 l。
- 将 1% sds (每克心脏重量1升) 的最终60升循环到 sds 灌注结束。图 6a显示了去净化过程的时间表, 为数据收集引出了终点: 在去净化过程中, 流量监测 (o 和 pa) 和压力头流出收集 (pa 和非 pa)。
- 由于 svc 和 ivc 是结扎的, 因此可以合理地假定, 从 pa 收集的所有液体都是实际冠状动脉灌注的结果 (图 5b)。通过将注入溶液的流量直接划分为 o:
冠状动脉灌注效率 =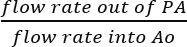 (%)。
(%)。 - 通过在透明的底部96孔板中加载200μl 和在280纳米的读数吸收率, 对从 pa 和 lv 获得的香水和注入的溶液一式两份进行对比分析。在尝试不同的值后根据经验选择的吸收值被发现给出了最佳的归一化值。
- 以清洁注入试剂的浊度为对照。流出物的浊度表示细胞碎片的冲洗, 并可在去室化过程中作为过程的跟踪工具立即量化。
- 在用 1x pbs 的 10 l 进行最后洗涤时, 加入500毫升的无菌中和2.1% 过氧乙酸溶液, 用 10n naoh 中和, 从而在 pbs 中产生0.1% 的过氧乙酸溶液 (v/v)。使用此解决方案对脚手架进行消毒。
3. 对去病毒心的评价
注: 去病毒化后, 代表性心脏将用于冠状动脉造影成像和生化检测。
- 对具有代表性的去细胞化的人的心脏进行冠状动脉造影, 以检查冠状动脉血管的内酯性。简要而言, 使用荧光镜, 图像去光去光后, 通过冠状动脉造影剂在主冠状动脉和左冠状动脉注射造影剂。
- 解剖脱细胞的心脏, 从19个区域获取样本, 以评估脱氮组织中剩余的脱氧核糖核酸 (dna)、糖胺多糖 (gag) 和 sds 水平。将心脏底部从心室中取出, 并将心室解剖为4个相等的部分 (图 6c)。将每个部分分为前、后右心室 (rv)、前、后室和室间隔 (ivs)。包含先端的组织被分解成 lv 和 rv 进行取样。
- 切割 dna、gag 和 sds 检测的组织样本 (约15毫克湿重)。
- 在65°c 下消化 1 m naoh 样品 3小时, 提取双链 dna (dsdna), 并使用 10倍 tris-edta (te) 缓冲液和 1 m 盐酸 (hcl) 将 ph 值调整为7。
- 使用具有小腿胸腺标准的 dsdna 检测试剂盒对 dsDNA 进行定量 (见材料表)。使用荧光微板读取器 (在 480 nm 处激发, 在 520 nm 处发射), 一式两份地读取样品。通过比较每个组织中的 dsdna 浓度和尸体中的 dsdna 浓度 (% 尸体), 计算去细胞化心脏中残留 dsdna 的百分比。
- 在65°c 下, 通过在木瓜蛋白酶萃取溶液中消化组织样本 (0.2 m 磷酸钠缓冲液与 edta 二钠、半胱氨酸 hcl、醋酸钠和木瓜蛋白酶) 在3小时内获得硫化 gag。使用糖胺多糖检测试剂盒测量 gag 含量 (一式两份)。
- 用于在加热真空中测定 sds 并测量干重的冻干样品。在每个干燥样品中加入200μl 超纯水, 并进行均质化, 将剩余的 sds 提取到溶液中。将此 sds 溶液与氯仿和亚甲蓝溶液混合 (12 毫克亚甲蓝, 1 升 0.01 m hcl)。sds 将通过与亚甲蓝染料结合在有机层中分离。
- 使用荧光微板读取器, 阅读吸收率 (655 nm) 的标准和样品一式两份, 以计算剩余的 sds。将此 sds 值归一化到组织干重。
- 利用非线性光学显微镜 (nlom) 从人体心脏的厚区域 (即lv、rv 和隔膜) 采集的图像样本, 以确认去细胞化后的细胞去除。nlom 设置在我们以前的出版物18、19、20中详细介绍。nlom 使我们能够通过双光子荧光 (tpf) 和第二谐波产生 (shg) 通道对细胞、弹性蛋白、胶原蛋白和肌球蛋白纤维进行成像, 而无需使用任何外源染色或染料21。
结果
在120毫米汞柱的恒压下, 经过7天的主动脉前灌注去细胞化, 人的心脏变成了半透明 (图 6b)。心脏被严重解剖成19个部分进行生化 (dna、gag 和 sds) 分析 (图 6c), 以评估最终脱病毒产物。
在整个去电磁化过程中, 不同溶液的输液流量随压力保持不变而变化。当灌注溶液从高渗变为低渗溶液...
讨论
据我们所知, 这是首次报告在加压袋内的人的心脏倒置去病毒化, 并对流速和细胞碎片清除进行延时监测。心包状袋在整个去渗过程中保持心脏方向稳定。与传统的直立朗根多夫灌注解离方法9相比, 将整个心脏浸入眼袋内可防止脱水, 并最大限度地减少主动脉 (从心脏重量) 上的过度拉伤.这反过来又保持了主动脉瓣的能力。
为了实现最大的去渗效率, 冠状动脉?...
披露声明
泰勒博士是 miromatrix 医疗公司的创始人和股东。这种关系是根据明尼苏达大学和德州心脏研究所的利益冲突政策管理的;其他作者没有利益冲突可以披露。
致谢
这项研究得到了休斯敦捐赠赠款和德州新兴技术基金的支持。作者感谢器官采购机构 life赠送, inc. 和捐献者的家人使这项研究成为可能。
材料
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture | Ethicon | SA85H | Suture used to ligate superior and inferior vena cava |
| 1/4" x 3/8" connector with luer | NovoSci | 332023-000 | Connect aorta and pulmonary artery |
| Masterflex platinum-cured silicone tubing | Cole-Parmer | HV-96410-16 | Tubing to connect heart chambers/veins |
| infusion and outflow line | Smiths Medical | MX452FL | For flowing solutions through the vasculature |
| Polyester pouch (Ampak 400 Series SealPAK Pouches) | Fisher scientific | 01-812-17 | Pericardium-like pouch for containing heart during decellularization |
| Snapware Square-Grip Canister | Snapware | 1022 | 1-liter Container used for perfusing heart |
| Black rubber stoppers | VWR | 59586-162 | To seal the perfusion container |
| Peristaltic pump | Harvard Apparatus | 881003 | To pump fluid through the inflow lines and to drain fluids |
| 2 L aspirator bottle with bottom sidearm | VWR | 89001-532 | For holding solutions/perfusate |
| Quant-iT PicoGreen dsDNA Assay kit | Life Technologies | P7589 | For quantifying dsDNA |
| Calf thymus standard | Sigma | D4522 | DNA standard |
| Blyscan Glycosaminoglycan Assay Kit | Biocolor Ltd | Blyscan #B1000 | GAG assay kit |
| Plate reader | Tecan | Infinite M200 Pro | For analytical assays |
| GE fluoroscopy | General Electric | OEC 9900 Elite | Angiogram |
| Visipaque | GE | 13233575 | Contrast agent |
参考文献
- Writing Group Members. Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association. Circulation. 133 (4), 447-454 (2016).
- Zia, S., et al. Hearts beating through decellularized scaffolds: whole-organ engineering for cardiac regeneration and transplantation. Critical Reviews in Biotechnology. 36 (4), 705-715 (2016).
- Zimmermann, W. H. Strip and Dress the Human Heart. Circulation Research. 118 (1), 12-13 (2016).
- Ott, H. C., et al. Perfusion-decellularized matrix: Using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Sanchez, P. L., et al. Acellular human heart matrix: A critical step toward whole heart grafts. Biomaterials. 61, 279-289 (2015).
- Peloso, A., et al. Current achievements and future perspectives in whole-organ bioengineering. Stem Cell Research & Therapy. 6, 107 (2015).
- Guyette, J. P., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Momtahan, N., Sukavaneshvar, S., Roeder, B. L., Cook, A. D. Strategies and Processes to Decellularize and Cellularize Hearts to Generate Functional Organs and Reduce the Risk of Thrombosis. Tissue Engineering Part B-Reviews. 21 (1), 115-132 (2015).
- Lee, P. F., et al. Inverted orientation improves decellularization of whole porcine hearts. Acta Biomaterialia. , (2016).
- Momtahan, N., et al. Automation of Pressure Control Improves Whole Porcine Heart Decellularization. Tissue Eng Part C Methods. , (2015).
- Weymann, A., et al. Development and Evaluation of a Perfusion Decellularization Porcine Heart Model - Generation of 3-Dimensional Myocardial Neoscaffolds. Circulation Journal. 75 (4), 852-860 (2011).
- Weymann, A., et al. Bioartificial heart: A human-sized porcine model--the way ahead. PLoS One. 9 (11), e111591 (2014).
- Remlinger, N. T., Wearden, P. D., Gilbert, T. W. Procedure for decellularization of porcine heart by retrograde coronary perfusion. Journal of Visualized Experiments. (70), e50059 (2012).
- Guyette, J. P., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Sanchez, P. L., et al. Data from acellular human heart matrix. Data Brief. 8, 211-219 (2016).
- Garreta, E., et al. Myocardial commitment from human pluripotent stem cells: Rapid production of human heart grafts. Biomaterials. 98, 64-78 (2016).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Engineering Part C-Methods. 16 (3), 525-532 (2010).
- Larson, A. M., Yeh, A. T. Ex vivo characterization of sub-10-fs pulses. Optics Letters. 31 (11), 1681-1683 (2006).
- Lee, P. F., Yeh, A. T., Bayless, K. J. Nonlinear optical microscopy reveals invading endothelial cells anisotropically alter three-dimensional collagen matrices. Experimental Cell Research. 315 (3), 396-410 (2009).
- Lee, P. F., Bai, Y., Smith, R. L., Bayless, K. J., Yeh, A. T. Angiogenic responses are enhanced in mechanically and microscopically characterized, microbial transglutaminase crosslinked collagen matrices with increased stiffness. Acta Biomaterialia. 9 (7), 7178-7190 (2013).
- Wu, Z., et al. Multi-photon microscopy in cardiovascular research. Methods. 130, 79-89 (2017).
- Ramanathan, T., Skinner, H. Coronary blood flow. Continuing Education in Anaesthesia Critical Care & Pain. 5 (2), 61-64 (2005).
- Murthy, V. L., et al. Clinical Quantification of Myocardial Blood Flow Using PET: Joint Position Paper of the SNMMI Cardiovascular Council and the ASNC. Journal of Nuclear Cardiology. 25 (1), 269-297 (2018).
- Molina, D. K., DiMaio, V. J. Normal organ weights in men: Part I-the heart. The American Journal of Forensic Medicine and Pathology. 33 (4), 362-367 (2012).
- Molina, D. K., DiMaio, V. J. Normal Organ Weights in Women: Part I-The Heart. The American Journal of Forensic Medicine and Pathology. 36 (3), 176-181 (2015).
- Robertson, M. J., Dries-Devlin, J. L., Kren, S. M., Burchfield, J. S., Taylor, D. A. Optimizing cellularization of whole decellularized heart extracellular matrix. PLoS One. 9 (2), e90406 (2014).
- Robertson, M. J., Soibam, B., O'Leary, J. G., Sampaio, L. C., Taylor, D. A. Cellularization of rat liver: An in vitro model for assessing human drug metabolism and liver biology. PLoS One. 13 (1), e0191892 (2018).
- Baghalishahi, M., et al. Cardiac extracellular matrix hydrogel together with or without inducer cocktail improves human adipose tissue-derived stem cells differentiation into cardiomyocyte-like cells. Biochemical and Biophysical Research Communications. , (2018).
- Perea-Gil, I., et al. In vitro comparative study of two decellularization protocols in search of an optimal myocardial scaffold for recellularization. American Journal of Translational Research. 7 (3), 558-573 (2015).
- Freytes, D. O., O'Neill, J. D., Duan-Arnold, Y., Wrona, E. A., Vunjak-Novakovic, G. Natural cardiac extracellular matrix hydrogels for cultivation of human stem cell-derived cardiomyocytes. Methods Molecular Biology. 1181, 69-81 (2014).
- Oberwallner, B., et al. Preparation of cardiac extracellular matrix scaffolds by decellularization of human myocardium. Journal of Biomedical Materials Research Part A. 102 (9), 3263-3272 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。