Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Decellularization des ganzen menschlichen Herz in einem unter Druck stehenden Beutel in eine umgekehrte Orientierung
In diesem Artikel
Zusammenfassung
Diese Methode ermöglicht Decellularization ein komplexes solide Organ mit einem einfachen Protokoll basierend auf osmotischen Schock und Durchblutung des Ionischen Waschmittel mit minimalen Orgel Matrix Störung. Es verfügt über eine neuartige Decellularization-Technik für die Herzen der Menschen in einem unter Druck stehenden Beutel mit Echtzeit-Überwachung der Strömung Dynamik und zellulären Schutt Abfluss.
Zusammenfassung
Die ultimative Lösung für Patienten mit terminaler Herzinsuffizienz ist Organtransplantation. Aber Spender Herzen sind begrenzt, Immunsuppression erforderlich ist und letztendlich Ablehnung auftreten kann. Erstellen einer funktionalen, könnte autologes Bio-künstliches Herz diese Herausforderungen lösen. Biofabrication eines Herzens bestehend aus Gerüst und Zellen ist eine Option. Eine natürliche Gerüst mit gewebespezifischen Zusammensetzung sowie Mikro- und Makro-Architektur erhalten Sie von einem Herzen von Menschen oder große Tiere wie Schweine. Decellularization beinhaltet Zelltrümmer und gleichzeitig 3D extrazellulären Matrix und Gefäßsystem und damit "Cellularization" auf einen späteren Timepoint auswaschen. Aufbauend auf unseren Roman zu finden, dass Perfusion Decellularization komplexe Organe ist möglich, entwickelten wir eine weitere "physiologisch" Methode, um nicht transplantable Menschenherzen zu decellularize, indem man sie in einem unter Druck stehenden Beutel in einem umgekehrten Orientierung unter kontrollierter Druck. Der Zweck der Verwendung eines unter Druck stehenden Beutels ist die Schaffung Druckgradienten über die Aortenklappe geschlossen halten und Verbesserung der myokardialen Perfusion. Gleichzeitige Beurteilung der Strömungsdynamik und Zelltrümmer Entfernung bei Decellularization erlaubt uns, sowohl Flüssigkeit und Schmutz Abfluss zu überwachen, damit erzeugen ein Gerüst, das sein kann entweder für einfache kardiale Reparatur verwendet (z.B. als Pflaster oder Ventil-Gerüst) oder als Ganzes-Orgel Gerüst.
Einleitung
Herzinsuffizienz führt zu hoher Sterblichkeit bei Patienten. Die ultimative Behandlungsoption für terminaler Herzinsuffizienz ist allo-Transplantation. Jedoch gibt es eine lange Warteliste für eine Transplantation aufgrund des Mangels an Spenderorganen und Patienten Gesicht nach Transplantation Hürden, die von lebenslange Immunsuppression zu chronischen Orgel Ablehnung1,2reichen. Bioengineering funktionale Hearts von Wiederbevölkerung decellularized menschlicher Herzen mit einer patienteneigenen Zellen könnten diese Hürden3zu umgehen.
Ein wichtiger Schritt in der "Technik" ein Herz ist die Schaffung ein Gerüst mit geeigneten Gefäß- und parenchymatösen Struktur, Zusammensetzung und Funktion um die Ausrichtung zu führen und Organisation von gelieferten Zellen. Im Beisein der geeignete Rahmen sollte Zellen ausgesät auf dem Schafott die Umwelt zu erkennen und erfüllen die erwartete Funktion als Teil dieses Organs. Unserer Meinung nach umfasst decellularized Orgel extrazelluläre Matrix (dECM) die notwendigen Merkmale das ideale Gerüst.
Durch die Verwendung von intrinsischen Gefäßsystem, kann komplexe ganze-Orgel Decellularization durch Antegrade oder retrograde Perfusion4 zelluläre Komponenten zu entfernen, unter Beibehaltung der zarten 3D extrazelluläre Matrix und Gefäßsystem2erreicht werden, 5,6,7. Eine funktionale Gefäßsystem ist in Bioengineering ganze Organe nur wichtig, wie in Vivo, Nährstoffverteilung und Abfallentsorgung8. Koronaren Perfusion Decellularization nachweislich wirksam bei der Schaffung von decellularized Herzen von Ratten4oder Schweine4,7,9,10,11 ,12,13, und Menschen5,7,14,15,16. Jedoch kann die Integrität der Ventile, Atrien und anderen "dünnen" Regionen leiden.
Menschliche Größe decellularized Herzen Gerüste erhalten Sie von Schweinen mit Druck Kontrolle7,9,10,11,12 oder Infusion Flow Rate Control13, 17 und5,7,14,15von menschlichen Spendern mit Druck zu kontrollieren. Decellularization der menschlichen Spender Herzen erfolgt über 4-8 Tage unter Druck auf 80-100 MmHg in aufrechter Orientierung5,15,16 oder über 16 Tage unter Druck gesteuert um 60 MmHg14 gesteuert . Unter Antegrade, druckgesteuerten Decellularization spielt die Aortenklappe Kompetenz eine entscheidende Rolle bei der Aufrechterhaltung der koronaren Perfusion Effizienz und stabile Druck an die Aortenwurzel. Unsere bisherige Arbeit ergab, dass die Ausrichtung des Herzens die koronaren Perfusion Effizienz während des Decellularization-Verfahrens und damit das Gerüst Integrität im Ende9beeinflusst.
Als Fortsetzung von unserer bisherigen Arbeit9stellen wir ein neuartiges Konzept, wobei ein Herzbeutel-wie Beutel hinzugefügt wird, um vollem Herzen Decellularization zu verbessern. Wir beschreiben die Decellularization menschlicher Herzen platziert in unter Druck stehenden Beutel, umgekehrt orientiert, und unter Druck auf 120 MmHg auf die Aortenwurzel gesteuert. Dieses Protokoll umfasst die Überwachung der Strömungsprofil und Sammlung von Abfluss Medien während des Decellularization-Verfahrens, koronaren Perfusion Effizienz und Schmutzentfernung Zelle zu bewerten. Biochemische Tests werden dann durchgeführt, um die Wirksamkeit der Methode zu testen.
Protokoll
Alle Experimente eingehalten, die Ethik-Ausschuss Leitlinien aus Texas Heart Institute.
1. Orgel-Vorbereitung
Hinweis: In Zusammenarbeit mit LifeGift, einer Non-Profit-Organbeschaffungsorganisation in Texas (http://www.lifegift.org), spendete die Herzen der Menschen nicht geeignet für Transplantation waren für die Forschung mit zugelassenen Zustimmung verwendet.
- Um Herzen zu beschaffen, die intravenös Infusion 30.000 U Heparin in die Herzen. Sicher Naht Kardioplegie Kanüle in der Aorta und befestigen Sie eine eingespannte Perfusion-Linie. Perforieren der minderwertigen Vena Cava (IVC), das rechte Herz zu lüften. Schneiden Sie die linken überlegen Pulmonalvene oder die linken atrial Anhängsel, die linken Herzkammern vent.
- 1 L Kardioplegie oder heparinisierten Kochsalzlösung einzuflößen. Sezieren Sie Aortenbogen Zweigen, Vena Cava superior (SVC) und andere Lungenvenen, das Herz von Pfändungen Gefäß- oder umliegenden Gewebe freizugeben. Tauchen Sie gut heparinisierten Herzen in vereisten Salzlösung.
- Überprüfen die gespendeten menschlichen Herzens (anterior und nach hinten, Abbildung 1). Legen Sie das Herz in einen sezierenden Fach und für strukturelle Schäden oder anatomische Fehlbildungen zu inspizieren. Leber und/oder Lunge für die Transplantation beschafft wurden, kann das Herz mit einer kurzen minderwertige Vena Cava und/oder Abwesenheit des linken atrial hinteren Wand darstellen.
- Interne Inspektion auf mögliche Mängel - Vorhofseptumdefekt (ASD), Ventrikelseptumdefekt (VSD) oder Fehlbildung Ventil (pulmonale, Aorten-, Mitral-, dreiaufklappbar) durchzuführen.
- Wenn ein septal Defekt vorhanden ist, korrigieren Sie es mit geeigneten Nähten (Abb. 2A, 2 b). Die Korrektur von septal defekten wird benötigt, um Decellularization über Pulmonalarterie (PA) Abfluss Trübungsmessung Fortschritte. Korrektur des septal defektes entfernt Links zum rechten Shunt, daher, der Abfluss von PA stellt den Abfluss aus dem Herz-Kreislauf durch den Koronarsinus.
- Verbinden Sie superior und inferior Vena Cava mit 2: 0 Seide Naht (Abbildung 2).
- Die Aorta (Ao) vom Haupt-PA (Abb. 2D) für anschließende Kanülierung zu sezieren.
- Einsetzen Sie Steckverbinder, basierend auf den Durchmesser des Gefäßes, (Abbildung 3) in Ao und PA und sichern sie mit 2: 0 seidenen Fäden (Abb. 4A).
- Fügen Sie eine Röhre Zeile durch den linken Vorhof (Abbildung 4 b) und in Richtung der linke Ventrikel (LV) (Abbildung 3), unter Verwendung eines Pulmonalvene Körperöffnungen.
- Schließen Sie einen Infusionsschlauch an den Anschluss in der Ao und der Abfluss-Linie, die in der PA (Abbildung 3) gelegt.
- Setzen Sie die vorbereiteten Herzen ein Polyester Tasche in umgekehrter Orientierung (Kopf).
- Legen Sie den Beutel mit Herz in einen Behälter Perfusion und schließen Sie den Deckel (Abbildung 4).
- Schließen Sie jede der Linien an den jeweiligen Häfen in den Gummistopfen (basierend auf den Durchmesser des Behälters) und legen Sie es auf den Deckel des Behälters Perfusion den Polyester-Beutel (Abbildung 4 und Abbildung 5 b) abzudichten.
- Durchspülen Sie 1 X Phosphat gepufferte Kochsalzlösung (PBS) (136 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4 und 1,8 mM KH2PO4 in destilliertem Wasser, pH 7,4) über die Infusion Port des Gummistopfens Abfluss aus der PA und von der Linie überprüfen in LV eingefügt
- Verwenden Sie diese Strömung um das Organ des verbleibenden Spuren von Blut in das Gefäßsystem zu reinigen. Fluss nicht beachtet, ziehen Sie die Anschlussleitungen an, wie sie lose sein könnten.
2. System-Setup und Orgel Decellularization Verfahren
- Montieren Sie des Bioreaktors und legen Sie in eine aufrechte Ausrichtung (Abbildung 5). Die Perfusion System beinhaltet einen Personal Computer (PC), Proportional-Integral-Derivat (PID) Controller, einer peristaltischen Pumpe für Ao-Infusion, Perfusion Bioreaktor, ein Kopf Druckbehälter für LV Perfusat Retention (2L Sauger Flasche mit Boden Nebenarm), und einer peristaltischen Pumpe, überschüssigen Flüssigkeit aus dem Kopf Druckbehälter abzulassen und den Abfluss von PA zu sammeln
- Verbinden Sie in der Gummiseptum den Infusionsschlauch, Druck-Kopf Line, PA-Abfluss Linie und Bioreaktor Entwässerung Line mit den Kautschuk GAP Oberfläche Anschlüssen über die Perfusion Bioreaktor (Abb. 5A) platziert.
- Decellularize Herzen unter dem ständigen Druck von 120 MmHg gemessen an der Aortenwurzel. Mitteldruck der LV sollte innerhalb von 14-18 MmHg während des gesamten Decellularization-Prozesses.
- Decellularize Herzen wie folgt: 4 h der hypertonen Lösung (500 mM NaCl), 2 h Hypotonische Lösung (20 mM NaCl), 120 h Sodium Dodecyl Sulfat (1 % SDS) Lösung, und eine endgültige waschen mit 120 L 1 X PBS (Abb. 6A).
- Decellularize die Herzen unter konstantem Druck-Kontrolle (120 MmHg). Infusion Durchflussmenge in Ao ist Herz-abhängig und ist im Durchschnitt 98.06±16.22 mL/min für Hypertone Lösung, 76.14±7.90 mL/min für hypotone Lösung und 151.50±5.76 mL/min für SDS 185.24±7.10 mL/min für PBS. Im Durchschnitt verbrauchten Gesamtvolumens von jedem Reagenz 23.36±5.70 L für Hypertone Lösung und 9.13±1.26 L für hypotone Lösung.
- Umwälzen Sie die letzten 60 L 1 % SDS (1 L pro Gramm Gewicht Herz) bis zum Ende des SDS Perfusion. Abbildung 6A zeigt eine Zeitleiste für den Decellularization-Prozess Endpunkte für die Datenerfassung zu entlocken: flow Rate Überwachung (Ao und PA) und Abfluss Sammlung (PA und nicht-PA) von Druck Kopf während der Decellularization.
- Da der SVC und IVC ligiert sind, ist es vernünftig anzunehmen, dass alle Flüssigkeit aus der PA gesammelt ist das Ergebnis der tatsächlichen koronaren Perfusion (Abb. 5 b). Koronaren Perfusion Effizienz zu bestimmen, indem man direkt die Durchflussmenge des Perfusat aus der PA durch die Strömungsgeschwindigkeit des infundierten Lösung in Ao:
Koronaren Perfusion Effizienz =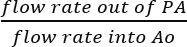 (%).
(%). - Vergleichende Analyse der Perfusat erhalten aus der PA und der LV und die infundierten Lösungen in zweifacher Ausfertigung durch 200 μL pro Well in eine klar unten 96-Well-Platte laden und lesen Absorption bei 280 nm. Der Extinktion Wert, empirisch nach dem Versuch verschiedene Werte ausgewählt wurde gefunden, um das beste Werte normalisiert.
- Verwenden Sie die Trübung des sauberen infundiert Reagenz als das Steuerelement. Die Trübung der Abfluss Perfusat stellt Auswaschung von Zellenrückstand und sofort während der Decellularization als ein Tracking-Tool des Prozesses quantifiziert werden kann.
- Während der letzten Wäsche mit 10 L 1 X PBS fügen Sie 500 mL sterile neutralisierte 2,1 % Peressigsäure saure Lösung, mit 10N NaOH, führt zu einer 0,1 % Peressigsäure saure Lösung (V/V) mit PBS-Puffer neutralisiert hinzu. Verwenden Sie diese Lösung, um das Gerüst zu sterilisieren.
3. Bewertung der Decellularized Herzen
Hinweis: Nach Decellularization, repräsentativen Herzen für koronare Angiogramm Bildgebung und biochemischen Assays verwendet werden.
- Führen Sie Koronarangiographie der repräsentativen decellularized das Herz des Menschen, die Unversehrtheit des koronaren Gefäßsystem zu untersuchen. Kurz gesagt, mit Hilfe einer Sonographie, Bild decellularized Menschenherz nach Injektion von Kontrastmittel durch koronare ostial Kanüle in den wichtigsten rechten und linken Koronararterien.
- Sezieren Sie decellularized Herzen um Proben aus 19 Regionen zur Bewertung der verbleibenden Desoxyribonukleinsäure (DNA), Glykosaminoglykan (GAG) und SDS Ebenen in decellularized Gewebe zu erhalten. Entfernen Sie die Basis des Herzens aus Ventrikeln und sezieren Sie die Ventrikel in 4 gleiche Abschnitte (Abbildung 6). Jeder Abschnitt in den vorderen und hinteren rechten Ventrikel (RV), die vordere und hintere LV und der interventricular Septum (IVS) unterteilen. Das Gewebe mit der Spitze ist für die Probenahme in der LV und RV seziert.
- Schneiden Sie Gewebeproben für DNA, Knebel und SDS Assays (~ 15 mg Frischgewicht).
- Extrahieren Sie doppelsträngige DNA (DsDNA) von Proben in 1 M NaOH für 3 h bei 65 ° C zu verdauen und justieren Sie pH bis 7 mit 10 X-Tris-EDTA (TE)-Puffer und 1 M Salzsäure (HCl).
- Ein Kalb Thymus standard eine DsDNA Assay Kit mit DsDNA zu quantifizieren (siehe Tabelle der Materialien). Proben in zweifacher Ausfertigung mit einem Fluoreszenz Mikrotestplatte Reader lesen (Erregung bei 480 nm und Emission bei 520 nm). Berechnen Sie den Prozentsatz der verbleibenden DsDNA in den decellularized Herzen durch den Vergleich DsDNA-Konzentration in jedem Gewebe, dass in cadaveric (% cadaveric).
- Erhalten Sie sulfatierte GAGs in Lösung durch Verdauung Gewebeproben in eine Papain Extraktionslösung (0,2 M Natriumphosphat Puffer mit EDTA Binatrium Salz, Cystein HCl, Natriumacetat und Papain) bei 65 ° C für 3 Stunden. GAG-Inhalt (in zweifacher Ausfertigung) mithilfe eines Glykosaminoglykan Assay Kit zu messen.
- Lyophilize Proben für SDS-Assay in einem beheizten Vakuum und Maßnahme Trockengewicht. Jede getrocknete Probe 200 µL ultrareinem Wasser hinzu und homogenisieren Sie, um die restlichen SDS in Lösung zu extrahieren. Mischen Sie diese SDS-Lösung zu chloroform und eine Methylenblau-Lösung (12 mg Methylenblau in 1 L von 0,01 M HCl). Die SDS wird in der organischen Schicht durch die Bindung an die Methylenblau-Dye trennen.
- Mit einem Fluoreszenz Mikrotestplatte Reader lesen die Extinktion (655 nm) Standards und Proben in zweifacher Ausfertigung, die restliche SDS zu berechnen. Normalisieren Sie diesen SDS-Wert auf Gewebe Trockengewicht.
- Bildbeispiele aus dicken Regionen (d. h. LV, RV und Septum) des menschlichen Herzens mit nichtlinearen optischen Mikroskopie (NLOM), zelluläre entfernen nach Decellularization zu bestätigen. Das NLOM Setup wird in unseren vorherigen Veröffentlichungen18,19,20erläutert. NLOM ermöglicht es uns, Bildzelle, Elastin, Kollagen und Myosin-Fasern durch seine zwei-Photonen-Fluoreszenz (TPF) und zweiten harmonischen Generation (SHG) Kanäle ohne Verwendung einer exogenen Fleck oder Farbstoff21.
Ergebnisse
Nach einer 7-Tage-Decellularization mit Antegrade aortalen Perfusion unter dem ständigen Druck von 120 MmHg wandte sich das menschliche Herz transluzente (Abb. 6 b). Das Herz war grob in 19 Sektionen für biochemische (DNA, Knebel und SDS) Analyse (Abbildung 6), um das Endprodukt decellularized bewerten seziert.
Während des Decellularization Prozesses war Fluss Infusi...
Diskussion
Nach unserer Kenntnis ist dies die erste Studie, Bericht invertiert Decellularization menschlicher Herzen in einem unter Druck stehenden Beutel mit Zeitraffer Überwachung der Flow-Rate und Zelle Schmutzentfernung. Der Perikard-wie Beutel hält die Ausrichtung des Herzens stabil während des Decellularization-Verfahrens. Eintauchen und invertieren von ganzen Herzen in einem Beutel verhindert Austrocknung und minimiert die übermäßige Belastung der Aorta (von Herzen Gewicht) als im Vergleich zu den herkömmlichen aufrec...
Offenlegungen
Dr. Taylor ist der Gründer und Gesellschafter in Miromatrix Medical, Inc. Diese Beziehung wird im Einklang mit der Interessenkonflikt-Politik von der University of Minnesota und Texas Heart Institute; die anderen Autoren haben keinen Interessenkonflikt, offen zu legen.
Danksagungen
Diese Forschung wurde von der Houston Endowment-Zuschuss und die Texas Emerging Technology Fund unterstützt. Die Autoren erkennen die Orgel Beschaffungsbehörde LifeGift, Inc. und der Spenderfamilien dafür, dass diese Studie ermöglicht.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture | Ethicon | SA85H | Suture used to ligate superior and inferior vena cava |
| 1/4" x 3/8" connector with luer | NovoSci | 332023-000 | Connect aorta and pulmonary artery |
| Masterflex platinum-cured silicone tubing | Cole-Parmer | HV-96410-16 | Tubing to connect heart chambers/veins |
| infusion and outflow line | Smiths Medical | MX452FL | For flowing solutions through the vasculature |
| Polyester pouch (Ampak 400 Series SealPAK Pouches) | Fisher scientific | 01-812-17 | Pericardium-like pouch for containing heart during decellularization |
| Snapware Square-Grip Canister | Snapware | 1022 | 1-liter Container used for perfusing heart |
| Black rubber stoppers | VWR | 59586-162 | To seal the perfusion container |
| Peristaltic pump | Harvard Apparatus | 881003 | To pump fluid through the inflow lines and to drain fluids |
| 2 L aspirator bottle with bottom sidearm | VWR | 89001-532 | For holding solutions/perfusate |
| Quant-iT PicoGreen dsDNA Assay kit | Life Technologies | P7589 | For quantifying dsDNA |
| Calf thymus standard | Sigma | D4522 | DNA standard |
| Blyscan Glycosaminoglycan Assay Kit | Biocolor Ltd | Blyscan #B1000 | GAG assay kit |
| Plate reader | Tecan | Infinite M200 Pro | For analytical assays |
| GE fluoroscopy | General Electric | OEC 9900 Elite | Angiogram |
| Visipaque | GE | 13233575 | Contrast agent |
Referenzen
- Writing Group Members. Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association. Circulation. 133 (4), 447-454 (2016).
- Zia, S., et al. Hearts beating through decellularized scaffolds: whole-organ engineering for cardiac regeneration and transplantation. Critical Reviews in Biotechnology. 36 (4), 705-715 (2016).
- Zimmermann, W. H. Strip and Dress the Human Heart. Circulation Research. 118 (1), 12-13 (2016).
- Ott, H. C., et al. Perfusion-decellularized matrix: Using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Sanchez, P. L., et al. Acellular human heart matrix: A critical step toward whole heart grafts. Biomaterials. 61, 279-289 (2015).
- Peloso, A., et al. Current achievements and future perspectives in whole-organ bioengineering. Stem Cell Research & Therapy. 6, 107 (2015).
- Guyette, J. P., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Momtahan, N., Sukavaneshvar, S., Roeder, B. L., Cook, A. D. Strategies and Processes to Decellularize and Cellularize Hearts to Generate Functional Organs and Reduce the Risk of Thrombosis. Tissue Engineering Part B-Reviews. 21 (1), 115-132 (2015).
- Lee, P. F., et al. Inverted orientation improves decellularization of whole porcine hearts. Acta Biomaterialia. , (2016).
- Momtahan, N., et al. Automation of Pressure Control Improves Whole Porcine Heart Decellularization. Tissue Eng Part C Methods. , (2015).
- Weymann, A., et al. Development and Evaluation of a Perfusion Decellularization Porcine Heart Model - Generation of 3-Dimensional Myocardial Neoscaffolds. Circulation Journal. 75 (4), 852-860 (2011).
- Weymann, A., et al. Bioartificial heart: A human-sized porcine model--the way ahead. PLoS One. 9 (11), e111591 (2014).
- Remlinger, N. T., Wearden, P. D., Gilbert, T. W. Procedure for decellularization of porcine heart by retrograde coronary perfusion. Journal of Visualized Experiments. (70), e50059 (2012).
- Guyette, J. P., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Sanchez, P. L., et al. Data from acellular human heart matrix. Data Brief. 8, 211-219 (2016).
- Garreta, E., et al. Myocardial commitment from human pluripotent stem cells: Rapid production of human heart grafts. Biomaterials. 98, 64-78 (2016).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Engineering Part C-Methods. 16 (3), 525-532 (2010).
- Larson, A. M., Yeh, A. T. Ex vivo characterization of sub-10-fs pulses. Optics Letters. 31 (11), 1681-1683 (2006).
- Lee, P. F., Yeh, A. T., Bayless, K. J. Nonlinear optical microscopy reveals invading endothelial cells anisotropically alter three-dimensional collagen matrices. Experimental Cell Research. 315 (3), 396-410 (2009).
- Lee, P. F., Bai, Y., Smith, R. L., Bayless, K. J., Yeh, A. T. Angiogenic responses are enhanced in mechanically and microscopically characterized, microbial transglutaminase crosslinked collagen matrices with increased stiffness. Acta Biomaterialia. 9 (7), 7178-7190 (2013).
- Wu, Z., et al. Multi-photon microscopy in cardiovascular research. Methods. 130, 79-89 (2017).
- Ramanathan, T., Skinner, H. Coronary blood flow. Continuing Education in Anaesthesia Critical Care & Pain. 5 (2), 61-64 (2005).
- Murthy, V. L., et al. Clinical Quantification of Myocardial Blood Flow Using PET: Joint Position Paper of the SNMMI Cardiovascular Council and the ASNC. Journal of Nuclear Cardiology. 25 (1), 269-297 (2018).
- Molina, D. K., DiMaio, V. J. Normal organ weights in men: Part I-the heart. The American Journal of Forensic Medicine and Pathology. 33 (4), 362-367 (2012).
- Molina, D. K., DiMaio, V. J. Normal Organ Weights in Women: Part I-The Heart. The American Journal of Forensic Medicine and Pathology. 36 (3), 176-181 (2015).
- Robertson, M. J., Dries-Devlin, J. L., Kren, S. M., Burchfield, J. S., Taylor, D. A. Optimizing cellularization of whole decellularized heart extracellular matrix. PLoS One. 9 (2), e90406 (2014).
- Robertson, M. J., Soibam, B., O'Leary, J. G., Sampaio, L. C., Taylor, D. A. Cellularization of rat liver: An in vitro model for assessing human drug metabolism and liver biology. PLoS One. 13 (1), e0191892 (2018).
- Baghalishahi, M., et al. Cardiac extracellular matrix hydrogel together with or without inducer cocktail improves human adipose tissue-derived stem cells differentiation into cardiomyocyte-like cells. Biochemical and Biophysical Research Communications. , (2018).
- Perea-Gil, I., et al. In vitro comparative study of two decellularization protocols in search of an optimal myocardial scaffold for recellularization. American Journal of Translational Research. 7 (3), 558-573 (2015).
- Freytes, D. O., O'Neill, J. D., Duan-Arnold, Y., Wrona, E. A., Vunjak-Novakovic, G. Natural cardiac extracellular matrix hydrogels for cultivation of human stem cell-derived cardiomyocytes. Methods Molecular Biology. 1181, 69-81 (2014).
- Oberwallner, B., et al. Preparation of cardiac extracellular matrix scaffolds by decellularization of human myocardium. Journal of Biomedical Materials Research Part A. 102 (9), 3263-3272 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten