Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Decellularization всего человеческого сердца внутри под давлением мешочек в Перевернутый ориентации
В этой статье
Резюме
Этот метод позволяет decellularization комплекс твердых органа с использованием простой протокол, основанный на осмотическим шоком и перфузии ионных моющих средств с минимальными орган матрица нарушения. Она включает в себя Роман decellularization техника для человеческого сердца внутри под давлением мешочек с мониторинг в реальном времени динамику и сотовых оттока потока мусора.
Аннотация
Идеальное решение для пациентов с терминальной стадии сердечной недостаточности — пересадка. Но доноров сердца ограничены, иммуносупрессия не требуется, и в конечном итоге может произойти отказ. Создание функциональных, аутологичные био искусственное сердце может решить эти проблемы. Одним из вариантов является Biofabrication сердца состоит эшафот и клеток. Естественный леску с состав ткани конкретных, а также микро - и макро архитектуры могут быть получены путем decellularizing сердца людей или крупных животных, таких как свиньи. Decellularization включает в себя мытье сотовой мусора при сохранении 3D внеклеточного матрикса и сосудистую и позволяет «cellularization» в более поздних timepoint. Опираясь на наш роман, найти что Изотопное decellularization сложных органов возможно, мы разработали более «физиологические» метод decellularize не-которые спасаютжизньпритрансплантации человеческие сердца, помещая их внутри под давлением мешочек, в Перевернутый ориентация, под контролируемого давления. Цель использования в герметичный мешок является создание градиентов давления через клапан аорты, держите его закрытые и улучшения перфузии миокарда. Одновременной оценки динамики потока и сотовой мусора во время decellularization, позволили нам контролировать жидкости приток и отток мусора, создавая тем самым эшафот, что могут быть использованы либо для простой ремонт сердца (например как патч или клапан леса) или в целом орган леску.
Введение
Сердечная недостаточность приводит к высокой смертности больных. Параметр конечной лечения для конечной стадии сердечной недостаточности — Алло трансплантация. Однако существует длинный лист ожидания для трансплантации из-за нехватки донорских органов, и больные лица после трансплантации препятствия диапазоне от непрерывного иммуносупрессии хронической орган отклонение1,2. Функциональные сердца биоинженерии, заселив decellularized человеческого размера сердца пациента клетки могут обойти эти препятствия3.
Крупный шаг в «Инжиниринг» сердце является создание леску с соответствующим сосудистой и Паренхиматозный структуру, состав и функции для руководства выравнивание и организации поставленных клеток. При наличии надлежащих рамок клетки посеян на эшафот следует признать окружающей среды и выполнять функцию ожидаемых в рамках этого органа. По нашему мнению decellularized орган внеклеточного матрикса (dECM) включает в себя необходимые характеристики идеального эшафот.
Используя встроенные сосудистую, сложные decellularization целом орган может быть достигнуто через антеградная или ретроградным перфузии4 для удаления клеточных компонентов при сохранении деликатный 3D внеклеточного матрикса и сосудистую2, 5,6,7. Функциональный сосудистую имеет важное значение в биоинженерии целые органы просто как в естественных условиях, для распределения питательных веществ и удаление отходов8. Decellularization коронарной перфузии доказано, чтобы быть эффективным в создании decellularized сердца от крыс4, или свиней4,7,9,10,11 ,12,13и люди5,7,14,,1516. Тем не менее могут страдать от целостности клапанов, предсердиями и других «тонких» регионов.
Сердце человека размер decellularized леса могут быть получены из свиней, используя давление управления7,9,10,11,12 или настой потока скорость управления13, 17 и от человека доноров, используя давление управления5,7,14,15. Decellularization человеческих донорских сердец происходит в течение 4-8 дней под давлением, контролируемых на 80-100 мм рт.ст, в вертикальной ориентации5,,1516 или более 16 дней под давлением, контролируемых на 60 мм рт.ст14 . Под антеградная, под контролем давления decellularization, аортальный клапан компетентности играет решающую роль в поддержании эффективности коронарной перфузии и стабильное давление на корню аорты. Наши предыдущие работы показали, что ориентация сердца зависит его эффективность коронарной перфузии во время процедуры decellularization и, следовательно, эшафот целостность в конце9.
Как продолжение нашей предыдущей работы9мы вводим новые концепции, которой добавляется сумке перикарда как улучшить целом сердце decellularization. Мы описываем decellularization человеческих сердец, размещенных внутри под давлением Чехлы, обратно ориентированной и под давлением, контролируемых на 120 мм рт.ст на корню аорты. Этот протокол включает в себя мониторинг профиля потока и сбора отток средств массовой информации во всем decellularization процедуры для оценки эффективности коронарной перфузии и удаление остатков клеток. Биохимические анализы затем выполняются для проверки эффективности метода.
протокол
Все эксперименты соблюдать руководящие принципы Комитета этики от института сердца Texas.
1. орган подготовка
Примечание: В сотрудничестве с LifeGift, некоммерческой органа Организации закупочной деятельности в Техасе (http://www.lifegift.org), дар человеческих сердцах не подходит для пересадки были использованы для исследований с утвержденными согласия.
- Для приобретения сердца, внутривенно настаиваться 30 000 U гепарина в сердцах. Надежно шовные Кардиоплегия канюли в аорте и прикрепить зажимается перфузии линию. Перфорировать нижней полой вены (IVC) вентиляционные правых отделов сердца. Вырежьте Улучшенный левой легочной вены или левого предсердий придаток провентилировать левой камеры сердца.
- Влить 1 Л Кардиоплегия или гепаринизированным физиологическим. Вскрыть ветвей дуги аорты, верхней полой вены (SVC) и другие легочные вены освободить сердце от привязанности сосудов или окружающих тканей. Опускайте хорошо гепаринизированным сердца в холодный солевой раствор.
- Осмотрите пожертвовано человеческого сердца (кпереди и кзади, рис. 1). Место сердце на подносе рассечения и инспектировать любые структурные повреждения или анатомических аномалий. Если печень или легкие были закуплены для трансплантации, сердце может представлять с короткой нижней полой вены и/или отсутствие левого предсердий задней стенки.
- Выполнение внутренней инспекции для возможных дефектов - Дефект межпредсердной перегородки (ASD), дефект межжелудочковой перегородки (VSD) или мальформация клапан (трехстворчатого аортального, митрального,-легочной).
- Если присутствует дефект межпредсердной перегородки, исправьте ее с соответствующей швов (рисунок 2A, 2B). Коррекция дефектов межпредсердной перегородки необходима для мониторинга прогресса decellularization через легочной артерии (PA) отток мутности. Коррекция дефекта межжелудочковой перегородки удаляет слева в правый шунта, следовательно, отток от ПА представляет собой отток от коронарного кровообращения через коронарного синуса.
- Перевязать верхней и нижней полой вены с 2-0 Шелковый шов (рис. 2 c).
- Вскрыть вдали от главных ПА (Рисунок 2D) для последующего катетеризации аорты (Ao).
- Вставьте разъемы, основанный на диаметр сосуда, (рис. 3) в Ao и ПА и закрепите их с 2-0 шелковые швы (рис. 4A).
- Вставка линии труб через левое предсердие (рис. 4B) и к левого желудочка (LV) (рис. 3), используя один из отверстия легочной вены.
- Подсоедините линию настой к разъему в Ao и отток линии в ПА (рис. 3).
- Поместите подготовленные сердца в полиэфирных мешочек в Перевернутый ориентации (вверх ногами).
- Поместите мешочек с сердцем в контейнер перфузии и закройте крышку (рис. 4 c).
- Подключите каждой из линий в соответствующие порты в резиновую пробку (основанный на диаметр контейнера) и вставить его на крышке контейнера перфузии для герметизации полиэстер мешочек (Рисунок 4 c и Рисунок 5B).
- Perfuse 1 x фосфатный буфер (PBS) (136 мм NaCl, 2,7 мм KCl, 10 мм Na2HPO4 и 1,8 мм х2PO4 в дистиллированной воде, рН 7,4) через порт настой резиновую пробку для проверки отток из ПА и линии вставляется в LV.
- Используйте этот поток для очистки орган каких-либо остаточных следов крови в сосудистую. Если поток не наблюдается, затяните линий связи, как они могут быть свободными.
2. системы установки и органа Decellularization процедура
- Соберите биореактор и место в вертикальном положении (рис. 5). Перфузии система включает в себя персональный компьютер (ПК), пропорционального интеграл производная (PID) контроллер, Перистальтический насос для инфузии Ao, биореактор перфузии, давление головы контейнер для LV perfusate крепления (бутылка 2 Л Аспиратор с дном пистолет) и насос перистальтический слейте лишнюю жидкость из головы контейнера давление и собирать отток от ПА.
- В резиновые септум Подключите настой линии, -напорные линии, линия ПА отток и биореактор сливной линии в резиновый колпачок поверхности порты поверх перфузии биореактор (Рисунок 5A).
- Decellularize сердца под постоянным давлением 120 мм рт.ст, измеренных в корня аорты. Среднее давление LV должна быть в течение 14-18 мм рт.ст на протяжении всего процесса весь decellularization.
- Decellularize сердца следующим: 4 h гипертонический раствор (500 мм NaCl), 2 h гипотонический раствор (20 мм NaCl), 120 h натрия Додециловый сульфат (1% SDS) решения и окончательный промыть 120 L ПБС (рис. 6A).
- Decellularize сердца под контролем постоянного давления (120 mmHg). Скорость потока вливания в Ao зависит от сердца и составляет, в среднем, 98.06±16.22 мл/мин для гипертонический раствор, 76.14±7.90 мл/мин для гипотонический раствор, 151.50±5.76 мл/мин на SDS и 185.24±7.10 мл/мин для PBS. Общий объем потребления каждого реагента в среднем 23.36±5.70 для гипертонический раствор и 9.13±1.26 Л для гипотонический раствор.
- Разослать окончательный 60 Л 1% SDS (1 Л на грамм веса сердца) до конца SDS перфузии. Рисунок 6A показывает график для процесса decellularization, вызывая конечных точек для сбора данных: потока скорость контроля (Ao и ПА) и отток коллекции (ПА и -PA) от давления во время decellularization.
- Так как лигируют SVC и IVC, это разумно предположить, что все жидкости, собранные из ПА является результатом фактических коронарной перфузии (Рисунок 5B). Определите эффективность коронарной перфузии разделив непосредственно скорости потока perfusate из ПА, скорость потока проникнуты решения Ao:
Эффективность коронарной перфузии =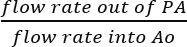 (%).
(%). - Выполнить сравнительный анализ perfusate, полученные от ПА и LV и проникнуты решения в двух экземплярах, Загрузка 200 мкл на скважину в четких днище 96-луночных и читая поглощения на 280 nm. Значение поглощения, эмпирически выбран после попытки различных значений, было установлено, чтобы дать лучшее нормализованные значения.
- Используйте помутнение чистой проникнуты реагента в качестве элемента управления. Мутность отток perfusate представляет размыва клеток мусора и может быть определена количественно мгновенно во время decellularization как инструмент отслеживания процесса.
- Во время окончательной стирки с 10 Л ПБС добавьте 500 мл раствора стерильную нейтрализованы 2,1% надуксусной кислоты, нейтрализованы с 10N NaOH, ведущих к 0,1% надуксусной кислоты раствор (v/v) в PBS. Это решение используйте для стерилизации на эшафот.
3. Оценка Decellularized сердец
Примечание: После decellularization, представитель сердца будет использоваться для коронарной Ангиограмма изображений и биохимических анализов.
- Выполняйте коронарография представитель decellularized человеческого сердца для изучения целостности коронарного сосудистую. Кратко изображение с помощью флюороскопа, decellularized сердце человека после инъекции контрастного вещества через коронарного Лютая канюли в основной правый и левый коронарных артерий.
- Вскрыть decellularized сердце, чтобы получить образцы из 19 районов для оценки оставшихся дезоксирибонуклеиновой кислоты (ДНК), Глюкозаминогликан (GAG) и уровни SDS в decellularized тканях. Снимите основание сердца из желудочков и вскрыть желудочков на 4 равные части (рис. 6 c). Каждый раздел разделите на передний и задний правый желудочек (RV), передний и задний LV и межжелудочковой перегородки (ИВС). Ткани, содержащие Апекс тренированное в LV и RV для отбора проб.
- Вырежьте образцы тканей для анализов ДНК, кляп и SDS (~ 15 мг живого веса).
- Добывать двуцепочечной ДНК (dsDNA) переваривать образцов в 1 М NaOH за 3 ч при температуре 65 ° C и скорректировать рН 7, используя 10 x буфер Tris-ЭДТА (TE) и 1 М соляной кислоты (HCl).
- Количественно dsDNA с помощью dsDNA Assay комплект с теленка тимуса стандарта (см. Таблицу материалы). Прочитайте образцы в двух экземплярах с помощью Считыватель микропланшетов флуоресцирования (возбуждения в 480 Нм и выбросов на 520 Нм). Вычислить процент остаточной dsDNA в decellularized сердца, сравнивая dsDNA концентрация в каждой ткани, трупной (% трупных).
- Получения сульфатированных приколов в раствор переваривания образцы тканей в решении добыча папаин (буфер фосфат натрия 0,2 М с ЭДТА динатриевая соль, хвоща HCl, натрия ацетат и папаин) при температуре 65 ° C для 3 часов. Измерить с помощью комплекта Assay Глюкозаминогликан кляп содержание (в двух экземплярах).
- Lyophilize образцы для assay SDS в подогревом вакуума и мера сухого веса. 200 мкл ультрачистая вода для каждого образца сушеных и гомогенизации для извлечения остаточных SDS в раствор. Смешайте это решение SDS хлороформа и раствором метиленового синего (12 мг метиленового синего в 1 Л 0,01 М HCl). ПБ будет отделять в органическом слое путем привязки к красителя метиленового синего.
- Использование Считыватель микропланшетов флуоресценции, читать поглощения (655 нм) стандартов и образцы в двух экземплярах для вычисления остаточного ИКБ. Нормализовать это значение SDS ткани сухого веса.
- Примеры изображений из толстых регионов (то есть, LV, RV и перегородки) человеческого сердца с нелинейной оптической микроскопии (NLOM) для подтверждения удаления сотовой после decellularization. Установки NLOM подробно в наших предыдущих публикациях18,19,20. NLOM позволяет нам изображение клетки, эластин, коллаген и миозина волокна через свои две Фотон флуоресценции (ВПС) и второй гармоники поколения (SHG) каналов без использования каких-либо внешних пятно или краситель21.
Результаты
После 7-дневного decellularization с антеградная аорты перфузии под постоянным давлением 120 мм рт.ст. сердце человека оказалось полупрозрачный (Рисунок 6B). Сердце было грубо расчлененный 19 разделов для биохимического анализа (ДНК, кляп и SDS) (рис. 6 c
Обсуждение
Насколько нам известно это первое исследование доклад Перевернутый decellularization человеческих сердец внутри под давлением мешочек с покадровой мониторинг потока скорость и ячейки удаления мусора. Сумке перикарда как сохраняет ориентацию сердца стабильной на протяжении всей процедуры dec...
Раскрытие информации
Д-р Тейлор является учредителем и акционером в Miromatrix Medical, Inc. Эта связь управляется в соответствии с политикой конфликта интересов университета Миннесоты и Техас институт сердца; другие авторы имеют никакого конфликта интересов раскрыть.
Благодарности
Это исследование было поддержано Хьюстон Дотационный Грант и Техас Фонд для новых технологий. Авторы признают агентство по закупкам орган LifeGift, Inc. и семьями донора для изготовления этого исследования возможных.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture | Ethicon | SA85H | Suture used to ligate superior and inferior vena cava |
| 1/4" x 3/8" connector with luer | NovoSci | 332023-000 | Connect aorta and pulmonary artery |
| Masterflex platinum-cured silicone tubing | Cole-Parmer | HV-96410-16 | Tubing to connect heart chambers/veins |
| infusion and outflow line | Smiths Medical | MX452FL | For flowing solutions through the vasculature |
| Polyester pouch (Ampak 400 Series SealPAK Pouches) | Fisher scientific | 01-812-17 | Pericardium-like pouch for containing heart during decellularization |
| Snapware Square-Grip Canister | Snapware | 1022 | 1-liter Container used for perfusing heart |
| Black rubber stoppers | VWR | 59586-162 | To seal the perfusion container |
| Peristaltic pump | Harvard Apparatus | 881003 | To pump fluid through the inflow lines and to drain fluids |
| 2 L aspirator bottle with bottom sidearm | VWR | 89001-532 | For holding solutions/perfusate |
| Quant-iT PicoGreen dsDNA Assay kit | Life Technologies | P7589 | For quantifying dsDNA |
| Calf thymus standard | Sigma | D4522 | DNA standard |
| Blyscan Glycosaminoglycan Assay Kit | Biocolor Ltd | Blyscan #B1000 | GAG assay kit |
| Plate reader | Tecan | Infinite M200 Pro | For analytical assays |
| GE fluoroscopy | General Electric | OEC 9900 Elite | Angiogram |
| Visipaque | GE | 13233575 | Contrast agent |
Ссылки
- Writing Group Members. Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association. Circulation. 133 (4), 447-454 (2016).
- Zia, S., et al. Hearts beating through decellularized scaffolds: whole-organ engineering for cardiac regeneration and transplantation. Critical Reviews in Biotechnology. 36 (4), 705-715 (2016).
- Zimmermann, W. H. Strip and Dress the Human Heart. Circulation Research. 118 (1), 12-13 (2016).
- Ott, H. C., et al. Perfusion-decellularized matrix: Using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Sanchez, P. L., et al. Acellular human heart matrix: A critical step toward whole heart grafts. Biomaterials. 61, 279-289 (2015).
- Peloso, A., et al. Current achievements and future perspectives in whole-organ bioengineering. Stem Cell Research & Therapy. 6, 107 (2015).
- Guyette, J. P., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Momtahan, N., Sukavaneshvar, S., Roeder, B. L., Cook, A. D. Strategies and Processes to Decellularize and Cellularize Hearts to Generate Functional Organs and Reduce the Risk of Thrombosis. Tissue Engineering Part B-Reviews. 21 (1), 115-132 (2015).
- Lee, P. F., et al. Inverted orientation improves decellularization of whole porcine hearts. Acta Biomaterialia. , (2016).
- Momtahan, N., et al. Automation of Pressure Control Improves Whole Porcine Heart Decellularization. Tissue Eng Part C Methods. , (2015).
- Weymann, A., et al. Development and Evaluation of a Perfusion Decellularization Porcine Heart Model - Generation of 3-Dimensional Myocardial Neoscaffolds. Circulation Journal. 75 (4), 852-860 (2011).
- Weymann, A., et al. Bioartificial heart: A human-sized porcine model--the way ahead. PLoS One. 9 (11), e111591 (2014).
- Remlinger, N. T., Wearden, P. D., Gilbert, T. W. Procedure for decellularization of porcine heart by retrograde coronary perfusion. Journal of Visualized Experiments. (70), e50059 (2012).
- Guyette, J. P., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Sanchez, P. L., et al. Data from acellular human heart matrix. Data Brief. 8, 211-219 (2016).
- Garreta, E., et al. Myocardial commitment from human pluripotent stem cells: Rapid production of human heart grafts. Biomaterials. 98, 64-78 (2016).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Engineering Part C-Methods. 16 (3), 525-532 (2010).
- Larson, A. M., Yeh, A. T. Ex vivo characterization of sub-10-fs pulses. Optics Letters. 31 (11), 1681-1683 (2006).
- Lee, P. F., Yeh, A. T., Bayless, K. J. Nonlinear optical microscopy reveals invading endothelial cells anisotropically alter three-dimensional collagen matrices. Experimental Cell Research. 315 (3), 396-410 (2009).
- Lee, P. F., Bai, Y., Smith, R. L., Bayless, K. J., Yeh, A. T. Angiogenic responses are enhanced in mechanically and microscopically characterized, microbial transglutaminase crosslinked collagen matrices with increased stiffness. Acta Biomaterialia. 9 (7), 7178-7190 (2013).
- Wu, Z., et al. Multi-photon microscopy in cardiovascular research. Methods. 130, 79-89 (2017).
- Ramanathan, T., Skinner, H. Coronary blood flow. Continuing Education in Anaesthesia Critical Care & Pain. 5 (2), 61-64 (2005).
- Murthy, V. L., et al. Clinical Quantification of Myocardial Blood Flow Using PET: Joint Position Paper of the SNMMI Cardiovascular Council and the ASNC. Journal of Nuclear Cardiology. 25 (1), 269-297 (2018).
- Molina, D. K., DiMaio, V. J. Normal organ weights in men: Part I-the heart. The American Journal of Forensic Medicine and Pathology. 33 (4), 362-367 (2012).
- Molina, D. K., DiMaio, V. J. Normal Organ Weights in Women: Part I-The Heart. The American Journal of Forensic Medicine and Pathology. 36 (3), 176-181 (2015).
- Robertson, M. J., Dries-Devlin, J. L., Kren, S. M., Burchfield, J. S., Taylor, D. A. Optimizing cellularization of whole decellularized heart extracellular matrix. PLoS One. 9 (2), e90406 (2014).
- Robertson, M. J., Soibam, B., O'Leary, J. G., Sampaio, L. C., Taylor, D. A. Cellularization of rat liver: An in vitro model for assessing human drug metabolism and liver biology. PLoS One. 13 (1), e0191892 (2018).
- Baghalishahi, M., et al. Cardiac extracellular matrix hydrogel together with or without inducer cocktail improves human adipose tissue-derived stem cells differentiation into cardiomyocyte-like cells. Biochemical and Biophysical Research Communications. , (2018).
- Perea-Gil, I., et al. In vitro comparative study of two decellularization protocols in search of an optimal myocardial scaffold for recellularization. American Journal of Translational Research. 7 (3), 558-573 (2015).
- Freytes, D. O., O'Neill, J. D., Duan-Arnold, Y., Wrona, E. A., Vunjak-Novakovic, G. Natural cardiac extracellular matrix hydrogels for cultivation of human stem cell-derived cardiomyocytes. Methods Molecular Biology. 1181, 69-81 (2014).
- Oberwallner, B., et al. Preparation of cardiac extracellular matrix scaffolds by decellularization of human myocardium. Journal of Biomedical Materials Research Part A. 102 (9), 3263-3272 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены