A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Decellularization של הלב האנושי כולו בתוך נרתיק מווסת בכיוון הפוך
In This Article
Summary
שיטה זו מאפשרת decellularization של איבר מוצק מורכבים באמצעות פרוטוקול פשוט המבוסס על שוק אוסמוטי זלוף של יונית סבון עם הפרעה מטריצות איבר מינימלי. היא כוללת טכניקה decellularization הרומן מלב אנוש בתוך נרתיק מווסת עם ניטור בזמן אמת זרימה dynamics וסלולר יצוא פסולת.
Abstract
הפתרון האולטימטיבי עבור חולים עם אי ספיקת לב בשלב הסופי הוא ניתוח השתלה. אבל תורם לבבות מוגבלים, החיסוני נדרש, בסופו של דבר דחייה יכולה להתרחש. יצירת פונקציונלי, לב ביו-מלאכותי עצמיים יכול לפתור אתגרים אלה. Biofabrication מלב מורכבת לגרדום ותאים היא אפשרות אחת. לפיגום טבעי עם הרכב רקמות ספציפיות, כמו גם מיקרו-מאקרו-אדריכלות ניתן להשיג על ידי לבבות decellularizing של בני אדם או חיות גדולות כמו חזירים. Decellularization כרוך שוטף פסולת הסלולר תוך שימור מטריצה חוץ-תאית תלת-ממד של להערכת ומאפשר "cellularization"-timepoint מאוחר יותר. ניצול את הרומן שלנו למצוא את decellularization זלוף של איברים מורכבים אפשרי, אנחנו פיתחנו שיטה "פיזיולוגיים" יותר decellularize לבבות אנושיים שאינם שיפותחו על-ידי הצבתם בתוך נרתיק מווסת, ב הפוך כיוון, תחת לחץ מבוקר. המטרה של שימוש נרתיק בלחץ היא ליצור לחץ מעברי צבע על פני שסתום אבי העורקים שיישאר סגור ושיפור זלוף שריר הלב. הערכה בו זמנית של דינמיקת זרימת פסולת הסלולר הסרת במהלך decellularization אפשרה לנו לעקוב אחר תזרים נוזלים וגם יצוא פסולת, ובכך יוצר לפיגום שניתן המשמש לתיקון הלב פשוט (למשל ככתם או שסתום לגרדום) או בדומה לפיגום איברים שלמים.
Introduction
אי ספיקת לב מוביל תמותה גבוהה בחולים. אפשרות הטיפול האולטימטיבי עבור אי ספיקת לב בשלב הסופי הוא מאפשר-השתלת. עם זאת, יש רשימת המתנה ארוכה עבור השתלת בשל המחסור תורם איברים, חולים הפנים שלאחר השתלת hurdles שנעים בטווח שבין החיסוני חיים ארוך ל עוגב כרונית דחייה1,2. הלבבות פונקציונלי בביו-הנדסה לאכלס מחדש decellularized לבבות בגודל של האדם עם עצמו של החולה תאים יכול לעקוף מכשולים אלה3.
צעד חשוב "הנדסה" הלב הוא הקמת לפיגום עם מבנה כלי הדם ואת parenchymal המתאים, הרכב ותפקוד להנחות את היישור וארגון של תאים למשלוח. בנוכחות המסגרת המתאימה, תאים נזרע על הגרדום צריך לזהות את הסביבה ולבצע הפונקציה הצפוי כחלק האיבר הזה. לדעתנו, מטריצה חוץ-תאית איברים decellularized (dECM) כוללת את המאפיינים הדרושים של לגרדום אידיאלי.
על ידי ניצול להערכת מהותי, מורכב כולו אורגן decellularization יכולה להיות מושגת באמצעות תמיסה לשיתוק או זלוף רטרוגרדית4 כדי להסיר את מרכיבי התא תוך כדי שמירה על עדין מטריצה חוץ-תאית 3D ולהערכת2, 5,6,7. להערכת תפקודית חשוב בביו-הנדסה כל האיברים רק ויוו, חלוקת מזון, פינוי פסולת8. זלוף כלילית decellularization הוכח כיעיל ביצירת לבבות decellularized חולדות4או חזירים4,7,9,10,11 12, ,13ו בני5,7,14,15,16. ובכל זאת, שלמות של המסתמים, אטריה אזורים "דק" אחרים עלולים לסבול.
ניתן להשיג לב decellularized בגודל אדם פיגומים חזירים באמצעות הלחץ הבקרה7,9,10,11,12 או אינפוזיה תזרים קצב שליטה13, 17 מתורמים האנושי באמצעות לחץ לשלוט5,7,14,15. Decellularization לבבות אדם התורם מתרחשת במשך 4-8 ימים בלחץ נשלטת על 80-100 מ מ כספית התמצאות זקוף5,15,16 או במשך 16 ימים בלחץ נשלטת על 60 מ מ כספית14 . תחת תמיסה לשיתוק, שבשליטת הלחץ decellularization, כשירות שסתום אבי העורקים ממלא תפקיד מכריע בשמירה על יעילות זלוף כלילית ובלחץ יציב בספריית הבסיס של אבי העורקים. העבודות הקודמות שלנו גילה כי הכיוון של הלב השפעות ביעילותה זלוף כלילית במהלך ההליך decellularization ולכן שלמות לגרדום ב סוף9.
כהמשך של העבודה הקודמת שלנו9, אנחנו מציגים קונספט שבו נרתיק דמוי קרום הלב נוסף כדי לשפר את decellularization לב-שלם. אנו מתארים את decellularization של לבבות אדם הניח בתוך שקיות מווסת, בכיוון הפוך, ותחת לחץ מבוקר-120 מ מ כספית בסיס אב העורקים. פרוטוקול זה כולל ניטור פרופיל זרימה של אוסף המדיה יצוא לאורך כל ההליך decellularization כדי להעריך את יעילות זלוף כלילית והסרה פסולת תא. מבחני הביוכימי מבוצעות ואז לבחון את יעילות השיטה.
Protocol
כל הניסויים דבקה הנחיות ועדת האתיקה ממכון הלב טקסס.
1. איבר הכנה
הערה: בשיתוף פעולה עם LifeGift, ארגון הרכש איברים ללא מטרות רווח בטקסס (http://www.lifegift.org), תרם לבבות אנושיים שאינם מתאימים להשתלה שימשו למחקר בהסכמת שאושרו.
- להשיג לבבות, דרך הווריד להשרות 30,000 הפארין U לליבם. באופן מאובטח תפר בצינורית הלב באבי העורקים ולצרף קו זלוף בחוזקה. לנקב הכלילי התחתון (IVC) לפרוק את הלב הנכון. חותכים את וריד ריאתי עליון שמאל או הפרוזדור השמאלי לפרוק הצ'יימברס השמאלי של הלב.
- להשרות 1 ליטר של הלב או heparinized מלוחים. לנתח סניפים קשת אבי העורקים, הווריד הנבוב העליון (SVC), אחרים הוורידים ריאתי כדי לשחרר את הלב של כל קובץ מצורף רקמה וסקולרית או שמסביב. להטביע את הלב היטב heparinized בתמיסת קר.
- בדוק את הלב האנושי שנתרמו (הן anteriorly והן posteriorly, איור 1). מקום בלב על מגש ויבתר ולבדוק עבור כל נזק או מומים אנטומיים. אם הכבד או הריאות היו רכש עבור השתלת, הלב יכול להציג עם קצר הכלילי ו/או העדרו של שמאל פרפור הקיר האחורי.
- לבצע בדיקה פנימית פגמים אפשריים - פרוזדורים פגם במחיצה הבין-פרוזדורית (ASD), פגם במחיצה הבין-חדרית (VSD) או מום שסתום (אבי העורקים, ריאות, המסתם הדו-צניפי, התלת-צניפי).
- אם קיים פגם במחיצה הבין-פרוזדורית, לתקן אותה עם התפרים המתאים (איור 2 א, 2 ב). התיקון של פגמים במחיצה הבין-פרוזדורית נחוץ כדי לעקוב אחר ההתקדמות decellularization באמצעות מדידת עכירות יצוא עורק הריאה (PA). תיקון פגם במחיצה הבין-פרוזדורית מסיר משמאל המחלף הנכון, ומכאן, זרימה החוצה מן הרשות הפלסטינית מייצג זרימה החוצה זרימת הדם בעורק הכלילי דרך הסינוס התקף לב.
- מאתרים ומפסיקים הנבוב לכוחו של 2-0 בתפר משי (איור 2C).
- לנתח העורקים (Ao) מן הרשות המרכזית (איור דו-ממדי) עבור תעלות עוקבות.
- להוסיף מחברים, המבוסס על הקוטר של כלי השיט, (איור 3) אל אאו והרשות ולאבטח אותם בתפרים משי 2-0 (איור 4A).
- הוספת קו צינורות דרך אטריום שמאל (איור 4B) וכלפי החדר השמאלי (LV) (איור 3), שימוש באחת פתחי וריד ריאתי.
- להתחבר קו אינפוזיה המחבר ממוקמת ב- Ao ובין הקו יצוא האחד בשטחי הרשות (איור 3).
- מקם את הלב מוכן לתוך נרתיק פוליאסטר בכיוון ההפוך (הפוך).
- מקם את התיק עם הלב לתוך מיכל זלוף, סגור את המכסה (איור 4C).
- להתחבר כל אחת השורות היציאות המתאימות פקק הגומי (מבוסס על הקוטר של מיכל) ולהוסיפו ל מכסה המכולה זלוף כדי לסגור את התיק פוליאסטר (4C איור , איור 5B).
- Perfuse 1 x buffered פוספט תמיסת מלח (PBS) (136 מ"מ NaCl, מ מ 2.7 אשלגן כלורי, 10 מ מ נה2HPO4 ו- 1.8 מ מ ח'2PO4 במים מזוקקים, pH 7.4) באמצעות יציאת אינפוזיה של פקק הגומי כדי לוודא יצוא של הרשות הפלשתינית, מהקו מוכנס לתוך LV.
- השתמש זרם זה כדי לנקות את האיבר של עקבות דם להערכת שיורית. אם לא נצפית זרימה, להדק את קווי החיבור כפי שהם עשויים להיות משוחרר.
2. מערכת ההתקנה וההליך Decellularization איברים
- להרכיב את ביוריאקטור ולמקם אוריינטציה זקוף (איור 5). המערכת זלוף כוללת מחשב אישי (PC), בקר (PID) פרופורציונלי-אינטגרל-נגזרת, משאבה סחרור של אאו אינפוזיה, מגיב ביולוגי זלוף, מיכל לחץ ראש עבור LV perfusate שימור (2 ל' ליניקת בקבוק עם התחתון sidearm), ומשאבה סחרור כדי לנקז את הנוזלים העודפים מהגורם הראשי לחץ וכדי לאסוף זרימה יוצאת של אבא
- מחצה גומי, לחבר את קו אינפוזיה, קו ראש-לחץ, הרשות הפלסטינית-יצוא קו וקו ביוריאקטור המנקזים יציאות משטח ה cap גומי הממוקמת מעל ביוריאקטור זלוף (איור 5A).
- Decellularize לבבות תחת לחץ מתמיד של 120 מ מ כספית נמדד בספריית הבסיס של אבי העורקים. הלחץ הממוצע של בעירוי צריך להיות בתוך 14-18 מ מ כספית לאורך כל התהליך כולו decellularization.
- Decellularize לבבות כדלקמן: 4 שעות של hypertonic פתרון (500 מ מ NaCl), 2 h של פתרון היפוטוניק (20 מ מ NaCl), h 120 של נתרן dodecyl סולפט (1% מרחביות) פתרון, ולאחר שטיפה סופית עם 120 L של X 1 PBS (איור 6A).
- Decellularize הלבבות תחת לחץ קבוע שליטה (120 מ מ כספית). אינפוזיה קצב הזרימה לתוך אאו תלויי-הלב והוא, בממוצע, 98.06±16.22 mL/min לפתרון hypertonic, 76.14±7.90 mL/min לפתרון היפוטוניק, 151.50±5.76 mL/min עבור מרחביות, 185.24±7.10 mL/min עבור PBS. סה כ נפח נצרך כל ריאגנט הממוצע 23.36±5.70 L לפתרון hypertonic ו- 9.13±1.26 L לפתרון היפוטוניק.
- Recirculate בחיצים 60 הסופי של 1% מרחביות (1 ליטר לגרם משקל הלב) עד לסוף זלוף מרחביות. איור 6A מראה ציר זמן עבור התהליך decellularization, העלאת נקודות קצה עבור איסוף נתונים: זרימה קצב ניטור (Ao ו הרשות הפלסטינית) ואוסף יצוא (PA ו- PA) מהראש לחץ במהלך decellularization.
- מאז SVC של IVC מאתרים, סביר להניח כי כל נוזל שנאסף הרשות הפלסטינית היא התוצאה של זלוף כלילית בפועל (איור 5B). לקבוע יעילות זלוף כלילית חילוק קצב הזרימה של perfusate מתוך הרשות הפלסטינית על ידי קצב הזרימה של פתרון מוחדר ישירות לתוך אאו:
זלוף כלילית יעילות =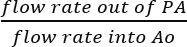 (%).
(%). - לבצע ניתוח השוואתי של perfusate שבידי הרשות הפלסטינית ואת בעירוי של פתרונות חדורים כפילויות טעינת μL 200 לאדם טוב בצלחת 96-ובכן התחתונה ברורה וקריאה ספיגת ב 280 ננומטר. הערך ספיגת, שנבחר מדעית לאחר שניסה ערכים שונים, נמצאה לתת את הטוב ביותר מנורמל ערכים.
- השתמש את עכירות של ריאגנט חדורים נקי של הפקד. עכירות של perfusate יצוא מייצג שטיפה של שאריות תאים, ניתן לכמת באופן מיידי במהלך decellularization ככלי מעקב של התהליך.
- במהלך בכביסה הסופי עם L 10 ל- 1 X PBS, להוסיף 500 מ"ל של מונטסקייה peracetic 2.1% חומצה פתרון סטרילי, שהמשרד עם NaOH 10N, מוביל לפתרון של 0.1% peracetic חומצה (v/v) ב- PBS. השתמש פתרון זה לחטא לגרדום.
3. הערכה של לבבות Decellularized
הערה: לאחר decellularization, נציג לבבות ישמש עבור מבחני הדמיה וביוכימי אנגיוגרפיה כלילית.
- לבצע צילום אנגיוגרפיה כלילית הלב האנושי נציג decellularized לבחון את intactness של להערכת כלילית. בקצרה, התמונה באמצעות פלואורוסקופ, decellularized לב האדם לאחר ההזרקה של ניגודיות סוכן דרך בצינורית ostial כלילית ב הראשי ימינה ושמאלה העורקים הכליליים.
- לנתח את הלב decellularized להשיג דגימות מאזורים 19 כדי להעריך את הנותרים חומצה deoxyribonucleic (DNA), גליקוזאמינוגליקן (איסור פרסום) ורמות מרחביות ברקמות decellularized. הסר את הבסיס של הלב על החדרים ומנתחים החדרים 4 חלקים שווים (איור 6C). לחלק כל מקטע anterior ואת אחורי החדר הימני (RV) בעירוי anterior ואת אחורי, מחצה interventricular (עירויים). הרקמה המכילה את איפקס גזור לתוך LV ואת RV לדיגום.
- חותכים דגימות רקמה עבור מבחני ה-DNA, איסור פרסום ומרחביות (~ 15 מ ג של משקל רטוב).
- לחלץ שני גדילי ה-DNA (dsDNA) על ידי דגימות של NaOH M 1 בשביל 3 h ב 65 ° C ו pH 7 באמצעות מאגר טריס-EDTA (TE) x 10 ו- 1 מ' חומצת מימן כלורי (HCl).
- לכמת dsDNA באמצעות dsDNA של ערכת Assay עם עגל בלוטת התימוס רגיל (ראה טבלה של חומרים). לקרוא דוגמאות ב שכפל באמצעות קורא microplate קרינה פלואורסצנטית (עירור 480 ננומטר, פליטה-520 ננומטר). לחשב את אחוז dsDNA שיורית בליבם decellularized על-ידי השוואת dsDNA ריכוז כל רקמה את זה ב- cadaveric (% cadaveric).
- להשיג sulfated GAGs לתוך פתרון על ידי דגימות רקמה בפתרון פפאין החילוץ (0.2 מ' מאגר סודיום פוספט עם EDTA ניתרן מלח, ציסטאין HCl, סודיום אצטט ו פפאין)-65 מעלות צלזיוס למשך 3 שעות. למדוד איסור פרסום תוכן (כפולים) באמצעות ערכת Assay גליקוזאמינוגליקן.
- Lyophilize דוגמאות עבור מרחביות assay ב מחוממת ואקום ולמדוד משקל יבש. להוסיף 200 µL של מים הנדסה גנטית כל מדגם מיובשים, homogenize כדי לחלץ את מרחביות שיורית לתוך פתרון. מערבבים שפתרון זה מרחביות כלורופורם ופתרון מתילן כחול (12 מ ג של מתילן כחול ב- 1 ליטר של 0.01 M HCl). זמנים תוססים יפריד לשכבת אורגני באמצעות קשירה לצבוע מתילן כחול.
- שימוש בקורא microplate פלורסצנטיות, לקרוא את ספיגת (655 ננומטר) של תקנים, דוגמאות כפילויות כדי לחשב זמנים תוססים שיורית. לנרמל את הערך מרחביות כ משקל יבש של רקמות.
- דגימות מאזורים עבה (קרי, LV, RV ו מחצה) של הלב האנושי עם מיקרוסקופ אופטי לא לינארית (NLOM) כדי לאשר את הסרת הסלולר לאחר decellularization. הגדרת NLOM מפורט שלנו הקודם פרסומים18,19,20. NLOM מאפשר לנו תמונה תא, אלסטין, סיבי קולגן, צולבות הקישור חוטים שרירן דרך שלה שני הפוטונים קרינה פלואורסצנטית (TPF) וערוצים הרמונית דור (SHG) השני ללא שימוש כל אקסוגניים כתם או צבע21.
תוצאות
לאחר 7 ימים decellularization עם תמיסה לשיתוק זלוף אבי העורקים תחת לחץ מתמיד של 120 מ מ כספית, הלב האנושי הפך שקוף (איור 6B). הלב היה גזור בגסות למקטעים 19 לניתוח ביוכימי (דנ א, איסור פרסום ומרחביות) (איור 6C) כדי להעריך את המוצר decellularized הסופי.
Discussion
לידע שלנו, זהו המחקר הראשון decellularization ח הפוכה של לבבות אדם בתוך נרתיק מווסת עם ניטור בצילום מואץ של קצב זרימה והסרת הלכלוך תא. נרתיק דמוי קרום הלב שומרת את הכיוון של הלב יציב לאורך כל ההליך decellularization. השוקע, היפוך את ליבם שלם בתוך נרתיק מונע התייבשות וצמצום עומס יתר על העורקים (מתוך הלב משקל) ?...
Disclosures
ד ר טיילור היא אחת המניות ב Miromatrix רפואי, inc. מערכת היחסים הזאת מנוהלת בהתאם למדיניות ניגוד עניינים על ידי אוניברסיטת מינסוטה ו מכון הלב טקסס; המחברים אחרים יש אין ניגוד אינטרסים לחשוף.
Acknowledgements
מחקר זה נתמך על ידי המענק יוסטון הקרן והקרן טקסס המתעוררים טכנולוגיה. המחברים להכיר איברים רכש סוכנות LifeGift, inc. ומשפחות של התורם עבור ביצוע מחקר זה אפשרי.
Materials
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture | Ethicon | SA85H | Suture used to ligate superior and inferior vena cava |
| 1/4" x 3/8" connector with luer | NovoSci | 332023-000 | Connect aorta and pulmonary artery |
| Masterflex platinum-cured silicone tubing | Cole-Parmer | HV-96410-16 | Tubing to connect heart chambers/veins |
| infusion and outflow line | Smiths Medical | MX452FL | For flowing solutions through the vasculature |
| Polyester pouch (Ampak 400 Series SealPAK Pouches) | Fisher scientific | 01-812-17 | Pericardium-like pouch for containing heart during decellularization |
| Snapware Square-Grip Canister | Snapware | 1022 | 1-liter Container used for perfusing heart |
| Black rubber stoppers | VWR | 59586-162 | To seal the perfusion container |
| Peristaltic pump | Harvard Apparatus | 881003 | To pump fluid through the inflow lines and to drain fluids |
| 2 L aspirator bottle with bottom sidearm | VWR | 89001-532 | For holding solutions/perfusate |
| Quant-iT PicoGreen dsDNA Assay kit | Life Technologies | P7589 | For quantifying dsDNA |
| Calf thymus standard | Sigma | D4522 | DNA standard |
| Blyscan Glycosaminoglycan Assay Kit | Biocolor Ltd | Blyscan #B1000 | GAG assay kit |
| Plate reader | Tecan | Infinite M200 Pro | For analytical assays |
| GE fluoroscopy | General Electric | OEC 9900 Elite | Angiogram |
| Visipaque | GE | 13233575 | Contrast agent |
References
- Writing Group Members. Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association. Circulation. 133 (4), 447-454 (2016).
- Zia, S., et al. Hearts beating through decellularized scaffolds: whole-organ engineering for cardiac regeneration and transplantation. Critical Reviews in Biotechnology. 36 (4), 705-715 (2016).
- Zimmermann, W. H. Strip and Dress the Human Heart. Circulation Research. 118 (1), 12-13 (2016).
- Ott, H. C., et al. Perfusion-decellularized matrix: Using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Sanchez, P. L., et al. Acellular human heart matrix: A critical step toward whole heart grafts. Biomaterials. 61, 279-289 (2015).
- Peloso, A., et al. Current achievements and future perspectives in whole-organ bioengineering. Stem Cell Research & Therapy. 6, 107 (2015).
- Guyette, J. P., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Momtahan, N., Sukavaneshvar, S., Roeder, B. L., Cook, A. D. Strategies and Processes to Decellularize and Cellularize Hearts to Generate Functional Organs and Reduce the Risk of Thrombosis. Tissue Engineering Part B-Reviews. 21 (1), 115-132 (2015).
- Lee, P. F., et al. Inverted orientation improves decellularization of whole porcine hearts. Acta Biomaterialia. , (2016).
- Momtahan, N., et al. Automation of Pressure Control Improves Whole Porcine Heart Decellularization. Tissue Eng Part C Methods. , (2015).
- Weymann, A., et al. Development and Evaluation of a Perfusion Decellularization Porcine Heart Model - Generation of 3-Dimensional Myocardial Neoscaffolds. Circulation Journal. 75 (4), 852-860 (2011).
- Weymann, A., et al. Bioartificial heart: A human-sized porcine model--the way ahead. PLoS One. 9 (11), e111591 (2014).
- Remlinger, N. T., Wearden, P. D., Gilbert, T. W. Procedure for decellularization of porcine heart by retrograde coronary perfusion. Journal of Visualized Experiments. (70), e50059 (2012).
- Guyette, J. P., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Sanchez, P. L., et al. Data from acellular human heart matrix. Data Brief. 8, 211-219 (2016).
- Garreta, E., et al. Myocardial commitment from human pluripotent stem cells: Rapid production of human heart grafts. Biomaterials. 98, 64-78 (2016).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Engineering Part C-Methods. 16 (3), 525-532 (2010).
- Larson, A. M., Yeh, A. T. Ex vivo characterization of sub-10-fs pulses. Optics Letters. 31 (11), 1681-1683 (2006).
- Lee, P. F., Yeh, A. T., Bayless, K. J. Nonlinear optical microscopy reveals invading endothelial cells anisotropically alter three-dimensional collagen matrices. Experimental Cell Research. 315 (3), 396-410 (2009).
- Lee, P. F., Bai, Y., Smith, R. L., Bayless, K. J., Yeh, A. T. Angiogenic responses are enhanced in mechanically and microscopically characterized, microbial transglutaminase crosslinked collagen matrices with increased stiffness. Acta Biomaterialia. 9 (7), 7178-7190 (2013).
- Wu, Z., et al. Multi-photon microscopy in cardiovascular research. Methods. 130, 79-89 (2017).
- Ramanathan, T., Skinner, H. Coronary blood flow. Continuing Education in Anaesthesia Critical Care & Pain. 5 (2), 61-64 (2005).
- Murthy, V. L., et al. Clinical Quantification of Myocardial Blood Flow Using PET: Joint Position Paper of the SNMMI Cardiovascular Council and the ASNC. Journal of Nuclear Cardiology. 25 (1), 269-297 (2018).
- Molina, D. K., DiMaio, V. J. Normal organ weights in men: Part I-the heart. The American Journal of Forensic Medicine and Pathology. 33 (4), 362-367 (2012).
- Molina, D. K., DiMaio, V. J. Normal Organ Weights in Women: Part I-The Heart. The American Journal of Forensic Medicine and Pathology. 36 (3), 176-181 (2015).
- Robertson, M. J., Dries-Devlin, J. L., Kren, S. M., Burchfield, J. S., Taylor, D. A. Optimizing cellularization of whole decellularized heart extracellular matrix. PLoS One. 9 (2), e90406 (2014).
- Robertson, M. J., Soibam, B., O'Leary, J. G., Sampaio, L. C., Taylor, D. A. Cellularization of rat liver: An in vitro model for assessing human drug metabolism and liver biology. PLoS One. 13 (1), e0191892 (2018).
- Baghalishahi, M., et al. Cardiac extracellular matrix hydrogel together with or without inducer cocktail improves human adipose tissue-derived stem cells differentiation into cardiomyocyte-like cells. Biochemical and Biophysical Research Communications. , (2018).
- Perea-Gil, I., et al. In vitro comparative study of two decellularization protocols in search of an optimal myocardial scaffold for recellularization. American Journal of Translational Research. 7 (3), 558-573 (2015).
- Freytes, D. O., O'Neill, J. D., Duan-Arnold, Y., Wrona, E. A., Vunjak-Novakovic, G. Natural cardiac extracellular matrix hydrogels for cultivation of human stem cell-derived cardiomyocytes. Methods Molecular Biology. 1181, 69-81 (2014).
- Oberwallner, B., et al. Preparation of cardiac extracellular matrix scaffolds by decellularization of human myocardium. Journal of Biomedical Materials Research Part A. 102 (9), 3263-3272 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved