Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Decellularization ters yönde bir basınçlı bir kese içinde bütün insan kalp
Bu Makalede
Özet
Bu yöntem, decellularization karmaşık bir solid organ ozmotik şok ve perfüzyon en az organ matris bozulma ile iyonik deterjan dayalı basit bir protokol kullanarak sağlar. Gerçek zamanlı akış dinamiği ve hücresel enkaz çıkış izleme ile basınçlı bir kese içinde insan kalpleri bir roman decellularization tekniği oluşmaktadır.
Özet
Organ nakli son aşama kalp yetmezliği olan hastalar için nihai çözümdür. Ama donör kalp sınırlıdır, immünosupresyon gereklidir ve sonuçta ret oluşabilir. Bir işlev oluşturma, otolog biyo-yapay kalp bu sorunları çözebilir. Biofabrication, iskele ve hücreleri oluşur bir kalp bir seçenektir. Doku özel kompozisyon yanı sıra mikro ve makro mimarisi ile doğal bir iskele insanlar ya da domuz gibi büyük hayvanlar tarafından decellularizing kalpler elde edilebilir. Decellularization ise 3D hücre dışı matriks ve damarlara koruyarak ve "cellularization" daha sonra bir timepoint sağlayan hücresel enkaz yıkama içerir. O perfüzyon decellularization karmaşık organları bulmak bizim romanından büyük harfe çevirmeyi mümkündür, transplantable insan kalpleri bir ters içinde basınçlı bir kese içinde yerleştirerek decellularize için daha fazla bir "fizyolojik" yöntemini geliştirdik Yönlendirme, kontrollü baskı altında. Basınçlı bir kese kullanılmasının amacı kapalı ve miyokard perfüzyon geliştirmek tutmak aort kapak arasında basınç gradyanları oluşturmaktır. Akış dinamiği ve hücresel enkaz kaldırma sırasında bize sıvı giriş akımı ve enkaz çıkış akışı izlemek izin decellularization eşzamanlı değerlendirilmesi, böylece olabilir bir iskele oluşturmak basit kardiyak onarım için kullanılan (Örneğin bir yama olarak veya Vana iskele) veya bir bütün-organ iskele olarak.
Giriş
Yüksek mortalite hastalarda kalp yetmezliği yol açar. Allo-nakli son aşama kalp yetmezliği için nihai tedavi seçeneğidir. Ancak, donör organ sıkıntısı nedeniyle nakli için uzun bir bekleme listesi ve hastalar yüz nakli sonrası ömür boyu immünosupresyon arasında değişen kronik organ ret1,2Engelli. Decellularized insan ölçekli mavi kalpler olan bir hastanın kendi kullanıma tarafından Biyomühendislik fonksiyonel kalp hücreleri bu Engelli3aşmak.
Önemli bir adım "mühendislik", uygun vasküler ve parenkimal yapısı, kompozisyon ve hizalama kılavuzunu fonksiyonu ile bir iskele oluşturulması ve organizasyon teslim edilen hücre kullanılan bir kalptir. Uygun çerçeve varlığında, iskele üzerinde seribaşı hücreleri çevreyi tanımak ve bu organ bir parçası olarak beklenen işlevi gerçekleştirmek gerekir. Bize göre ideal iskele gerekli özellikleri decellularized organ hücre dışı matriks (dECM) oluşur.
İçsel damarlara kullanarak, karmaşık bütün-organ decellularization antegrade veya hassas 3D hücre dışı matriks ve damarlara2koruyarak hücresel bileşenleri kaldırmak için retrograd perfüzyon4 üzerinden elde edilebilir, 5,6,7. Vivo, besin dağıtım ve atık kaldırma8için olduğu gibi fonksiyonel damarlara Biyomühendislik tüm organlarda sadece önemlidir. Koroner perfüzyon decellularization fareler4veya domuz4,7,9,10,11 decellularized kalpler yaratmada etkili olduğu kanıtlanmıştır ,12,13ve insanlar5,7,14,15,16. Henüz, vanalar, kulakçık ve "ince" diğer bölgeler bütünlüğünü muzdarip olabilir.
İnsan boyutunda decellularized kalp iskele basınç kontrol7,9,10,11,12 veya infüzyon akış hızı Denetim13, kullanarak domuz elde edilebilir 17 ve basınç kullanarak insan bağışçılardan5,7,14,15kontrol. İnsan donör kalplerin decellularization 4-8 gün içinde 80-100 mmHg dik yönlendirme5,15,16 ya da 16 gün boyunca 60 mmHg14 , kontrollü baskı altında kontrollü baskı altında oluşur . Antegrade altında decellularization, basınç kontrollü aort kapak yetkinlik koroner perfüzyon verimlilik ve aortik kökü sabit basınçta korumada önemli bir rol oynar. Önceki çalışmalarımız kalp yönünü decellularization yordam ve bu nedenle iskele bütünlük içinde son9sırasında koroner perfüzyon verimliliğini etkiler ortaya koydu.
Bizim önceki iş9devamı olarak, biz bütün-kalp decellularization geliştirmek için bir kalp zarını benzeri kese onda eklendi bir roman kavramı tanıtmak. Biz ters odaklı, basınçlı torbalar içinde ve aortik kök 120 mmHg, kontrollü baskı altında yerleştirilen insan gönül decellularization açıklar. Bu iletişim kuralı akışı profil ve koroner perfüzyon verimliliği ve hücre enkaz kaldırma değerlendirmek için decellularization yordam boyunca dışa akış ortamlarının topluluğu izleme içerir. Biyokimyasal deneyleri sonra yönteminin etkinliğini test etmek için gerçekleştirilir.
Protokol
Tüm deneyler Etik Komitesi yönergelere Teksas Kalp Enstitüsü'nden yapıştırılır.
1. organ hazırlık
Not: LifeGift, Texas (http://www.lifegift.org), kar amacı gütmeyen organ tedarik organizasyon ile işbirliği hibe insan kalp nakli için uygun değildir araştırma onaylı izni ile kullanılmaya başlanmıştır.
- Kalpler temin etmek, intravenöz kalpleri için 30.000 U heparin süzülür. Güvenli bir şekilde aort Minikardiyopleji yöntemi kanül dikiş ve bir klempe perfüzyon çizgi ekleyin. İnferior vena kava (sağ kalbe boşaltmaya IVC) sorgulamaktı. Sol üst pulmoner ven veya kalbin sol Odalar havalandırma için sol atriyal apendiks keser.
- Minikardiyopleji yöntemi veya heparinized tuz 1 litre süzülür. Aort şubeleri, üstün vena kava (SVC) ve vasküler veya çevreleyen doku ekleri yürekten serbest bırakmak için diğer pulmoner damarlar incelemek. Buzlu tuzlu çözüm iyi heparinized kalbinde daldırın.
- Bağışlanan insan kalbi inceleyin (anteriorly ve özafagusu, Şekil 1). Kalp parçalanmış bir tepsiye yerleştirin ve herhangi bir yapısal hasar veya anatomik malformasyonlar için orijinal olup. Eğer karaciğer ve/veya akciğer nakli için tedarik, kalp bir kısa inferior vena kava ve/veya sol atriyal posterior duvar yokluğu ile takdim edebilir miyim?
- İç kontrol için olası hataları - atriyal septal defekt (ASD), ventriküler septal defekt (VSD) veya vana (aort, akciğer, mitral, triküspit) malformasyonu edin.
- Septal defekt varsa, uygun dikiş (Şekil 2A, 2B) ile düzeltin. Septal defektlerde düzeltilmesi ile pulmoner arter (PA) çıkış bulanıklık ölçüm decellularization ilerlemesini izlemek için gereklidir. Sola doğru şant septal defekt düzeltilmesi kaldırır, dolayısıyla, PA çıkım temsil eder çıkış koroner dolaşım koroner sinüs yoluyla gelen.
- Superior ve inferior vena kava 2-0 ipek sütür (Şekil 2C) ile ligate.
- Aort (Ao) sonraki cannulation için ana PA (Şekil 2B) uzak incelemek.
- Bağlayıcılar, Ao ve PA gemi (Şekil 3) çapı göre eklemek ve onları ile 2-0 ipek sütür (Şekil 4A) güvenli.
- Pulmoner ven deliklerini birini kullanarak bir boru hattı (Şekil 4B) sol atrium ve sol ventrikül (LV) (Şekil 3), doğru yerleştirin.
- Bir infüzyon hattı Ao ve PA (Şekil 3) bir çıkış hattına yerleştirilen konektörüne bağlayın.
- Hazırlanan kalp (ters) ters yönde polyester bir kese içine koyun.
- Kalp ile kese bir perfüzyon konteyner içine yerleştirin ve kapağı (Şekil 4 c) kapatın.
- Her satır (kapsayıcı çapı göre) kauçuk tıpa ilgili bağlantı noktalarına bağlanmak ve polyester kese (Şekil 4 c ve Şekil 5B) imzalamaya perfüzyon konteyner kapağı takın.
- 1 x tamponlanmış fosfat serum (PBS) (136 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4 ve 1.8 mM KH2PO4 ' te distile su, pH 7,4) çıkış PA ve satırından doğrulamak için kauçuk tıpa infüzyon portundan sıvı LV. eklenen
- Bu akış damarlara kan herhangi bir kalıntı izleri organı temizlemek için kullanın. Akış gözlem değil yapılırsa, gevşek olarak bağlantı çizgileri sıkın.
2. sistem kurulumu ve Organ Decellularization yordamı
- Biyoreaktör montaj ve bir dik yönde (Şekil 5) yerleştirin. Perfüzyon sistemi içerir bir kişisel bilgisayar (PC), oransal-integral-türev (PID) denetleyicisi, Ao infüzyon için peristaltik pompa, perfüzyon biyoreaktör, LV perfusate saklama (2L aspiratör şişeyle alt basınç baş kapsayıcısı Tabancan) ve peristaltik pompa basınç baş konteyner üzerinden fazla sıvıyı ve çıkış PA toplamak için
- Kauçuk septum perfüzyon biyoreaktör (Şekil 5A) üstüne yerleştirilmiş kauçuk kapak yüzey bağlantı noktalarına infüzyon çizgi, basınç-kafa çizgi, PA-çıkış hattı ve biyoreaktör drenaj hattı bağlayın.
- Kalpler 120 mmHg aort kökünde ölçülen sürekli baskı altında decellularize. Ortalama basınç LV 14-18 mmHg bütün decellularization sürecinde içinde olmalıdır.
- Kalpler aşağıdaki gibi decellularize: hipertonik çözüm (500 mM NaCl), Hipotonik çözüm (20 mM NaCl), Sodyum Lauryl Sülfat (%1 SDS) çözüm, 120 h 2 h 4 h ve son yıkama 1 X PBS (Şekil 6A) 120 L ile.
- Kalpler sabit basınç kontrol (120 mmHg) altında decellularize. İnfüzyon akış hızı Ao içine kalp bağımlı olup, ortalama olarak, 98.06±16.22 mL/dk'ya hipertonik çözüm, 76.14±7.90 mL/dk'ya hipotonik eriyik, 151.50±5.76 mL/dk'ya SDS ve 185.24±7.10 mL/dk'ya PBS. Her reaktif tüketilen toplam hacmi hipertonik çözüm için 23.36±5.70 L ve 9.13±1.26 L hipotonik eriyik için ortalamasını alır.
- % 1 SDS (kalp ağırlığının gram başına 1 L) son 60 L SDS perfüzyon sonuna kadar recirculate. Şekil 6A gösterir zaman çizelgesi decellularization işlemi için veri toplama için bitiş noktalarını alabilme: akış hızı (Ao ve PA) izleme ve çıkış koleksiyonundan (PA ve sigara-PA) baskı kafası decellularization sırasında.
- SVC ve IVC bakmaksızın, varsaymak makul çünkü tüm sıvı PA toplanan gerçek koroner perfüzyon (Şekil 5B) sonucudur. Koroner perfüzyon verimliliği doğrudan perfusate PA dışarı akış hızı tarafından infüzyon çözüm akış hızı Ao bölerek belirleyin:
Koroner perfüzyon verimliliği =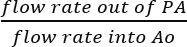 (%).
(%). - PA ve LV ve yinelenen infüzyon çözümlerinde açık alt 96-şey plaka bir kuyu başına 200 μL yükleme ve 280 absorbans okuyarak elde perfusate karşılaştırmalı analizi gerçekleştirmek nm. Ampirik olarak farklı değerler, denedikten sonra seçilen absorbans değeri en iyi vermek için değerleri normalleştirilmiş bulundu.
- Temiz infüzyon reaktif bulanıklık denetimi olarak kullanın. Çıkış perfusate bulanıklık hücre artıkları fiyasko temsil eder ve anında decellularization sırasında işlem izleme aracı olarak sayılabilir.
- 1 X PBS 10 L ile son yıkama sırasında 500 mL %0,1 Perasetik asit çözeltilerine (v/v) PBS önde gelen 10N NaOH ile etkisiz hale steril etkisiz % 2.1 Perasetik asit çözeltisi, ekleyin. Bu çözüm iskele sterilize etmek için kullanın.
3. Decellularized kalpler değerlendirilmesi
Not: decellularization sonra temsilcisi kalp koroner anjiyo görüntüleme ve biyokimyasal testleri için kullanılır.
- Koroner anjiyografi koroner damarlara intactness incelemek için temsilcisi decellularized insan kalbinin gerçekleştirin. Kısaca, bir fluoroskop kullanarak, görüntü insan kalbi enjeksiyon kontrast ajanın ana sağ ve sol koroner arterler koroner ostial kanül aracılığıyla sonra decellularized.
- Kalan Deoksiribonükleik asit (DNA), glikozaminoglikan (GAG) ve SDS düzeyleri decellularized dokularda değerlendirmek için 19 alanları örnekleri almak için decellularized kalp incelemek. Tabanı kalbin ventrikül kaldırın ve ventrikül 4 eşit bölüme (Şekil 6C) incelemek. Her bölümün anterior ve posteiror sağ ventrikül (RV), anterior ve posteiror LV ve interventricular septum (serum) bölün. Tepe içeren doku içine belgili tanımlık LV ve RV örnekleme için kesmiştim.
- Doku örneği DNA, GAG ve SDS deneyleri (~ 15 mg ıslak ağırlık) için kesti.
- 3 h 65 ° c için 1 M NaOH örneklerinde sindirerek tarafından çift iplikçikli DNA (dsDNA) ayıklamak ve pH 7-10 x Tris-EDTA (TE) tampon ve 1 M hidroklorik asit (HCl) kullanımı için ayarlayın.
- Bir buzağı timus standart bir dsDNA tahlil seti kullanarak dsDNA ölçmek ( Tablo malzemelerigörmek). Bir Floresan Mikroplaka Okuyucu kullanarak yinelenen örnekleri okumak (uyarma 480 nm ve emisyon, 520 nm). Kadavra (% kadavra) o her dokusunda dsDNA konsantrasyon karşılaştırarak decellularized kalplerinde kalan dsDNA yüzdesini hesaplamak.
- Sülfürlü GAGs doku örnekleri bir çözümde papain ayıklama (EDTA disodyum tuz, sistein HCl ile 0.2 M sodyum fosfat tampon, sodyum asetat ve papain) 65 ° C'de 3 saat sindirerek tarafından çözüm elde edilir. GAG içeriğinde (yinelenen) glikozaminoglikan tahlil Kit kullanarak ölçün.
- SDS tahlil içinde ısıtmalı bir vakum ve ölçü Kuru ağırlık için örnekleri lyophilize. Kurutulmuş örnekleri 200 µL ultrasaf su ekleyin ve kalan SDS çözümde ayıklamak için homojenize. Bu SDS Çözüm kloroform ve metilen mavisi çözüm (metilen mavisi 0.01 M HCL 1 L 12 mg) karıştırın. SDS metilen mavisi boya bağlama yaparak organik katmanda ayrı olacak.
- Bir Floresan Mikroplaka Okuyucu kullanılarak okunan absorbans (655 nm) standartları ve kalan SDS hesaplamak için yinelenen örnekleri. Bu doku Kuru ağırlık SDS değerine normalleştirmek.
- Örnek bölgelerinden kalın (Yani, LV, RV ve septum) decellularization sonra hücresel kaldırma işlemini onaylamak için doğrusal olmayan optik mikroskobu (NLOM) ile insan kalbi. NLOM kurulum bizim önceki yayınları18,19,20içinde detaylı. NLOM bize görüntü hücre, elastin, kollajen ve myosin lifleri onun iki fotonlu Floresan (TPF) ve ikinci harmonik üretimi (SHG) kanalları aracılığıyla herhangi bir eksojen leke veya boya21kullanmadan sağlar.
Sonuçlar
120 mmHg, sürekli baskı altında antegrade aort perfüzyon ile 7 gün decellularization sonra insan kalbi yarı saydam (Şekil 6B) döndü. Kalp fena halde biyokimyasal (DNA, GAG ve SDS) Analizi (Şekil 6Cson decellularized ürün değerlendirmek için) için 19 bölümlere disseke.
Decellularization süreci boyunca infüzyon debisi basınç çeşitli farklı çözüm...
Tartışmalar
Bilgimizi, akış hızı ve hücre enkaz kaldırma zaman hata izleme ile ters rapor decellularization basınçlı bir kese içinde insan gönül için ilk çalışmadır. Kalp zarını benzeri kese kalp yönünü decellularization yordam sabit tutar. Batış ve tüm kalpleri bir kese içinde ters çevirme dehidratasyon engeller ve aort (dan kalp ağırlık) üzerinde aşırı yük ne zaman en aza indirir geleneksel dik Langendorff perfüzyon decellularization Yöntem9' a göre. Bu, sırayla, aort ...
Açıklamalar
Doktor Taylor kurucusu ve Miromatrix tıp, Inc hissedar. Bu ilişki çatışması ilkelerine uygun olarak Minnesota Üniversitesi ve Teksas Kalp Enstitüsü tarafından yönetilmektedir; diğer yazarlar hiçbir ifşa etmek çıkar çatışması var.
Teşekkürler
Bu araştırma Houston bağış hibe ve Texas gelişmekte olan teknoloji Fonu tarafından desteklenmiştir. Organ tedarik ajansı yazarlar kabul LifeGift, Inc. ve vericinin aileler bu çalışma mümkün yapmak için.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture | Ethicon | SA85H | Suture used to ligate superior and inferior vena cava |
| 1/4" x 3/8" connector with luer | NovoSci | 332023-000 | Connect aorta and pulmonary artery |
| Masterflex platinum-cured silicone tubing | Cole-Parmer | HV-96410-16 | Tubing to connect heart chambers/veins |
| infusion and outflow line | Smiths Medical | MX452FL | For flowing solutions through the vasculature |
| Polyester pouch (Ampak 400 Series SealPAK Pouches) | Fisher scientific | 01-812-17 | Pericardium-like pouch for containing heart during decellularization |
| Snapware Square-Grip Canister | Snapware | 1022 | 1-liter Container used for perfusing heart |
| Black rubber stoppers | VWR | 59586-162 | To seal the perfusion container |
| Peristaltic pump | Harvard Apparatus | 881003 | To pump fluid through the inflow lines and to drain fluids |
| 2 L aspirator bottle with bottom sidearm | VWR | 89001-532 | For holding solutions/perfusate |
| Quant-iT PicoGreen dsDNA Assay kit | Life Technologies | P7589 | For quantifying dsDNA |
| Calf thymus standard | Sigma | D4522 | DNA standard |
| Blyscan Glycosaminoglycan Assay Kit | Biocolor Ltd | Blyscan #B1000 | GAG assay kit |
| Plate reader | Tecan | Infinite M200 Pro | For analytical assays |
| GE fluoroscopy | General Electric | OEC 9900 Elite | Angiogram |
| Visipaque | GE | 13233575 | Contrast agent |
Referanslar
- Writing Group Members. Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association. Circulation. 133 (4), 447-454 (2016).
- Zia, S., et al. Hearts beating through decellularized scaffolds: whole-organ engineering for cardiac regeneration and transplantation. Critical Reviews in Biotechnology. 36 (4), 705-715 (2016).
- Zimmermann, W. H. Strip and Dress the Human Heart. Circulation Research. 118 (1), 12-13 (2016).
- Ott, H. C., et al. Perfusion-decellularized matrix: Using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Sanchez, P. L., et al. Acellular human heart matrix: A critical step toward whole heart grafts. Biomaterials. 61, 279-289 (2015).
- Peloso, A., et al. Current achievements and future perspectives in whole-organ bioengineering. Stem Cell Research & Therapy. 6, 107 (2015).
- Guyette, J. P., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Momtahan, N., Sukavaneshvar, S., Roeder, B. L., Cook, A. D. Strategies and Processes to Decellularize and Cellularize Hearts to Generate Functional Organs and Reduce the Risk of Thrombosis. Tissue Engineering Part B-Reviews. 21 (1), 115-132 (2015).
- Lee, P. F., et al. Inverted orientation improves decellularization of whole porcine hearts. Acta Biomaterialia. , (2016).
- Momtahan, N., et al. Automation of Pressure Control Improves Whole Porcine Heart Decellularization. Tissue Eng Part C Methods. , (2015).
- Weymann, A., et al. Development and Evaluation of a Perfusion Decellularization Porcine Heart Model - Generation of 3-Dimensional Myocardial Neoscaffolds. Circulation Journal. 75 (4), 852-860 (2011).
- Weymann, A., et al. Bioartificial heart: A human-sized porcine model--the way ahead. PLoS One. 9 (11), e111591 (2014).
- Remlinger, N. T., Wearden, P. D., Gilbert, T. W. Procedure for decellularization of porcine heart by retrograde coronary perfusion. Journal of Visualized Experiments. (70), e50059 (2012).
- Guyette, J. P., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Sanchez, P. L., et al. Data from acellular human heart matrix. Data Brief. 8, 211-219 (2016).
- Garreta, E., et al. Myocardial commitment from human pluripotent stem cells: Rapid production of human heart grafts. Biomaterials. 98, 64-78 (2016).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Engineering Part C-Methods. 16 (3), 525-532 (2010).
- Larson, A. M., Yeh, A. T. Ex vivo characterization of sub-10-fs pulses. Optics Letters. 31 (11), 1681-1683 (2006).
- Lee, P. F., Yeh, A. T., Bayless, K. J. Nonlinear optical microscopy reveals invading endothelial cells anisotropically alter three-dimensional collagen matrices. Experimental Cell Research. 315 (3), 396-410 (2009).
- Lee, P. F., Bai, Y., Smith, R. L., Bayless, K. J., Yeh, A. T. Angiogenic responses are enhanced in mechanically and microscopically characterized, microbial transglutaminase crosslinked collagen matrices with increased stiffness. Acta Biomaterialia. 9 (7), 7178-7190 (2013).
- Wu, Z., et al. Multi-photon microscopy in cardiovascular research. Methods. 130, 79-89 (2017).
- Ramanathan, T., Skinner, H. Coronary blood flow. Continuing Education in Anaesthesia Critical Care & Pain. 5 (2), 61-64 (2005).
- Murthy, V. L., et al. Clinical Quantification of Myocardial Blood Flow Using PET: Joint Position Paper of the SNMMI Cardiovascular Council and the ASNC. Journal of Nuclear Cardiology. 25 (1), 269-297 (2018).
- Molina, D. K., DiMaio, V. J. Normal organ weights in men: Part I-the heart. The American Journal of Forensic Medicine and Pathology. 33 (4), 362-367 (2012).
- Molina, D. K., DiMaio, V. J. Normal Organ Weights in Women: Part I-The Heart. The American Journal of Forensic Medicine and Pathology. 36 (3), 176-181 (2015).
- Robertson, M. J., Dries-Devlin, J. L., Kren, S. M., Burchfield, J. S., Taylor, D. A. Optimizing cellularization of whole decellularized heart extracellular matrix. PLoS One. 9 (2), e90406 (2014).
- Robertson, M. J., Soibam, B., O'Leary, J. G., Sampaio, L. C., Taylor, D. A. Cellularization of rat liver: An in vitro model for assessing human drug metabolism and liver biology. PLoS One. 13 (1), e0191892 (2018).
- Baghalishahi, M., et al. Cardiac extracellular matrix hydrogel together with or without inducer cocktail improves human adipose tissue-derived stem cells differentiation into cardiomyocyte-like cells. Biochemical and Biophysical Research Communications. , (2018).
- Perea-Gil, I., et al. In vitro comparative study of two decellularization protocols in search of an optimal myocardial scaffold for recellularization. American Journal of Translational Research. 7 (3), 558-573 (2015).
- Freytes, D. O., O'Neill, J. D., Duan-Arnold, Y., Wrona, E. A., Vunjak-Novakovic, G. Natural cardiac extracellular matrix hydrogels for cultivation of human stem cell-derived cardiomyocytes. Methods Molecular Biology. 1181, 69-81 (2014).
- Oberwallner, B., et al. Preparation of cardiac extracellular matrix scaffolds by decellularization of human myocardium. Journal of Biomedical Materials Research Part A. 102 (9), 3263-3272 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır