Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Descelularización de todo humano corazón dentro de una bolsa presurizada en una orientación invertida
En este artículo
Resumen
Este método permite la descelularización de un órgano sólido complejo utilizando un protocolo simple basado en choque osmótico y perfusión de detergente iónico con una interrupción mínima del órgano matriz. Se compone de una técnica de descelularización novela para los corazones humanos dentro de una bolsa presurizada con monitoreo en tiempo real de flujo dinámica y celulares residuos de la salida.
Resumen
La solución definitiva para pacientes con insuficiencia cardiaca de fase final es el trasplante de órganos. Pero corazones de donantes son limitados, inmunosupresión es necesaria y en última instancia puede ocurrir rechazo. Creación de un funcional, corazón bio-artificial autóloga podría resolver estos desafíos. Biofabrication de un corazón de andamio y de las células es una opción. Un andamio natural con composición de tejidos específicos así como micro y macro arquitectura puede obtenerse por decellularizing corazones de seres humanos o animales grandes, como cerdos. Descelularización consiste en lavar los desechos celulares mientras preserva vasculatura y 3D de la matriz extracelular y permitir que "cellularization" en un punto más adelante. Capitalizando nuestra novela encontrar eso descelularización de perfusión de órganos complejos es posible, se desarrolló un método más "fisiológica" para decellularize no transplantable corazones humanos colocándolos dentro de una bolsa a presión, en un invertido orientación, bajo presión controlada. El propósito de usar una bolsa presurizada es crear gradientes de presión a través de la válvula aórtica para mantenerlo cerrado y mejorar la perfusión miocárdica. Evaluación simultánea de la dinámica del flujo y la eliminación de detritos celulares durante la descelularización permitida monitorear flujo líquido y flujo de escombros, generando un andamio que puede ser utilizado tanto para la simple reparación cardiaca (por ejemplo, como un parche o andamio de la válvula) o como un andamio de todo órgano.
Introducción
Insuficiencia cardíaca provoca alta mortalidad en los pacientes. La opción de tratamiento definitivo por insuficiencia de la fase final es el trasplante de allo. Sin embargo, hay una larga lista de espera para el trasplante debido a la escasez de donantes de órganos y pacientes cara poste-trasplante obstáculos que van desde inmunosupresión de por vida a rechazo crónico de órgano1,2. Corazones funcionales Bioingeniería por repoblación decellularized corazones de tamaño humano con un paciente células podrían eludir estos obstáculos3.
Un paso importante en la "ingeniería" un corazón es la creación de un andamio con adecuada estructura vascular y parenquimatosa, composición y función para guiar la alineación y organización de las células entregadas. En presencia del marco adecuado, las células sembradas en el andamio deben reconocer el entorno y realizan la función esperada como parte de ese órgano. En nuestra opinión, matriz extracelular decellularized órgano (dECM) comprende las características necesarias del andamio ideal.
Mediante la utilización de vasculatura intrínseca, complejo descelularización de todo órgano puede lograrse vía anterógrada o retrógrada perfusión4 quitar componentes celulares conservando el delicado 3D matriz extracelular y la vasculatura2, 5,6,7. Una vasculatura funcional es importante en órganos enteros de Bioingeniería justo como es en vivo, para la distribución de nutrientes y eliminación de residuos8. Descelularización de perfusión coronaria ha demostrado para ser eficaz en la creación de decellularized corazones de ratas4o cerdos4,7,9,10,11 ,12,13y los humanos5,7,14,15,16. Sin embargo, puede sufrir integridad de las válvulas, aurículas y otras regiones "finas".
Corazón decellularized tamaño andamios pueden obtenerse en cerdos usando presión control7,9,10,11,12 o infusión flujo tasa control13, 17 y control de donantes humanos ejerciendo una presión de5,7,14,15. Descelularización de corazón de donante humano ocurre durante 4-8 días bajo presión controlada en 80-100 mmHg en orientación vertical5,15,16 o más de 16 días bajo presión controlada en 60 mmHg14 . Bajo anterógrado, descelularización de presión controlada, la competencia de la válvula aórtica desempeña un papel crucial en el mantenimiento de la eficacia de la perfusión coronaria y presión estable en la raíz aórtica. Nuestro trabajo anterior reveló que la orientación del corazón influye en su eficacia de la perfusión coronaria durante el procedimiento de descelularización y por lo tanto la integridad del andamio en el final9.
Como continuación de nuestro anterior trabajo9, introducimos un nuevo concepto en donde se agrega una bolsa pericardio-como mejorar la descelularización de todo corazón. Describimos la descelularización de corazones humanos colocados dentro de bolsas a presión, inversamente orientadas y bajo presión controlada a 120 mmHg en la raíz aórtica. Este protocolo incluye el monitoreo del perfil de flujo y colección de los medios de salida durante el procedimiento de descelularización para evaluar la eficacia de la perfusión coronaria y eliminación de desechos celulares. Luego se realizan ensayos bioquímicos para comprobar la eficacia del método.
Protocolo
Todos los experimentos se adhirieron a las directrices del Comité de ética del Instituto del corazón de Texas.
1. el órgano preparación
Nota: En colaboración con LifeGift, una organización de compras de órgano sin fines de lucro en Texas (http://www.lifegift.org), donada los corazones humanos no apto para trasplante fueron utilizados para investigación con consentimiento aprobado.
- Para obtener corazones, infundir por vía intravenosa 30.000 heparina U a los corazones. Bien cardioplejía cánula en la aorta de sutura y fijar una línea de perfusión afianzada con abrazadera. Perforar la vena cava inferior (IVC) para ventilar el corazón derecho. Cortar la vena pulmonar superior izquierda o en la orejuela izquierda para ventilar la cámara izquierda del corazón.
- Infundir 1 L de cardioplejía o solución salina heparinizada. Disecar ramas del arco aórtico, vena cava superior (SVC) y otras venas pulmonares para liberar el corazón de cualquier accesorio de tejido vascular o alrededores. Sumerja el corazón bien heparinizado en solución salina helada.
- Inspeccione el corazón humano donado (anterior y posterior, figura 1). Coloque el corazón en una bandeja de disección e inspeccione por daños estructurales o malformaciones anatómicas. Si el hígado o los pulmones fueron procurados para el trasplante, el corazón puede presentar con un corta vena cava inferior o la ausencia de la pared posterior auricular izquierda.
- Realizar una inspección interna por posibles defectos - comunicación interauricular (CIA), interventricular (CIV) o malformación de la válvula (aórtica, pulmonar, mitral, tricúspide).
- Si existe un defecto septal, corríjalo con suturas apropiadas (figura 2A, 2B). La corrección de defectos septales es necesario para monitorear el progreso de la descelularización mediante medición de turbiedad de salida de la arteria pulmonar (PA). Quita la corrección del defecto septal izquierda a la desviación derecha, por lo tanto, la salida de PA representa la salida de la circulación coronaria a través del seno coronario.
- Liga superior e inferior de la vena cava con sutura de seda 2-0 (figura 2).
- Disecar la aorta (Ao) del PA principal (Figura 2D) para la posterior canulación.
- Inserte los conectores, basados en el diámetro del vaso, (figura 3) en Ao y PA y fijar con suturas de seda 2-0 (Figura 4A).
- Insertar una línea de tubería a través de la aurícula izquierda (Figura 4B) y hacia el ventrículo izquierdo (LV) (figura 3), utilizando uno de los orificios de la vena pulmonar.
- Conectar una línea de infusión conector en el Ao y la línea de salida a la del PA (figura 3).
- Coloque el corazón preparado en una bolsa de poliéster en orientación invertida (boca abajo).
- Coloque la bolsa con el corazón en un recipiente de perfusión y cierre la tapa (figura 4).
- Cada una de las líneas conecta a los puertos correspondientes en el tapón de goma (basado en el diámetro del envase) e insértela en la tapa del contenedor de la perfusión para sellar la bolsa poliester (figura 4 y figura 5B).
- Tamponada fosfato salino (PBS) (136 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4 y 1,8 mM KH2PO4 en agua destilada, pH 7,4) del x 1 vía el puerto de infusión el tapón de goma para verificar la salida del PA y de la línea de perfusión insertado en LV.
- Utilice este flujo para limpiar el órgano de cualquier residuos de sangre en la vasculatura. Si no se observa flujo, ajuste las líneas de conexión que sean sueltos.
2. sistema y procedimiento de la descelularización de órgano
- Montar el biorreactor y en una orientación vertical (figura 5). El sistema de perfusión incluye un ordenador personal (PC), regulador del proporcional-integral-derivado (PID), una bomba peristáltica de infusión del Ao, un biorreactor de perfusión, un depósito presurizado de cabeza para la retención de la solución de LV (frasco de aspirador de 2L con fondo mano) y una bomba peristáltica para drenar el exceso de líquido del recipiente de presión principal y para recoger la salida de PA
- En la membrana de goma, conecte la línea de infusión, línea de la cabeza de la presión, PA-salida y línea de drenaje biorreactor a los puertos de superficie de tapón de goma colocados en la parte superior del biorreactor de perfusión (figura 5A).
- Decellularize corazones bajo la constante presión de 120 mmHg, medida a la raíz aórtica. La presión media del LV debe ser dentro de 14-18 mmHg durante todo el proceso de descelularización todo.
- Decellularize corazones como sigue: 4 h de la solución hipertónica (500 mM de NaCl), 2 h de una solución hipotónica (20 mM de NaCl), 120 h de sodio dodecil sulfato (SDS 1%) en solución y un lavado final con 120 L de 1 X PBS (figura 6A).
- Decellularize los corazones bajo el control de presión constante (120 mmHg). Tasa de flujo de infusión en Ao depende del corazón y es, en promedio, 98.06±16.22 mL/min de solución hipertónica, 76.14±7.90 mL/min de una solución hipotónica, 151.50±5.76 mL/min para SDS y 185.24±7.10 mL/min para PBS. El volumen total consumido de cada reactivo es de 23.36±5.70 L de solución hipertónica y 9.13±1.26 L de una solución hipotónica.
- Recircular el final 60 L de SDS 1% (1 L por gramo de peso del corazón) hasta el final de la perfusión de la SDS. La figura 6A muestra un cronograma para el proceso de descelularización, obtención de puntos finales para la recolección de datos: flujo tasa de monitoreo (Ao y PA) y la colección salida (PA y PA no) de la cabeza de presión durante la descelularización.
- Puesto que el SVC y la vena cava inferior se unen, es razonable asumir que todo el líquido Obtenido de la Autoridad Palestina es el resultado de la perfusión coronaria real (figura 5B). Determinar la eficacia de la perfusión coronaria dividiendo directamente el flujo de la solución del PA por el caudal de solución infundida en Ao:
Eficacia de la perfusión coronaria =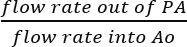 (%).
(%). - Realizar análisis comparativo de la solución obtenida del PA y el LV y las soluciones infundidas por duplicado por carga 200 μL por pozo en una placa de 96 pocillos de fondo claro y la lectura de absorbancia a 280 nm. El valor de absorbancia, seleccionado empíricamente después de probar diferentes valores, se encontró dar mejor normalizaron los valores.
- Usar la turbiedad de reactivo limpio infundido como el control. La turbidez de la solución de salida representa el lavado de restos celulares y puede ser cuantificada al instante durante la descelularización como una herramienta de seguimiento del proceso.
- Durante el lavado final con 10 L de 1 X PBS, agregar 500 mL de estéril neutralizado 2,1% peracético solución de ácido neutralizada con NaOH 10N, conduce a una solución ácida (v/v) de 0.1% peracético en PBS. Use esta solución para esterilizar el andamio.
3. evaluación de corazones Decellularized
Nota: Después de descelularización, representante de corazones se utilizará para los análisis de proyección de imagen y bioquímicos angiograma coronario.
- Realizar angiografía coronaria del corazón humano decellularized representante para examinar la integridad de la vasculatura coronaria. Brevemente, utilizando un fluoroscopio, imagen decellularized corazón humano después de la inyección de medio de contraste a través de la cánula ostiaria coronaria en las principales arterias coronarias derecha e izquierdas.
- Diseccionar el corazón decellularized para obtener muestras de 19 áreas para evaluar las restantes ácido desoxirribonucleico (ADN), glicosaminoglicano (GAG) y niveles de SDS en los tejidos decellularized. Retire la base del corazón de ventrículos y diseccionar los ventrículos en 4 partes iguales (figura 6). Dividir cada sección en el ventrículo derecho anterior y posterior (RV), el LV anterior y posterior y el tabique interventricular (IVS). El tejido que contiene el ápice es disecado en la LV y la RV para el muestreo.
- Cortar muestras de tejido para análisis de ADN, mordaza y SDS (~ 15 mg de peso húmedo).
- Extracto de ADN bicatenario (dsDNA) por extracción de muestras en 1 M NaOH por 3 h a 65 ° C y ajustar pH a 7 con 10 x de buffer Tris-EDTA (TE) y 1 M de ácido clorhídrico (HCl).
- Cuantificar dsDNA utilizando un dsDNA kit de ensayo con un timo de becerro estándar (véase Tabla de materiales). Leer las muestras por duplicado utilizando un lector de microplacas de fluorescencia (excitación a 480 nm y emisión a 520 nm). Calcular el porcentaje de dsDNA residual en los corazones decellularized comparando la concentración de dsDNA en cada tejido cadavérico (% cadavérico).
- Obtener GAGs sulfatados en solución por extracción de muestras de tejido en una solución de extracción de la papaína (tampón de fosfato de sodio de 0,2 M con cisteína, sal disódica de EDTA ácido clorhídrico, acetato de sodio y papaína) a 65 ° C durante 3 horas. Medir el contenido GAG (por duplicado) mediante el uso de un Kit de análisis de glicosaminoglicanos.
- Liofilizar muestras para análisis de SDS en un caliente vacío y medida de peso seco. Añadir 200 μL de agua ultrapura para cada muestra seca y homogeneizar para extraer el SDS residual en la solución. Mezcle esta solución de SDS a cloroformo y una solución de azul de metileno (12 mg de azul de metileno en 1 L de 0.01 M HCl). El SDS se separará en la capa orgánica por Unión al tinte de azul de metileno.
- Usando un lector de microplacas de fluorescencia, leer la absorbancia (655 nm) de los estándares y las muestras por duplicado para el cálculo de la SDS residual. Normalizar este valor SDS para peso seco de tejido.
- Muestras de regiones gruesas (es decir, del LV, RV y tabique) del corazón humano con la microscopía óptica no lineal (NLOM) para confirmar la eliminación celular después de descelularización en imagen. La configuración NLOM se detalla en nuestras anteriores publicaciones18,19,20. NLOM nos permite imagen célula, elastina, colágeno y miosina de las fibras por su fluorescencia de dos fotones (TPF) y segundo canales de generación armónico (SHG) sin utilizar cualquier mancha o tinte exógeno21.
Resultados
Tras una descelularización de 7 días con perfusión aórtica anterógrada bajo constante presión de 120 mmHg, el corazón humano volvió translúcida (Figura 6B). El corazón fue disecado groseramente en 19 secciones para el análisis bioquímico (ADN, mordaza y SDS) (figura 6) para evaluar el producto final decellularized.
Durante el proceso de descelularización, t...
Discusión
A nuestro conocimiento, éste es el primer estudio a descelularización Informe invertida del corazón humano dentro de una bolsa presurizada con control Time-lapse del retiro de escombros célula y tasa de flujo. La bolsa de pericardio-como mantiene la orientación del corazón estable durante todo el procedimiento de descelularización. Sumergir los corazones todo dentro de una bolsa de inversión previene la deshidratación y minimiza la excesiva tensión en la aorta (del peso del corazón) cuando en comparación con ...
Divulgaciones
El Dr. Taylor es el fundador y accionista de Miromatrix Medical, Inc. Esta relación es administrada conforme a las políticas de conflicto de intereses por la Universidad de Minnesota y el Instituto del corazón de Texas; otros autores no tienen ningún conflicto de interés que revelar.
Agradecimientos
Esta investigación fue apoyada por la concesión de la dotación de Houston y el fondo de tecnología emergente de Texas. Los autores reconocen la Agencia de contratación del órgano LifeGift, Inc. y las familias de los donantes por hacer posible este estudio.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-0 silk suture | Ethicon | SA85H | Suture used to ligate superior and inferior vena cava |
| 1/4" x 3/8" connector with luer | NovoSci | 332023-000 | Connect aorta and pulmonary artery |
| Masterflex platinum-cured silicone tubing | Cole-Parmer | HV-96410-16 | Tubing to connect heart chambers/veins |
| infusion and outflow line | Smiths Medical | MX452FL | For flowing solutions through the vasculature |
| Polyester pouch (Ampak 400 Series SealPAK Pouches) | Fisher scientific | 01-812-17 | Pericardium-like pouch for containing heart during decellularization |
| Snapware Square-Grip Canister | Snapware | 1022 | 1-liter Container used for perfusing heart |
| Black rubber stoppers | VWR | 59586-162 | To seal the perfusion container |
| Peristaltic pump | Harvard Apparatus | 881003 | To pump fluid through the inflow lines and to drain fluids |
| 2 L aspirator bottle with bottom sidearm | VWR | 89001-532 | For holding solutions/perfusate |
| Quant-iT PicoGreen dsDNA Assay kit | Life Technologies | P7589 | For quantifying dsDNA |
| Calf thymus standard | Sigma | D4522 | DNA standard |
| Blyscan Glycosaminoglycan Assay Kit | Biocolor Ltd | Blyscan #B1000 | GAG assay kit |
| Plate reader | Tecan | Infinite M200 Pro | For analytical assays |
| GE fluoroscopy | General Electric | OEC 9900 Elite | Angiogram |
| Visipaque | GE | 13233575 | Contrast agent |
Referencias
- Writing Group Members. Executive Summary: Heart Disease and Stroke Statistics--2016 Update: A Report From the American Heart Association. Circulation. 133 (4), 447-454 (2016).
- Zia, S., et al. Hearts beating through decellularized scaffolds: whole-organ engineering for cardiac regeneration and transplantation. Critical Reviews in Biotechnology. 36 (4), 705-715 (2016).
- Zimmermann, W. H. Strip and Dress the Human Heart. Circulation Research. 118 (1), 12-13 (2016).
- Ott, H. C., et al. Perfusion-decellularized matrix: Using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Sanchez, P. L., et al. Acellular human heart matrix: A critical step toward whole heart grafts. Biomaterials. 61, 279-289 (2015).
- Peloso, A., et al. Current achievements and future perspectives in whole-organ bioengineering. Stem Cell Research & Therapy. 6, 107 (2015).
- Guyette, J. P., et al. Perfusion decellularization of whole organs. Nature Protocols. 9 (6), 1451-1468 (2014).
- Momtahan, N., Sukavaneshvar, S., Roeder, B. L., Cook, A. D. Strategies and Processes to Decellularize and Cellularize Hearts to Generate Functional Organs and Reduce the Risk of Thrombosis. Tissue Engineering Part B-Reviews. 21 (1), 115-132 (2015).
- Lee, P. F., et al. Inverted orientation improves decellularization of whole porcine hearts. Acta Biomaterialia. , (2016).
- Momtahan, N., et al. Automation of Pressure Control Improves Whole Porcine Heart Decellularization. Tissue Eng Part C Methods. , (2015).
- Weymann, A., et al. Development and Evaluation of a Perfusion Decellularization Porcine Heart Model - Generation of 3-Dimensional Myocardial Neoscaffolds. Circulation Journal. 75 (4), 852-860 (2011).
- Weymann, A., et al. Bioartificial heart: A human-sized porcine model--the way ahead. PLoS One. 9 (11), e111591 (2014).
- Remlinger, N. T., Wearden, P. D., Gilbert, T. W. Procedure for decellularization of porcine heart by retrograde coronary perfusion. Journal of Visualized Experiments. (70), e50059 (2012).
- Guyette, J. P., et al. Bioengineering Human Myocardium on Native Extracellular Matrix. Circulation Research. 118 (1), 56-72 (2016).
- Sanchez, P. L., et al. Data from acellular human heart matrix. Data Brief. 8, 211-219 (2016).
- Garreta, E., et al. Myocardial commitment from human pluripotent stem cells: Rapid production of human heart grafts. Biomaterials. 98, 64-78 (2016).
- Wainwright, J. M., et al. Preparation of Cardiac Extracellular Matrix from an Intact Porcine Heart. Tissue Engineering Part C-Methods. 16 (3), 525-532 (2010).
- Larson, A. M., Yeh, A. T. Ex vivo characterization of sub-10-fs pulses. Optics Letters. 31 (11), 1681-1683 (2006).
- Lee, P. F., Yeh, A. T., Bayless, K. J. Nonlinear optical microscopy reveals invading endothelial cells anisotropically alter three-dimensional collagen matrices. Experimental Cell Research. 315 (3), 396-410 (2009).
- Lee, P. F., Bai, Y., Smith, R. L., Bayless, K. J., Yeh, A. T. Angiogenic responses are enhanced in mechanically and microscopically characterized, microbial transglutaminase crosslinked collagen matrices with increased stiffness. Acta Biomaterialia. 9 (7), 7178-7190 (2013).
- Wu, Z., et al. Multi-photon microscopy in cardiovascular research. Methods. 130, 79-89 (2017).
- Ramanathan, T., Skinner, H. Coronary blood flow. Continuing Education in Anaesthesia Critical Care & Pain. 5 (2), 61-64 (2005).
- Murthy, V. L., et al. Clinical Quantification of Myocardial Blood Flow Using PET: Joint Position Paper of the SNMMI Cardiovascular Council and the ASNC. Journal of Nuclear Cardiology. 25 (1), 269-297 (2018).
- Molina, D. K., DiMaio, V. J. Normal organ weights in men: Part I-the heart. The American Journal of Forensic Medicine and Pathology. 33 (4), 362-367 (2012).
- Molina, D. K., DiMaio, V. J. Normal Organ Weights in Women: Part I-The Heart. The American Journal of Forensic Medicine and Pathology. 36 (3), 176-181 (2015).
- Robertson, M. J., Dries-Devlin, J. L., Kren, S. M., Burchfield, J. S., Taylor, D. A. Optimizing cellularization of whole decellularized heart extracellular matrix. PLoS One. 9 (2), e90406 (2014).
- Robertson, M. J., Soibam, B., O'Leary, J. G., Sampaio, L. C., Taylor, D. A. Cellularization of rat liver: An in vitro model for assessing human drug metabolism and liver biology. PLoS One. 13 (1), e0191892 (2018).
- Baghalishahi, M., et al. Cardiac extracellular matrix hydrogel together with or without inducer cocktail improves human adipose tissue-derived stem cells differentiation into cardiomyocyte-like cells. Biochemical and Biophysical Research Communications. , (2018).
- Perea-Gil, I., et al. In vitro comparative study of two decellularization protocols in search of an optimal myocardial scaffold for recellularization. American Journal of Translational Research. 7 (3), 558-573 (2015).
- Freytes, D. O., O'Neill, J. D., Duan-Arnold, Y., Wrona, E. A., Vunjak-Novakovic, G. Natural cardiac extracellular matrix hydrogels for cultivation of human stem cell-derived cardiomyocytes. Methods Molecular Biology. 1181, 69-81 (2014).
- Oberwallner, B., et al. Preparation of cardiac extracellular matrix scaffolds by decellularization of human myocardium. Journal of Biomedical Materials Research Part A. 102 (9), 3263-3272 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados