A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
اثنين-فوتون تصوير الجذب Microglial العمليات تجاه ATP أو السيروتونين في الدماغ الحادة شرائح
* These authors contributed equally
In This Article
Summary
Microglia، الخلايا المناعية المقيمين من الدماغ، والاستجابة بسرعة مع التغيرات المورفولوجية لإدخال تعديلات على بيئتهم. هذا البروتوكول توضح كيفية استخدام اثنين-فوتون الفحص المجهري لدراسة جاذبية عمليات microglial تجاه السيروتونين أو ATP في الدماغ الحادة شرائح من الفئران.
Abstract
خلايا Microglial هي الخلايا المناعية الفطرية المقيم في الدماغ باستمرار مسح البيئة الخاصة بهم مع عملياتها طويلة، وعند اختلال التوازن، الخضوع للتغيرات المورفولوجية. على سبيل المثال، يدفع آفة ليزر في بضع دقائق إلى نمو موجه من عمليات ميكروجليال، وتسمى أيضا "اتجاهي الحركة"، تجاه الموقع للإصابة. يمكن الحصول على تأثير مماثل بإيصال محلياً ATP أو السيروتونين (5-هيدروكسيتريبتاميني [5-HT]). في هذه المقالة، نحن تصف وضع بروتوكول للحث على نمو اتجاهات العمليات microglial تجاه تطبيق محلي ATP أو 5-HT في شرائح الدماغ الحادة للفئران الصغار والكبار وصورة هذا الجذب على مر الزمن بالفحص المجهري مولتيفوتون. طريقة بسيطة للقياس الكمي بصورة حرة ومفتوحة المصدر برمجيات التحليل المقترح. هو تحدي الذي لا يزال يميز شرائح الدماغ الحادة الوقت المحدود، تتناقص مع التقدم في العمر، خلالها الخلايا تظل في حالة فيزيولوجية. هذا البروتوكول، وبالتالي، يسلط الضوء على بعض التحسينات التقنية (الدائرة المتوسطة، الهواء السائل واجهة، التصوير الدائرة مع نضح مزدوجة) تهدف إلى تحسين جدوى خلايا microglial على مدى ساعات عدة، لا سيما في الشرائح من الفئران الكبار.
Introduction
خلايا Microglial الضامة المقيم في الدماغ وتلعب دوراً في كل الظروف الفسيولوجية والمرضية1،2. لديهم مورفولوجيا الغاية تشعبت ويتم باستمرار توسيع والتراجع عن العمليات3،4. ويعتقد هذا السلوك "المسح" أن تكون ذات صلة وضرورية لدراسة البيئة المحيطة بهم. يتم التعبير عن اللدونة المورفولوجية ل microglia في ثلاث طرق. أولاً، أن بعض المركبات تعدل سرعة مورفولوجيا microglial: إضافة ATP5،6 أو5،نمدا7 في الأجلين المتوسط والاستحمام شرائح المخ الحاد يزيد من تعقيد تشعبات ميكروجليال، وفي حين يقلل من إفراز6. هذه الآثار أما مباشرة توسط مستقبلات ميكروجليال (ل ATP وإفراز) أو المطالبة بإطلاق سراح ATP من الخلايا العصبية (نمدا). ثانيا، بسرعة النمو وتراجع عمليات ميكروجليال، تسمى حركية أو "المراقبة"، يمكن أن تتأثر بعوامل خارج الخلية8أو9،اختلالات التوازن10الطفرات9، 10،11. وثالثاً، بالإضافة إلى هذه التغييرات الخواص مورفولوجيا وحركية، microglia لديها القدرة على توسيع عملياتها توجه نحو ماصة إيصال ATP3،5،12، 13 , 14، في الثقافة، في شرائح الدماغ الحادة أو في الحية، أو تسليم 5-HT في الدماغ الحادة شرائح15. ووصفت هذا النمو الموجه لعمليات ميكروجليال، وتسمى أيضا حركية اتجاهي، أولاً كاستجابة لليزر محلي آفة3،4. وهكذا، الفيزيولوجية، يجوز أن تتعلق بالاستجابة للإصابة أو اللازمة لاستهداف العمليات microglial تجاه الاشتباكات العصبية أو مناطق الدماغ التي تحتاج إلى التقليم خلال التنمية15،16، أو فيالفسيولوجية 17 ،،من1819 أو الحالات المرضية9،،من1819،20 في مرحلة البلوغ. ثلاثة أنواع من التغييرات الشكلية التي تعتمد على مختلف الآليات داخل الخلايا11،،من1320، ومجمع معين واحد ليس بالضرورة تعدل كل منهم (مثل نمدا، الذي يعمل بشكل غير مباشر على microglia، له تأثير على مورفولوجيا ولكن عدم حمل حركية اتجاهي5،7). ولذلك، عندما تهدف لوصف تأثير مركب أو طفرة أو علم أمراض على microglia، من المهم أن تميز المكونات الثلاثة لما اللدونة المورفولوجية. وهنا يصف لنا أسلوباً لدراسة اتجاهات نمو عمليات microglial تجاه مصدر محلي للمجمع، و، هنا، ATP أو 5-HT.
وهناك عدة نماذج لدراسة الجذب microglia العمليات: الثقافات الأولية في بيئة 3D6،،من1819، الدماغ الحادة شرائح6،،من1315، وفي فيفو التصوير3،13. المجراة في النهج الذي هو الأفضل للحفاظ على الحالة الفسيولوجية ل microglia. بيد أن التصوير إينترافيتال من المناطق العميقة يتطلب إجراءات جراحية معقدة، وذلك، أنها غالباً ما تقتصر على الطبقات القشرية السطحية. استخدام الثقافة الأولية microglia هو أسلوب أسهل لاختبار عدد كبير من الشروط مع عدد محدود من الحيوانات. ومع ذلك، فإنه من المستحيل الحصول على مورفولوجية الخلية نفسها كما هو الحال في فيفو، والخلايا تفقد تلك التفاعلات الفسيولوجية مع الخلايا العصبية و astrocytes. شرائح الدماغ الحادة تمثل حلاً وسطا بين هذين النهجين. هذا النموذج يسمح للباحثين لدراسة هياكل الدماغ التي خلاف الصعب للوصول إلى وصورة بدقة عالية في الحية، والتحقيق في شرائح من مراحل الأطفال حديثي الولادة، بينما transcranial مجهرية تتم غالباً في مرحلة البلوغ. وأخيراً، فإنه يجعل من الممكن لمراقبة في الوقت الحقيقي آثار التطبيق المحلي للمخدرات، وتكرار التجارب أثناء استخدام عدد محدود من الحيوانات. ومع ذلك، هو مسألة مع شرائح الدماغ الحادة ضيق الوقت (بضع ساعات) خلالها الخلايا البقاء على قيد الحياة، خاصة بالنسبة لشرائح من الفئران التي مضى عليها أكثر من أسبوعين، واحتمال تغير مورفولوجيا microglia على مر الوقت21،22 .
هنا، يمكننا وصف بروتوكول لإعداد شرائح الدماغ الحادة من Cx3cr1 الصغار والكبارالتجارة والنقل/+ الفئران تصل إلى شهرين من العمر، مع الحفاظ على مورفولوجيا microglia وحركية لعدة ساعات. ثم، ونحن تصف كيفية استخدام هذه الشرائح لدراسة جاذبية عمليات microglial تجاه المركبات مثل ATP، أو 5-HT.
Access restricted. Please log in or start a trial to view this content.
Protocol
جميع التجارب التي أقرتها اللجنة الأخلاقية المحلية (اللجنة داروين، اتفاقات #1170 و #10921).
1-إعداد ميكروبيبيتيس الزجاج للتطبيق المحلي للمركبات
- إعداد الماصات من البورسليكات الشعيرات الدموية رقيقة الجدار الزجاج مع ساحبة كهربائي. ضبط معلمات للحصول على الماصات يبلغ قطرها 4-5 ميكرومتر في أقصى ما. ويبين الشكل 2D ماصة واحدة في برايتفيلد في تضخم منخفض.
2-الحلول
- ضمان أن الأواني الزجاجية فقط التي تم تنظيفها بدوره اﻷوتوكﻻف، تليها الشطف x 2-x 3 مع الماء عالي النقاوة، سوف تستخدم. ابدأ استخدام الأواني الزجاجية التي كانت على اتصال بارافورمالدهيد.
-
إعداد mol· 2 لام-1 كاكل2 حل الأسهم بتذويب مغ 14.7 كاكل2·2H2س في 50 مل ماء درجة نقاء عالية (الماء عالي النقاوة، ومقاومة 18.2 MΩ؛ وآثار المعادن في الماء المقطر أو ماء الصنبور يمكن أن يؤدي إلى نوعية شريحة الأمثل نظراً ل آثار برو-الأكسدة).
- تخزين هذا الحل الأسهم في درجة حرارة الغرفة لمدة أقصاها شهر واحد.
-
في يوم التجربة، إعداد 1 لتر حل الكولين-قام (السائل الدماغي النخاعي اصطناعية)، الذي يتكون من 110 mmol· لام-1 الكولين Cl، 25 mmol· لام-1 الغلوكوز، 25 mmol· لام-1 3من ناكو، 7 mmol· لام-1 MgCl2، 11.6 mmol· لام-1 حمض الأسكوربيك، 3.1 mmol· لام-1 الصوديوم بيروفات، 2.5 mmol· لام-1 بوكل، 1.25 mmol· لام-1 نة2بو4، و 0.5 mmol· لام-1 كاكل2، 0.5.
- لإعداد هذا الحل، إضافة، بالترتيب التالي، إلى قارورة 1 لتر تخرج: 0.186 غرام بوكل 0.195 ز نة2بو4، ز 2.04 من حمض الأسكوربيك، غ 2.1 ناكو3و 4.5 غرام من السكر.
- شغل حوالي نصف الحجم النهائي مع الماء عالي النقاوة ويقلب حتى حل كامل.
- إضافة ز 0.34 بيروفات صوديوم و 15.36 ز من الكولين Cl.
ملاحظة: أنها ملائمة لحل أول الكولين Cl مع 5 إلى 10 مل من محلول إعدادها في الخطوة 2.3.2 قبل إضافتها إلى حل كامل. - إضافة 7 مل 1 mol· لام-1 MgCl2 و 250 ميليلتر من 2 mol· لام-1 كاكل2 (أعد في الخطوة 2، 2) إلى الحل.
- ملء قارورة تخرج ما يصل إلى 1 لتر بالماء عالي النقاوة.
- مع أوسموميتير ضغط البخار، تحقق من الاسموليه بين 300 و 310 mΩ. إذا لم يكن الأمر كذلك، ضبطه مع الجلوكوز.
- فحص درجة الحموضة بعد كاربوجينيشن (أي محتدما مع "كاربوجين"، مزيج من 95% O2%5 CO2) وضبطه، إذا لزم الأمر، إلى 7.3-7.4 مع 10 M هيدروكسيد الصوديوم.
- نقل الحل إلى زجاجة زجاجية للتخزين. الاحتفاظ الزجاجة في الثلاجة حتى الاستخدام (الخطوة 3.1).
ملاحظة: من المستحسن جعل حل طازجة في اليوم من هذه التجربة. ومع ذلك، إذا لزم الأمر، الكولين-قام يمكن تخزين لمدة يومين في 4 درجات مئوية.
-
في يوم التجربة، إعداد 1 لتر حل قام، الذي يتكون من 124 mmol· لام-1 كلوريد الصوديوم، 26.2 mmol· لام-1 3من ناكو، 25 mmol· لام-1 الغلوكوز، 2.5 mmol· لام-1 بوكل، 2 mmol· لام-1 كاكل2، 1 mmol· لام-1 MgCl2، و 1.25 mmol· لام-1 نة2ص4.
- لإعداد هذا الحل، إضافة، بالترتيب التالي، إلى قارورة تخرج: 0.150 ز نة2بو4ز 0.186 من بوكل، ز 2.2 ناكو3، 4.5 غ من السكر و 7.3 غرام من كلوريد الصوديوم. تحقيق الحل لحجم 1 لتر ماء عالي النقاوة وآثاره من قوة على طبق من إثارة.
- أضف 1 مل 1 mol· لام-1 MgCl2 و 1 مل من 2 mol· لام-1 كاكل2 إلى الحل ونقل الحل قام بزجاجة للتخزين.
- التحقق مما إذا كان الاسموليه mΩ· 300-310 ل-1 ، وإذا لم يكن كذلك، ضبطه مع الجلوكوز.
- فحص درجة الحموضة بعد كاربوجيناتيون (أي، محتدما مع "كاربوجين") وضبطه، إذا لزم الأمر، إلى 7.3-7.4 مع 10 M هيدروكسيد الصوديوم.
- نقل الحل إلى زجاجة زجاجية للتخزين. الاحتفاظ الزجاجة في الثلاجة حتى الاستخدام (الخطوة 3.1).
ملاحظة: من المستحسن جعل حل طازجة في اليوم من هذه التجربة. ومع ذلك، هو بديل إعداد 10 × الأسهم محلول يحتوي على كلوريد الصوديوم و3ناكو، بوكل ونه2بو4 في 10 × تركيز النهائية، التي يمكن تخزينها لمدة أسبوع واحد لا يزيد على 4 درجة مئوية. جعل قام النهائي في يوم التجربة بتمييع الحل 10 x الأسهم مع الماء عالي النقاوة وإضافة السكر، كاكل2، ومجكل2.
- إعداد الحلول المخدرات اليوم من التجربة. استخدم الحل قام بتقديمهم للتركيزات النهائية وهي، هنا، 500 µmol· لام-1 ATP و 5 µmol· لام-1 على 5-HT.
ملاحظة: يمكن أن تكون مستعدة ل ATP، حل أسهم (مثلاً 50 مم ATP في الماء)، المخزنة في النموذج اليكووتيد في-20 درجة مئوية، وتضعف مع قام بتركيز نهائي اليوم من التجربة. على النقيض من ذلك، الحل 5-HT (السيروتونين-HCl) يجب أن يكون إعداده من مسحوق في يوم التجربة، في 1 mg·mL-1 في المياه وأبقى على 4 درجة مئوية لتجنب الأكسدة 5-HT وتضعف في قام في وقت التجربة.
3-إعداد شرائح الدماغ الحادة
-
إعداد منطقة التشريح
- إعداد 70 مل من المثلج الكولين-قام في كوب 80 مل على الجليد، والتي ستستخدم التروية القلبية، والتبريد السريع المخ، وتشريح. إعداد 150 مل من الكولين-قام في 200 مل بلورة الطبق، وتوضع في حمام مائي ساخن الإبقاء على 32 درجة مئوية. وضع مصفاة مش نايلون في الطبق المتبلور الاحتفاظ بالشرائح. سيتم استخدام هذا للسماح لاسترداد لمدة 10 دقائق فقط بعد تقطيع الشرائح.
- على الأقل 30 دقيقة قبل البدء بالتشريح (القسم 3.2)، بدء محتدما هذين الحلين (70 مل من الكولين-قام على الجليد) و 150 مل من الكولين-قام عند 32 درجة مئوية مع كاربوجين. الحفاظ على كاربوجيناتيون المستمر خلال الإجراء بأكمله.
- تحضير جهاز واجهة الدائرة (الشكل 1)، التي ستستخدم للحفاظ على شرائح حتى استخدامها.
- في غذاء مختومة مربع (10 × 10 سم أو 10 سم في القطر، 8 سم في الطول)، مثبتة على محرض مغناطيسي، ضع 200 مل بلورة الطبق مع شريط مغناطيس.
- إضافة 200 مل قام في هذا الطبق المتبلور ومكان صاحب شريحة واجهة 3D المطبوعة على أعلى من ذلك (حامل شريحة واجهة تتكون من اثنين تماما تركيب أجزاء، مع شبكة بولي أميد امتدت بينهما، الشكل 1 أ، ب).
- إزالة وحدة التخزين الزائد من طبق المتبلور للحفاظ على طبقة رقيقة من حل تغطي شبكة صاحب الشريحة واجهة. هذا سيخلق لاحقاً ريم خير حل المحيطة بالشرائح (ولكن دون تغطية لهم).
- وضع بضعة ملليمترات من قام في الجزء السفلي من مربع الأغذية وبدء محتدما أنه مع كاربوجين (عند الاستخدام الأول، جعل ثقب صغير في الجدار مربع مختومة الأغذية للتأكد من إدخال الأنبوب في المربع).
- قم بإغلاق مربع مختومة مع الحفاظ على كاربوجينيشن المستمر. سيقوم هذا بإنشاء هوميديفيد 95% O25% CO2 بيئة غنية التي سيتم نقلها بعد شفائهم في الكولين-قام الشرائح والمحافظة قبل أن يتم أخذ صورة عنه. هذا الجهاز هو يشار إلى قاعة "واجهة" (الشكل 1).
-
تشريح الدماغ وتشريح
- تخدير الماوس مع حقن mg·mL 50-1 بينتوباربيتال (0.15 مل/20 غرام وزن الجسم الماوس) داخل وشل عليه وفضح القلب وأداء التروية قلبية مع 10 مل من المثلج، كاربوجيناتيد، قام الكولين (راجع الخطوة 3.1.1)، مع مضخة تمعجية. ويلاحظ شحوب الكبد كمؤشر التروية الجيدة. ويستمر نضح أقل من 5 دقائق.
- قطع رأس الماوس وقطع الجلد لفضح الجمجمة. مع مقص كبير، تطبيق التخفيضات مستعرضاً اثنين من الثقبة الكبيرة وقطع السهمي طويلة واحدة، واستخدام الملقط غرامة، إزالة لوحات الجمجمة.
- بسرعة ولطف استخراج الدماغ (في أقل من 1 دقيقة) ووضعه لمدة 1 دقيقة في الكأس 80 مل تحتوي على المتبقي (~ 60 مل) المثلج الكولين-قام (لا يزال تحت كاربوجينيشن ثابتة)، بغية تهدئة أنه.
- نقل الدماغ على ورقة تصفية الرطب سابقا مع قام.
- قطع المخ وفقا لمنطقة الدماغ للفائدة وزاوية المفضل للتقطيع. على سبيل المثال، الصورة المهاد أو الحصين في شرائح الاكليلية، قطع بشفرة المبضع المخيخ، ومن ثم، عن 2 مم من الأطراف روسترال ووالذيليه للدماغ.
ملاحظة: من المهم إزالة أجزاء الدماغ التي أيضا روسترال أو والذيلية جداً لأنه أصغر منطقة تقليم قبل الوصول إلى مجال الاهتمام، أسرع تشريح. ويوصي وقت إجمالي لتشريح (الخطوة 3.2.7) من أقل من 20 دقيقة. - لشرائح الاكليلية، موقف والصق (مع الغراء cyanoacrylate) الوجه والذيلية الدماغ على 10 سم طبق بيتري، لصقها على كتلة القطع تقطيع اللحم وتهتز ووضعه في غرفة خزان لتقطيع اللحم تهتز، الذي يقع في دائرة أكبر مليئة بالجليد. ثم ملء طبق بيتري مع جميع المتبقية المثلج الكولين-قام.
- مع الحفاظ على ثابت 95% O25% CO2 محتدما من الكولين المثلج-قام، قطع 300 ميكرون سميكة الاكليلية شرائح (السرعة: 0.08 mm·s-1، والاهتزاز بليد: 60 هرتز، سعة الاهتزاز: 1 ملم).
- جمع شرائح المخ مع نقل واسع-فم (قطرها 4 ملم) المتاح "الماصة؛"، واحداً تلو الآخر بعد كل تمريره واحدة من الشفرة، لتجنب تراكم العناصر السامة الصادرة عن أطراف الشرائح. الحرص على تجنب فقاعات الهواء أثناء النقل ووضع كل شريحة في الكولين-قام عند 32 درجة مئوية لحوالي 10 دقيقة للانتعاش.
- مع ماصة نقل، وضع الشرائح على قطعة لتنظيف العدسة ورقة تعلوها قطره من الكولين-قام. نضح الفائض من الكولين-قام، ومع الملعقة، وضع الشرائح، أرسى على أنسجة تنظيف العدسة، على شبكة قاعة الواجهة التي تحتوي على كاربوجيناتيد قام في درجة حرارة الغرفة (انظر 3.1.3.5). واسمحوا أن الشريحة استرداد في هذه البيئة لمدة 30 دقيقة على الأقل.
ملاحظة: بعد هذا، الشرائح جاهزة ويمكن استخدامها للفئران microglia التصوير لما يصل إلى 6 س بعد استخراج المخ من الشباب (أقل من عمره شهر واحد) وما يصل إلى 4 ح بعد استخراج المخ من الكبار البالغ من العمر سنتين الأشهر.
4-اثنين-فوتون مجهرية
- معلمات الإعداد
- قم بالتبديل في النظام مولتيفوتون (كاشفات الهجين، ليزر، الماسح الضوئي، المغير الكهرضوئية، ومجهر).
- لحن الليزر في 920 شمال البحر الأبيض المتوسط، والتحقق من أن الليزر هو وضع غير الساحلية، وتعيين السلطة في 5-15% وكسب 10 في المائة. وهذا يتوافق مع قوة من 3-5 ميغاواط في إطار الهدف. ضمان أن تقوم الكشف عن نونديسكانيد وتثبيت عوامل التصفية المناسبة الانبعاثات والإثارة.
- تعيين معلمات برامج التصوير للقيم التالية: لحجم الإطار، 1024 × 1024 بكسل المقابلة لمنطقة 295.07 x 295.07 ميكرومتر؛ للتكبير، 2. إذا كانت الإشارة صاخبة جداً، تنطبق خط في متوسط 2. لديناميات بكسل، مجموعة برامج التصوير في 12 بت أو أكثر.
ملاحظة: الصور مع قيمة بت أعلى تسمح للباحثين التمييز بين الاختلافات أصغر في كثافة الأسفار من الصور مع قيمة بت أقل: تغيير واحد أن تتوافق مع قيمة الرمادي في صور 8-بت لتغيير قيم الرمادي 16 في 12 بت والرمادي 256 قيم أنا n صورة 16 بت. ولذلك، صور أعلى بت أكثر ملاءمة للتحليل الكمي، ولكن كما يزيد حجمها مع عمق البت، سعة التخزين والحوسبة السلطة يمكن أن يصبح الحد. - حدد وضع المسح الضوئي إكسيزت مع مجموعة Z-الفاصل زمني في 2 ميكرومتر وفاصل T من 2 دقيقة.
ملاحظة: X، y و z القرار تتحدد حسب نظرية أخذ العينات نايكست. سيكون حجم Z-خطوة حول 0.8 الأمثل لحل العمليات microglia (التي يبلغ قطرها < 1 ميكرومتر)، بل هو تحد من الدقة البصرية للفحص المجهري مولتيفوتون (في 920 شمال البحر الأبيض المتوسط بهدف نا هو 0.95، القرار المحوري حول 1 ميكرومتر). وعلاوة على ذلك حاجز مادي، في تجربة العيش-التصوير ونسبة حساسية أو إشارة إلى الضوضاء، القرار، السرعة والمسألة وقت الملاحظة الإجمالية. مع مراعاة جميع هذه المعلمات, z-خطوة 2 ميكرومتر (كما هو الحال في عدة دراسات3،،من1114) وحجم صورة 1024 × 1024 بكسل، واقتناء عالية السرعة استخدام ماسح ضوئي رنانة بالإضافة إلى الكشف عن HyD ( يستغرق حوالي 15 ثانية للحصول على خطط ض 50) اختير هنا. تواتر عمليات الشراء واحد من سلسلة إكسيزت كل 2 دقيقة وإجمالي مدة 30 دقيقة. إذا أن البنية ليست سريعة أو حساسة بما يكفي، فمن الممكن للحد من القرار الأفقي (وصولاً إلى 512 × 512) أو العدد من شرائح z (بتصوير حصرا في z-العمق الذي يسلك fluorescence أقوى [أي لا أعمق z-الشرائح حيث الأسفار الإغماء])، أو تقلل من سرعة الماسح الضوئي. يمكن أيضا تقليل القرار المحوري بزيادة z-الخطوة حتى 3 ميكرومتر، ولكن كما قد يؤثر هذا التحديد الكمي، ينبغي إجراء جميع التجارب بالمقارنة مع نفس z-الخطوة.
ملاحظة: فمن الممكن لإجراء تجارب مماثلة على شرائح من CX3CR1creER-يفب الفئران18، خط ماوس يستخدم لحمل الحذف الوراثية في microglia فقط، وفي microglia التي تعبر عن مؤثرا بروتين فلوري الصفراء (يفب). ومع ذلك، مستوى التعبير يفب منخفضة جداً مقارنة بالبروتينات الفلورية الخضراء (التجارة والنقل) في CX3CR1التجارة والنقل/+ الفئران؛ وهكذا، تصوير ممكنة ولكنها صعبة وتتطلب تحسين المعلمات اقتناء. من المستحسن لتعديلها على النحو التالي. - لحن الليزر في 970 شمال البحر الأبيض المتوسط (أيهما أفضل تكييف للإثارة يفب من 920 nm)، السلطة على 50%، والحصول على 50 ٪، الذي يتوافق مع قوة ليزر في إطار الهدف 5-6 ميغاواط.
- تعيين متوسط خط 4 (أو أكثر) لتحسين نسبة الإشارة إلى الضجيج.
- لتحديد المواقع من الشريحة وميكروبيبيتي الزجاج، والتطبيق المحلي للمجمع
- قم بتوصيل مضخة تمعجية قاعة تسجيل، 30 دقيقة قبل بدء التسجيل. بعد تنظيف النظام نضح كله مع 50 مل من الماء عالي النقاوة، تبدأ التروية في دائرة تسجيل قام (50 مل) الواردة في كوب زجاج تحت كاربوجينيشن المستمر. في جميع أنحاء هذه التجربة، تبقى قام المتداولة إلى 32 درجة مئوية مع ميكروهيتير مضمنة أو سخان بلتيير.
ملاحظة: دائرة نضح محددة مع نضح أعلى وأسفل يهدف إلى تحسين الأوكسجين في كلا الجانبين من الشريحة. تتكون غرفة نضح من تماما تركيب جزأين، مع شبكة بولي أميد امتدت بينهما (الشكل 2 أ، ب). بالمقارنة مع أنواع أخرى من الدوائر، حيث يتم مباشرة وضع الشريحة ساترة من زجاج، هذه الدائرة يقلل من موت الخلايا العصبية في الجزء السفلي من الشريحة ويحسن البقاء ويحد من تحركات شريحة الناجمة عن تورم. - مع نقل المتاح على نطاق الفم ماصة، نقل شريحة الدماغ تصويرها للكأس قام إزالة الورق العدسة، وليكن من بالوعة (كدليل على أن يرد لا فقاعة هواء)، وأنه نقل إلى دائرة التسجيل (نضح).
- موقف حامل شريحة (دبوس مصنوع من البلاتين مع فرعين وانضم خيوط النايلون موازية) على شريحة لتقليل حركة الشريحة بسبب تدفق التروية.
- استخدام إضاءة ساطعة الحقل لاستهداف منطقة الدماغ للفائدة (وقت التعرض: ms 50 إلى 80) استخدام هدفا تضخم منخفض (5 X أو 10 X). قم بالتبديل إلى أعلى والتكبير (x 25 مع عدسة 0.35 x) الماء الغمر الهدف وضبط الموضع.
ملاحظة: تجنب حقول صورة مقربة من خيوط النايلون صاحب الشريحة أنها يمكن أن تمنع الضوء وتشوه محلياً من الشريحة. تأكد من أن مجال الاهتمام شقة. إذا لزم الأمر، قم بإزالة حامل شريحة من أجل تغيير موضع الشريحة و/أو حامل الشريحة. - استخدام الإضاءة الفلورية لتحديد خلايا microglial الفلورية تصويرها في الميدان (وقت التعرض: 250-500 مللي ثانية).
ملاحظة: تسمح هذه الخطوة الباحثين للتحقق من وجود خلايا في المنطقة من اهتمام وقوتها الأسفار، والتحكم في مقدار الحطام الخلوية. - الردم الماصة مع 10 ميليلتر من قام مع ATP، 5-HT، أو المخدرات من الفائدة في تركيزه النهائي. نقطة التلميح إلى الأسفل ولطف يهز الماصة مليئة بالمخدرات لإزالة أي فقاعات الهواء محاصرين في التلميح.
ملاحظة: إذا كان الحل بالحقن يميل إلى تشكيل فقاعات، النظر في استخدام الماصات البورسليكات مع خيوط داخلية. تسرب ATP من أصل ماصة يمكن أن تجتذب عمليات microglial حتى قبل الحقن (في حالة حدوث ذلك، سيكون مرئياً في خطوة التحليل). على الرغم من أن هذا ينبغي أن تكون معتدلة مع تركيز ATP تستخدم (500 µmol· لام-1)، إذا قضية، النظر في بريفيلينج ميكروبيبيتي مع 2 مل قام قبل إضافة ATP (أو الأخرى المجمع) الحل في الخطوة 4.2.6. - جبل ماصة شغلها في حامل ماصة، متصلة بأنابيب شفافة لحقنه 5 مللي، مع المكبس المتمركزة في موقف 5 مل. صاحب ماصة نفسها هي التي شنت على ميكرومانيبولاتور ثلاثة محاور.
- تحت إضاءة ساطعة الحقل، استخدم في ميكرومانيبولاتور لوضع الماصة في وسط الميدان. استنساخه والأمثل التوسيط، عرض واستخدام المساطر على الصورة.
- أقل ماصة بلطف نحو الشريحة، مراقبة وضبط الهدف في نفس الوقت، حتى تلميح ماصة طفيفة يمس سطح الشريحة. وقف نزول ماصة حالما تظهر أنه قد تم التطرق إلى الشريحة يسمح تلميح ماصة لاختراق 80-100 ميكرون من سطح الشريحة (انظر الشكل 3).
- لحن الليزر (انظر المعلمات أعلاه) والتبديل المجهر لوضع مولتيفوتون. تأكد من أنه يتم فحص الدائرة من أي مصدر للضوء (مثل شاشة كمبيوتر). التبديل على كاشفات نونديسكانيد والربح. استخدام جدول بحث (لوط) مع حد العلوي مرمزة لتجنب تشبع بكسل في الصورة.
- تحديد سمك الشريحة تصويرها (أي، العلوي والسفلي z-مواقف فيها الأسفار قابلاً للاكتشاف [عادة ما بين 220 و 290 مليميكرون مجموع]).
ملاحظة: يوجد في سطح الشريحة، بزيادة كثافة العمليات وربما microglia، غالباً مع مورفولوجيا غير عادية، بالمقارنة بداخل الشريحة. وسوف يكون هذا التراكم أكثر بروزا مع الوقت (أي.، أكثر وضوحاً في الأخير مما في شريحة الدماغ الأولى تصويرها). ولذلك، لا ينبغي أن تستخدم للتحليل z-الطائرات في ميكرومتر الأولى 30 ~ ويمكن تخطيها حتى للحصول على. - بدء التسجيل لمدة 30 دقيقة (أو أكثر إذا رغبت في ذلك) مجموع وبعد أساس 5 دقائق، محلياً تطبيق المجمع لاختبار (دون مقاطعة التصوير). للقيام بهذا، ببطء اضغط على المكبس المحاقن متصلاً ميكروبيبيتي، من 5 مل إلى الموضع 1 مل (في حوالي 5 s). يجب أن يكون شعر المقاومة عند الضغط على المكبس فورا. إذا لم يكن الأمر كذلك، قد يكون التلميح مكسورة.
ملاحظة: لمدربين مجرب، استنساخه بالحقن مع هذا الأسلوب، ولكن بدلاً من ذلك إلى التلاعب اليدوي بحقنه، يمكن ربطها الماصة بنظام طرد ضغط الآلي للسماح مراقبة أفضل لحجم تسليم. الحقن يقوم بتشويه مادية للشريحة في موقع الحقن. هذا التشويه مرئياً اللاحق في أول اثنين أو ثلاثة صور بعد الحقن لكن يجب أن لا تكون مرئية على الصورة الرابعة، (أي، 8 دقيقة بعد الحقن). إذا ما استمر، بعين الاعتبار تغيير المعلمات من أجل إعداد ماصة. - في نهاية لاقتناء (30 دقيقة)، تجاهل ميكروبيبيتي وإزالة الشريحة. إذا رغبت في ذلك، إصلاح الشريحة لمزيد من إيمونولابيلينج. على سبيل المثال، الأسلوب اللقطة هو الأمثل للتثبيت وتلطيخ سميكة شرائح23.
- قبل البدء في صورة شريحة جديدة، تجعل الفيلم 2D (قسم 5.1) بغية التحقق من أن ميكروجليا لها التشكل طبيعي وهي تتحرك، ومن ثم أن الشرائح يتمتعون بصحة جيدة.
- قم بتوصيل مضخة تمعجية قاعة تسجيل، 30 دقيقة قبل بدء التسجيل. بعد تنظيف النظام نضح كله مع 50 مل من الماء عالي النقاوة، تبدأ التروية في دائرة تسجيل قام (50 مل) الواردة في كوب زجاج تحت كاربوجينيشن المستمر. في جميع أنحاء هذه التجربة، تبقى قام المتداولة إلى 32 درجة مئوية مع ميكروهيتير مضمنة أو سخان بلتيير.
5-تحليل لاجتذاب عمليات ميكروجليال
-
الإسقاط في 2D وتصحيح الانحراف
- فتح الملف (. ليف) مع فيجي24.
- إذا لزم الأمر، جعل من سوبستاك (الصورة/رزمة/أدوات/جعل سوبستاك) مع فقط z-طائرات الفائدة. على سبيل المثال، تستبعد z-الطائرات المقابلة لسطح الشريحة إذا فقد اكتسبت ولكن ليس لاستخدامها للتحليل (راجع الملاحظة بعد الخطوة 4.2.11) وأعمق z-الطائرات مع لا الأسفار. عموما يحتوي المكدس النهائي 90-110 z-شرائح (180-220 ميكرومتر).
- تشغيل الدالة Z المشروع (المشروع صورة/رزمة/Z") وحدد نوع الإسقاط كثافة ماكس جعل إسقاطات z-المكدس المكتسبة عند كل نقطة في الوقت.
- إطلاق البرنامج المساعد مولتيستاكريج (المساعد/التسجيل/مولتيستاكريج)، تحديد العمل 1: محاذاة و التحول: "هيئة جامدة" لتصحيح طفيف الانجرافات التي قد تكون حدثت أثناء اكتساب. حفظ هذا الفيلم 2D كملف جديد (.tiff).
-
تجهيز البيانات
- افتح هذا الملف الجديد مع الجليدية25.
- رسم منطقة R1 تعميما للفائدة (العائد على الاستثمار) من 35 ميكرون في القطر، وتركزت على موقع الحقن (محددة خاصة بظل الماصة والتشويه التي تم إنشاؤها في وقت الحقن).
- استخدام البرنامج المساعد تطور كثافة العائد على الاستثمار ، وقياس كثافة يعني مع مرور الوقت في R1.
- حفظ النتائج إلى. ملف XLS.
-
التقدير الكمي والتمثيل للنتائج
- تحديد لقياس الاستجابة microglial مع مرور الوقت، عند كل نقطة في الوقت
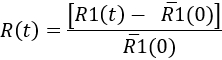
Here,'R1(0) هو متوسط القيم R1(t) قبل الحقن. ثم النتائج يمكن أن تمثل الحركية لاستجابة ميكروجليال، أو نقطة في وقت معين (انظر الشكل 7).
- تحديد لقياس الاستجابة microglial مع مرور الوقت، عند كل نقطة في الوقت
Access restricted. Please log in or start a trial to view this content.
النتائج
هذا البروتوكول وصف أسلوب الحث ومراقبة وقياس نمو موجه العمليات microglial تجاه مركب المطبقة محلياً، على سبيل المثال، ATP أو 5-HT، في الدماغ الحادة شرائح من الشباب أو البالغين (على الأقل تصل إلى يومين شهرا) الفئران. ومن العوامل التي تسهم في الحفاظ على شرائح الدماغ من الحيوانات الكب...
Access restricted. Please log in or start a trial to view this content.
Discussion
بالمحافظة على، على خلاف في فصلها أو شريحة أورجانوتيبيك الثقافة، سلامة هيكلية مع تعديلات شبكة محدودة، شرائح الدماغ الحادة السماح للباحثين بدراسة ميكروجليا في بيئتهم الفسيولوجية. ومع ذلك، أحد القيود الرئيسية التي هي حقيقة أن ينشئ إجراء تشريح على الإصابات التي يمكن أن تنال من سرعة صلاحية ا...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونحن نشكر الخلايا والأنسجة مرفق التصوير من معهد دو Fer à مولان، حيث تم إجراء جميع الحصول على الصور وتحليل. تم دعم هذا العمل جزئيا خلال المركز الوطني "البحث العلمي"، المعهد الوطني الصحة et de la "ميديكال البحوث"، "العلوم في جامعة السوربون"، ومن المنح المقدمة من جامعة السوربون جامعتا بيير et (جامعة ماري كوري برنامج اميرجينسيوبمك 2011/2014)، والمؤسسة من أجل البحوث la sur le الدماغ، فرنسا مؤسسة، المؤسسة من أجل البحوث ميديكال "ايكيب FRM DEQ2014039529"، الوزارة الفرنسية للبحوث (الوكالة الوطنية للبحوث ANR-17-CE16-0008 ودعفينير يشرف برنامج "بيو-Psy لابيكس" ANR-11-معرض أيدكس-0004-02) و "البحوث التعاونية" في برنامج "علم الأعصاب الحسابية"، المؤسسة الفرنسية "العلم الوطني والوكاله الوطنية" للبحوث (رقم: 1515686). جميع المؤلفين وينتسب إلى البحوث المجموعات التي هي أعضاء في مدرسة باريس لعلم الأعصاب (سياسة الجوار الأوروبية) ومن "لابيكس" بيو-Psy. هو طالب دكتوراه والمنتسب إلى جامعة السوربون، دكتوراه في كوليج، F-75005 باريس، فرنسا، وتموله "لابيكس" بيو-Psy. وعين زميل ما بعد دكتوراه تمول "البحوث التعاونية" في برنامج "علم الأعصاب الحسابية"، المؤسسة الفرنسية "العلم الوطني والوكاله الوطنية" للبحوث (رقم: 1515686). يشكر المؤلفون كولودجيساك مارتا الذين شاركوا في البدء في المشروع.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| for pipettes preparation | |||
| Clark Borosilicate Thin Wall Capillaries | Harvard Apparatus | 30-0065 | Borosilicate Thin Wall without Filament, 1.5 mm OD, 1.17 mm ID, 75 mm L , Pkg. of 225 |
| DMZ Universal Puller | Zeitz Instrumente | ||
| Name | Company | Catalog Number | Comments |
| for solutions | |||
| Calcium Chloride dihydrate (CaCl2) | Sigma | C5080 | |
| Choline Chloride | Sigma | C7527 | |
| D-(+)-Glucose | Sigma | G8270 | |
| L-Ascorbic acid | Sigma | A5960 | |
| Magnesium Chloride solution 1 M (MgCl2) | Sigma | 63020 | |
| Potassium chloride SigmaUltra >99.0% (KCl) | Sigma | P9333 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium Chloride (NaCl) | Sigma | S5886 | |
| Sodium phosphate monobasic | Sigma | S5011 | |
| Sodium pyruvate | Sigma | P2256 | |
| Ultrapure water | MilliQ | for all the solutions | |
| Name | Company | Catalog Number | Comments |
| for slice preparation | |||
| 2x 200 mL crystalizing dishes | |||
| 80 mL Pyrex beaker | |||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For mice perfusion and 2-photon chamber perfusion (aCSF) |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | ||
| Dolethal | Vetoquinol | Dolethal 50 mg/mL | |
| Filter papers (Whatman) | Sigma | WHA1001042 | Whatman qualitative filter paper, Grade 1 (Pore size: 11µM) |
| Fine Scissors - Sharp | Fine Science Tools | 14060-60 | |
| Food box 10 cm diameter, 8 cm Height | |||
| glue (ethyl cyanoacrylate) | Loctite | super glue 3 power flex | |
| Hippocampal Tool (spatula) | Fine Science Tools | 10099-15 | The largest extremity has to be angled at 90° |
| Ice | |||
| Iris Forceps (curved) | Moria | MC31 | |
| Lens cleaning tissue | THOR LABS | ||
| Nylon mesh strainer | diameter 7 cm | ||
| Razor blades | Electron Microscopy Sciences | 72000 | For the slicer |
| scalpel blade | |||
| Slice interface holder | home-made, the file for 3D printing is provided in Supplemental Material | ||
| Surgical Scissors - Sharp | Fine Science Tools | 14002-14 | |
| Vibrating slicer | Thermo Scientific | 720-2709 | Model: HM 650V (Vibrating blade microtome) |
| Water bath | Set at 32 °C (first recovery step) | ||
| Name | Company | Catalog Number | Comments |
| for slice imaging | |||
| × 25 0.95 NA water-immersion objective | Leica Microsystems (Germany) | HCX Irapo | |
| 2-photon MP5 upright microscope with resonant scanners (8 kHz) and two HyD Hybrid detectors | Leica Microsystems (Germany) | ||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For 2-photon chamber perfusion with aCSF |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | I1501L50R2A001 | |
| Chameleon Ultra2 Ti:sapphire laser | Coherent (Germany) | ||
| disposable transfer pipettes , wide mouth | ThermoFischer scientific | for example : 232-11 | 5.8 mL with fin tip, but we cut it (approx 7 cm) to have a 4 mm diameter mouth |
| emission filter SP680 | Leica Microsystems (Germany) | ||
| fluorescent cube containing a 525/50 emission filter and a 560 dichroic filter (for fluorescence collection) | Leica Microsystems (Germany) | ||
| glass beaker with 50 mL of ACSF to maintain constant perfusion of the slice | |||
| Heating system | Warner Instrument Corporation | Automatic Heater Controller TC-324B | to maintain perfusion solution at 32 °C |
| perfusion chamber | home-made, the file for 3D printing is provided in Supplemental Material | ||
| slice holder ("harp") | home made : hairpin made of platinum with the two branches joined by parallel nylon threads | ||
| Name | Company | Catalog Number | Comments |
| for slice stimulation | |||
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A-26209 | to be prepared ex-temporaneously : 1 mg/mL (3 mM) stock solution prepared the day of the experiment, kept at 4 °C (a few hours) and diluted just before use |
| Fluorescein (optional) | Sigma | F-6377 | use at 1 µM final |
| Micromanipulator | Luigs and Neumann | SM7 | connected to the micropipette holde |
| Micropipette holder | same as for eletrophysiology | ||
| Serotonin hydrochloride | Sigma | H-9523 | aliquots of 50mM stock solution in H20 kept at -20 °C. 500 µM solution prepared the day of the experiment. |
| Syringe 5 mL (without needle) | Terumo medical products | SS+05S1 | |
| Transparent tubing | Fischer Scientific | 11750105 | Saint Gobain Performance Plastics™ Tygon™ E-3603 Non-DEHP Tubing |
| Name | Company | Catalog Number | Comments |
| for image analysis | |||
| Fiji | https://fiji.sc | Schindelin, J. et al Nat. Methods (2012) doi 10.1038 | |
| Icy | Institut Pasteur | http://icy.bioimageanalysis.org | de Chaumont, F. et al. Nat. Methods (2012) |
| Name | Company | Catalog Number | Comments |
| mice | |||
| CX3CR1-GFP mice | Jung et al, 2000 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. | |
| CX3CR1creER-YFP mice | Parkhurst et al 2013 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. |
References
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nature Publishing Group. 23 (9), 1018-1027 (2017).
- Tay, T. L., Savage, J., Hui, C. W., Bisht, K., Tremblay, M. -È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. , (2016).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Dissing-Olesen, L., et al. Activation of neuronal NMDA receptors triggers transient ATP-mediated microglial process outgrowth. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10511-10527 (2014).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. Journal of Biological Chemistry. 288 (21), 15291-15302 (2013).
- Eyo, U. B., et al. Neuronal hyperactivity recruits microglial processes via neuronal NMDA receptors and microglial P2Y12 receptors after status epilepticus. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10528-10540 (2014).
- Hristovska, I., Pascual, O. Deciphering Resting Microglial Morphology and Process Motility from a Synaptic Prospect. Frontiers in Integrative Neuroscience. 9, 1231(2016).
- Avignone, E., Lepleux, M., Angibaud, J., Nägerl, U. V. Altered morphological dynamics of activated microglia after induction of status epilepticus. Journal of Neuroinflammation. 12, 202(2015).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biology. 14 (5), e1002466(2016).
- Madry, C., et al. Microglial Ramification, Surveillance, and Interleukin-1β Release Are Regulated by the Two-Pore Domain K+Channel THIK-1. Neuron. 97 (2), 299-312 (2018).
- Honda, S., et al. Extracellular ATP or ADP induce chemotaxis of cultured microglia through Gi/o-coupled P2Y receptors. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 21 (6), 1975-1982 (2001).
- Haynes, S. E., et al. The P2Y12 receptor regulates microglial activation by extracellular nucleotides. Nature Neuroscience. 9 (12), 1512-1519 (2006).
- Wu, L. -J., Vadakkan, K. I., Zhuo, M. ATP-induced chemotaxis of microglial processes requires P2Y receptor-activated initiation of outward potassium currents. Glia. 55 (8), 810-821 (2007).
- Kolodziejczak, M., et al. Serotonin Modulates Developmental Microglia via 5-HT 2BReceptors: Potential Implication during Synaptic Refinement of Retinogeniculate Projections. ACS Chemical Neuroscience. 6 (7), 1219-1230 (2015).
- Schafer, D. P., et al. Microglia Sculpt Postnatal Neural Circuits in an Activity and Complement-Dependent Manner. Neuron. 74 (4), 691-705 (2012).
- Pfeiffer, T., Avignone, E., Nägerl, U. V. Induction of hippocampal long-term potentiation increases the morphological dynamics of microglial processes and prolongs their contacts with dendritic spines. Scientific Reports. 6, 32422(2016).
- Parkhurst, C. N., et al. Microglia Promote Learning-Dependent Synapse Formation through Brain-Derived Neurotrophic Factor. Cell. 155 (7), 1596-1609 (2013).
- Wu, Y., Dissing-Olesen, L., Macvicar, B. A., Stevens, B. Microglia: Dynamic Mediators of Synapse Development and Plasticity. Trends in Immunology. 36 (10), 605-613 (2015).
- Ohsawa, K., et al. P2Y12 receptor-mediated integrin-beta1 activation regulates microglial process extension induced by ATP. Glia. 58 (7), 790-801 (2010).
- Kurpius, D., Wilson, N., Fuller, L., Hoffman, A., Dailey, M. E. Early activation, motility, and homing of neonatal microglia to injured neurons does not require protein synthesis. Glia. 54 (1), 58-70 (2006).
- Stence, N., Waite, M., Dailey, M. E. Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices. Glia. 33 (3), 256-266 (2001).
- Dissing-Olesen, L., Macvicar, B. A. Fixation and Immunolabeling of Brain Slices: SNAPSHOT Method. Current Protocols in Neuroscience. 71, 1.23.1-12 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Aitken, P. G., et al. Preparative methods for brain slices: a discussion. Journal of Neuroscience Methods. 59 (1), 139-149 (1995).
- Paris, I., et al. ProMoIJ: A new tool for automatic three-dimensional analysis of microglial process motility. Glia. 66 (4), 828-845 (2018).
- Pagani, F., et al. Defective microglial development in the hippocampus of Cx3cr1 deficient mice. Frontiers in Cellular Neuroscience. 9 (229), 111(2015).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. , Clifton, NJ. 221-242 (2014).
- Mainen, Z. F., et al. Two-photon imaging in living brain slices. Methods. 18 (2), San Diego, CA. 231-239 (1999).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Gyoneva, S., et al. Systemic inflammation regulates microglial responses to tissue damage in vivo. Glia. 62 (8), 1345-1360 (2014).
- Heindl, S., et al. Automated Morphological Analysis of Microglia After Stroke. Frontiers in Cellular Neuroscience. 12, 106(2018).
- Dailey, M. E., Eyo, U., Fuller, L., Hass, J., Kurpius, D. Imaging microglia in brain slices and slice cultures. Cold Spring Harbor Protocols. 12 (12), 1142-1148 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved