É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem de dois fotões de atração Microglial processos para ATP ou de serotonina no cérebro aguda fatias
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Microglia, as residentes células imunes do cérebro, responder rapidamente com alterações morfológicas às modificações do seu ambiente. Este protocolo descreve como usar dois fotões microscopia para estudar a atração dos processos microglial em direção a serotonina ou ATP em fatias aguda do cérebro de ratos.
Resumo
Microglial são residentes inatas imunes células do cérebro que constantemente digitalizar seu ambiente com seus longos processos e, após o rompimento da homeostase, passam por rápidas mudanças morfológicas. Por exemplo, uma lesão do laser induz em poucos minutos um crescimento orientado de processos microglial, também chamado de "motilidade direcional", para o local da lesão. Um efeito similar pode ser obtido através da entrega localmente ATP ou serotonina (5-hidroxitriptamina [5-HT]). Neste artigo, descrevemos um protocolo para induzir um crescimento direcional de processos microglial em direção a uma aplicação local de ATP ou 5-HT em fatias aguda do cérebro de ratos jovens e adultos e a imagem esta atração ao longo do tempo por microscopia do multiphoton. Propõe-se um método simples de quantificação com software de análise de imagem livre e open-source. Um desafio que ainda caracteriza fatias cerebral aguda é o tempo limitado, diminuindo com a idade, durante o qual as células permanecem em um estado fisiológico. Este protocolo, portanto, destaques algumas melhorias técnicas (secção interface ar-líquido médio, imagem de câmara com uma dupla perfusão) visam otimizar a viabilidade de células microglial durante várias horas, especialmente em fatias de ratos adultos.
Introdução
Microglial células são macrófagos residentes do cérebro e desempenham um papel em ambas as condições fisiológicas e patológicas1,2. Eles têm uma morfologia altamente ramificada e são constantemente ampliar e retraindo seus processos3,4. Esse comportamento de "digitalização" é acreditado para ser relacionadas e necessárias para o levantamento de seus arredors. A plasticidade morfológica da micróglia é expressa em três modos. Primeiro, alguns compostos rapidamente modulam microglial morfologia: a adição de ATP5,6 ou5,de NMDA7 no meio de banho fatias cerebral aguda aumenta a complexidade das ramificações microglial, Considerando que a noradrenalina diminui-lo6. Estes efeitos são diretamente mediados por receptores de microglial (para ATP e norepinefrina) ou requerem uma liberação de ATP de neurônios (NMDA). Em segundo lugar, a velocidade de crescimento e retração de processos microglial, chamado de "vigilância", ou motilidade pode ser afetada por fatores extracelulares8, homeostase interrupções9,10ou mutações9, 10,11. Em terceiro lugar, para além destas alterações isotrópicas de morfologia e motilidade, microglia têm a capacidade de estender seus processos direcionalmente em direção a uma pipeta entregando ATP3,5,12, 13 , 14, na cultura, em fatias de cérebro aguda ou in vivo, ou entregando 5-HT cerebral aguda fatias15. Tal crescimento orientado de processos microglial, também chamado de motilidade direcional, foi descrito pela primeira vez como uma resposta a uma lesão de laser local3,4. Assim, fisiologicamente, pode ser relacionado com a resposta à injúria ou necessária para o direcionamento de processos microglial para sinapses ou regiões do cérebro que exigem poda durante desenvolvimento15,16, ou em fisiológicas17 ,18,19 ou situações patológicas9,18,19,,20 em idade adulta. Os três tipos de alterações morfológicas dependem de diferentes mecanismos intracelulares11,13,20, e um determinado composto não necessariamente modulam todas elas (por exemplo, NMDA, que age indiretamente na microglia, tem um efeito sobre a morfologia, mas não induz a motilidade direcional5,7). Portanto, quando, com o objetivo de caracterizar o efeito de um composto, uma mutação ou uma patologia na microglia, é importante caracterizar os três componentes da sua plasticidade morfológica. Aqui, descrevemos um método para estudar o crescimento direcional de processos microglial na direção de uma fonte local de composto, que é, aqui, ATP ou 5-HT.
Existem vários modelos para estudar a atração dos processos microglia: culturas primárias em ambiente 3D6,18,19, fatias do cérebro aguda6,13,15e na vivo imagem3,13. A abordagem em vivo é o melhor para preservar o estado fisiológico da micróglia. No entanto, intravital imagem de regiões profundas exige procedimentos cirúrgicos complexos e, portanto, muitas vezes é limitado às camadas corticais superficiais. O uso de cultura primária microglia é a técnica mais fácil de testar um grande número de condições, com um número limitado de animais. No entanto, é impossível obter a mesma morfologia celular como vivo, e as células perdem suas interações fisiológicas com neurônios e astrócitos. Fatias de cérebro aguda representam um compromisso entre essas duas abordagens. Este modelo permite aos pesquisadores estudar estruturas cerebrais que são de outra maneira difíceis de alcançar e para imagem com alta resolução em vivo e para investigar fatias de estágios neonatais, Considerando que a microscopia transcraniana é realizada principalmente na idade adulta. Finalmente, ele torna possível observar em tempo real os efeitos da aplicação da droga local e de repetir experiências enquanto estiver usando um número limitado de animais. No entanto, um problema com fatias de cérebro aguda é o tempo limitado (algumas horas), durante o qual as células permanecem vivas, nomeadamente para fatias de ratos mais de duas semanas e a possível mudança da morfologia microglia sobre tempo21,22 .
Aqui, descrevemos um protocolo para preparar fatias aguda do cérebro de jovens e adultos Cx3cr1GFP / + ratos até dois meses de idade, com a preservação da microglia morfologia e motilidade durante várias horas. Em seguida, descrevemos como usar essas fatias para estudar a atração dos processos microglial para compostos como o ATP ou 5-HT.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os experimentos foram aprovados pelo Comitê de ético local (Comité de Darwin, acordos 1170 # e #10921).
1. preparação de Micropipetas de vidro para a aplicação Local de compostos
- Prepare-se pipetas de borosilicato capilares de vidro de parede fina com um extrator de eletrodo. Ajuste os parâmetros para obter pipetas com um 4-5 µm de diâmetro em sua extremidade. Figura 2D mostra uma pipeta em brightfield baixa ampliação.
2. soluções
- Assegurar que produtos vidreiros único que foi limpa por um ciclo de autoclave, seguido de enxaguamento 2x - 3x com água ultrapura, será usado. Nunca usar produtos vidreiros que tem estado em contacto com paraformaldeído.
-
Preparar um 2 mol · L-1 CaCl2 solução dissolvendo 14,7 mg de CaCl2·2H2O em 50 mL de água de alta pureza (água ultrapura, resistência 18,2 MΩ; os traços do metal em água destilada ou água de torneira podem levar a fatia suboptimal qualidade devido a efeitos de pro-oxidativo).
- Armazene em temperatura ambiente por um período máximo de um mês desta solução.
-
No dia do experimento, preparar 1 L de solução de colina-aCSF (líquido cefalorraquidiano artificial), cuja composição é 110 mmol· Colina de L-1 Cl, mmol· 25 Glicose de L-1 , 25 mmol· L-1 NaHCO3, mmol· 7 L-1 de MgCl2, mmol· 11.6 Ácido ascórbico de L-1 , mmol· de 3,1 Piruvato de sódio L-1 , 2.5 mmol· L-1 KCl, 1.25 mmol· L-1 NaH2PO4e 0,5 mmol· L-1 CaCl2, 0,5.
- Para preparar esta solução, adicionar, na seguinte ordem, para um balão aferido de 1 L se formou: 0,186 g de KCl, 0,195 g de NaH2PO4, 2,04 g de ácido ascórbico, 2,1 g de NaHCO3e 4,5 g de glicose.
- Preencha cerca de metade do volume final com água ultrapura e agitar até dissolução completa.
- Adicione 0,34 g de piruvato de sódio e 15,36 g de colina Cl.
Nota: É conveniente primeiro dissolver a colina Cl com 5 a 10 mL da solução preparada no passo 2.3.2 antes de adicioná-lo para toda a solução. - Adicionar 7 mL de 1 mol · L-1 de MgCl2 e 250 µ l de 2 mol · L-1 de CaCl2 (preparado no passo 2.2) para a solução.
- Encha o balão graduado até 1 L com água ultrapura.
- Com um pressão de vapor de aparelhos, verifique se a osmolaridade está entre 300 e 310 mΩ. Se não, ajustá-lo com glicose.
- Verificar o pH após carbogenation (ou seja, borbulhando com "carbogen", uma mistura de 95% O25% CO2) e ajustá-lo, se necessário, 7.3-7.4 com 10 M de NaOH.
- Transferi a solução para um frasco de vidro para armazenamento. Mantenha o frasco na geladeira até o uso (passo 3.1).
Nota: Recomenda-se fazer uma solução fresca no dia do experimento. No entanto, se necessário, colina-aCSF pode ser armazenado dois dias a 4 ° C.
-
No dia do experimento, preparar 1 L de uma solução de aCSF, cuja composição é mmol· 124 L-1 NaCl, 26,2 mmol· L-1 NaHCO3, mmol· 25 Glicose de L-1 , 2.5 mmol· L-1 KCl, mmol· 2 L-1 de CaCl2, 1 mmol· L-1 MgCl2e 1.25 mmol· L-1 NaH2PO4.
- Para preparar esta solução, adicionar, na seguinte ordem, para um balão aferido: 0,150 g de NaH2PO4, 0,186 g de KCl, 2,2 g de NaHCO3, 4,5 g de glicose e 7,3 g de NaCl. Trazer a solução para um volume de 1 L com água ultrapura e agite-o vigorosamente em uma placa de agitação.
- Adicionar 1 mL de 1 mol · L-1 de MgCl2 e 1 mL de 2 mol · L-1 de CaCl2 para a solução e a transferência a aCSF solução para um frasco de vidro para armazenamento.
- Verificar se a osmolaridade é de 300-310 mΩ· L-1 e, se não, ajustá-lo com glicose.
- Verificar o pH após a carbogenation (i.e., borbulhando com "carbogen") e ajustá-lo, se necessário, 7.3-7.4 com 10 M de NaOH.
- Transferi a solução para um frasco de vidro para armazenamento. Mantenha o frasco na geladeira até o uso (passo 3.1).
Nota: Recomenda-se fazer uma solução fresca no dia do experimento. No entanto, uma alternativa é preparar um 10 x solução contendo NaCl, NaHCO3, KCl e NaH2PO4 em 10 x a concentração final, que pode ser armazenada por não mais de uma semana a 4 ° C. Fazer a aCSF final no dia do experimento: diluir a solução estoque 10 x com água ultrapura e adicionando a glicose, CaCl2e MgCl2.
- Prepare as soluções de drogas no dia do experimento. Use a solução de aCSF para trazê-los para as concentrações finais que são, aqui, µmol· 500 L-1 para ATP e µmol· 5 L-1 para 5-HT.
Nota: Para ATP, uma solução pode ser preparada (por exemplo, 50 mM ATP na água), armazenado no formulário aliquotado a-20 ° C e diluído com aCSF para a concentração final no dia do experimento. Em contraste, a solução de 5-HT (serotonina-HCl) deve ser preparada a partir de pó no dia do experimento, em 1 mg·mL-1 , na água, mantida a 4 ° C para evitar a oxidação de 5-HT e diluída em aCSF no momento do experimento.
3. preparação de fatias cerebral aguda
-
Preparação da área de dissecação
- Prepare a 70 mL de colina-aCSF gelada em um copo de 80 mL colocado no gelo, deve ser usado para perfusão cardíaca, rápido arrefecimento do cérebro e cortar. Preparar 150 mL de colina-aCSF em um 200ml cristalizar o prato, num banho de água aquecida, mantida a 32 ° C. Coloque um filtro de malha de nylon no prato cristalização para reter as fatias. Isto será usado para deixar as fatias recuperar por 10 min, logo após o corte.
- Pelo menos 30 min antes de iniciar a dissecação (seção 3.2), começar a borbulhar estas duas soluções (70 mL de colina-aCSF no gelo) e 150 mL de colina-aCSF a 32 ° C com carbogênio. Manter carbogenation constante durante todo o procedimento.
- Prepare o dispositivo de câmara de interface (Figura 1), que será usado para manter as fatias até sua utilização.
- Em uma alimento selado caixa (10 x 10 cm ou 10 cm de diâmetro, 8 cm de altura), instalada em um agitador magnético, coloque um 200ml cristalizar o prato com uma barra de ímã.
- Adicionar 200 mL de aCSF neste prato de cristalização e coloque o suporte de fatia de interface 3D-impresso em cima dela (o titular de fatia de interface é composto por dois perfeitamente montagem peças, com uma malha de poliamida esticada entre eles, figura 1A, B).
- Remova o excesso volume do prato cristalização para manter apenas uma fina película de solução cobrindo a malha do titular da fatia da interface. Mais tarde, isso irá criar uma borda fina de solução que cercam as fatias (mas sem cobri-las).
- Colocar alguns milímetros da aCSF na parte inferior da caixa de comida e começar a borbulhá-lo com carbogênio (na primeira utilização, faça um pequeno furo na parede de caixa selada alimentos para certificar-se de que a tubagem pode inserir a caixa).
- Feche a caixa selada, mantendo constante carbogenation. Isto irá criar um umidificado 95% O25% CO2 ambiente rico em que as fatias serão transferidas após sua recuperação na colina-aCSF e mantidas antes de eles são criação da imagem. Este dispositivo é doravante referido como a "câmara de interface" (Figura 1).
-
Dissecção do cérebro e corte
- Anestesiar o rato com uma injeção intraperitoneal de 50 mg·mL-1 pentobarbital (0,15 mL/20 g de peso corporal de rato), imobilizá-lo, expor o coração e realizar uma perfusão cardíaca com 10 mL de gelado, carbogenated, colina-aCSF (consulte a etapa 3.1.1), com uma bomba peristáltica. Observe a palidez do fígado como um indicador de uma boa perfusão. A perfusão dura menos de 5 min.
- Decapitar o mouse e cortar a pele para expor a caveira. Com uma tesoura grande, aplicar dois cortes transversais do forame grande e um corte sagital há muito tempo e, usando a pinça fina, remover as placas do crânio.
- Suavemente e rapidamente extrair o cérebro (em menos de 1 min) e coloque-o por 1 min no copo 80 mL contendo o restantes (~ 60 mL) gelada colina-aCSF (ainda sob constante carbogenation), para esfriá-la.
- Transferi o cérebro em um papel de filtro previamente molhado com aCSF.
- Corte o cérebro de acordo com a região do cérebro de interesse e ângulo preferencial de fatiar. Por exemplo, para o tálamo ou hipocampo em fatias coronais de imagem, corte com uma lâmina de bisturi no cerebelo e, em seguida, cerca de 2 mm nas extremidades rostrais e caudais do cérebro.
Nota: É importante remover partes do cérebro que são demasiado rostral ou caudal também porque quanto menor a região para aparar antes de atingir a área de interesse, mais rápido o corte. Recomenda-se um tempo total para corte (etapa 3.2.7) de menos de 20 min. - Para fatias coronais, posicionar e colar (com cola de cianoacrilato) face caudal do cérebro em uma placa de Petri, 10cm colado no bloco de corte de um cortador de vibração e posicioná-lo na câmara de reservatório da vibra segmentação de dados, que é posicionada em uma câmara de maior cheio de gelo. Em seguida, encha o prato de Petri com todos o restante gelada colina-aCSF.
- Mantendo constante a 95% O25% CO2 borbulhando da colina gelada-aCSF, cortar 300 µm de espessura de fatias coronais (velocidade: 0,08 mm·s-1, a vibração da lâmina: 60 Hz, amplitude de vibração: 1 mm).
- Recolher as fatias de cérebro com uma transferência descartável de boca larga (4 mm de diâmetro) Pipetar, um por um após cada única passagem da lâmina, para evitar o acúmulo de componentes tóxicos, lançado pela periferia das fatias. Tome cuidado para evitar bolhas de ar durante a transferência e coloque cada fatia na colina-aCSF a 32 ° C, durante cerca de 10 min para recuperação.
- Com a pipeta de transferência, coloque as fatias em pedaços de limpeza de lente papel coberto com uma gota de colina-aCSF. Aspire o excesso de colina-aCSF e, com a espátula, coloque as fatias, colocadas sobre o tecido de limpeza de lente, sobre a malha da câmara interface contendo aCSF carbogenated à temperatura ambiente (ver 3.1.3.5). Deixe a fatia recuperar neste ambiente pelo menos 30 min.
Nota: Depois disso, as fatias estão prontas e podem ser usadas para ratos microglia imagem para até 6 h após a extração do cérebro de jovens (menos de um mês de idade) e até 4 h após a extração do cérebro de adultos de dois meses de idade.
4. dois fotões microscopia
- Parâmetros de configuração
- Ligue o sistema do multiphoton (detectores de híbrido, laser, scanner, modulador de electro-óptica, microscópio).
- Ajustar o laser em 920 nm, verifique que o laser é modo bloqueado e definir o poder em 5-15% e o ganho de 10%. Isso corresponde a uma potência de 3-5 mW no âmbito do objectivo. Certifique-se que os detectores de nondescanned estão envolvidos e os filtros de emissão e excitação adequados instalado.
- Definir parâmetros do software da imagem latente para os seguintes valores: para o tamanho do quadro, 1024 x 1024 pixels correspondentes a uma área de 295.07 x 295.07 µm; para o zoom, 2. Se o sinal é muito barulhento, aplica uma média de linha de 2. Para a dinâmica de pixel, defina o software da imagem latente em 12 bits ou mais.
Nota: Imagens com um maior valor de bit permitem aos investigadores distinguir diferenças menores na intensidade da fluorescência do que imagens com um valor mais baixo de bit: uma alteração de um valor de cinza em uma imagem de 8 bits corresponde a uma mudança de 16 valores de cinza em um 12 bits e de cinza de 256 valores i n uma imagem de 16 bits. Portanto, imagens mais bits são os mais adequadas para a análise quantitativa, mas à medida que seu tamanho aumenta com a profundidade de bits, capacidade de armazenamento e computação poder pode tornar-se limitando. - Selecione o modo de varredura XYZT com uma gama de Z-intervalo de 2 µm e um T-intervalo de 2 min.
Nota: O x, y e z de resolução são determinados pelo teorema de amostragem de Nyquist. Um tamanho de Z-passo em torno de 0,8 seria ideal para resolver processos microglia (com um diâmetro de < 1 µm), mas a resolução óptica de microscopia do multiphoton é limitante (em 920 nm com um objectivo de at 0.95, a resolução axial é em torno de 1 µm). Em cima disso barreira física, em uma experiência de geração de imagens ao vivo, a relação de sensibilidade ou sinal-ruído, a resolução, a velocidade e a questão do tempo de observação total. Tendo em conta todos estes parâmetros, um z-passo de 2 µm (como em inúmeros estudos3,11,14), um tamanho de imagem de 1024 x 1024 pixels e uma aquisição de alta velocidade usando um scanner ressonante acoplado aos detectores de HyD (que leva cerca de 15 s para adquirir 50 z-planos) foram selecionados aqui. A frequência de aquisições é uma série XYZT cada 2 min e a duração total é de 30 min. Se o set-up não é rápido ou suficientemente sensível, é possível reduzir a resolução lateral (até 512 x 512) ou o número de fatias-z (pela imagem exclusivamente na z-profundidade que apresenta a mais forte fluorescência [ou seja, não é as z-fatias mais profundas onde fluorescência é fraca]), ou para diminuir a velocidade do scanner. A resolução axial também pode ser diminuída, aumentando o z-passo até 3 µm, mas como isto pode impactar a quantificação, todas as experiências, a comparação devem ser realizadas com o mesmo z-passo.
Nota: É possível realizar experimentos semelhantes em fatias de CX3CR1creER-YFP ratos18, uma linha de rato usada para induzir a deleção genética no microglia apenas e no qual microglia constitutivamente expressa a proteína fluorescente amarela (YFP). No entanto, o nível de expressão de YFP é muito baixo em comparação com a proteína verde fluorescente (GFP) em CX3CR1GFP / + ratos; assim, a imagem é possível, mas desafiador e exige a otimização dos parâmetros de aquisição. Recomenda-se ajustá-las da seguinte maneira. - Ajustar o laser em 970 nm (o que é melhor adaptado à excitação YFP que 920 nm), a potência em 50% e o ganho em 50%, o que corresponde a uma potência de laser no âmbito do objectivo de 5-6 mW.
- Defina uma média de linha de 4 (ou mais) para melhorar a relação sinal-ruído.
- Posicionamento da fatia e a micropipeta de vidro, e a aplicação local do composto
- Conecte a bomba peristáltica para a câmara de gravação, 30 min antes de iniciar a gravação. Após a limpeza do sistema de perfusão inteiro com 50 mL de água ultrapura, inicie a perfusão da câmara de gravação com aCSF (50 mL) contida em um copo de vidro sob constante carbogenation. Durante todo o experimento, manter a circulação aCSF a 32 ° C, com um microheater de inline ou um aquecedor de Peltier.
Nota: Uma câmara de perfusão específico com perfusão superior e inferior é projetada para otimizar a oxigenação em ambos os lados da fatia. A câmara de perfusão é composta de dois perfeitamente montagem peças, com uma malha de poliamida esticada entre eles (Figura 2A, B). Em comparação com outros tipos de câmaras, onde a fatia diretamente está deitado sobre uma lamela de vidro, esta câmara reduz morte neuronal na parte inferior da fatia, melhora a viabilidade e reduz os movimentos de fatia induzidos pelo seu inchaço. - Com uma pipeta de transferência descartável de boca larga, transferi a fatia do cérebro para ser fotografada para o béquer aCSF para remover o papel de lente, deixá-lo afundar-se (como uma prova de que nenhuma bolha de ar é ligada) e transferi-lo para a câmara de gravação (perfusão).
- Posição titular (um gancho de cabelo feito de platina com os dois ramos Unidos por fios de nylon paralela) de uma fatia na fatia para minimizar o movimento de fatia devido ao fluxo de perfusão.
- Use a iluminação de campo claro para direcionar a região do cérebro de interesse (tempo de exposição: 50 a 80 ms) usando um objectivo de baixa ampliação (5x ou 10x). Alterne para o maior objetivo de imersão de água ampliação (25 x com uma lente x 0,35) e ajustar a posição.
Nota: Evite a campos de imagem perto de fios de nylon a fatia do titular como eles podem bloquear a luz e deformar-se localmente a fatia. Certifique-se que a área de interesse é plana. Se necessário, remova o titular fatia para reposicionar a fatia e/ou o titular de fatia. - Use a iluminação de fluorescência para localizar as células fluorescentes microglial para ser fotografada no campo (tempo de exposição: 250-500 ms).
Nota: Este passo permite que os pesquisadores para verificar a presença de células na região de interesse e sua intensidade de fluorescência e controlar para a quantidade de restos celulares. - Aterramento a pipeta com 10 µ l de aCSF com ATP, 5-HT, ou a droga de interesse em sua concentração final. Aponte a ponta para baixo e agite suavemente a pipeta cheia de droga para remover quaisquer bolhas de ar presas na ponta.
Nota: Se a solução a ser injetada tende a formar bolhas, considere o uso de pipetas de borosilicato com um filamento interno. Escapamento do ATP da pipeta pode atrair microglial processos antes mesmo da injeção (se isso ocorrer, será visível na etapa de análise). Embora isto deve ser moderado com a concentração de ATP usado (500-µmol· L-1), se é um problema, considere a possibilidade de prefilling a micropipeta com 2 mL de aCSF antes da adição do ATP (ou outro composto) solução a passo 4.2.6. - Monte a pipeta cheia em um suporte de pipeta, conectado com tubo transparente a uma seringa de 5 mL, com um êmbolo posicionado na posição 5 mL. O titular de uma pipeta própria é montado sobre um micromanipulador de três eixos.
- Sob a iluminação de campo claro, use o micromanipulador para posicionar a pipeta no centro do campo. Para uma centralização reproduzíveis e ideal, exibir e usar os governantes na imagem.
- Abaixe a pipeta suavemente em direção a fatia, controlando e ajustando o objetivo ao mesmo tempo, até que a ponta da pipeta levemente toca a superfície da fatia. Parando a descida da pipeta, assim que é visível que a fatia foi tocada permite que a ponta da pipeta penetrar 80-100 µm da superfície da fatia (ver Figura 3B).
- Ajustar o laser (Ver os parâmetros acima) e o microscópio, alternar para o modo do multiphoton. Certifique-se que a câmara é selecionada a partir de qualquer fonte de luz (por exemplo, uma tela de computador). Ligar os detectores nondescanned e definir o ganho. Use uma tabela de pesquisa (LUT) com um limite superior codificadas por cor para evitar saturando os pixels na imagem.
- Determinar a espessura da fatia para criação da imagem (ou seja, as superiores e inferiores z-posições onde a fluorescência é detectável [geralmente entre 220 e 290 µm no total]).
Nota: Na superfície da fatia, há um aumento da densidade dos processos e possivelmente da micróglia, frequentemente com uma morfologia incomum, em comparação com o interior da fatia. Esta acumulação será mais marcante com o tempo (ou seja,., mais visível nos últimos do que na primeira fatia de cérebro para ser fotografada). Portanto, os z-aviões no primeiro de ~ 30 µm não devem ser usados para a análise e nem podem ser ignorados para a aquisição. - Iniciar a gravação para uma duração total de 30 min (ou mais se desejar) e depois uma linha de base 5 min, localmente, aplicar o composto a ser testado (sem interromper a imagem). Para isso, pressione lentamente o êmbolo da seringa ligado à micropipeta, dos 5 mL para a posição de 1 mL (em cerca de 5 s). Resistência ao pressionar o êmbolo deve ser sentida imediatamente. Se não, a ponta pode estar quebrada.
Nota: Para um experimentador treinado, as injeções com este método são reproduzíveis, mas como alternativa à manipulação manual de uma seringa, a pipeta pode ser ligada a um sistema de ejeção automática de pressão para permitir um melhor controlo do volume entregado. A injeção cria uma distorção física da fatia no local da injeção. Esta distorção é visível a posteriori nas primeiras duas ou três imagens após a injeção, mas não deve ser visível na quarta imagem, (ou seja, 8 min após a injeção). Se persistir, considere alterar os parâmetros para a preparação de uma pipeta. - No final da aquisição (30 min), descartar a micropipeta e remover a fatia. Se desejado, consertar a fatia para immunolabeling ainda mais. Por exemplo, o método instantâneo é otimizado para a fixação e coloração de grossas fatias de23.
- Antes de iniciar uma nova fatia de imagem, fazer o filme 2D (seção 5.1) a fim de verificar a microglia têm uma morfologia normal e estão se movendo e, assim, que as fatias são saudáveis.
- Conecte a bomba peristáltica para a câmara de gravação, 30 min antes de iniciar a gravação. Após a limpeza do sistema de perfusão inteiro com 50 mL de água ultrapura, inicie a perfusão da câmara de gravação com aCSF (50 mL) contida em um copo de vidro sob constante carbogenation. Durante todo o experimento, manter a circulação aCSF a 32 ° C, com um microheater de inline ou um aquecedor de Peltier.
5. análise da atração dos processos Microglial
-
Projecção em 2D e correção de deriva
- Abra o arquivo (. LIF) com Fiji24.
- Se necessário, fazer um substack (Imagem/pilhas/ferramentas/Make Substack) com apenas os z-aviões de interesse. Por exemplo, excluir os z-aviões correspondente à superfície da fatia, se eles foram adquiridos, mas não devem ser utilizados para a análise (consulte a observação após etapa 4.2.11) e os mais profundos z-aviões com nenhuma fluorescência. A pilha final geralmente contém 90-110 z-fatias (180-220 µm).
- Lançar a função de projeto Z (Projeto imagem/pilhas/Z") e selecione o tipo de projeção de Intensidade de Max para fazer as projeções da z-pilha adquiriu em cada ponto de tempo.
- Lançar o plugin MultiStackReg (Plugin/registo/MultiStackReg), selecionando acção 1: alinhar e transformação: corpo rígido para corrigir desvios ligeiros que possam ter ocorrido durante a aquisição. Salve este filme 2D como um novo arquivo (. TIFF).
-
Processamento de dados
- Abra este novo arquivo com gelado de25.
- Desenhe uma circular R1 região de interesse (ROI) de 35 µm de diâmetro, centralizado no local da injeção (identificado nomeadamente pela sombra da pipeta e a distorção criada no momento da injeção).
- Usar o plugin de evolução de intensidade ROI e medir a intensidade média ao longo do tempo em R1.
- Salvar os resultados para um. Arquivo XLS.
-
Quantificação e a representação dos resultados
- Para quantificar a resposta microglial ao longo do tempo, determinar em cada ponto de tempo
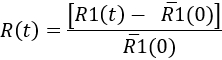
Here,'R1(0) é a média dos valores de R1(t) antes da injeção. Em seguida, os resultados podem ser representados como uma cinética da resposta microglial, ou em um tempo específico ponto (ver Figura 7).
- Para quantificar a resposta microglial ao longo do tempo, determinar em cada ponto de tempo
Access restricted. Please log in or start a trial to view this content.
Resultados
Este protocolo descreve um método para induzir, observar e quantificar o crescimento orientado de processos microglial em direção a um composto aplicado localmente, por exemplo, fatias de ATP ou 5-HT, no cérebro agudo de jovem ou adulto (pelo menos até dois meses de idade) ratos. Entre os fatores que contribuem para a manutenção de fatias de cérebro de animais adultos, em um estado saudável durante várias horas, é o uso de duas ferramentas projetado para otimizar a sobrevivênc...
Access restricted. Please log in or start a trial to view this content.
Discussão
Mantendo-se, ao contrário de em dissociada ou organotypic fatia de cultura, uma integridade estrutural com ajustes de rede limitada, fatias de cérebro aguda permitem aos pesquisadores estudar microglia no seu ambiente fisiológico. No entanto, uma das principais limitações é o fato de que o procedimento de corte cria lesões que rapidamente podem comprometer a viabilidade de neurônios, particularmente no cérebro adulto. Como microglia são particularmente reactivo ao dano celular, é importante limitar a morte cel...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a célula e tecido Imaging facilidade do Institut du Fer à Moulin, onde foram realizados todos os aquisição de imagem e análise. Este trabalho foi apoiado em parte pelo Centre National de la Recherche Scientifique, o Institut National de la Santé et de la Recherche Médicale, Ciências da Université de Sorbonne e por concessões da Sorbonne universidades-Pierre et Marie Curie University ( Programa Emergence-UPMC 2011/2014), da Fondation pour la Recherche sur le Cerveau, a Fondation de France, a Fondation pour la Recherche Médicale "Equipe FRM DEQ2014039529", o Ministério francês da pesquisa (Agence Nationale pour la Recherche ANR-17-CE16-0008 e o d'Avenir Investissements programa "Bio-Psy Labex" ANR-11-IDEX-0004-02) e uma pesquisa colaborativa em programa de neurociência computacional, Science Foundation/francês nacional Agência Nacional para a pesquisa (número: 1515686). Todos os autores são filiados à investigação de grupos que são membros da escola de Paris de neurociência (PEV) e do Labex Bio-Psy. Fe é um estudante de doutorado filiado a Sorbonne Université, Collège doutoral, F-75005 Paris, França e é financiado pelo Labex Bio-Psy. V.M. é bolsista de pós-doutoramento financiada pela pesquisa colaborativa em programa de neurociência computacional, Science Foundation/francês nacional Agência Nacional para a pesquisa (número: 1515686). Os autores graças a Marta Kolodziejczak que participaram no início do projeto.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| for pipettes preparation | |||
| Clark Borosilicate Thin Wall Capillaries | Harvard Apparatus | 30-0065 | Borosilicate Thin Wall without Filament, 1.5 mm OD, 1.17 mm ID, 75 mm L , Pkg. of 225 |
| DMZ Universal Puller | Zeitz Instrumente | ||
| Name | Company | Catalog Number | Comments |
| for solutions | |||
| Calcium Chloride dihydrate (CaCl2) | Sigma | C5080 | |
| Choline Chloride | Sigma | C7527 | |
| D-(+)-Glucose | Sigma | G8270 | |
| L-Ascorbic acid | Sigma | A5960 | |
| Magnesium Chloride solution 1 M (MgCl2) | Sigma | 63020 | |
| Potassium chloride SigmaUltra >99.0% (KCl) | Sigma | P9333 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium Chloride (NaCl) | Sigma | S5886 | |
| Sodium phosphate monobasic | Sigma | S5011 | |
| Sodium pyruvate | Sigma | P2256 | |
| Ultrapure water | MilliQ | for all the solutions | |
| Name | Company | Catalog Number | Comments |
| for slice preparation | |||
| 2x 200 mL crystalizing dishes | |||
| 80 mL Pyrex beaker | |||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For mice perfusion and 2-photon chamber perfusion (aCSF) |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | ||
| Dolethal | Vetoquinol | Dolethal 50 mg/mL | |
| Filter papers (Whatman) | Sigma | WHA1001042 | Whatman qualitative filter paper, Grade 1 (Pore size: 11µM) |
| Fine Scissors - Sharp | Fine Science Tools | 14060-60 | |
| Food box 10 cm diameter, 8 cm Height | |||
| glue (ethyl cyanoacrylate) | Loctite | super glue 3 power flex | |
| Hippocampal Tool (spatula) | Fine Science Tools | 10099-15 | The largest extremity has to be angled at 90° |
| Ice | |||
| Iris Forceps (curved) | Moria | MC31 | |
| Lens cleaning tissue | THOR LABS | ||
| Nylon mesh strainer | diameter 7 cm | ||
| Razor blades | Electron Microscopy Sciences | 72000 | For the slicer |
| scalpel blade | |||
| Slice interface holder | home-made, the file for 3D printing is provided in Supplemental Material | ||
| Surgical Scissors - Sharp | Fine Science Tools | 14002-14 | |
| Vibrating slicer | Thermo Scientific | 720-2709 | Model: HM 650V (Vibrating blade microtome) |
| Water bath | Set at 32 °C (first recovery step) | ||
| Name | Company | Catalog Number | Comments |
| for slice imaging | |||
| × 25 0.95 NA water-immersion objective | Leica Microsystems (Germany) | HCX Irapo | |
| 2-photon MP5 upright microscope with resonant scanners (8 kHz) and two HyD Hybrid detectors | Leica Microsystems (Germany) | ||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For 2-photon chamber perfusion with aCSF |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | I1501L50R2A001 | |
| Chameleon Ultra2 Ti:sapphire laser | Coherent (Germany) | ||
| disposable transfer pipettes , wide mouth | ThermoFischer scientific | for example : 232-11 | 5.8 mL with fin tip, but we cut it (approx 7 cm) to have a 4 mm diameter mouth |
| emission filter SP680 | Leica Microsystems (Germany) | ||
| fluorescent cube containing a 525/50 emission filter and a 560 dichroic filter (for fluorescence collection) | Leica Microsystems (Germany) | ||
| glass beaker with 50 mL of ACSF to maintain constant perfusion of the slice | |||
| Heating system | Warner Instrument Corporation | Automatic Heater Controller TC-324B | to maintain perfusion solution at 32 °C |
| perfusion chamber | home-made, the file for 3D printing is provided in Supplemental Material | ||
| slice holder ("harp") | home made : hairpin made of platinum with the two branches joined by parallel nylon threads | ||
| Name | Company | Catalog Number | Comments |
| for slice stimulation | |||
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A-26209 | to be prepared ex-temporaneously : 1 mg/mL (3 mM) stock solution prepared the day of the experiment, kept at 4 °C (a few hours) and diluted just before use |
| Fluorescein (optional) | Sigma | F-6377 | use at 1 µM final |
| Micromanipulator | Luigs and Neumann | SM7 | connected to the micropipette holde |
| Micropipette holder | same as for eletrophysiology | ||
| Serotonin hydrochloride | Sigma | H-9523 | aliquots of 50mM stock solution in H20 kept at -20 °C. 500 µM solution prepared the day of the experiment. |
| Syringe 5 mL (without needle) | Terumo medical products | SS+05S1 | |
| Transparent tubing | Fischer Scientific | 11750105 | Saint Gobain Performance Plastics™ Tygon™ E-3603 Non-DEHP Tubing |
| Name | Company | Catalog Number | Comments |
| for image analysis | |||
| Fiji | https://fiji.sc | Schindelin, J. et al Nat. Methods (2012) doi 10.1038 | |
| Icy | Institut Pasteur | http://icy.bioimageanalysis.org | de Chaumont, F. et al. Nat. Methods (2012) |
| Name | Company | Catalog Number | Comments |
| mice | |||
| CX3CR1-GFP mice | Jung et al, 2000 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. | |
| CX3CR1creER-YFP mice | Parkhurst et al 2013 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. |
Referências
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nature Publishing Group. 23 (9), 1018-1027 (2017).
- Tay, T. L., Savage, J., Hui, C. W., Bisht, K., Tremblay, M. -È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. , (2016).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Dissing-Olesen, L., et al. Activation of neuronal NMDA receptors triggers transient ATP-mediated microglial process outgrowth. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10511-10527 (2014).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. Journal of Biological Chemistry. 288 (21), 15291-15302 (2013).
- Eyo, U. B., et al. Neuronal hyperactivity recruits microglial processes via neuronal NMDA receptors and microglial P2Y12 receptors after status epilepticus. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10528-10540 (2014).
- Hristovska, I., Pascual, O. Deciphering Resting Microglial Morphology and Process Motility from a Synaptic Prospect. Frontiers in Integrative Neuroscience. 9, 1231(2016).
- Avignone, E., Lepleux, M., Angibaud, J., Nägerl, U. V. Altered morphological dynamics of activated microglia after induction of status epilepticus. Journal of Neuroinflammation. 12, 202(2015).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biology. 14 (5), e1002466(2016).
- Madry, C., et al. Microglial Ramification, Surveillance, and Interleukin-1β Release Are Regulated by the Two-Pore Domain K+Channel THIK-1. Neuron. 97 (2), 299-312 (2018).
- Honda, S., et al. Extracellular ATP or ADP induce chemotaxis of cultured microglia through Gi/o-coupled P2Y receptors. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 21 (6), 1975-1982 (2001).
- Haynes, S. E., et al. The P2Y12 receptor regulates microglial activation by extracellular nucleotides. Nature Neuroscience. 9 (12), 1512-1519 (2006).
- Wu, L. -J., Vadakkan, K. I., Zhuo, M. ATP-induced chemotaxis of microglial processes requires P2Y receptor-activated initiation of outward potassium currents. Glia. 55 (8), 810-821 (2007).
- Kolodziejczak, M., et al. Serotonin Modulates Developmental Microglia via 5-HT 2BReceptors: Potential Implication during Synaptic Refinement of Retinogeniculate Projections. ACS Chemical Neuroscience. 6 (7), 1219-1230 (2015).
- Schafer, D. P., et al. Microglia Sculpt Postnatal Neural Circuits in an Activity and Complement-Dependent Manner. Neuron. 74 (4), 691-705 (2012).
- Pfeiffer, T., Avignone, E., Nägerl, U. V. Induction of hippocampal long-term potentiation increases the morphological dynamics of microglial processes and prolongs their contacts with dendritic spines. Scientific Reports. 6, 32422(2016).
- Parkhurst, C. N., et al. Microglia Promote Learning-Dependent Synapse Formation through Brain-Derived Neurotrophic Factor. Cell. 155 (7), 1596-1609 (2013).
- Wu, Y., Dissing-Olesen, L., Macvicar, B. A., Stevens, B. Microglia: Dynamic Mediators of Synapse Development and Plasticity. Trends in Immunology. 36 (10), 605-613 (2015).
- Ohsawa, K., et al. P2Y12 receptor-mediated integrin-beta1 activation regulates microglial process extension induced by ATP. Glia. 58 (7), 790-801 (2010).
- Kurpius, D., Wilson, N., Fuller, L., Hoffman, A., Dailey, M. E. Early activation, motility, and homing of neonatal microglia to injured neurons does not require protein synthesis. Glia. 54 (1), 58-70 (2006).
- Stence, N., Waite, M., Dailey, M. E. Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices. Glia. 33 (3), 256-266 (2001).
- Dissing-Olesen, L., Macvicar, B. A. Fixation and Immunolabeling of Brain Slices: SNAPSHOT Method. Current Protocols in Neuroscience. 71, 1.23.1-12 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Aitken, P. G., et al. Preparative methods for brain slices: a discussion. Journal of Neuroscience Methods. 59 (1), 139-149 (1995).
- Paris, I., et al. ProMoIJ: A new tool for automatic three-dimensional analysis of microglial process motility. Glia. 66 (4), 828-845 (2018).
- Pagani, F., et al. Defective microglial development in the hippocampus of Cx3cr1 deficient mice. Frontiers in Cellular Neuroscience. 9 (229), 111(2015).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. , Clifton, NJ. 221-242 (2014).
- Mainen, Z. F., et al. Two-photon imaging in living brain slices. Methods. 18 (2), San Diego, CA. 231-239 (1999).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Gyoneva, S., et al. Systemic inflammation regulates microglial responses to tissue damage in vivo. Glia. 62 (8), 1345-1360 (2014).
- Heindl, S., et al. Automated Morphological Analysis of Microglia After Stroke. Frontiers in Cellular Neuroscience. 12, 106(2018).
- Dailey, M. E., Eyo, U., Fuller, L., Hass, J., Kurpius, D. Imaging microglia in brain slices and slice cultures. Cold Spring Harbor Protocols. 12 (12), 1142-1148 (2013).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados